实验二愈伤组织的诱导与分化
(2021年整理)第三章-愈伤组织诱导

(完整)第三章-愈伤组织诱导编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)第三章-愈伤组织诱导)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)第三章-愈伤组织诱导的全部内容。
第三章愈伤组织的诱导与培养第一节愈伤组织的诱导与继代培养愈伤组织(callus): 在培养基上,由外植体经脱分化和细胞分裂形成的一团无序生长的薄壁细胞。
大部分外植体细胞须经脱分化形成愈伤,才能再分化成完整植株,只有茎尖等少数细胞只恢复为分生状态但不分裂,直接再分化。
愈伤组织的诱导与分化是植物组培的基本环节。
一、愈伤组织的诱导及其形态特征1、愈伤组织的诱导1)起动期/诱导期(initiation/induction stage, Induction of growth)外植体细胞在外源激素作用下,经脱分化而恢复分裂状态,开始形成愈伤。
细胞外观无明显变化,代谢旺盛,合成加强,为分裂做准备.持续十几小时~几天。
2)分裂期(divition stage/phase):外植体切口边缘膨大,外层细胞迅速分裂,体积变小,具分生细胞的特征,细胞数速增。
3)形成期(formation stage/Differentiation phase):外植体表层细胞分裂减缓,内部细胞开始分裂,大量细胞形成瘤状/泡状或片状结构。
若不及时继代,将分化出拟分生组织瘤状物和维管组织,又称分化期。
2. 愈伤组织的形态特征质地:松脆易碎的颗粒状;紧密坚实的结块状;水渍或浆糊状。
颜色:白色或淡黄色;淡绿色或绿色;黄色至褐色。
一般,淡黄或淡绿/绿色松脆(近圆形)或致密的颗粒状愈伤再生能力较强,白色/灰白色或黄褐色、浆糊状或紧实(香蕉形)的愈伤再生能力差。
愈伤组织的诱导和培养
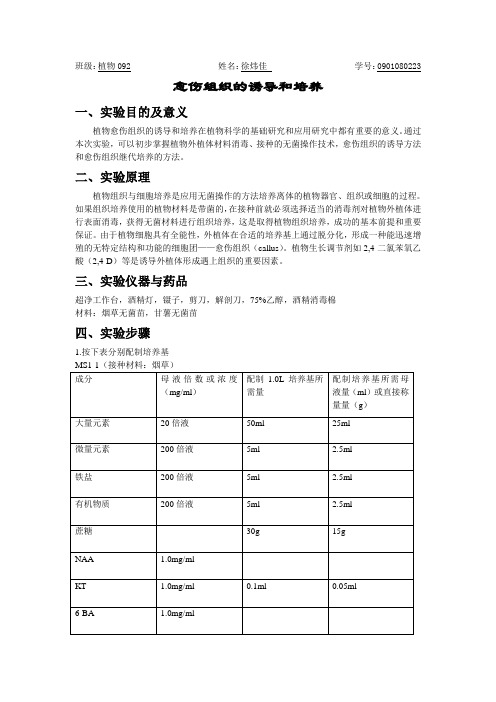
班级:植物092 姓名:徐炜佳学号:0901080223愈伤组织的诱导和培养一、实验目的及意义植物愈伤组织的诱导和培养在植物科学的基础研究和应用研究中都有重要的意义。
通过本次实验,可以初步掌握植物外植体材料消毒、接种的无菌操作技术,愈伤组织的诱导方法和愈伤组织继代培养的方法。
二、实验原理植物组织与细胞培养是应用无菌操作的方法培养离体的植物器官、组织或细胞的过程。
如果组织培养使用的植物材料是带菌的,在接种前就必须选择适当的消毒剂对植物外植体进行表面消毒,获得无菌材料进行组织培养,这是取得植物组织培养,成功的基本前提和重要保证。
由于植物细胞具有全能性,外植体在合适的培养基上通过脱分化,形成一种能迅速增殖的无特定结构和功能的细胞团——愈伤组织(callus)。
植物生长调节剂如2,4-二氯苯氧乙酸(2,4-D)等是诱导外植体形成遇上组织的重要因素。
三、实验仪器与药品超净工作台,酒精灯,镊子,剪刀,解剖刀,75%乙醇,酒精消毒棉材料:烟草无菌苗,甘薯无菌苗四、实验步骤1.按下表分别配制培养基将配置的四种培养基分别分装入20个培养瓶,高温灭菌后水平放置凝固2.接种前,将实验所需器具放入超净工作台,打开紫外灯灭菌20~30min,关闭紫外灯,开启通风开关。
洗手后用酒精喷洒消毒手、手臂、实验材料及培养基外部等进入超净工作台的部分。
进入超净工作台,用酒精棉擦拭台面(手勿伸出工作台),台面完全风干后点燃酒精灯。
3.接种开始时,将镊子及手术刀在酒精中浸泡,并在酒精灯外焰上烧炽片刻,充分冷却。
取幼嫩的烟草(甘薯)叶片,用手术刀切割成小片,再用镊子将其接种至相应的培养基上,每瓶接种3~5片,封口后取出超净工作台,标注姓名、日期、培养基和接种材料。
4.将上述培养材料常温暗培养,每隔7天观察一次,并记录培养情况五、实验结果组织长芽,而当生长素含量大于细胞分裂素含量时,二者共同作用在室温下可诱导外植体生成不定根,也可形成愈伤组织,细胞色素沉淀情况严重;NAA为植物生长素,6-BA为细胞分裂素,促进扦插生根,而当细胞分裂素含量大于生长素含量时,二者共同作用在室温下可诱导外植体生成不定芽,此次实验由于温度非形成愈伤组织的最适温度,所以未形成完整的愈伤组织细胞团。
实验2-3 胡萝卜愈伤组织继代培养基的配制

(2)植物材料的表面灭菌和接种
①操作人员洗手消毒
②装材料的容器及玻璃棒用酒精表面消毒
③将待消毒的材料浸入75%的酒精中10秒, 取出用无菌水冲洗干净。 ④倒入消毒剂( 0.1%HgCl2 )并计时
⑤到预定时间(20分钟)后倒出消毒液并 用无菌水清洗干净。
⑥将材料切块后接种到诱导培养基上。
6 实验流程
(1)准备工作
① 外植体表面灭菌前的准备工作 a 接种室的清洁和消毒; b 超净工作台的开机和消毒;
c 消毒溶液、无菌水、装等的准备。
② 实验材料的准备
a 准备新鲜健康的胡萝卜肉质直根作实验 材料;
b 实验材料的修整、刷洗、冲洗; c 用洗衣粉水或肥皂水浸洗后再用自来水 冲净。
(2)胡萝卜愈伤组织增殖培养基的配制
配方:MS基本培养基+ 2mg/L NAA+ 0.1mg/L 6-BA+200mg/L水解酪蛋白+ 0.7 %琼脂+3%蔗糖 配制流程:同胡萝卜愈伤组织诱导培养基 的配制
作业
详细写出胡萝卜愈伤组织诱导培养的操作 步骤。
实验2-2 胡萝卜愈伤组织的诱导
1 实验目的
通过本次实验,使同学能够熟练掌握外植 体的表面消毒技术和无菌操作技术。 2 实验原理 将胡萝卜的贮藏根(根的变态)表面消毒 后切割成小块接种于愈伤组织诱导培养基 上,诱导外植体脱分化产生愈伤组织。
3 主要实验用具和仪器
用具:酒精棉球、小块纱布、已灭菌滤纸、 枪状镊子、手术剪、解剖刀、已灭菌培养 皿、酒精灯等。 仪器:超净工作台、恒温培养箱 4 药品和试剂 胡萝卜愈伤组织诱导培养基、无菌水、75 %酒精、0.1%HgCl2。 5 实验材料:胡萝卜肉质直根
2 烟草愈伤组织诱导实验

烟草叶片愈伤组织诱导分化实验1. 实验目的(1)通过诱导植物(烟草叶片、水稻种子)愈伤组织和器官发生,分析生长素和细胞分裂素对烟草叶片离体培养的作用。
(2)了解植物组织在离体培养条件下脱分化和再分化的特点。
2. 实验原理外植体形成愈伤组织大致要经历三个时期:启动期、分裂期和形成期。
启动期主要通过激素以及环境因素的诱导使外植体细胞代谢增强,大量蛋白质与核酸形成为细胞分裂做准备;分裂期时外植体细胞在激素诱导下脱分化并不断增殖,形成结构疏松的组织块;形成期时,由于不同植物生长激素的诱导使愈伤组织形成根、芽等形态分化。
烟草为常见模式植物之一,常用于植物组织培养,是研究细胞脱分化和再分化的理想材料。
在愈伤组织诱导及分化过程中,光照条件起到的作用是促使愈伤组织进行光合作用生成糖类,促使代谢活动进行。
6-BA、NAA均为植物生长调节剂,6-BA属于细胞分裂素,可诱导愈伤组织发生并促进牙的形成;NAA属于细胞分裂素,能促进细胞分裂与扩大,诱导形成不定根。
根据Skoog和Miller提出的生长素和细胞分裂素相对浓度调节器管分化的概念,相对高的生长素有利于细胞增殖和不定根的分化,而相对高的细胞分裂素浓度有利于不定芽的分化。
通过改变激素的种类和浓度,有效地调节培养组织的器官分化,已经在许多植物的组织培养中得到证实,甚至在一些低等植物中也得到了证实。
3. 实验材料与操作方法3.1 实验材料3.1.1 材料选择:烟草By-2,滤纸片,枪头3.1.2 实验试剂:(1)植物生长调节剂(超净台过滤灭菌,1.5 mLEP管分装后-20℃贮存)6-BA 0.5mg/mL(1mol/L NaOH溶解再用蒸馏水定容)NAA 0.5mg/mL(1 mol/L NaOH溶解再用蒸馏水定容)(2)抗生素(超净台过滤灭菌,1.5 mLEP管分装后-20℃贮存)卡那霉素50 mg/mL(蒸馏水定容)利福平15 mg/mL(无水乙醇溶解再用蒸馏水定容)链霉素30 mg/mL(蒸馏水定容)羧苄青霉素100 mg/mL(蒸馏水定容)(3)实验用培养基MS大量元素储存母液(50×,蒸馏水定容):1650mg/L NH4NO3+1900mg/L KNO3+370mg/L MgSO4·7H2O+170mg/L KH2PO4+440mg/LCaCl2·2H2O(CaCl2·2H2O在配制过程中不易溶解,可单独配成储液存放)MS微量元素储存母液(100×,蒸馏水定容):0.83mg/L KI+6.2mg/L H3BO3+22.3mg/L MnSO4·4H2O+8.6mg/L ZnSO4·7H2O+ 0.25mg/L Na2MoO4·2H2O+0.025mg/L CuSO4·5H2O+0.025mg/L CoCl2·6H2O +27.8mg/LFeSO4·7H2O +37.3 mg/L Na2-EDTA·2H2O(FeSO4·7H2O 和Na2-EDTA·2H2O两个试剂配制成100×溶液4℃冰箱避光储存)MS有机成分储存母液(100×,蒸馏水定容):3mg/L甘氨酸+0.5mg/L烟酸(维生素B5)+0.5mg/L盐酸吡哆醇(维生素B6)+0.1mg/L盐酸硫胺素(维生素B1)+100mg/L肌醇(肌醇难溶解,一般独自配成浓缩液储存)MS培养基(NaOH调节至pH 5.8,蒸馏水定容):1×大量元素+1×微量元素+1×有机成分+30g/L蔗糖+0.8%琼脂+不同比例生长素(6-BA+IAA)3.1.3 实验仪器:超净工作台,烧杯,锥形瓶,培养皿,枪形镊子,眼科剪,移液枪,酒精灯,光照培养室,3.2 操作方法取幼嫩烟草叶片约5片(选择幼年的外植体较好,如分生组织、维管束、形成层组织、静止的薄壁组织),用自来水清洗晾干。
愈伤组织实验报告

一、实验目的1. 掌握植物组织培养技术的基本操作流程。
2. 熟悉愈伤组织的诱导方法及再分化过程。
3. 学习植物激素在愈伤组织形成与再分化中的作用。
4. 了解植物细胞的全能性及组织培养技术在植物育种中的应用。
二、实验原理植物组织培养技术是将植物器官、组织或细胞在人工条件下进行无菌培养,使其在适宜的培养环境中生长、分化,最终形成完整植株的过程。
愈伤组织是植物组织培养过程中的一个重要阶段,它是由已经分化的细胞脱分化形成的无定形细胞团。
通过诱导愈伤组织,可以进一步分化为根、茎、叶等器官,实现植物繁殖和育种。
三、实验材料与试剂1. 实验材料:水稻叶片、玉米叶片、胡萝卜根段。
2. 试剂:无菌水、无菌滤纸、70%乙醇、5%次氯酸钠、琼脂、蔗糖、硝酸钙、硝酸钾、硝酸铵、磷酸二氢钾、生长素、细胞分裂素、琼脂酶、滤纸等。
四、实验步骤1. 材料预处理(1)将水稻叶片、玉米叶片、胡萝卜根段分别用70%乙醇消毒30秒,再用5%次氯酸钠消毒5分钟,最后用无菌水清洗3次。
(2)将消毒后的材料用无菌滤纸吸干水分。
2. 愈伤组织诱导(1)将预处理后的材料切成约1cm×1cm的小块,放入含有不同浓度生长素和细胞分裂素的MS培养基中。
(2)将培养皿放入培养箱中,在适宜的温度和光照条件下培养。
3. 愈伤组织再分化(1)将愈伤组织转移到含有不同浓度生长素和细胞分裂素的MS培养基中。
(2)在适宜的温度和光照条件下培养,观察愈伤组织分化为根、茎、叶等器官的情况。
4. 数据记录与分析(1)观察并记录愈伤组织的生长情况,包括生长速度、愈伤组织颜色、形态等。
(2)观察并记录愈伤组织再分化为根、茎、叶等器官的情况,包括器官形态、生长速度等。
(3)分析不同植物激素浓度对愈伤组织形成与再分化的影响。
五、实验结果与分析1. 愈伤组织诱导实验结果表明,水稻叶片、玉米叶片、胡萝卜根段在含有不同浓度生长素和细胞分裂素的MS培养基中均能诱导出愈伤组织。
实验二 植物组织培养2-愈伤组织的诱导

中国海洋大学实验报告2015 年 4 月23 日姓名###云年级BBB专业UUUUUU学号HHHHHHHHHHHH课程细胞工程学实验题目植物愈伤组织诱导实验一、实验目的1、掌握植物愈伤组织诱导、继代、器官分化的原理;2、掌握植物组织接种培养的整个无菌操作的过程;3、熟悉超净工作台的使用。
二、实验原理植物组织培养是将植物的器官组织以至单个细胞,应用无菌操作方法,使其在人工条件下,能够分裂、增殖、分化发育成一完整植株的过程。
植物的组织在人工培养条件下,原来已经分化停止生长的细胞,可以重新分裂,形成没有组织结构的细胞团,即愈伤组织,这一过程称为“脱分化作用”。
而已经“脱分化”的愈伤组织,在一定条件下,又能重新分化形成输导系统以及根和芽等组织和器官,这一过程称为“再分化作用”。
植物激素在“再分化”过程中起着重要作用,生长素和细胞分裂素的比例,决定了根和芽的分化。
超净工作台是一种水平单向流型局部空气净化设备。
三、实验仪器试剂1、仪器:镊子、解剖刀、烧杯、酒精灯、试剂瓶、含有培养基的培养瓶、培养皿、金属盘、记号笔2、用品:胡萝卜、75%酒精、10%次氯酸钠、无菌水四、实验步骤:(1)用70~75%的酒精棉擦拭双手和操作台面,进行常规的无菌操作准备。
(2)将植物体用准备好的自来水冲洗后,用酒精棉擦拭取材部位表面, 于70%酒精中浸沾数秒钟。
(3)将材料放入已灭菌的100ml试剂瓶中,加入10%的次氯酸钠溶液,浸泡5分钟。
(4)弃次氯酸钠浸泡液,再加入10%的次氯酸钠溶液,浸泡10分钟。
(5)弃次氯酸钠浸泡液,用准备的无菌水浸泡漂洗3~4次,每次1~2分钟,用无菌镊子搅动。
(6)将已灭菌的植物材料置于平板内,按无菌操作要求剥去外皮,用解剖刀切成5mm 厚的薄片,弃去两头的两片,取中间部分的薄片,用镊子将其接种在愈伤组织诱导培养基上,注意圆片的切口朝向培养基,每瓶4~6片,均匀分散。
(7)将瓶口和瓶盖在酒精灯火焰上方一过,拧紧瓶盖。
实验二愈伤组织的诱导与分化

实验二 愈伤组织的诱导与再分化一、目的掌握外植体的消毒方法和接种技术;了解愈伤组织诱导的过程及再分化。
二、原理以植物器官、组织、细胞等作外植体进行离体培养都能形成愈伤组织。
愈伤再经分化培养,通过器官发生途径或体细胞胚胎发生途径可再生成植株。
外植体如果是带菌的,在接种前都必须消毒。
对于难消毒的材料,有时要几种消毒剂配合使用;对于多茸毛表面粗糙不平的材料,要加展著剂(吐温20)以增强消毒效果。
三、实验材料水稻成熟种子(用于诱导愈伤组织);四、仪器设备及用具(一) 仪器设备超净工作台 培养室(二) 用具(每组5人用量)量筒:100ml ×2培养皿:¢9cm ×1三角瓶:50ml ×2(无菌),1000ml ×1枪形镊:×4无菌滤纸:(10cm ×10cm )×5五、试剂及培养基(一) 试剂75%酒精,2% NaCLO ,无菌水(每组1瓶400ml)(二) 培养基1、诱导培养基:N 6+2,4-D2mg/1+蔗糖30g/l+琼脂8g/l2、分化培养基:N 6+ CuSO 4·5H 2O 1.25mg/l+BA 2mg/l+NAA 1mg/l+蔗糖30g/l+琼脂8g/l六、实验步骤1、接种室、培养基及用具表面消毒用75%酒精棉球试擦超净工作、镊子,将培养基及用具放工作台,打开紫外灯,照射20分钟以表面消毒。
之后关紫外灯,打开工作台风机,通风30分钟后可进行无菌操作。
2、消毒剂的配制(1)、75%酒精:每组配95ml 。
量取95%酒精75ml ,加蒸馏水至95ml 即可.(2)、2%NaCLO :每组配100ml.x :应吸取的NaCLO 原液的毫升数;y :NaCLO 原液的有效氯浓度。
3、种子去壳用自制的脱壳砂纸脱去谷壳,注意保持胚完整。
每人准备30粒去壳种子。
4、外植体消毒(以下工作在超净工作台内进行)将米粒放入50ml 无菌三角瓶→无菌水洗一次→弃水,倒入75%酒精,搅拌,30秒→弃酒精,倒入2% NaCLO ,不时搅拌,30分钟→弃NaCLO ,用无菌水洗3次,每次停留10.5%×100 yX= (ml)分钟→倒去无菌水,种子放在带无菌滤纸的培养皿中吸干。
烟草叶片愈伤组织诱导与分化试验设计方案

烟草叶片愈伤组织诱导与分化试验设计方案班第组一、实验目的:诱导烟草叶片长出愈伤组织(或根或者芽)二、实验用具:超净工作台、镊子、手术剪、酒精灯、培养皿、广口瓶、高压灭菌锅等。
三、实验材料与试剂1.实验材料烟草叶片2.试剂 MS培养基、75%酒精、0.1%升汞、无菌水、IAA(0.1mg/mL)、6BA( 0.1mg/mL)等四、实验方法与步骤1.培养基的制备与灭菌按配制培养基的方法配制MS基本培养基250mL。
根据实验目的,采用培养基配方为MS+6BA( mg/L) +NAA( mg/L)。
所有培养基均附加30g/L蔗糖,4g/L琼脂粉。
在高压灭菌前将pH用1mol/LNaOH调至5.8,然后分装到三角瓶,每瓶分装培养基大约40-50mL。
2.试剂、无菌水及培养皿的准备配制75%的酒精、0.1%升汞;将蒸馏水装入三角瓶或广口瓶,每瓶装50-60 mL,按照培养基灭菌的方法灭菌30min,即可获得无菌水;将剪裁好的滤纸放入洗净的培养皿中,每培养皿放3层,加少量蒸馏水润湿后,用牛皮纸或两层报纸将培养皿包严,高压灭菌30 min后备用。
3.接种室准备首先,用纱布蘸取75%酒精擦拭工作台台面,将接种用具、无菌蒸馏水、培养基等置于工作台上,打开工作台开关和紫外线灯,确认工作台正常送风后,开机30 min。
然后,用喷雾器向接种室空中喷洒75%酒精或打开接种室内的紫外线灯,进行空气灭菌。
4. 培养材料的表面灭菌从盆栽烟草植株上选取鲜绿、肥厚且充分展开的叶子,先用自来水冲洗30 min,用蒸馏水漂洗3次,然后在无菌条件下将其剪成适宜大小,放入广口瓶中。
先倒入75%酒精,摇动两三下(10s),立即将酒精倒出,然后加入0.1%升汞溶液,浸泡7min。
注意加入的升汞溶液应浸过叶片,浸泡过程中要不断摇动。
最后,将升汞倾出,加入无菌水摇动20-30 s倒出,重复用无菌水冲洗5次,备用。
5. 接种将经过表面灭菌的叶片按照无菌操作的要求取出,放入打开的无菌培养皿内。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验二 愈伤组织的诱导与再分化
一、目的
掌握外植体的消毒方法和接种技术;了解愈伤组织诱导的过程及再分化。
二、原理
以植物器官、组织、细胞等作外植体进行离体培养都能形成愈伤组织。
愈伤再经分化培养,通过器官发生途径或体细胞胚胎发生途径可再生成植株。
外植体如果是带菌的,在接种前都必须消毒。
对于难消毒的材料,有时要几种消毒剂配合使用;对于多茸毛表面粗糙不平的材料,要加展著剂(吐温20)以增强消毒效果。
三、实验材料
水稻成熟种子(用于诱导愈伤组织);
四、仪器设备及用具
(一) 仪器设备
超净工作台 培养室
(二) 用具(每组5人用量)
量筒:100ml ×2
培养皿:¢9cm ×1
三角瓶:50ml ×2(无菌),1000ml ×1
枪形镊:×4
无菌滤纸:(10cm ×10cm )×5
五、试剂及培养基
(一) 试剂
75%酒精,2% NaCLO ,无菌水(每组1瓶400ml)
(二) 培养基
1、诱导培养基:N 6+2,4-D2mg/1+蔗糖30g/l+琼脂8g/l
2、分化培养基:N 6+ CuSO 4·5H 2O 1.25mg/l+BA 2mg/l+NAA 1mg/l+蔗糖30g/l+琼脂8g/l
六、实验步骤
1、接种室、培养基及用具表面消毒
用75%酒精棉球试擦超净工作、镊子,将培养基及用具放工作台,打开紫外灯,照射20分钟以表面消毒。
之后关紫外灯,打开工作台风机,通风30分钟后可进行无菌操作。
2、消毒剂的配制
(1)、75%酒精:每组配95ml 。
量取95%酒精75ml ,加蒸馏水至95ml 即可.
(2)、2%NaCLO :每组配100ml.
x :应吸取的NaCLO 原液的毫升数;
y :NaCLO 原液的有效氯浓度。
3、种子去壳
用自制的脱壳砂纸脱去谷壳,注意保持胚完整。
每人准备30粒去壳种子。
4、外植体消毒(以下工作在超净工作台内进行)
将米粒放入50ml 无菌三角瓶→无菌水洗一次→弃水,倒入75%酒精,搅拌,30秒→弃酒精,倒入2% NaCLO ,不时搅拌,30分钟→弃NaCLO ,用无菌水洗3次,每次停留10.5%×100 y X= (ml)
分钟→倒去无菌水,种子放在带无菌滤纸的培养皿中吸干。
5、接种与观察
愈伤组织诱导
将吸干的种子接入培养基,注意使胚朝上。
每瓶接10粒,每人2瓶。
写上日期、接种人、放入培养室25℃暗培养。
1周后调查计算污染率,2周后调查计算愈伤组织诱导率。
6、愈伤组织的再分化观察
在无菌条件下将诱导获得的愈伤组织(从约3周后安排此实验),从原材料中用镊子剥离后,接种到分化培养基中,每瓶接种4粒,每个同学接种3瓶,后置于光照条件下控制培养(25℃,2000lux 每天光照10小时下培养),观察分化出苗的状况(一般需要2-3个星期的培养时间)。
1个月后调查计算分化率。
七、结果与分析
1. 如何降低污染率?
2. 愈伤组织的形成、愈伤组织再分化与哪些因素有关?
分化率(%)= ×l00 分化植株的愈伤块数 ×100
形成愈伤组织的种子数
污染率(%)=
×100 污染的种子数 接种的总种子数 诱导率 (%)=
接种的总种子数 接种的总块数。
