元素周期表第三课时
原子结构和元素周期律—元素周期表(无机化学课件)

课程小结
本节重点
一、周期表的结构 周期(横行)结构: 三长、三短、一不全。 族(纵行)结构: 七主、七副、零和Ⅷ族。
二、原子结构与元素在周期表中位置的关系 a.周期序数=电子层数 b.主族序数=最外层电子数
无机化学
˝
元素周期表
案例导入
插入二维动画(待制作)
元素周期表是怎么来的?
目录
CONTENTS
01 元素周期表
02 元素周期表的结构及特点
01
元素周期表
一、元素周期表
定义:把电子层数相同的各元素, 按原子序数递增的顺序从左到右排 成横行;把不同行中外层电子数相 同的元素,按电子层递增的顺序由 上而下排成纵列,就可以得到一张 表格,叫元素周期表。 元素周期表是元素周期律的具体表 现形式。
02
元素周期表的结构及特点
二、元素周期表的结构及特点
二、元素周期表的结构及特点
1 周期(横行)具有相同电子层数的元素按照原子序数递增的顺 序排列的一个横行。
短周期 长周期
不完全周期
1
1
2K 2
234
5
6
7
8
9
10
L K
8 2
3 11 12
M 18
13 14 15 16 17 18 L 8
k
2
4 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36
二、元素周期表的结构及特点
族的分类 包含元素
表示 个数
主族
副族
长、短周期元素 ⅠA,ⅡA等
长周期元素 ⅠB,ⅡB等
7
7
零族
Ⅷ族
稀有气体元素 8、9、10纵行
化学:《元素周期表-周期表结构》课件(新人教版必修2)

氕 (氢)
(重氢) 氘
(超重氢) 氚
H、D、T这三种核素互称为同位素
常见的同位素:
碳 碳-12
12C
6
碳-13
13C
6
碳-14
14C
6
氧 氯 铀
16O
8
17O
8
18O
8
35Cl
17 92
37Cl
17
234U
235U
92
238U
92
【同位素小结】
两同(同质子数、同一元素)
两不同(中子数不同、原子不同)
(2)碱金属元素从上到下(Li 、Na、K、 Rb、Cs),随着核电荷数的增加,碱金属 元素原子的电子层数逐渐 增多 ,原子核 对 最外层电子 的引力逐渐减弱,原子失 电子的能力逐渐 增强 。 元素的金属性逐渐 增强 ,与水和氧气 的反应越来越 剧烈 ,生成的氧化物越来 越 复杂 。最高价氧化物对应水化物的碱 性越来越 强 。
第88号元素: 88-86 =2
第五周期第ⅦA 族。
第七周期第ⅡA 族。
第82号元素:
第六周期第ⅣA 族。
6、下列各表为周期表的一部分(表中为 原子序数),其中正确的是( D )
A.0 11 18 19
C.
6 11 12 13 24
D.
6 14 31 32
7
7. A、B、C是周期表中相邻的三种元素,其中A、B是同 周期,B、C是同主族。此三种元素原子最外层电子数之
卤素原子结构的相似性,决定了单质化学性质的相似性。
与氢反应的能力渐弱 氢化物的稳定性渐弱 与水反应的能力渐弱
元素非金属性强弱判断依据:
1、单质跟氢气反应生成气态氢化物的 难易;
第三节 元素周期表
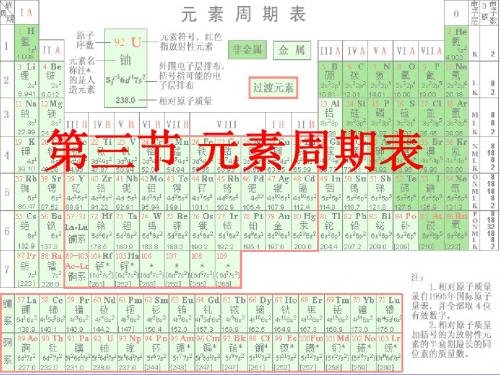
(1)主族:由短周期元素和长周期元素共 同构成的族。 表示方法:在族序数后面标一“A” 字。ⅠA、ⅡA、ⅢA、…ⅦA (2)副族:完全由长周期元素构成的族。 表示方法:在族序数后标“B”字。 如ⅠB、ⅡB、ⅢB、…ⅦB (3)第VⅢ族: (“8、9、10” 三个纵行) (4) 0族:稀有气体元素
米奇利还分析了其它的一些规律, 最终,一种全新的致冷剂CCl2F2终 于应运而生了。 80年代,科学家们发现氟里昂会破 坏大气的臭氧层,危害人类的健康 的气候,逐步将被淘汰。人们又将 在元素周期表的指导下去寻找新一 代的致冷剂。
氟里昂的发现与元素周期表
在第三周期中,单质的易燃性是 Na>Mg>Al,在第二周期中,CH4比 NH3易燃,NH3双比H2O易燃,再比较 氢化物的毒性:AsH3>PH3>NH3 H2S>H2O,根据这样的变化趋势,元 素周期表中右上角的氟元素的化合物 可能是理想的元素,不易燃的致冷剂。
氟里昂的发现与元素周期表
> HCl > HBr > HI NH3 < HF NH3 > PH3
HF 2.碱性强弱: KOH
>
NaOH HNO3
3.酸性强弱: HClO4
> > >
Mg(OH)2 HBrO4 H3PO4
三、元素化合价与元素在周期表中 位置的关系
价电子——元素原子的最外层电子或
某些元素的原子的次外层或倒数第三层的 部分电子。 (1)最高正价= 主族序数 = 最外层电子数
2
10
K
2
4
12 20 38 III B 21 39 IV B 22 40 V B 23 41 VI B 24
元素周期表 第三课时核素

特性 决定 因素
只有种类, 没有个数 质子数 H、C、N 三种元素
化学反应中的最 小微粒 质子数、中子数
1
化学性质几乎完 全相同 质子数、中子数
234 92 238 92
由 一种元素组 成,可独立存在 组成元素、 结构 O2 与 O3 互为同 素异形体
举例
H、1 H、1 H 三 1 种核素
2
3
U、92 U、 U 互为同位素
37 ������
二、核素
1.定义 具有一定数目质子和一定数目中子的一种原子。 2.氢的三种核素
氢元素的原子核 质子数(Z) 1 1 1 中子数(N) 0 1 2 原子名称 氕 氘 氚
������ 原子符号( X) ������ 1 1 2 1 3 1
H H或D H或T
自主思考 1: 所有原子的原子核内一定含有质子和中子吗? 提示:不一定。原子核中一定含质子,但不一定有中子,如 1 H 中只有质子而 没有中子。
235
2.联系
(1)一种单质可能由不同核素构成,如:HD、HT 等; (2)一种核素可以构成不同单质,如:16O2、16O3。
知识点1
原子内的几个数量关系
【例题 1】某元素的一种同位素 X 的原子的质量数为 A,含 N 个中子,它与 1 H 原子构成 HmX 分子。在 a g HmX 中所含质子的物质的量是( )
第 3 课时 核素
氕、氘、氚原子中质子、中子和电子的数量关系示意图
1.了解元素和核素的含义。 2.理解质量数和 ������ X 的含义。
������
一、原子的组成
1.组成微粒 原子核 质子(带正电) 中子(不带电)
原子
核外电子(带负电)
2.数值关系 (1)质量数:忽略电子的质量,将核内所有质子和中子的相对质量取近似 值相加所得的数值。 (2)数值关系。 质量关系:质量数(A)=质子数(Z)+中子数(N) 数量关系:原子序数=核电荷数=质子数=核外电子数 3.原子构成的表示方法 一般用符号 ������ X 表示,字母表示意义如下: A 表示质量数,Z 表示质子数,X 表示元素符号,如 17 Cl 表示质量数为 37、 质子数或核电荷数为 17 的氯原子。
第一节 元素周期表(第三课时:卤族元素)

【效果检测】
1.a、b、c、d四个集气瓶中装有Cl2、H2、HCl、HBr 中的任一种气体,若a、d两瓶气体混合后强光照射下 发生爆炸,a、b两瓶气体相混,瓶壁上出现红棕色液 滴,则a、b、c、d四瓶中气体应是( ) A.Cl2、HBr、HCl、H2 B.Cl2、HCl、HBr、H2 C.H2、HBr、HCl、Cl2 D.H2、HCl、HBr、Cl2
走进“物质结构”的天堂 探寻物质世界的奥秘 这里卤素知识让您开眼界!
水
【阅读讨论】(自主学习)
(一)、分小组讨论 小组1:周期表中为什么把氟、氯、溴、碘四种元素 编在一个族呢?它们的原子结构和性质是不是同样具 有相似性和递变性呢? 小组2:课本第8页资料卡片中,体现出卤素单质物理 性质有哪些递变性? 小组3:结合课本第8页(1)卤素单质与氢气的反应 的信息,完成卤素单质与H2反应,并说说氢化物的稳定 性。 (选代表汇报、教师捕捉问题,相机引导)
结论:氧化性强弱
Cl2>Br2>I2,
那么F2呢?你能从原子结构的角度去分析吗?
得 电 子 能 力 逐 渐 减 弱
非 金 属 性 逐 渐 减 弱
结论:随着核电荷数的增加,卤族单质氧化性强弱顺序为: F2>Cl2>Br2>I2
总
结
同主族元素随着核电荷数的增大,金属性逐渐 增强,非金属性逐渐减弱。
判断元素金属性强弱的方法 1、单质跟水(或酸)反应置换出氢的难易 2、最高价氧化物对应的水化物—氢氧化物的碱 性强弱 3、置换反应 判断元素非金属性强弱的方法 1、单质与氢气生成气态氢化物的难易程度 以及氢化物的稳定性 2、最高价氧化物对应的水化物的酸性强弱 3、置换反应
元素
元素单质与氢气反应的难易 (易 ~ 强 ) 气态氢化物的稳定性 (稳定~强)
元素周期表(三个课时)
使人们开始认识到通过原子的内部了解元素周期系的 本质和所有元素之间的内部联系,推动近代科学技术的发 展指导人们进入人工合成元素的新时代.
五、人工合成元素和锕系元素
(略...)
六、预言周期表
世界的无穷的,人类的认识也是无穷 的,周期表会更加完善.
副族≤2e、主族1e—6e
22种非金属元素
非金属元素 B Si As Te At
金属元素 Al Ge Sb Po 117
全部的主族元素1e—7e ≥3e ≤7e
结论3:
同周期从左到右,元素的金属性减弱,非 金属性增强。 判断: (1)硒酸与高溴酸的酸性强弱。 (2)H2Te与HI的稳定性。 (3)LiOH与Be(OH)2的碱性。
5、元素的原子量是按各种天然同位素的原子量及原 子个数所占的一定百分比算出的平均值。 即:= A·a% + B·b% + C·c% + …
6、元素的近似原子量是按各种天然同位素的质量数 及原子个数所占的一定百分比算出的平均值。
例: 符号
3157Cl 3177Cl
质量数 35 37
同位素的原子量 34.969 36.966
均无金属元素; ③ⅡA到Ⅷ族即第2列到12列均为金
属元素; ④ⅢB族元素种类最多32种元素; ⑤Ⅷ族包括3列12种金属元素.
主族:
ⅠA ⅡA
ⅢA ⅣA ⅤA ⅥA ⅦA
副族元素:
由长周期元素组成.
视图.
练习
知识点4 结构、性质与位置关系
分区 左下方 右上方
分界线附近
元素性质
最外层电子数
90种金属元素
元素周期表(第三课时)

1
复习: 复习:
元素的定义: 元素的定义: 元素是具有相同核电荷数 即核内质子) 相同核电荷数( 元素是具有相同核电荷数(即核内质子) 一类原子的总称。 一类原子的总称。 想一想: 想一想:同种元素的中子数是不是都 相同? 相同?
1 H 1
2 H 1
3 1H
氕 氘 H D 重氢 氢 1、核素: 核素:
Cl Cl
34.969 36.966
75.77% 75.77% 24.23% 24.23%
34.969×0.7577+36.966×0.2423 34.969×0.7577+36.966× =35.453, 35.453, 即:氯的原子量为35.453。 氯的原子量为35.453。
练习3 练习3:
同位素的相对原子质量: 同位素的相对原子质量:是各同位素原 的真实质量1/12 子的真实质量分别与 C的真实质量1/12 的比值。 的比值。 氯元素 的两种同位素的相对原子质量分 35 37 别是: Cl为34.969, Cl为36.966。 别是:17Cl为34.969, Cl为36.966。 17
一种微粒的质子数和电子数和另一种微 粒的质子数和电子数均相等,下列对2 粒的质子数和电子数均相等,下列对2种 微粒间关系的说法错误的是( 微粒间关系的说法错误的是( D ) A、它们可能是不同的分子 B、可能是相同的原子 C、可能是同位素 D、可能是一种分子和一种离子
二、元素的(平均)相对原子质量: 元素的(平均)相对原子质量:
质子数=核电荷数 核外电子数 质子数 核电荷数=核外电子数 原子序数 核电荷数 核外电子数=原子序数 质量数( )=质子数( )+中子数( ) )=质子数 )+中子数 质量数(A)=质子数(Z)+中子数(N)
人教版高二化学选择性必修2第一章 第二节 第3课时 元素周期律(二)

同周期自左而右电负性增大,所以电负性:P<S、N<F,同主族自上而 下电负性减小,所以电负性:P<N,N元素的非金属性比S元素强,故电 负性:P<S<N<F,即②<①<③<④,故C错误; F元素没有正化合价,所以最高正化合价:①>②=③,故D错误。
123456
5.X、Y是同周期的两种非金属元素,不能说明X元素的非金属性比Y元 素强的事实是__C_E_F__(填字母)。 A.将X的单质通入HnY溶液中产生浑浊 B.加热至300 ℃,HnY发生分解而HmX不分解 C.第一电离能:X>Y D.电负性:X>Y E.单质的熔点:X>Y F.气态氢化物的水溶液的酸性:HmX>HnY G.X与Y形成的化合物YmXn中X元素显负价
2.电负性、第一电离能与金属性和非金属性的关系 增大
减小 特别提醒 第一电离能:ⅡA>ⅢA,ⅤA>ⅥA。
判断正误
(1)在同周期中,稀有气体元素的第一电离能最大( √ )
(2)同周期,从左到右,元素的电负性逐渐增强,非金属性逐渐增强,第
一电离能也逐渐增大( × ) (3)主族元素的电负性越大,元素原子的第一电离能一定越大( × ) (4)同一周期(第一周期除外)元素中,第ⅦA族元素的原子半径最大( × )
深度思考 1.按照电负性的递变规律推测:元素周期表中电负性最大的元素和电负 性最小的元素位于周期表中的哪个位置? 提示 根据电负性的递变规律,在元素周期表中,越往右,电负性越大; 越往下,电负性越小,由此可知,电负性最强的元素位于周期表的右上 方,最弱的元素位于周期表的左下方。 2.(1) 根 据 化 合 物 SiC 、 CCl4 判 断 , Si 、 C 、 Cl 的 电 负 性 大 小 的 顺 序 是 _C_l_>__C_>__S_i_。 (2) 根 据 化 合 物 HCl 、 HClO 判 断 , H 、 Cl 、 O 的 电 负 性 大 小 顺 序 是 _O_>__C__l>__H__。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 2
《必修Ⅱ第1章第1节 元素周期表 核素》(第3课时)
编制:杨 忠 审核:杨 晓 斌
【课标要求】
1. 学会原子结构的表示方法。
2. 掌握元素、核素、同位素的概念。
【重点难点】
1. 掌握原子的质量数与质子数、中子数及核外电子之间的关系;
2. 正确区分核素与元素,核素与同位素等概念之间的关系。
【新课导学】 ①阅读教材p 9-p 10并回顾有关初中知识。
1、原子的构成:
原子
2、相对(原子、质子、中子)质量的计算公式 相对原子质量 =
3分析表格中的数据,回答下列问题
①质子带正电,电子带负电,而原子不显电性的原因是
②质子、中子的相对质量都近似为 ,电子的质量可以 ,原子的质量主要集中在 . 一、质量数
1、什么叫质量数?(请用文字简明扼要的回答)
2、质量数(A )、质子数(Z )、与中子数(N)之间有何关系?(请用公式回答)
3、解释符号
中各个字母所代表的意思。
4、试比较146C 与
126C 在结构上有何异同?
相同点: 不同点: 二、核素
1、定义:核素是具有一定数目的 和一定数目的 的一种 .
2、举例:认识氢的三种核素 原子符号(
三、同位素
1、定义: 相同而 不同的 不同原子互称为同位素
2、举例:列举两个互为同位素的例子如: 如:
3、同位素的 性质不同 性质相同. 【巩固训练】
1、用A.质子数 B.中子数 C.核外电子数 D.最外层电子数 E.电子层数,填写下列空格。
(1)同位素种类由________决定; (2)元素种类由________决定;
(3)元素有同位素由________决定; (4)元素的化学性质主要由________决定;
2、有以下一些微粒: ①
②
③
④
⑤
其中互为同位素的是 和
质量数相等但不能互为同位素的是 和
中子数相等,但质子数不等的是 和 、 和 。
3、Cl 元素有两种天然同位素
、。
在形成的Cl 2分子中,会有 种不同的分子,
它的相对分子质量分别为 、 、 。
4、1995年我国科研人员在兰州首次合成了镤元素的一种同位素镤-239,并测知其原子核内有148
个中子。
现有A 元素的一种同位素,比镤-239的原子核内少54个质子和100个中子,则A 元素在周期表中的位置是 ( ) A.第三周期第ⅠA 族 B.第四周期第ⅠA 族 C .第五周期第ⅠA 族 D.第三周期第ⅡA 族
5、某元素的一种同位素X 原子的质量数为A ,含N 个中子,它与1
H 原子组成H m X 分子,在ag H m X 分子中含质子的物质的量是 ( )
A.
a
A+m
B.
a
A
(A-N)mol C.
a
A+m
( A-N)mol D.
a
A
(A-N+m)mol
1 2。
