化学反应进行的方向作业纸
教师资格考试高级中学化学学科知识与教学能力试题与参考答案(2025年)

2025年教师资格考试高级中学化学学科知识与教学能力复习试题(答案在后面)一、单项选择题(本大题有20小题,每小题3分,共60分)1、下列物质中,哪一个作为酸碱指示剂时,在pH=7附近颜色变化最为明显?A. 酚酞B. 甲基橙C. 溴百里酚蓝D. 石蕊2、下列反应中,哪一个属于置换反应?A. H2 + O2 → H2OB. NaCl + AgNO3 → NaNO3 + AgCl↓C. Fe + CuSO4 → FeSO4 + CuD. CaCO3 → CaO + CO2↑3、题干:在化学教学中,教师为了帮助学生更好地理解化学反应原理,采用了以下哪种教学策略?A. 直接讲解化学反应方程式B. 通过实验演示化学反应过程C. 引导学生通过观察和提问自主学习D. 强制学生背诵化学反应原理4、题干:在高中化学教学中,教师如何设计教学活动,以促进学生对“物质的量”这一概念的理解?A. 仅通过大量习题训练学生的计算能力B. 通过实际生活中的实例引入,结合实验演示和讲解C. 侧重于理论知识的讲解,强调公式的推导和应用D. 强调学生之间的合作,进行小组讨论和问题解决5、下列哪种物质在酸性介质中的氧化能力最强?A. K2Cr2O7B. KMnO4C. H2O2D. I26、对于反应:N2(g) + 3H2(g) ⇌ 2NH3(g),如果增加体系的压力,平衡将会如何移动?A. 向左移动B. 向右移动C. 不移动D. 先向左后向右移动7、在化学教学过程中,教师为了提高学生的学习兴趣,采用了以下哪种教学方法?()A. 演示法B. 案例分析法C. 合作学习法D. 问卷调查法8、下列关于化学实验教学的说法中,正确的是()。
A. 化学实验教学中,教师应尽量减少实验操作,让学生多观察、多思考B. 化学实验教学中,教师应注重实验结果,忽略实验过程中的操作规范C. 化学实验教学中,教师应鼓励学生独立完成实验,培养学生的创新精神D. 化学实验教学中,教师应只注重实验操作,忽视实验原理的讲解9、下列物质中,属于金属单质的是()A. 氯化钠B. 氢气C. 氧气D. 铜丝 10、在下列化学反应中,不属于置换反应的是()A. 2H2 + O2 → 2H2OB. Fe + CuSO4 → FeSO4 + CuC. 2KClO3 → 2KCl + 3O2↑D. Zn + H2SO4 → ZnSO4 + H2↑11、在下列化学反应中,属于放热反应的是()A. 2H₂O₂ → 2H₂O + O₂B. 2HCl + 2NaOH → 2NaCl + 2H₂OC. N₂ + 3H₂ → 2NH₃D. CaCO₃ → CaO + CO₂12、在下列物质中,属于酸的是()A. 氢氧化钠(NaOH)B. 氯化钠(NaCl)C. 硫酸(H₂SO₄)D. 氧化钙(CaO)13、在下列物质中,属于纯净物的是()A. 空气B. 氯化钠溶液C. 纯碱D. 水玻璃14、下列关于化学反应速率的说法正确的是()A. 反应速率越快,反应越完全B. 增大反应物的浓度,反应速率一定增加C. 降低温度,反应速率一定减慢D. 增加反应物的接触面积,反应速率一定增加15、在下列化学反应中,不属于置换反应的是:A. 2HCl + Zn → ZnCl2 + H2↑B. Fe + CuSO4 → FeSO4 + CuC. 2KClO3 → 2KCl + 3O2↑D. 4NH3 + 5O2 → 4NO + 6H2O16、下列关于化学实验安全操作的描述,错误的是:A. 在实验室内禁止吸烟,以防火灾B. 实验室中的药品不能随意混合,以防发生危险C. 在实验室内禁止使用明火,以防爆炸D. 在进行易燃气体实验时,应先将气体排空,再进行实验17、在下列化学实验操作中,属于正确操作的是()A. 向试管中倾倒液体药品时,试管口紧贴试剂瓶口,防止药品洒落B. 用胶头滴管滴加液体时,滴管应悬空正放,避免污染药品C. 在进行试管加热实验时,试管底部应与火焰接触,使试管均匀受热D. 使用天平时,将待称物质直接放在天平托盘上,无需使用称量纸18、在下列化学反应中,不属于置换反应的是()A. 2H2 + O2 → 2H2OB. Zn + 2HCl → ZnCl2 + H2↑C. Fe + CuSO4 → FeSO4 + CuD. CaCO3 → CaO + CO2↑19、在化学实验中,以下哪种仪器用于精确测量溶液的体积?A. 量筒B. 容量瓶C. 烧杯D. 滴定管 20、在下列化学反应中,哪种类型的反应不属于氧化还原反应?A. 2H₂ + O₂ → 2H₂OB. Fe + CuSO₄ → FeSO₄ + CuC. 2KClO₃ → 2KCl + 3O₂D. H₂SO₄ + Ba(OH)₂ → BaSO₄ + 2H₂O二、简答题(本大题有2小题,每小题12分,共24分)第一题请简述化学教学中的实验探究教学策略,并举例说明如何在高中化学教学中应用这些策略。
化学期中考试总结与反思

化学期中考试总结与反思化学期中考试总结与反思「篇一」一、本次期中考试注重综合能力考查,注重用化学知识解决实际问题能力以及创新能力、探究性学习能力、分析计算能力、化学的学科素养的考查;但这份题个别题目难度偏大致使学生得分不高,下面就试卷中出现的一些问题作一总结:1.基础知识和基本技能不扎实。
表现在对化学式的意义表述不清;对化学反应的量的关系不能正确理解;对物质的分类混淆不清,如3题;计算能力非常薄弱如27题;不会书写化学反应的表达式等等。
2.实验基本技能差。
不会组合正确的实验装置和排列合适的实验操作顺序等。
3.能力与方法问题。
阅读理解、综合分析与归纳、语言表达、科学探究等能力较差,对化学学科中常用的科学方法不熟悉。
表现在不会进行探究性学习;根据现象总结结论的能力较差;4.用化学知识解决实际问题的能力较差。
表现在不能根据所设计的问题情境,结合自身体验来思考问题,寻求解决问题的方法。
5.语言表述不清楚,逻辑性较差,缺乏条理性。
表现在不能用精练的、准确的语言来描述具体的反应现象,或对反应现象叙述不清;回答问题不能抓住重点问题去阐述,不能答出关键点。
6.计算能力薄弱。
表现在根据化学式计算元素的质量分数和元素的质量比的计算。
二、对于一班和二班比较一班的三率均比二班差很多,在下一步的教学中需引起重视,加强一班的学法指导、练习跟踪、作业辅导、在精力跟时间上对一班有所倾斜。
努力提高一班的成绩。
关注临界生和后进生的发展,多沟通鼓励、激励学生学习,使其更上一层楼。
面向全体学生关注各个层面学生的学习,不放过不漏掉一个学生。
三、在下一步的教学中努力改进自己的课堂,积极学习新课改教学模式,课堂上教师要少讲、精讲,要倡导自主、合作、探究学习,调动学生积极参与课堂教学,充分发挥学生主体性。
要在教师的引导下,让学生自己思考、自己发现、自己归纳、自己表达,体验探究过程,学习科学方法,训练表达能力,在主动探求知识的过程中培养学生[ ]的多种能力和品质。
江苏省高三化学二轮复习 专题8《物质的分离与提纯》课时作业

专题八物质的分离与提纯作业纸1.如下表所示,为提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的是2.某实验小组只领取下列仪器或用品:铁架台、铁圈、铁夹、三角架、石棉网、烧杯、漏斗、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴。
只应用上述仪器或药品,不能进行的实验操作是A.蒸发B.萃取 C.过滤D.蒸馏3.现有三组溶液:①汽油和氯化钠溶液②39%的乙醇溶液③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是A.分液、萃取、蒸馏 B.萃取、蒸馏、分液 C.分液、蒸馏、萃取 D.蒸馏、萃取、分液4.已知丙酮(C3H6O)通常是无色液体,不溶于水,密度小于1g/mL,沸点约为55℃。
要从水与丙酮的混合液里将丙酮分离出来,下列方法最合理的是A.蒸馏 B.分液 C.过滤 D.蒸发5.为消除碘缺乏病,卫生部规定食盐必须加碘,其中碘以碘酸钾(KI03)形式存在。
已知溶液中IO3—可和I—发生反应IO3—+5I—+6H+==3I2+3H2O。
根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO3—。
可供选用的物质存:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食糖;⑥食醋;⑦白酒。
进行上述实验时必须使用的物质是A.①③ B.③⑥ C.②④⑥ D.①②④⑤⑦6.下列除去杂质的方法正确的是A.除去氮气中的少量水蒸气:通过足量过氧化钠固体B.除去铁粉中混有的铝:加入足量的稀氨水后过滤C.除去FeCl3酸性溶液中的少量的FeCl2:通人足量的C12D.除去苯中的苯酚:加入足量的浓溴水后再过滤7.下表为各物质中所含有的少量杂质,以及除去这些杂质应选用的试剂或操作方法。
正确的一组为A 8.工业上根据NaHCO 3溶解度比NaCl 、Na 2CO 3、NH 4HCO 3、NH 4Cl 都小的性质,运用CO 2 + NH 3 + H 2O + NaCl = NaHCO 3↓+ NH 4Cl 的反应原理,最终可制备纯碱。
作业七氧化还原反应概念和规律

氧化还原反应概念和规律(建议用时40分钟)1.(2021年河北适应性测试)化学与生活密切相关。
下列叙述不涉及氧化还原反应的是( ) A.牙膏中添加氟化物用于预防龋齿B.绿化造林助力实现碳中和目标C.氯化铁用于蚀刻金属眼镜架D.可降解包装材料的完全降解有利于减少白色污染【解析】选A。
牙齿表面含有Ca5(PO4)3OH,使用含氟牙膏,会发生反应:Ca5(PO4)3OH(s)+F-(aq)Ca5(PO4)3F+OH-(aq),Ca5(PO4)3OH转化为更难溶的氟磷酸钙Ca5(PO4)3F,使沉淀溶解平衡正向移动,最终在牙齿表面形成难溶性的Ca5(PO4)3F,因此可防止龋齿,在转化过程中元素化合价没有发生变化,因此不属于氧化还原反应,A符合题意;绿化造林,通过绿色植物的光合作用将CO2转化为有机物,同时释放氧气,反应过程中元素化合价发生了变化,因此反应属于氧化还原反应,B不符合题意;氯化铁具有强的氧化性,能够与金属眼镜架中一些金属如Cu发生氧化还原反应,产生FeCl2、CuCl2,因此FeCl3溶液能用于蚀刻金属眼镜架,C不符合题意;可降解包装材料通过完全降解一般变为CO2、H2O等,在该转化过程中元素化合价发生变化,有电子转移,因此属于氧化还原反应,D不符合题意。
2.(2021年湖南适应性测试)已知反应:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O,下列关于该反应说法错误的是( )A.氧化性:NaClO3>Cl2B.当反应中有2 mol e-转移时,被氧化的HCl为4 molC.氧化产物和还原产物的物质的量之比为1∶2D.产物ClO2和Cl2都可以用于自来水消毒杀菌【解析】选B。
A项:在2NaClO3+4HCl ===2ClO2↑+Cl2↑+2NaCl+2H2O反应中,氯酸钠中氯元素的化合价降低被还原作氧化剂,对应的ClO2是还原产物,氯化氢中氯元素的化合价升高被氧化作还原剂,对应的Cl2是氧化产物,在同一个氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,则氧化性:NaClO3>Cl2,故A正确;B项:当反应中有2 mol e-转移时,氯化氢中氯元素的化合价由-1价升高到0价,则被氧化的HCl为2 mol,故B错误;C项:Cl2是氧化产物,ClO2是还原产物,由方程式2NaClO3+4HCl === 2ClO2↑+Cl2↑+2NaCl+2H2O 可知,氧化产物和还原产物的物质的量之比为1∶2,故C 正确;D 项:产物ClO 2和Cl 2都具有氧化性,可以用于自来水消毒杀菌,故D 正确。
(2024年高考真题)2024年普通高等学校招生全国统一考试化学试卷 全国甲卷(无答案)

2024年普通高等学校招生全国统一考试 全国甲卷化学试卷养成良好的答题习惯,是决定成败的决定性因素之一。
做题前,要认真阅读题目要求、题干和选项,并对答案内容作出合理预测;答题时,切忌跟着感觉走,最好按照题目序号来做,不会的或存在疑问的,要做好标记,要善于发现,找到题目的题眼所在,规范答题,书写工整;答题完毕时,要认真检查,查漏补缺,纠正错误。
注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上,并将自己的姓名、准考证号、座位号填写在本试卷上。
2.回答选择题时,选出每小题答案后,用2B 铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案标号。
涂写在本试卷上无效。
3.作答非选择题时,将答案书写在答题卡上,书写在本试卷上无效。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Zn 65 Pb 207一、选择题:本题共13小题,每小题6分,共78分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.人类对能源的利用经历了柴薪、煤炭和石油时期,现正向新能源方向高质量发展。
下列有关能源的叙述错误的是( )A .木材与煤均含有碳元素B .石油裂化可生产汽油C .燃料电池将热能转化为电能D .太阳能光解水可制氢8.下列过程对应的离子方程式正确的是( )A .用氢氟酸刻蚀玻璃:2--+342SiO +4F +6H =SiF +3H OB .用三氯化铁溶液刻制覆铜电路板:3+2+2Fe +3Cu=3Cu +2FeC .用硫代硫酸钠溶液脱氯:2-2--+23223S O +2Cl +3H O=2SO +4Cl +6HD .用碳酸钠溶液浸泡锅炉水垢中的硫酸钙:2-2-4334CaSO +CO =CaCO +SO 9.我国化学工作者开发了一种回收利用聚乳酸(PLA )高分子材料的方法,其转化路线如下所示。
( )下列叙述错误的是( )A .PLA 在碱性条件下可发生降解反应B .MP 的化学名称是丙酸甲酯C .MP 的同分异构体中含羧基的有3种D .MMA 可加聚生成高分子3CH [2n CH C ]||-3COOCH10.四瓶无色溶液432323NH NO Na CO Ba(OH)AlCl 、、、,它们之间的反应关系如图所示。
DNA的细胞化学Feulgen反应
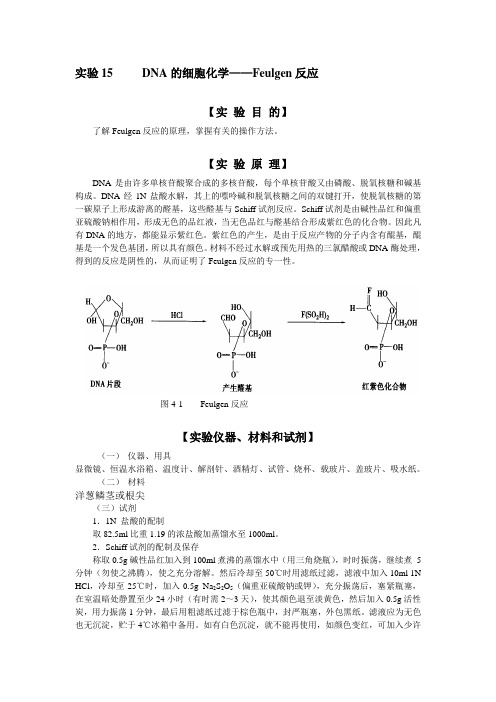
实验15 DNA的细胞化学——Feulgen反应【实验目的】了解Feulgen反应的原理,掌握有关的操作方法。
【实验原理】DNA是由许多单核苷酸聚合成的多核苷酸,每个单核苷酸又由磷酸、脱氧核糖和碱基构成。
DNA经1N盐酸水解,其上的嘌呤碱和脱氧核糖之间的双键打开,使脱氧核糖的第一碳原子上形成游离的醛基,这些醛基与Schiff试剂反应。
Schiff试剂是由碱性品红和偏重亚硫酸钠相作用,形成无色的品红液,当无色品红与醛基结合形成紫红色的化合物。
因此凡有DNA的地方,都能显示紫红色。
紫红色的产生,是由于反应产物的分子内含有醌基,醌基是一个发色基团,所以具有颜色。
材料不经过水解或预先用热的三氯醋酸或DNA酶处理,得到的反应是阴性的,从而证明了Feulgen反应的专一性。
图4-1 Feulgen反应【实验仪器、材料和试剂】(一)仪器、用具显微镜、恒温水浴箱、温度计、解剖针、酒精灯、试管、烧杯、载玻片、盖玻片、吸水纸。
(二)材料洋葱鳞茎或根尖(三)试剂1.1N 盐酸的配制取82.5ml比重1.19的浓盐酸加蒸馏水至1000ml。
2.Schiff试剂的配制及保存称取0.5g碱性品红加入到100ml煮沸的蒸馏水中(用三角烧瓶),时时振荡,继续煮5分钟(勿使之沸腾),使之充分溶解。
然后冷却至50℃时用滤纸过滤,滤液中加入10ml 1N HCl,冷却至25℃时,加入0.5g Na2S2O5(偏重亚硫酸钠或钾),充分振荡后,塞紧瓶塞,在室温暗处静置至少24小时(有时需2~3天),使其颜色退至淡黄色,然后加入0.5g活性炭,用力振荡1分钟,最后用粗滤纸过滤于棕色瓶中,封严瓶塞,外包黑纸。
滤液应为无色也无沉淀,贮于4℃冰箱中备用。
如有白色沉淀,就不能再使用,如颜色变红,可加入少许偏重亚硫酸钠或钾,使之再转变为无色时,仍可再用。
3.亚硫酸水取200ml自来水,加10ml 10%偏重亚硫酸钠(或偏重亚硫酸钾)水溶液和10ml 1N HCl,三者于使用前混匀。
2023衡水泰华中学(原衡水一中)决胜高考《化学》暑假必刷密卷第19套(新高考版)试题及答案
励志格言:幸福不会从天而降,梦想不会自动成真。
实现我们的奋斗目标,开创我们的美好未来,必须紧紧依靠人民、始终为了人民本套亮点:汇集电化学各地最新模拟题,有基础考查题,也有新颖且有思维量的题目,充2,请一律用0.5或以上的黑色中性签字笔在规定的答题纸上做答,注意书写规范;3,做题不改错,等于没有做!做完之后,要求依照答案用红笔自判所有主客观题,并算出总得分,请家长签字确认,并在积累本进行认真的错题整改反思,并把本套题的主要收获、主要不足和反思写到每套题所附的反思纸上,开学上交。
B.放电时NaCl溶液的pH减小C.放电时NaCl溶液的浓度增大D.每生成21mol Cl,电极a质量理论上增加23g2.(2022·浙江·高考真题)下列说法正确的是A.工业上通过电解六水合氯化镁制取金属镁B.接触法制硫酸时,煅烧黄铁矿以得到三氧化硫C.浓硝酸与铁在常温下不能反应,所以可用铁质容器贮运浓硝酸D.“洁厕灵”(主要成分为盐酸)和“84消毒液”(主要成分为次氯酸钠)不能混用3.(2022·全国·高考真题)2Li-O电池比能量高,在汽车、航天等领域具有良好的应用前景。
近年来科学家研究了一种光照充电2Li-O电池(如图所示)。
光照时,光催化电极产生电子()e-和空穴()h+,驱动阴极反应()Li e Li+-+=和阳极反应(Li2O2+2h+=2Li++O2)对电池进行充电。
下列叙述错误的是A.充电时,电池的总反应222Li O2Li O=+B.充电效率与光照产生的电子和空穴量有关C.放电时,Li+从正极穿过离子交换膜向负极迁移D.放电时,正极发生反应222O2Li2e Li O+-++=第2页共14页4.(2021·山东·高考真题)以KOH 溶液为离子导体,分别组成CH 3OH—O 2、N 2H 4—O 2、(CH 3)2NNH 2—O 2清洁燃料电池,下列说法正确的是A .放电过程中,K +均向负极移动B .放电过程中,KOH 物质的量均减小C .消耗等质量燃料,(CH 3)2NNH 2—O 2燃料电池的理论放电量最大D .消耗1molO 2时,理论上N 2H 4—O 2燃料电池气体产物的体积在标准状况下为11.2L5.(2021·全国·高考真题)沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率,为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。
江苏省高三化学二轮复习 专题18《化学反应速率及化学平衡》课时作业
专题十八 化学反应速率及化学平衡作业纸1.下列事实不能平衡移动原理来解释的是 A .往硫化氢水溶液中加碱有利于S 2-增多B .500℃左右比室温更有利于合成氨的反应C .加入催化剂有利于氨合成反应D .合成氨中采用氮气与氢气物质的量1.07:3 2.一定条件下,体积为10L 的密闭容器中,1molX 和1molY 进行反应: 2X(S )+Y(g)Z(g),经60s 达到平衡,生成0.3molZ 。
下列说法正确的是A .以X 浓度变化表示的反应速率为0.001mol/(L·S)B .将容器体积变为20L ,Z 的平衡浓度变为原来的0.5倍C .若增大压强,则物质Y 的转化率减小D .若升高温度,X 的体积分数增大,则该反应的△H 〈03.下列有关工业生产的叙述正确的是 A .合成氨生产过程中将NH 3液化分离,可加快正反应速率,提高N 2、H 2的转化率 B .在铁管上镀锌,用铁管作阳极,锌块作阴极C .电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl 2进入阳极室D .电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小4.铝粉和碘甲烷(CH 3I )制备(CH 3)3Al 时,于100℃搅拌 6 h 产率约10%,若用超声波则室温时 2 h 的产率可达96%。
有关叙述正确的是A 、超声波使铝粉于CH 3I 中乳化为胶体B 、超声波比搅拌使反应速率加快更为显著C 、超声波使两物质接触点急骤升温D 、超声波促使CH 3I 分解为CH 4和I 25.将一定量的固体42SO Ag 置于容积不变的密闭容器中(装有少量52O V ),某温度下发生反应:(s)SO Ag 42)(g SO )O(s Ag 32+,)(g 2SO 3)(g O )(g 2SO 22+,反应经过10 min 达到平衡,测得C SO3=0.4 mol/L ,C SO2=0.1 mol/L ,则下列叙述中不正确的是A .容器里气体的密度为1L g 40-⋅ B .化学反应速率 342SO SO Agv v =C .在这10 min 内的平均反应速率112O minL mol 0.005--⋅⋅=v D .S03的分解率为20%6.在恒温时,一固定容积的容器内发生如下反应:2NO 22O 4(g),达平衡时,再向容器内通入一定量的NO 2(g),重新达到平衡后,与第一次平衡时相比,NO 2的体积分数 A .不变B .增大C .减小D .无法判断7. 已知反应mX(g)+nY(g)qZ(g)的△H <0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是 A.通入稀有气体使压强增大,平衡将正向移动 B.X 的正反应速率是Y 的逆反应速率的m/n 倍C.降低温度,混合气体的平均相对分子质量变小D.增加X 的物质的量,Y 的转化率降低 8.合成氨工业对国民经济和社会发展具有重要的意义。
鲁科版高中化学选择性必修1化学反应原理精品课件 第3章物质在水溶液中的行为 分层作业17 盐类的水解
O
H
O+CO
↑+2OH
2
2
2
3
B.NH4Cl:NH4++H2O
NH3·H2O+OHC.CuSO4:Cu2++2H2O
Cu(OH)2+2H+
D.NaF:F-+H2O
HF+OH-
解析 多元弱酸酸根离子分步水解,多元弱碱阳离子水解一步写出,故A错
误,C正确;B中电荷不守恒;D应用“
解)程度。根据电荷守恒 c 平(NO-2 )+c 平(OH-)=c 平(H+)+c 平(Na+),c 平(H+)>
c 平(OH-),则 c 平(NO-2 )>c 平(Na+),由于水解程度小,故 c 平(NO-2 )>c 平(Na+)>c 平(H+)
>c 平(OH-)。
(3)pH=3 的 HNO2 溶液中 c 平(H+)=10-3 mol·L-1,则 c 平(HNO2)远大于 10-3 mol·L1
解,HCO-3 、CH3COO-对 NH4+的水解都有促进作用,故 NH4HSO4 溶液中 NH4+
的浓度最大。
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
12.为使Na2S溶液中
平 (Na+ )
平 (S2- )
的量的NaOH固体
进电离和水解,所以①CH3COOH溶液中c(CH3COO-)增大,②CH3COONa溶
液中c(CH3COO-)减小,故D不符合题意。
江苏省高三化学二轮复习 专题15《离子共存与离子方程式》课时作业
专题十五 离子共存与离子方程式作业纸1.若溶液中由水电离产生的C (OH -)=1×10—14mol ·L -1,此溶液中一定可以大量共存的离子组是A. Al 3+、Na +、NO 3-、Cl -B. K + 、Na +、Cl -、NO 3-C. K +、Na +、Cl -、AlO 2-D. K +、NH 4+、SO 32-、NO 3-2.某溶液既能溶解Al(OH)3,又能溶解H 2SiO 3,在该溶液中可以大量共存的离子组是A .K +、Na +、HCO 3-、NO 3-B .Na +、SO 42-、Cl -、ClO -C .H +、Mg 2+、SO 42-、NO 3-D .Ag +、K +、NO 3- 、Na +3.下列各组离子在溶液中不能大量共存,且加入过量NaOH 溶液或过量稀盐酸均能得到澄清溶液的是A . Fe 3+、Cl -、Na +、SO 42-B . Al 3+、Na +、CO 32-、NO 3-C . A g +、Na +、SO 42-、NO 3-D . AlO 2-、CO 32-、K +、Na +4.某能使石蕊试液变红的溶液中,能大量存在的离子是A .Al 3+NH 4+SO 42-Cl - B .Na +Mg 2+ HCO 3- NO 3-C .K +Na +AlO 2- Cl -D .Fe2+K +NO 3-Cl -5.在pH =0的无色透明溶液中,因发生氧化还原反应而不能大量共存的离子组是A .Na +、K +、MnO 4—、Cl —B .Cl —、S 2O 32—、K +、Na +C .Na +、Cl —、CH 3COO —、K +D .K +、I —、Na +、ClO —6.常温下测得某无色溶液中由水电离出的H +浓度为1×10—13mol/L ,又知该溶液中还有NO -3,Na +,Cl -,那么该溶液中还一定..存在的离子是 A .AlO 2—、ClO — B .Mg 2+、、SO 42— C .Fe 2+ 、Cu 2+ D .Ba 2+、K + 7.对下列各组离子的叙述不正确的是A .H +、AlO 2—、Ba 2+、HCO 3—不能在水中大量共存B .Mg 2+、NH 4+、Fe 2+、NO 3—能在酸性溶液中大量共存C .Fe 3+、K +、SCN -、Cl -能大量共存且使溶液显红色D .Na +、NO 3—、CO 32—、AlO 2—能在碱性溶液中大量共存 8.下列反应的离子方程式书写正确的是A .铁屑溶于足量稀硝酸:Fe +4H ++NO 3-=Fe 3++NO↑+2H 2OB .碳酸氢钙溶液中加入足量烧碱溶液:HCO 3-+OH -=CO 32-+H 2OC .过氧化钠固体与水反应: 2O 22—+2H 2O → 4OH -+O 2↑D .向KI 与稀硫酸的混合溶液中通入氧气:4H ++O 2+4I -===2I 2+2H 2O 9.下列离子方程式书写正确的是A .少量稀HNO 3中加入足量铁粉:Fe+4H ++NO 3-===NO↑+Fe 3++2H 2OB .以石墨作电极电解MgCl 2溶液:2Cl -+2H 2O 2OH -+H 2↑+Cl 2↑C .NH 4HCO 3溶液中加入过量石灰水:HCO3+Ca 2++OH -===CaCO 3↓+H 2OD .沸水中滴加FeCl 3饱和溶液制备Fe(OH)3胶体:Fe 3++3H 2O Fe(OH)3(胶体)+3H +10.下列反应的离子方程式正确的是①亚硫酸钠溶液中加入硝酸:SO 32-+ 2H += H 2O + SO 2↑ ②铜片跟浓硝酸反应:Cu + 2NO 3-+4H Cu 2++2NO 2↑+2H 2O ③向Ba(OH)2溶液中逐滴加入NH 4HSO 4溶液至刚好沉淀完全: Ba 2++2OH -+H ++ SO 42- + NH 4+= BaSO 4↓+ NH 3•H 2O+H 2O④0.1molFeBr 2中通入0.1molCl 2:2Fe 2++4Br -+3Cl 2=2Fe 3++2Br 2 +6Cl - ⑤硫化钠的水解:S 2-+ 2H 2O H 2S + 2OH -⑥向苯酚钠溶液中通入少量CO 2:C 6H 5O -+CO 2+H 2O→C 6H 5OH +HCO 3- A .①②③ B.②③⑥C .③④⑥D .④⑤⑥ 11. 某溶液可能是由Mg 2+、Ba 2+、Al 3+、K +、Cl -、SO 42-、HCO 3-、NO 3-中的几种组成,进行如下实验:(1)取样后在溶液中加入足量NaOH 溶液,生成的沉淀会部分溶解。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
翔宇监利中学高二化学作业纸:选修四第二章(实验班、平行班) 编写人:黎宏涛 审核人:朱作军
学号 班级 姓名
第四节 化学反应进行的方向
1.( )下列表述中正确的是
A .任何能使熵值增大的过程都能自发进行
B .△H <0,△S >0的化学反应一定能自发进行
C .已知热化学方程式2SO 2(g)+O 2(g)
2SO 3(g) △H =-QkJ·mol -
1(Q >0),则将
2mol SO 2(g) 和1mol O 2(g) 置于一密闭容器中充分反应后放出Q kJ 的热量
D .稀溶液中1mol NaOH 分别和1mol CH 3COOH 、1molHNO 3反应,两者放出的热量一样多 2.( )下列表述不正确...
的是 A .对于一个确定的反应来说,平衡常数的数值越大,反应限度越大 B .铝热反应会放出大量的热,因此常温下就能顺利发生
C .碳酸铵[(NH 4)2CO 3]在室温下就能自发地分解产生氨气,碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大
D .对于化学反应COCl 2(g )
CO (g )+Cl 2(g ) ΔH <0当反应达平衡时,恒温恒
压条件下通入Ar ,能提高COCl 2的转化率
3.( )工业上可利用合成气(CO 和H 2的混合气体)生产甲醇。
已知: CO(g)+2H 2(g)
CH 3OH(g) ΔH =—92.9kJ/mo1。
一定条件下,该反应在一体积固定的密闭容
器中达到平衡。
下列说法正确的是
A .该反应的△S <0
B .该反应在任何温度下均能自发进行
C .向容器中充入少量He ,平衡向正反应方向移动
D .升高温度平衡向正反应方向移动 4.( )250℃和1.01×105Pa 时,反应 2N 2O 5(g)=4NO 2(g )+O 2(g)△H =+56.76kJ•mol -1,自发进行的原因是 A .是吸热反应 B .是放热反应 C .是熵减少的反应 D .熵增大效应大于焓变效应。
5.( )下列说法不正确...
的是 A .化学反应过程中,一定有化学键的断裂和形成 B .盖斯定律实质上是能量守恒定律的体现
C .反应前后原子种类和数目不变遵循的是质量守恒定律
D .如果某化学反应的∆H 和∆S 均小于0,则反应一定能自发进行
6.( )金属锡的冶炼常用焦炭作还原剂:SnO 2(s )+2C(s)===Sn(s)+2CO(g)↑,反应过程中能量的变化如图所示。
下列有关该反应的ΔH 、ΔS 的说法中正确的是 A .ΔH<0 ΔS<0 B .ΔH>0 ΔS<0 C .ΔH<0 ΔS>0 D .ΔH>0 ΔS>0 7.( )下列说法中正确的是
A .同温同压下,H 2(g)+Cl 2(g)= 2HCl(g)在光照条件下和点燃条件下的ΔH 不同
B .常温下,2A(s)+B(g)= 2C(g)+D(g)不能自发进行,则该反应焓变一定大于零
C .1mol 硫酸与1molBa(OH)2完全中和所放出的热量为中和热
D .在25℃、101KPa 时,2mol S 的燃烧热是1mol S 的2倍
8.( )关于下列过程熵变的判断不正确的是
A .溶解少量食盐于水中,ΔS >0
B .纯碳和氧气反应生成CO(g),ΔS >0
C .H 2O(g)变成液态水,ΔS >0
D .CaCO 3(s)加热分解为CaO 和CO 2(g),ΔS >0
9.( )下列关于化学反应的熵变的叙述中,正确的是
A .化学反应的熵变与反应的方向无关
B .化学反应的熵变直接决定了反应的方向
C .熵变为正的反应都是混乱度增大的反应
D .能自发进行的反应熵变一定都为正 10.( )下列过程属于熵(S)增加的是
A .一定条件下,水由气态变成液态
B .高温高压条件下使石墨转变成金刚石
C .4NO 2(g)+O 2(g)=2N 2O 5 (g)
D .CaCO 3(s)=CaO(s)+CO 2(g) 11.( )下列说法正确的是
A .放热反应在常温下一定很容易发生
B .决定化学反应速率的主要因素是反应物的浓度、压强、温度、催化剂等
C .熵增加且放热的反应一定是自发反应
D .非自发的反应即不可能进行的反应 12.( )某反应2AB(g)
C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进
行,则该反应的ΔH 、ΔS 应为
A .ΔH <0,ΔS >0
B .ΔH <0,ΔS <0
C .ΔH >0,ΔS >0
D .ΔH >0,ΔS <0 13.( )对于化学反应方向的确定,下列说法正确的 A .反应的焓变是决定反应能否自发进行的唯一因素
B .温度、压强一定时,放热反应能自发进行
C .固体的溶解过程与焓变无关
D .在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 题号 1 2 3 4 5 6 7 8 9 10 11 12 13 答案
14.能源短缺是人类社会面临的重大问题。
甲醇是一种可再生能源,具有广泛的开发和应用前
景。
工业上合成甲醇的反应为:CO(g)+2H 2(g)
CH 3OH(g);ΔH
(1)已知,该反应在300℃,5MPa 条件下能自发进行,则ΔH 0,ΔS 0(填“<,>或=”)。
(2)在300℃,5MPa 条件下,将0.20mol 的 CO 与0.58mol H 2的混合气体充入2L 密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。
①在0~2min 内,以H 2表示的平均反应速率
为
,CO 的转化率为 。
②列式计算....
300℃时该反应的平衡常数K = 。
③300℃时,将0.50mol CO 、1.00mol H 2和1.00 mol CH 3OH 充入容积为2L 的密闭容器中,此时反应将 。
A .向正方向移动
B .向逆方向移动
C .处于平衡状态
D .无法判断 ④下列措施可增加甲醇产率的是 。
A .压缩容器体积
B .将CH 3OH(g)从体系中分离
C .充入He ,使体系总压强增大
D .再充入0.20mol CO 和0.58mol H 2。
