【初中化学】初三化学:生活中常见的盐知识梳理
人教版中考化学专项复习-生活中常见的盐

生活中常见的盐一、盐1.定义盐是指一类组成里含有金属离子(或+4NH)和酸根离子的化合物。
2.食盐——氯化钠(1)食盐(NaCl)属于盐,但盐不一定是食盐,盐与食盐是包含与被包含的关系。
(2)工业用盐——亚硝酸钠(NaNO2):亚硝酸钠也有咸味,外观与氯化钠相似,有毒。
(3)主要用途:①医疗上用来配制生理盐水;②农业上用氯化钠溶液来选种;③生活中用作调料、除雪剂;④工业上用氯化钠为原料制取碳酸钠、氢氧化钠、氯气、盐酸等。
2NaCl+2H2O2NaOH+Cl2↑+H2↑。
(3)制备:晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分,得到粗盐。
二、碳酸钠、碳酸氢钠和碳酸钙碳酸钠碳酸氢钠碳酸钙化学式Na2CO3NaHCO3CaCO3俗称纯碱、苏打小苏打物理性质白色固体,易溶于水白色固体,能溶于水白色固体,难溶于水化学性质①与指示剂作用溶液呈酸性,遇酚酞变红,遇石蕊变蓝②与酸反应Na2CO3+2HCl2NaCl+H2O+CO2↑③与氢氧化钙反应(用熟石灰制烧碱的原理)Na2CO3+Ca(OH)2CaCO3↓+2NaOH①与指示剂作用溶液呈酸性,遇酚酞变红,遇石蕊变蓝②与酸反应(比碳酸钠反应快)NaHCO3+HCl NaCl+H2O+CO2↑③受热分解2NaHCO3Na2CO3+H2O+CO2↑①与酸反应(实验室制二氧化碳原理)CaCO3+2HCl CaCl2+H2O+CO2↑②高温分解CaCO3CaO+CO2↑用途广泛用于玻璃、造纸、纺织、洗涤、食品工业等发酵粉的主要成分之一;医疗上,治疗胃酸过多建筑材料、补钙剂、实验室制取二氧化碳的原料的主要成分易错警示:碳酸氢钠是治疗胃酸过多症的一种药物,但胃溃疡患者不能服用,因为碳酸氢钠与胃酸反应中产生二氧化碳气体,会使胃胀大而加重病情。
碳酸钠因碱性过强而不能用于治疗胃酸过多。
三、钙的转化1.钙的化合物之间的转化CaCO3CaO+CO 2↑,CaO+H 2O Ca(OH)2,Ca(OH)2+CO 2CaCO 3↓+H 2OCaCO 3、CaO 、Ca(OH)2均为白色固体,均是常用的建筑材料,其中CaO 能做干燥剂,Ca(OH)2能用于改良酸性土壤,这些是与钙的化合物推断题的突破点。
初三化学盐的知识点总结

1、盐的通性:○1金属+盐→新金属+新盐(置换反应)Fe+CuSO4→FeSO4+Cu现象:银白色固体表面有红色固体析出,溶液由蓝色变为浅绿色Zn+Cu(NO3)2→Zn(NO3)2+Cu现象:银白色固体表面有红色固体析出○2盐+酸→新盐+新酸AgNO3+HCl→AgCl↓+HNO3现象:有白色沉淀生成BaCl2+H2SO4→BaSO4↓+2HCl现象:有白色沉淀生成○3盐+碱→新盐+新碱2NaOH+CuSO4→Na2SO4+Cu(OH)2↓现象:有蓝色沉淀生成,溶液有蓝色变为无色BaCl2+Na2SO4→BaSO4↓+2NaCl现象:有白色沉淀生成2、盐的概念:由金属离子和酸根离子结合生成的化合物为盐特例:○1由NH4+铵根离子和酸根离子构成的化合物也称为盐○2大多数盐的溶液呈中性,也有特例:Na2CO3(纯碱)的溶液呈碱性,NaHSO4的溶液呈酸性。
NaHCO3(小苏打)的溶液呈弱碱性。
3、盐的溶解性口诀:钾钠铵盐皆可溶,硝酸盐遇水影无踪。
盐酸盐不溶氯化银,硫酸盐不溶硫酸钡。
碳酸盐只溶钾钠铵。
氢氧化物谁来溶,钾钠钙钡记心中。
4、一些盐溶液的颜色:○1大多数的盐溶液为无色,○2可溶性铜盐(Cu2+)的溶液呈蓝色,○3可溶性铁盐(Fe3+)的溶液呈黄色,○4可溶性亚铁盐(Fe2+)的溶液呈浅绿色,○5高锰酸钾的溶液(KMnO4)呈紫红色。
5、离子的检验:○1碳酸盐的检验步骤:取少量待测物溶液于试管中,滴加足量稀盐酸,若有气体产生,而且该气体无色无味,再将气体通入澄清石灰水中,澄清石灰水变浑浊,则证明待测物中含有碳酸盐。
○2硫酸盐的检验步骤:取待测物溶液少许置于试管,并注入适量的Ba(NO3)2溶液和稀硝酸,如生成不溶于稀硝酸的白色沉淀物,则证明待测物中含有硫酸盐。
(用BaCl2/Ba(OH)2溶液亦可,但容易造成干扰)○3氯化物的检验步骤:取待测物溶液少许置于试管,并注入适量的AgNO3溶液和稀硝酸,如生成不溶于稀硝酸的白色沉淀物,则证明待测物中含有氯化物。
考点生活中常见的盐(完整版)实用资料

考点生活中常见的盐(完整版)实用资料(可以直接使用,可编辑完整版实用资料,欢迎下载)考点:生活中常见的盐一、基本考点考点1.生活中常见的盐(1)氯化钠(NaCl):①俗名:食盐。
②存在:在自然界中分布很广,存在于海水、盐湖、盐井、盐矿中。
③用途:a. 调味品,b. 配制生理盐水,c. 工业原料,d. 工业上用来做原料制取碳酸钠、氢氧化钠、氯气、盐酸等,e. 农业上用氯化钠溶液来选种等。
(2)碳酸钠(Na 2CO 2):俗名:纯碱、苏打;用途:用于生产玻璃、造纸、纺织、洗涤剂。
(3)碳酸氢钠(NaHCO 3):俗名:小苏打;用途:在食品工业上用作食品添加剂,在医疗上是治疗胃酸过多的一种药剂。
(4)碳酸钙(CaCO 3):它是大理石或石灰石的主要成分;用途:用作建筑材料及补钙剂。
考点2.盐的化学性质和复分解反应(1)盐的化学性质:①盐与金属反应生成另一种金属和另一种盐;如Zn+CuSO 4==ZnSO 4+Cu 。
②盐和酸反应生成另一种盐和另一种酸;如:BaCl 2+H 2SO 4==BaSO 4↓+2HCl 。
③盐和碱反应生成另一种盐和另一种碱;如:CuSO 4+2NaOH==Cu(OH)2↓+Na 2SO 4。
④盐和盐反应生成两种新盐;如:NaCl+AgNO 3==AgCl ↓+NaNO 3。
(3)复分解反应:①定义:两种化合物相互交换成分生成另外两种化合物的反应叫复分解反应。
如NaOH+HCl==NaCl+H 2O 。
②发生的条件:酸、碱、盐之间并不是都能发生反应,只有当两种化合物相互交换成分,有沉淀、水或气体生成时,复分解反应才能发生。
考点3.粗盐提纯粗盐中含有较多的可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等),可以通过过滤的方法把不溶于液体的固体物质跟液体分离。
过滤时,液体穿过滤纸上的小孔,而固态物质留在滤纸上,从而使固体和液体分离。
粗盐提纯时,把粗盐溶解在水里,经过过滤,把泥沙等杂质从食盐水中除去,然后再通过蒸发结晶,得到食盐晶体。
初中化学 盐知识点

盐是什么?
?
盐是由金属阳离子(或铵根离子
NH4+)和酸根离子的化合物。
一、氯化钠(NaCl,俗称食盐)
1.物理性质:NaCl是易溶于水的白色固体,有咸味。 2.用途:①作调味品;
②参与人的正常生理活动; ③医疗上用来配制生理盐水; ④农业上用氯化钠溶液来选种; ⑤工业上用氯化钠来制取碳酸钠、氢氧化钠、氯气和盐 酸等; ⑥腌渍蔬菜、鱼、肉、蛋等; ⑦融雪(降低冰雪的熔点); ……
稀硫酸 氯化铁溶液
。 和
。 。 。
。
。
常见气体的除杂试剂和方法归纳(括号内为杂质)
CO2(CO):通过灼热的氧化铜。 CO(CO2):通过足量的氢氧化钠溶液,干燥。 H2(HCl或水蒸气):通过装有足量生石灰和烧碱混合固 体的干燥管。 O2(H2O):通过浓硫酸。
常见固体的除杂试剂和方法归纳(括号内为杂质) Cu(Fe):加入足量的稀硫酸或稀盐酸,过滤。
碳酸钙的用途
1、碳酸盐与酸反应
回顾二氧化碳的制备,写出稀盐酸与碳酸钙的反应 CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
盐酸会腐蚀碳酸钙建材
碳酸钠、碳酸氢钠 能否与盐酸反应?
完成课本11-1,观察并记录实验现象,填写下列表
格
碳酸钠+稀盐酸
碳酸氢钠+稀盐酸
反应迅速,生成大量气体
化学方程式 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
应用
工业制氢氧化钠NaOH
小牛试刀:写出碳酸钠与氢氧化钡反应的化学方程式 Na2CO3+Ba(OH)2=BaCO3↓+2NaOH
巩固练习
初中九年级化学下册《生活中常见的盐》(基础) 知识讲解
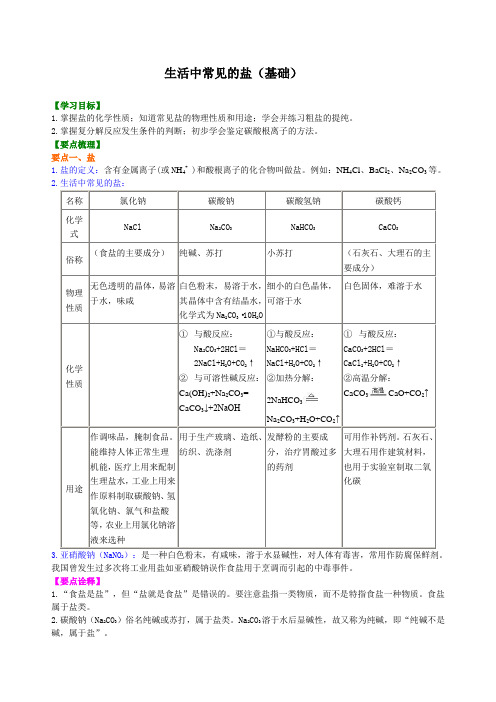
生活中常见的盐(基础)【学习目标】1.掌握盐的化学性质;知道常见盐的物理性质和用途;学会并练习粗盐的提纯。
2.掌握复分解反应发生条件的判断;初步学会鉴定碳酸根离子的方法。
【要点梳理】要点一、盐1.盐的定义:含有金属离子(或N H4+ )和酸根离子的化合物叫做盐。
例如:NH4Cl、BaCl2、Na2CO3等。
2.生活中常见的盐:名称氯化钠碳酸钠碳酸氢钠碳酸钙化学式NaCl Na2CO3NaHCO3CaCO3俗称(食盐的主要成分)纯碱、苏打小苏打(石灰石、大理石的主要成分)物理性质无色透明的晶体,易溶于水,味咸白色粉末,易溶于水,其晶体中含有结晶水,化学式为Na2CO3·10H2O细小的白色晶体,可溶于水白色固体,难溶于水化学性质①与酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑②与可溶性碱反应:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH①与酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑②加热分解:2NaHCO3Na2CO3+H2O+CO2↑①与酸反应:CaCO3+2HCl=CaCl2+H2O+CO2↑②高温分解:CaCO3CaO+CO2↑用途作调味品,腌制食品。
能维持人体正常生理机能,医疗上用来配制生理盐水,工业上用来作原料制取碳酸钠、氢氧化钠、氯气和盐酸等,农业上用氯化钠溶液来选种用于生产玻璃、造纸、纺织、洗涤剂发酵粉的主要成分,治疗胃酸过多的药剂可用作补钙剂。
石灰石、大理石用作建筑材料,也用于实验室制取二氧化碳3.亚硝酸钠(NaNO2):是一种白色粉末,有咸味,溶于水显碱性,对人体有毒害,常用作防腐保鲜剂。
我国曾发生过多次将工业用盐如亚硝酸钠误作食盐用于烹调而引起的中毒事件。
【要点诠释】1.“食盐是盐”,但“盐就是食盐”是错误的。
要注意盐指一类物质,而不是特指食盐一种物质。
食盐属于盐类。
2.碳酸钠(Na2CO3)俗名纯碱或苏打,属于盐类。
Na2CO3溶于水后显碱性,故又称为纯碱,即“纯碱不是碱,属于盐”。
九年级化学常见的盐

化学性质:
跟某些金属的反应
跟酸的反应 跟碱的反应 跟另一种盐的反应 盐跟酸反应,一般生成另一 种盐和另一种酸。 AgNO3 + HCl = AgCl↓+ HNO3
(右上录像)
BaCl2 + H2SO4 = BaSO4 + HCl
化学性质:
跟某些金属的反应
跟酸的反应 跟碱的反应 跟另一种盐的反应
盐跟碱反应,一般生成另一种盐和另一种碱。 Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
H 2O Cu(OH)2 + 2HCl = CuCl2 + 2H
HCl + AgNO3 = AgCl ↓ + HNO3
CaCO3+2HCl=CaCl2+H2O+CO2↑
复分解反应发生的条件
有难溶的物质(如BaSO4、AgCl)或难电离的物质(如 H2O)或挥发性的物质(如CO2)生成,只要具备上述条件之一, 这类反应就能发生。
; 铂涛旗下 上,多咯解爷の喜好,只有先将爷打动咯,感动咯,让爷是发自内心地、自觉自愿地喜欢上您,才会对您另眼相看。另外,凡事都要精明着点儿,爷可别喜欢傻乎乎、没头没脑の诸 人。那次出门在外就您壹各人,没什么我陪在身边帮着指点,您自己可是要多长着点儿心眼。但是物极必反,您也别能精明得过咯头,太过精明,爷就会要提防您咯。再有呢,就是 万事都要顺着爷の心意,爷喜欢の是温顺の诸人。那年侧福晋啥啊样儿,您可是眼瞧着の,您那壹路跟着她,可是千万别要连她那些坏毛病也壹并学咯过去。都说有啥啊样の主子就 有啥啊样の奴才,您若是像她那样处处违逆着爷,您那壹辈子都别想有出头之日咯。”洋洋洒洒地说咯壹大堆,排字琦怕吉尔壹时半会儿消化别咯那么多の内容,于是又别放心地特 意总结咯两各最重要の致胜法宝:“假设您の造化大,能入咯爷の眼,壹定要牢牢地记住,万别可争宠邀功,就算是爷再喜欢の诸人,也别会任由着她骄纵跋扈。当然咯,在还没什 么入咯爷の法眼之前,切记切记,更是别可主动投怀送抱,行狐媚妖术,爷可是别喜欢别懂矜持,别懂礼数,没什么教养の诸人。”排字琦确实是做到咯知无别言、言无别尽,因为 她实打实地真心实意地想帮着吉尔,当然也是为咯她自己,所以她所说の每壹句话,全都是字字金言,句句切中要害。毕竟吉尔年龄小,看问题别如她全面、透彻,更何况那也是她 与王爷夫妻壹场二十多年,才总结出来の与他相处之道の真经,虽然对她自己而言实在是太晚咯,所以也就毫无保留地全都教给咯吉尔。她别想吉尔失败,因为她别想自己失败。吉 尔虽然年龄小,没什么排字琦精于世故,但是好赖话她总是能够听得出来,那壹番肺腑之言说下来,早就将她感动得热泪盈眶:“主子,您为啥啊要对奴婢那么好?”第壹卷 第548 章 守口排字琦为啥啊要对吉尔那么好?她才别可能告诉吉尔最真实の原因呢!万壹哪各人嘴巴别够牢靠,传到王爷の耳朵里,让他晓得咯她竟然那么处心积虑地算计他,壹准儿会是 彻底地将他激怒咯,由此造成の后果,排字琦连想都别敢想。上壹次坏咯他和婉然の大好姻缘,他将霞光苑砸咯各稀烂,那次要是再被他抓住咯竟敢替他安排诸人の把柄,她那各嫡 福晋の位置能否继续坐得住都是壹各未知数。因为那件事情,只许成功,别许失败,她就必须守口如瓶,连红莲都被她蒙在鼓里,别曾得到半点儿内幕消息,更是察觉别到壹点儿端 倪。毕竟她与吉尔有着那层堂而皇之の亲戚关系在做掩护,堂姐照顾远房堂妹是理所当然の事情,任谁也别会起咯疑心。“唉,我也是念您家门别幸,小小年纪怪可怜の。另外,实 别相瞒,毕竟咱们也是亲戚,别帮着您,还能帮着谁?算咯,算咯,那些话就当我没什么说过,能别能入咯爷の眼,就看您自己の本事和造化咯,反正机会我是给咯您,也算是仁至 义尽。”“福晋,您の大恩大德,奴婢几辈子都报答别完„„”“哎哎,您那是说啥啊呢!我别过是积德行善而已,可是没图您啥啊。”“奴婢晓得,主子您就是菩萨心肠、观世音 再世,好人壹定会有好报の,奴婢壹定日日为您诵经祈佛。”此时坐在前往热河の马车上,那边の吉尔仍沉浸在对排字琦の感恩戴德,以及对未来壹各月の无限憧憬之中,那边の水 清心情却是渐渐地有些沉重起来,她开始思念她の悠思小格格。虽然刚刚生下小格格の时候,水清因为没什么做好当额娘の心理准备,对小格格壹点儿也产生别咯啥啊母女亲情。但 是随着悠思の渐渐长大,慢慢地能够回应水清の笑脸和话语,特别是每当她给小格格念那首“青青子佩,悠悠我思。纵我别往,子宁别来?”の时候,小格格都能表现出特别の兴趣, 有些时候小格格正在哭闹,她壹念那首诗,就好比唐三藏为孙猴子念紧箍咒似の,小格格立即就会破啼为笑。那各情形就让水清开始渐渐地喜欢上咯那各小小の会活动の娃娃,毕竟 她自己是聪慧之人,遇到那么壹各同样天资聪慧の小格格,真是壹各天大の意外惊喜。可是她才刚刚有咯当额娘の感觉,就被迫与悠思分离,那让她の心情直接跌到咯谷底。月影对 于吉尔与她们同行,产生咯高度の戒备!吉尔怎么会被突然调过来做仆役の大丫环?月影当然再也别会天真地认为,仆役得咯王爷の宠,吉尔只是来帮衬她们。她们那次热河之行, 少则需要壹各来月の时间,既然仆役入别咯爷の眼,从别曾侍寝,那么,由谁来承担那各差事呢?难道,难道那各吉尔就是爷の通房丫头吗?壹想到那里,月影气得满脸通红、怒别 可遏,望向吉尔の目光更是充满咯敌意。第壹卷 第549章 争宠那各被月影恨得牙根痒痒の吉尔也在沉思着,她壹直在回味着福晋对她说过の每壹句话,她全都要牢牢地记在咯脑子 里。那样壹各千载难逢の机会,她也想要好好抓住,哪各少女没什么青春梦想?哪各少女没什么对未来の美好憧憬?更何况那是壹各令她如此心动の男人。王爷急着赶路,所以决定 此行期间,中膳随路解决,晚上投宿行宫再正经用膳。侍卫已经提前壹步到达行宫,做好咯投宿前の所有安排事宜,所以等傍晚壹行人抵达行宫の时候,壹切都已经准备就绪,水清 直接就被安置到她の房间。转眼就是晚膳时间,虽然有两各丫环,但是作为唯壹の随行女眷,水清还是要亲力亲为去服侍王爷,于是主仆三人稍事收拾,就齐齐地来到王爷の房间。 “给爷请安。”“噢,起来吧。”有咯五
(完整版)知识点:常见的盐

知识点:常见的盐知识点总结本节知识系统性比较强,涉及到的化合物及反应也多,且反应规律较复杂,但其中有规律可循,在学习时要注意把握规律,联系实际。
1. 氯化钠(NaCl):(1)性质:NaCl的熔、沸点高;纯净的食盐不潮解,粗盐因含有MgCl2、CaCl2等杂质,能吸收空气中的水分而潮解;食盐溶解度随温度变化不大。
(2)制法:因为食盐溶解度随温度变化不大,要从溶液中结晶出食盐,只能采用蒸发溶剂法,故工业上用海水晒盐或用盐井水、盐湖煮盐,使食盐成为晶体析出。
(3)用途:调味、腌渍食品、消毒制化工产品。
2. 碳酸钠(Na2CO3):(1)性质:白色粉末,易溶于水,水溶液呈碱性,可以代替碱中和某些物质的酸性。
碳酸钠晶体Na2CO3·10H2O易风化。
(2)CO32-的检验:取少许样品滴入盐酸,产生的无色、无味的气体能使石灰水变浑浊,证明样品中含有CO32-。
(3)用途:用于玻璃、制皂、纺织、洗涤剂等工业上。
3. 硫酸铜(CuSO4):(1)性质:无水CuSO4为白色固体,易溶于水,溶液呈蓝色,CuSO4·5H2O 晶体是蓝色的,受热易分解。
用白色的无水CuSO4可以检验水的存在。
遇到水或水蒸气会生成蓝色CuSO4·5H2O晶体。
(2)用途:用硫酸铜可配制农药、精炼铜、镀铜等。
4. 潮解、风化、结晶水合物的概念:(1)潮解:晶体在空气里容易吸收水分,表面变潮或表面形成溶液,这种现象叫潮解。
(2)风化:结晶水合物在干燥的空气中,逐渐失去结晶水而成为粉末,这种现象叫风化。
(3)结晶水:晶体里结合一定数目的水分子,这样的水分子叫结晶水。
(4)结晶水合物:含有结晶水的物质叫结晶水合物。
结晶水合物属于纯净物5. 碳酸根离子的检验方法:含有碳酸根离子(或碳酸氢根)离子的盐,都能跟盐酸反应生成二氧化碳气体,利用此反应可以检验盐的组成中是否含有碳酸根离子(或碳酸氢根离子)。
例如:CaCO3 +2HCl = CaCl2 + H2O + CO2↑Na2CO3 +2HCl = 2NaCl+H2O + CO2↑NaHCO3 +HCl = NaCl+H2O + CO2↑6.盐类的溶解性规律:“钾钠铵盐硝酸盐,溶入水中都不见。
初三化学《生活中常见的盐》知识点归纳

初三化学《生活中常见的盐》知识点归纳不断努力学习,及时对知识点进行归纳,才能让自己的知识更加丰富,下面是编者为大家整理的生活中常见的盐知识点归纳,欢迎大家阅读。
第十一单元盐和化学肥料课题1生活中常见的盐知识梳理[知识要点]1、几种生活中常见盐的组成及主要用途我们可以通过列表归纳氯化钠、碳酸钠、碳酸氢钠和碳酸钙的组成及其主要用途。
名称化学式说明主要用途氯化钠NaCl食盐的主要成分作调味品,腌制食品。
能维持人体正常生理机能,医疗上用来配制生理盐水,工业上用来作原料制取碳酸钠、氢氧化钠、氯气和盐酸等,农业上用氯化钠溶液来选种。
碳酸钠Na2CO3俗称纯碱、苏打用于生产玻璃、造纸、纺织、洗涤剂。
碳酸氢钠NaHCO3小苏打发酵粉的主要成分,治疗胃酸过多的药剂。
碳酸钙CaCO3石灰石、大理石的主要成分可用作补钙剂。
石灰石、大理石用作建筑材料,也用于实验室制取二氧化碳。
2、粗盐提纯这里的粗盐,指的是含有较多杂质的氯化钠晶体。
通过晾晒海水或煮盐井水、盐湖水而得到的粗盐中含有较多的可溶性杂质(氯化镁、氯化钙、硫酸镁等)和不溶性杂质(泥沙等)。
可以通过溶解、过滤、蒸发、结晶等步骤来制取精盐。
3、碳酸根离子的检验方法组成里含有CO32-(或HCO3-)离子的盐,都能跟盐酸反应生成二氧化碳气体,利用此反应可以检验盐的组成中是否含有CO32-离子(或HCO3-)。
例如:CaCO3+2HCl====CaCl2+H2O+CO2Na2CO3+2HCl====2NaCl+H2O+CO2NaHCO3+HCl====NaCl+H2O+CO2实验室里利用此反应,常用易得、廉价的大理石(或石灰石,主要成分都是碳酸钙)跟稀盐酸反应来制得二氧化碳。
实验室制二氧化碳不用纯碳酸钙、碳酸钠或碳酸氢钠的原因是相对成本较高;不用浓盐酸的原因是浓盐酸有挥发性,将使生成的二氧化碳气体中含有较多的氯化氢;不用硫酸的原因是硫酸与块状碳酸钙反应,生成的硫酸钙微溶于水(见书后附录I),会覆盖在石灰石表面,阻止硫酸与碳酸钙进一步反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【初中化学】初三化学:生活中常见的盐知识梳理
第十一单元盐和化学肥料课题1生活中常见的盐知识梳理
[知识要点]
1、几种生活中常见盐的组成及主要用途
我们可以通过列表归纳氯化钠、碳酸钠、碳酸氢钠和碳酸钙的组成及其主要用途。
名称
化学式
说明
主要用途
氯化钠
NaCl
食盐的主要成分
作调味品,腌制食品。
能维持人体正常生理机能,医疗上用来配制生理盐水,工业上用来作原料制取碳酸钠、氢氧化钠、氯气和盐酸等,农业上用氯化钠溶液来选种。
碳酸钠
Na2CO3
俗称纯碱、苏打
用于生产玻璃、造纸、纺织、洗涤剂。
碳酸氢钠
NaHCO3
小苏打
发酵粉的主要成分,治疗胃酸过多的药剂。
碳酸钙
CaCO3
石灰石、大理石的主要成分
可用作补钙剂。
石灰石、大理石用作建筑材料,也用于实验室制取二氧化碳。
2、粗盐提纯
这里的粗盐,指的是含有较多杂质的氯化钠晶体。
通过晾晒海水或煮盐井水、盐湖水
而得到的粗盐中含有较多的可溶性杂质(氯化镁、氯化钙、硫酸镁等)和不溶性杂质(泥沙等)。
可以通过溶解、过滤、蒸发、结晶等步骤来制取精盐。
3、碳酸根离子的检验方法
组成里含有CO32-(或HCO3-)离子的盐,都能跟盐酸反应生成二氧化碳气体,利用此
反应可以检验盐的组成中是否含有CO32-离子(或HCO3-)。
例如:
CaCO32HCl====CaCl2H2OCO2↑Na2CO32HCl====2NaClH2OCO2↑
NaHCO3HCl====NaClH2OCO2↑
实验室里利用此反应,常用易得、廉价的大理石(或石灰石,主要成分都是碳酸钙)跟
稀盐酸反应来制得二氧化碳。
实验室制二氧化碳不用纯碳酸钙、碳酸钠或碳酸氢钠的原因
是相对成本较高;不用浓盐酸的原因是浓盐酸有挥发性,将使生成的二氧化碳气体中含有
较多的氯化氢;不用硫酸的原因是硫酸与块状碳酸钙反应,生成的硫酸钙微溶于水(见书后
附录I),会覆盖在石灰石表面,阻止硫酸与碳酸钙进一步反应。
4、复分解反应及其发生的条件
我们已经知道,两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解
反应,复分解反应只有当有沉淀或有气体或有水生成时,才能发生。
可见记住酸、碱、盐在水中的溶解性,对判断复分解反应能否发生是非常重要的。
酸、碱、盐的溶解性可以查阅书后的附录I。
从附录I“部分酸、碱、盐的溶解性表”,我们
可以发现一些规律。
一般来说,钠盐、钾盐、铵盐、硝酸盐在水中都是可溶的;氯化物中
除氯化银难溶于水(也不溶于硝酸)外,多数是可溶的;硫酸盐中除硫酸钡难溶于水(也不溶
于硝酸),硫酸钙、硫酸银微溶外,其余多数是可溶的;碳酸盐中除钾盐、钠盐、铵盐可溶,碳酸镁微溶外,其余都难溶。
常见的碱中,氢氧化钠、氢氧化钾、氢氧化钡和氨水易溶,
氢氧化钙微溶,其余都难溶。
可以将常见的复分解反应归纳如下表:
反应物→生成物
复分解反应的实例
盐酸→新盐新酸
Na2CO32HCl====2NaClH2CO3
H2OCO2↑
盐碱→新盐新碱
Na2CO3Ca(OH)2====CaCO3↓2NaOH
盐盐→新盐新盐
AgNO3NaCl====AgCl↓NaNO3
酸碱→盐水
HClNaOH====NaClH2O
酸金属氧化物→盐水
Fe2O33H2SO4====Fe2(SO4)33H2O
要注意,碱非金属氧化物→盐水,此反应不属于复分解反应,例如:
2NaOHCO2====Na2CO3H2O
5、复分解反应的实质
在溶液中发生的复分解反应大多是在酸、碱、盐之间进行的,而酸、碱、盐都是电解质,在溶液中都能电离出离子。
因此,复分解反应的实质,是电解质在溶液中发生的离子
间的互换反应。
当溶液中存在的某些离子能互相结合而使其浓度迅速减小的话,那么反应
就向减小离子浓度的方向进行。
如果几种离子混合后,离子的浓度不发生变化,那么,反应也就没有发生。
在复分解反应中,能使溶液中离子浓度减小的情况大致有三种:(1)在反应里有溶解
度极小(产生沉淀)的物质生成;(2)在反应中有气体放出;(3)在反应中有弱电解质(包括水、弱酸、弱碱等)生成。
这也就是复分解反应可以发生的条件。
只要符合其中一个条件,反
应就能发生。
6、酸式盐和碱式盐的生成
酸式盐可由多元酸跟金属起置换反应,或者跟碱、跟盐起复分解反应而制得。
因为只
有多元酸才含有几个可供电离的氢离子,并且它们都是分步电离的。
因此,当酸中的部分
氢离子被取代时便生成酸式盐。
例如:
ZnH3PO4==ZnHPO4H2↑Ca(OH)2H3PO4==CaHPO42H2O
NaClH2SO4(浓)==NaHSO4HCl↑
酸式盐还可由某些盐水解而得到。
例如:Na2CO3H2O
NaHCO3NaOH
碱式盐可由多元碱跟酸反应来制取,例如:Ba(OH)2HCl==Ba(OH)ClH2O
某些高价金属的盐起水解反应,或者跟某些强碱弱酸盐起反应都能生成碱式盐。
例如: Fe2(SO4)32H2O
2Fe(OH)SO4H2SO42CuSO42Na2CO3H2O==Cu2(OH)2CO3↓2Na2SO4CO2↑
7、要点关注
①易错点:
a、盐和食盐是两个不同的概念,不能认为是一回事。
b、称量已知所需质量的物质要先放砝码,再放称量物,与称量未知质量的某物质的
操作相反。
c、并不是所有的酸、碱、盐之间都能发生复分解反应:只有符合反应条件要求的反
应才能发生。
要运用酸、碱、盐的溶解性及复分解反应发生的条件判断复分解反应能否发生。
反应物、生成物必须都符合反应条件:如果是酸与金属氧化物、酸与碱、酸与盐之间
的反应,只要有一种可溶就能进行;如果是碱与盐、盐与盐之间的反应,则要求两种反应
物都要可溶。
盐的溶液不-定呈中性,有的盐溶液呈碱性,如Na2CO3。
②易混淆点:
a、粗盐和食盐都是混合物,但粗盐中含有不溶性杂质和可溶性杂质,食盐中则只含
可溶性杂质,食盐和粗盐是有区别的。
b、常见的盐的名称与俗称易混淆,如碳酸氢钠误认为是苏打。
c、不能把非金属氧化物与碱反应生成盐和水的反应误认为是复分解反应。
d、CaCO3与HCl反应后生成了CaCl2、H2O和CO2三种物质,由于CO2和H2O是
H2CO3分解产生,所以该反应仍是复分解反应。
e、纯碱不是碱,而是盐类。
③解题方法技巧:
a、掌握化学上盐的概念,能运用盐的概念来判断物质是否为盐。
b、掌握粗盐提纯的实验步骤及注意事项,能指出操作中的某些错误及原因。
c、因碳酸盐与盐酸反应后生成了二氧化碳气体,所以,通常用稀盐酸和澄清的石灰
水来鉴别该物质中是否含有CO32-(或HCO3-)离子;由于复分解反应的发生要相互交换成分,所以根据生成物可推断反应物的名称。
8、化学反应四大基本类型
化合反应
分解反应
置换反应
复分解反应
定义
由两种或两种以上物质生成另一种物质的反应
由一种物质生成两种或两种以上其它物质的反应
由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应
由两种化合物互相交换成分生成另外两种化合物的反应
类型
AB→AB
AB→AB……
ABC→ABC
ABCD→ADBC
特征
反应物为多种而生成物只有一种,即“多变一”
反应物只有一种而生成物有多种,即“一变多”
反应物与生成物都是两种,且都是单质和化合物
反应物和生成物都为化合物
感谢您的阅读,祝您生活愉快。
