物质在水溶液中的稳定性
配离子中稳定存在,但在水溶液,Cu 却没有Cu2 稳定,Cu
上表列出了铜离子水合焓的能量分解结果,可以看到: (1) 在铜离子的水合焓中,铜离子与水分子之间的静电作用占 了绝对优势,其中Cu+占80.8%,Cu2+占92.8%。 (2) 共价作用在Cu+中占有重要的地位,接近20%,而在Cu2+ 中,共价作用相对较小,仅占7.21%。 (3) d9结构的Cu2+的配位场作用占4.3%,而d10结构的Cu+没有 这一项。 (4) 除此之外,d9结构的Cu2+还存在姜-泰勒畸变稳定化能。
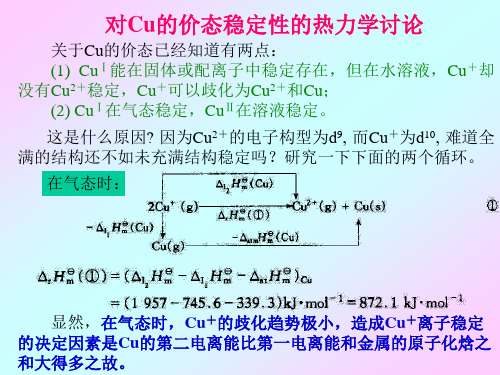
在气态时:
பைடு நூலகம்
显然,在气态时,Cu+的歧化趋势极小,造成Cu+离子稳定 的决定因素是Cu的第二电离能比第一电离能和金属的原子化焓之 和大得多之故。
在水溶液中
表明:在水溶液中,Cu+很容易歧化为 Cu2+和Cu。这是由 于Cu2+的水合焓很大,它补偿了Cu+气态歧化反应焓变的正值 和水合一价Cu+(aq)离子的脱水焓后还有剩余,从而改变了反应 自发进行的方向。
对Cu的价态稳定性的热力学讨论
关于Cu的价态已经知道有两点: (1) CuⅠ能在固体或配离子中稳定存在,但在水溶液,Cu+却 没有Cu2+稳定,Cu+可以歧化为Cu2+和Cu; (2) CuⅠ在气态稳定,CuⅡ在溶液稳定。 这是什么原因? 因为Cu2+的电子构型为d9, 而Cu+为d10, 难道全 满的结构还不如未充满结构稳定吗?研究一下下面的两个循环。
综上所述,在水溶液中, Cu2 + (aq) 比 Cu + (aq) 稳定 的主要原因是因为Cu2+与水的静电作用远大于Cu+。 其根源有两个:
一是Cu2+比Cu+的电荷大一倍, 离子半径又小于Cu+。 二是Cu2+为d9结构, 在水分子配位场的作用下, 发生d轨 道能级分裂, 得到配位场稳定化能和姜泰勒畸变稳定化能。
第四章配合物在溶液中的稳定性

如:第一胺与Ag+形成配合物,其pKa与logβ 的 数据见下表: 配体名称 pKa logβ 0.8 0.85 1.62 1.59 3.34 3.65 3.84 对硝基苯胺 2.0 间硝基苯胺 2.5 邻硝基苯胺 苯胺 甲胺 乙胺 丙胺 4.28 4.54 10.72 10.81 10.92
以logβ~pKa作图可以看出,Ag+与第一胺形成配 合物的稳定性与配体的碱性之间存在直线关系。
例如:丙二酸同金属离子生成无双键的六元 环螯合物,其中除Cu2+ 、Fe2+ 外,大多数不稳定。 但乙酰丙酮却可同大多数金属离子生成稳定的含双 键六元环螯合物。如图所示:
Cu2+ logβ 2=8.16 Fe2+ logβ 2=15.7
Cu2+ logβ 2=15.44 Fe2+logβ 2=26.7
但对Zn(Ⅱ)来说,其稳定性却是F->Cl->Br>I-,说明Zn(Ⅱ)的卤素离子配合物中以静电作 用为主。
④ 、d10构型的Ga(Ⅲ)、In(Ⅲ)、Tl(Ⅲ) 配合物的稳定性,与锌副族的情况类似,其中Tl (Ⅲ)的配合物最稳定,Ga(Ⅲ)和In(Ⅲ)的有 些配合物的稳定性顺序是Ga(Ⅲ)>In(Ⅲ),另一 些配合物则是Ga(Ⅲ)<In(Ⅲ)。 ⑤ 、d10构型的Cu(Ⅰ)、Ag(Ⅰ)、Au(Ⅰ) 配合物的稳定常数数据较少,它们与氨形成配合物 稳定性的顺序是Cu(Ⅰ)>Ag(Ⅰ)<Au(Ⅰ)。
第四章
4.1 4.2
配合物在溶液中的稳定性
中心原子性质对配合物稳定性的影响 配体性质对配合物稳定性的影响
4.3 配位原子性质和中心原子的关系
第四章 配合物在溶液中的稳定性
配合物在水溶液中的稳定性

[Ag(CN)2]- +
判断[Ag(NH3)2]+是否可能转化为[Ag(CN)2]-。
上页
下页
返回
帮助
§7–2 配合物在水溶液中的稳定性
第七章 配位平衡与配位滴定
上页
下页
返回
帮助
§7–2 配合物在水溶液中的稳定性
第七章 配位平衡与配位滴定
上页
下页
返回
帮助
§7–2 配合物在水溶液中的稳定性
第七章 配位平衡与配位滴定
Cu2+ + 4NH3
[Cu(NH3)4]2+
平衡浓度/( mol/L) 1.0×10-3
x
1.0
已知[Cu(NH3)4]2+ 的= 2.09×1013
上页 下页 返回 帮助
§7–2 配合物在水溶液中的稳定性
第七章 配位平衡与配位滴定
将上述各项代入累积稳定常数表示式:
K稳
[Cu(NH 3 ) 4 ] 2 [Cu 2 ][NH 3 ] 4
1.比较同类型配合物的稳定性 较高。但不同类型配合物的稳定性则不能仅用 K 比较。 稳
K 对于同类型配合物,稳定常数 稳 较大,其配合物稳定性
例1:比较下列两配合物的稳定性: [Ag(NH3)2]+ [Ag(CN)2]= 107.23 = 1018.74
由稳定常数可知[Ag(CN)2]-比[Ag(NH3)2]+稳定得多。
3.判断配离子与沉淀之间转化的可能性
配离子与沉淀之间的转化,主要取决与配离子的稳定性和 沉淀的溶解度。配离子和沉淀都是向着更稳定的方向转化。
【例3】
在1L[Cu(NH3)4]2+溶液中(c(Cu2+)为4.8×10-17mol/L), 加入0.001molNaOH,问有无Cu(OH)2沉淀生成? 若加入 0.001molNa2S,有无CuS沉淀生成? (设溶液体积基本不变)。
(完整版)初中化学溶液知识点总结

初中化学溶液知识点总结一、溶液和乳浊液1、定义:由一种或一种以上物质分散到另一种物质中形成均一、稳定的混合物2.溶液的特征:均一性:指溶液形成以后,溶液各部分的组成、性质完全相同。
如溶液中各部分密度、颜色等完全一样稳定性:指外界条件不变时溶液长期放置,溶质不会从溶液里分离出来注意:(1)溶液的关键词:均一、稳定、混合物。
均一、稳定的液体不一定是溶液,如水。
(2)判断某物质是否为溶液,一般看以下两点:①是否为均一、稳定的混合物;②一种物质是否溶解于另一种物质中。
(3)溶液是澄清、透明的,但不一定是无色的。
如CuSO4溶液为蓝色。
(4)一种溶液中可以含一种或多种溶质,但只有一种溶剂。
3、溶液的组成①从宏观上看,溶液是由溶质和溶剂组成的。
溶质:被溶解的物质溶剂:能溶解其它物质的物质②从微观上看,溶液的形成过程是溶质的分子(或离子)均一地分散到溶剂分子之间。
③溶液、溶剂和溶质之间的量的关系溶液质量=溶质质量+溶剂质量;溶液体积≠质体积+溶剂体积4、溶液中溶质、溶剂的判断①根据名称:溶液的名称一般为溶质的溶剂溶液,即溶质在前,溶剂在后,如植物油的汽油溶液中,植物油为溶质,汽油为溶剂;当溶剂为水时,水可以省略,如食盐水中食盐是溶质,水是溶剂;碘酒中碘是溶质,酒精是溶剂。
②若固、气体与液体混合,一般习惯将液体看作为溶剂,固、气体看作溶质③若是由两种液体混合组成的溶液,一般习惯上量多的作为溶剂,量少的看作溶质。
④两种液体混合且有水时,无论水多少,水一般作为溶剂•注意:a一般水溶液中不指名溶剂,如硫酸铜的溶液就是硫酸铜的水溶液,所以未指明溶剂的溶液,溶剂一般为水。
b、物质在溶解过程中发生了化学变化,那么在形成的溶液中,溶质是反应后且溶于水的生成物,如将足量的锌溶于稀硫酸所得到的溶液中,溶质是反应后且溶于水的生成物,如将足量的锌溶于稀硫酸所得到的溶液中,溶质是生成物硫酸锌,而不是锌;5. 影响因素溶解的因素有:①温度②溶质颗粒大小③搅拌6.乳浊液定义:由小液滴分散在液体里形成的混合物叫做乳浊液。
冶金原理(8.2)--铁-水系φ—pH的测定

铁-水系φ—pH的测定一、实验目的现代湿法冶金已广泛使用φ-pH图来分析物质在水溶液中的稳定性即各类反应的热力学平衡条件,如已知金属-水系φ-pH图,可以找出浸出与净化沉淀此种金属的电位和pH值的控制范围。
通过对Fe-H2O中不同pH值对应的电位测定,绘制出Fe-H2O系φ—pH图,从而加深对溶液中pH与氧化还原电位的了解以及有关φ—pH图的理论知识的理解。
二、实验原理本实验以Fe-H2O系为例,其三类反应具体平衡条件如下:一类反应(只有电子得失):…………………………(1-1)0=-(-17780)/(1×23060)=0.77(V)1-1当温度T=298K,,得φ1-1=0.77(V)Fe2++2e=Fe …………………………………(1-2)同理得根据以上Fe-H2O系七个平衡式,可作出该系的φ—pH图.三、实验方法本实验用Fe2(SO4)3·6H2O和FeSO4·7H2O试剂配成[Fe3+]=[Fe2+]=0.01mol/L的溶液,加入H2SO4和NaOH改变溶液的pH,用pH计测定溶液的pH值,同时用高阻电位差计测定相应的电位值,便可绘出φ—pH图。
但必须指出,由于平衡式(1-2)和(3-2)均在H2O析出H2的平衡线之下,所以在本实验条件下,无法测得上述两反应的φ和pH值。
因而无法绘制出这两条直线,又由于溶液中Fe3+和Fe2+活度不等于1,故实测曲线与理论曲线之间存在一定的偏差。
四、实验仪器及试剂1、实验仪器pH计、电位差计、恒温磁力加热搅拌器、检流计实验装置图如下:2、试剂Fe2(SO4)3·6H2O(分析纯)、FeSO4·7H2O(分析纯)、H2SO4(分析纯)、NaOH(分析纯)五、 实验步骤1. 溶液的配制:准确称取0.381g Fe2(SO4)3·6H2O及0.417g FeSO4·7H2O于200ml的烧杯中,加蒸馏水150ml溶解;2. 连接仪器,检查线路连接是否正确,如不正确及时更改;3.校正检流计;4. pH计的校正(1)接通电源,开启pH计,预热时间不少于半小时;(2)调节“温度“旋钮,使温度指到溶液温度;(3)将“斜率”旋钮顺时针调节到最大;(4)用纯水冲洗玻璃电极,用滤纸吸干玻璃电极,然后将其放置于pH6.86的标准溶液,调节“定位”旋钮,使pH指示为6.86,固定“定位”;(5)冲洗电极后用滤纸吸干,放置到pH4.00的标准溶液中,调节“斜率”旋钮使其指示到4.00的缓冲溶液中,调“斜率“纽使读数PH=4,斜率钮不能再变动了。
第五章 配合物在溶液中的稳定性-2013

Li >Na >K >Rb >Cs Be > Mg > Ca > Sr > Ba 电荷相同,半径越大,稳定相越差 高价金属配合物稳定性比低价金属离子配合物稳定性要高
② d10型金属离子 Cu+、Ag+、Au+、 Zn2+、Cd2+、Hg2+ Ga3+、In3+、TI3+ 其配合物一般比电荷相同、体积相近惰气型金属离子的配合 物稳定性高 对于Zn副族来说,大量的数据表明: Zn2+>/<Cd2+<Hg2+
•
f MLn
fM• fL
n
= βc
f MLn fM• fL n
浓度稳定常数
5.2 影响配合物稳定性的因素
中心离子性质对配合物稳定性的影响 一般来说,过渡金属离子形成配合物的能力比主族离子强 而主族金属中,又以电荷少、半径大的碱金属离子等最弱 ① 惰气型金属离子
碱金属: Li+、Na+、K+、Rb+、Cs+ 碱土金属:Be2+、Mg2+、Ca2+、Sr2+、Ba2+ 及:Al3+、Sc3+、Y3+、La3+
Co(CN)53-,Pd2+,Pt2+,Pt4+ Cu+,Ag+,Au+,Cd2+,Hg+,Hg2+
软
BH3,Ga(CH3)3,GaCl3,GaBr3,GaI3,Ti+,Tl(CH3)3 CH2,碳烯类 π接受体:三硝基本,醌类
酸
HO+,RO+,RS+,RSe+,Te4+,RTe+ Br2,Br+,I2,I+,ICN等 金属
配合物在溶液中的稳定性
[ML 2 ] β 2 = K 1K 2 = [M][L]2
β 3 = K 1K 2 K 3 =
[ML 3 ] [M][L]3
逐级稳定常数
积累稳定常数
最高配位数的积累稳定常数= 最高配位数的积累稳定常数=总稳定常数
第三章 配合物在溶液中的稳定性
化学与化工学院
3.2 中心离子性质对配合物稳定性的影响
第三章 配合物在溶液中的稳定性
稳定常数的表示方法
中心原子性质对配合物稳定性的影响 4
配体性质对配合物稳定性的影响 配位原子性质和中心原子的关系
第三章 配合物在溶液中的稳定性
化学与化工学院
第三章 配合物在溶液中的稳定性
• 稳定性是配合物在溶液中的一个重要性质,在化 稳定性是配合物在溶液中的一个重要性质, 学上有其重要的意义,研究某种配合物时, 学上有其重要的意义,研究某种配合物时,首先 要考虑它在给定条件下是否稳定。 要考虑它在给定条件下是否稳定。 • 稳定性大小常用稳定性常数描述的,稳定常数越 稳定性大小常用稳定性常数描述的, 配合物越稳定。 大,配合物越稳定。 • 稳定常数 K 稳定常数—K 逐级稳定常数—Kn 逐级稳定常数 Kn 积累稳定常数—β 积累稳定常数 β
作用力: (1) 作用力: 中心离子与配体间的作用主要是静电作用结合 成配离子。 成配离子。 影响配合物稳定性的因素: (2) 影响配合物稳定性的因素: 取决于中心离子的电荷和半径。 取决于中心离子的电荷和半径 。 中心离子的电 荷越大,半径越小形成的配离子越稳定。 荷越大,半径越小形成的配离子越稳定。
第三章 配合物在溶液中的稳定性
化学与化工学院
二、 d10型金属离子 Cu( Ag( Au( Cu(Ⅰ)、Ag(Ⅰ)、Au(Ⅰ) Zn( Cd( Hg( Zn(Ⅱ)、Cd(Ⅱ)、Hg(Ⅱ) Ga(Ⅲ)、In(Ⅲ)、Tl(Ⅲ) Ga( In( Tl( Ge( Sn( Pb( Ge(Ⅳ)、Sn(Ⅳ)、Pb(Ⅳ) 作用力: (1)作用力: 这些离子与配体间结合时, 这些离子与配体间结合时 , 在不同的程度上有明显的 共价性。 共价性。 稳定性的规律: (2)稳定性的规律: 这种金属离子的配合物一般比电荷相同、 ① 这种金属离子的配合物一般比电荷相同、体积相近 的惰气型金属离子的配合物要稳定。 的惰气型金属离子的配合物要稳定。 Zn( Cd( Hg( ② Zn(Ⅱ)、Cd(Ⅱ)、Hg(Ⅱ)这三种金属离子配 合物的稳定性是Hg Hg( 的最高。 合物的稳定性是Hg(Ⅱ)的最高。
影响水溶液中物质稳定性的因素
物质电极电位的影响
在湿法冶金过程中存在着许多氧化还原反应(有电子 参与的反应)。例如,在湿法炼锌过程中有如下反应:
2Fe2++MnO2++4H+=2Fe3++Mn2++2H2O (3)
现以银为例来计算形成配位化合物对标准电 极电位的影响。当不生成配合离子时:
如生成配合离子时,形成配合离子的反应式、 平衡常数,及其溶液中金属离子的浓度为:
Ag++2(CN)- = Ag(CN)2-
形成配位化合离子时,未配合金属离子还原 反应的平衡电极电位为
温度为298K时,若知 =1018.8, =1/ ,则形成配位 化合离子时未配合金属离子还原反应的标准 平衡电极电位为:
Cu2++Zn=Zn2++Cu
(4)
这些反应均可看作由氧化和还原的两个半电池反应构 成,如净化过程中常用到的置换反应(4)是由下列 两个半电池反应构成的:
Zn-2е=Zn2+
(氧化)
Cu2++2е=Cu
(还原)
那么,在溶液中就可能存在着两类氧化—还原反应。
1、简单离子的电极反应:Mez++ze=Me,如: Fe2++2е=Fe,Zn 2++2е=Zn
影响水溶液中物质稳定性的因素
在温度和压强一定的条件下,影响物质在水 溶液中稳定性的因素,则主要是水溶液的pH 值、物质的电极电位和活度。活度的影响主 要体现在计算水溶液pH值和物质电极电位的 时候,它与两者之间呈线形关系。一般来说, 溶液中物质的活度是以浓度的形式给出,需 通过活度系数加以校正后求得确定的活度值。
配合物在溶液中的稳定性
它是随着n增大,稳定性增强。这是因为Ag+形成 的配合物是直线型的,螯环增大张力就减小了。Hg2+ 与EDTA类型的配合物稳定性也有类似的反常现象。
精品课件
3、空间位阻
多齿配体的配位原子附近若存在着体积较大的基 团时,则有可能阻碍配合物的顺利形成,导致配合物 的稳定性降低,在严重的情况下,甚至不能形成配合 物,这种现象称为空间位阻。
2. [Cu(NH3)4]2+ 的 逐 级 稳 定 常 数
K1=1.41×104 、 K2=3.17×103 、 K3=7.76×102 、 K4=1.39×102。求K稳。
配合平衡符合平衡原理,当中心离子或配体浓度 发生变化时,或它们遇到能生成弱电解质、沉淀或发 生氧化还原反应的物质时精,品课平件 衡就被打破,发生移动。
Mn2+<Fe2+<Co2+<Ni2+<Cu2+ (d1-9) >
Zn2+(d10) 这 个 顺 序 叫 做 Ir ving-Williams 顺 序 , 此 顺 序 可
用晶体场理论和Jahn-Teller效应予以说明。
精品课件
4.2.2 配体性质的影响(内因)
除中心离子的性质外,配体的性质也直接影响配 合物的稳定性。如酸碱性、螯合效应(包括螯合物环 的大小及环的数目)、空间位阻及反位效应等因素都 影响配合物的稳定性。
的离子,它们比电荷相同,半径相近的8e-惰性气体型
金属离子的成配能力稍强,而比18电子构型金属离子
的成配能力弱得多。这类金属离子的配离子中,目前
除Tl+、Sn2+、Pb2+外,已知的稳定常数数据很少。
影响水溶液中物质稳定性的因素解读共26页
21、要知道对好事的称颂过于夸大,也会招来人们的反感轻蔑和嫉妒。——培根 22、业精于勤,荒于嬉;行成于思,毁于随。——韩愈
23、一切节省,归根到底都归结为时间的节省。——马克思 24、意志命运往往背道而驰,决心到最后会全部推倒。——莎士比亚
25、学习是劳动,是充满思想的劳动。——乌申斯基
影响水溶液中物质稳定性的因素解读
21、没有人陪你走一辈子,所以你要 适应孤 独,没 有人会 帮你一 辈子, 所以你 要奋斗 一生。 22、当眼泪流尽的时候,留下的应该 是坚强 。 23、要改变命运,首先改变自己。
24、勇气很有理由被当作人类德性之 首,因 为这种 德性保 证了所 有其余 的德性 ,它只 是让人 们的脚 放上一 段时间 ,以便 让别一 只脚能 够再往 上登。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 pH值对反应的作用 以 Fe(OH)3=Fe+3OH- (1) 为例,可以推导出 反应(1)的平衡条件是:
pH 1.61 3log F3e
可编辑ppt
4
12.1 影响物质稳定性的主要因素
1 pH值对反应的作用 结论: 物质在水溶液中的溶解度,或叫稳定性程度,同种 物质随溶液的pH值的不同而变,且不同物质在同样 pH值下的稳定程度也不一样。这样,就可以控制溶 液的pH值,使同一物质或不同物质的反应向欲定方 向进行,即使某些物质在溶液中稳定,而另一些物 质在溶液中不稳定发生沉淀,达到分离的目的。
可编辑ppt
10
12.1 影响物质稳定性的主要因素
现以银为例来计算形成配合物对标准电极电位的影响。当不生 成配合离子时:
Ag++e=Ag 如生成配合离子时:
0 Ag
0.79V9
Ag
A(C g) 2 N eA g 2 CN
当
A(gCN )2 CN 1温度为298K时:
A 0(C g)N 2 Ag A 0gA gR zF lT n K d 0.31V
可编辑ppt
11
12.1 影响物质稳定性的主要因素
用同样的方法,可以求出
0 A(uCN )2
Au
A 0uAu0.05l9o1K gd0.562V
A 0uAu1.50V
结论:
以上计算结果表明,当生成配合离子、后,显著降低了Au、Ag被 氧化的电位。这是因为溶液中存在有CN-时,配合物显著降低了 可被还原的Au、Ag的有效浓度。AU+、Ag+易被还原,而、三是 较难还原的。所以,形成配合离子使金、银被氧化变得很容易, 即金、银以配合离子稳定于溶液中。
(1) 简单离子的电极反应 该反应的通式是:
Mez++ze = Me 以,Fe2+十2e=Fe为例,此类反应的平衡电位(εe)
与水溶液中金属离子之间的关系,可由能斯特公式 求出:
F2 eF e 0 .44 0 .0 2l9 o5 F g 2 e5
可编辑ppt
7
12.1 影响物质稳定性的主要因素
第三篇 湿法冶金原理
可编辑ppt
1
第十二章 物质在水溶液中的稳定性
[教学内容]:影响物质稳定性的主要因素;水的热力 学稳定区;电位—pH图的绘制方法与分析;高温水溶 液热力学和电位—pH图
[教学要求]:了解浸出、净化和沉积在湿法冶金中的 应用;了解物质在水溶液中的稳定性及其影响因素; 了解水的热力学稳定区的意义;熟练掌握电位—pH图 的绘制方法及其应用
可编辑ppt
12
12.2 水的热力学稳定区
1 水的热力学稳定区域图的绘制
(1) 如果在给定条件下,溶液中有电极电位比氢的电极电位更负 电性的还原剂存在,还原过程就可能发生。而在酸性介质中 决定于电化学反应2H++2e=H2,或者在碱性溶液中决定于电 化学反应2H2O+2e=H2+2OH-。氢电极电位以下式表示:
3. 形成配合物对反应的作用 设配合剂L不带电,形成配合物的反应通式为:
MzenLMeznL
M z n e M L eM 0z n e M L e R zF lT n M z n e L R zF lT n L n
上式便是配合物的平衡电极电位计算式。如果已知 配合物的活度、配合剂的活度和配合物的离解常数, 就可以求出形成配合物的平衡电极电位值。
H H2
0 H H2
RTln
2 H
zF pH2
298K时:
H H 2 0 .05 p 9 H 0 .0 12 lo p 9 H 2 g (a ) 5
可编辑ppt
13
12.2 水的热力学稳定区
(2) 如果在给定条件下,溶液中有电极电位比氧的电极电位更 正电性的氧化剂存在,氧化过程就可能发生。而在酸性溶液 中决定于电化学反应2H2O-4e=O2+4H+,或者在碱性溶液中 决定于电化学反应40H--4e=O2+2H2O。氧电极电位可以下 式表示
(2) 溶液中离子之间的反应 以Fe3++e=Fe为例,此类反应的电极电位与溶液中离 子活度之间的关系是:
F 03 e F 2 e 0 .7 7 0 .015 lo9 F 3 g e 1 0 .05 lo9 F 2 g e1
用同样方法可以计算出其它各半电池反应的平衡电 极电位关系式。当溶液中离子活度已知时,便可算出 在该条件下的平衡电极电位。
可编辑ppt
5
12.1 影响物质稳定性的主要因素
2 电位对反应的作用 在湿法冶金过程中存在着许多氧化、还原反应。一 般说来,存在有两类氧化-还原反应。一类是简单离 子的电极反应,例如,Fe2+十2e=Fe,另一类是溶 液中离子间的反应,例如,Fe3++e=Fe
可编辑ppt
6
12.1 影响物质稳定性的主要因素
可编辑ppt
8
12.1 影响物质稳定性的主要因素
结论: 控制溶液中的电位,就可以控制反应的方向和限度。 当控制电位高于溶液的平衡电极电位时,溶液中的 元素就向氧化方向进行,直到控制电位与溶液的平 衡电极电位相等时为止。相反,溶液中的元素则向 还原方向进行,也是至两电位相等时为止。
可编辑ppt
9
12.1 影响物质稳定性的主要因素
O 2O HO 02O HR zF lTnpO 21 H 4
298K时,
O 2O H O 02O H R zF lTnpO 21 H 4(b)
可编辑ppt
14
12.2 水的热力学稳定区
根据(a)和(b)式,可以绘出水的热力学稳定区域图。
1-在为101325Pa(1atm)时氧电 极电位随pH值的变化; 2-在为101325Pa(1atm)时氢电 极电位随pH值的变化 a-Au3+/Au;b-Fe3+/Fe2+; c-Cu2+/Cu;d-Ni2+/Ni; e-Zn2+/Zn
[教学重点和难点]:电位—pH图的绘制方法定性
12.1 影响物质稳定性的主要因素 12.2 水的热力学稳定区 12.3 电位-pH图的绘制方法与分析 12.4 高温水溶液热力学和电位-pH图
可编辑ppt
3
12.1 影响物质稳定性的主要因素
