有机化学 第九章 醇酚醚
合集下载
有机化学-第九章

甲醇(球棒模型) CH3OH 甲醇(球棒模型)
乙醇(比例模型) C2H5OH 乙醇(比例模型)
9.1 醇的结构和分类
由于氧原子的强吸电子作用,使醇羟基上的氢有一定的酸 酸 性,而氧原子上的未共用电子对则有一定的碱性和亲核性 碱性和亲核性 。 受羟基的影响,醇的α-碳和该碳上的氢(α-H)容易发 生氧化或脱氢反应 氧化或脱氢反应,而β-碳上的氢则可参与分子内的脱 氧化或脱氢反应 分子内的脱 水反应。 水反应
醇一般有如下酸性强弱次序: CH3OH > 1o ROH > 2o ROH > 3o ROH
9.2 醇的化学性质
醇的酸性虽然很弱,但也足以使Grignard试剂发生分解。 Grignard试剂 Grignard试剂
9.2 醇的化学性质
醇羟基中的氢可被活泼的金属单质置换,放出氢气并生成 醇金属。
9.2 醇的化学性质
9.2 醇的化学性质
醇氧化与脱氢反应
一、醇的氧化
1.伯醇的氧化 1.伯醇的氧化 由于羟基的影响,醇的α-氢原子比较活泼,容易被氧 化。伯醇被氧化剂(如K2Cr2O7、KMnO4、浓HNO3等)氧化时, 先是生成醛,然后进一步被氧化,生成羧酸。
9.2 醇的化学性质
采用一种称为 PCC 的氧化剂,用于氧化伯醇制取醛是比 较好的氧化方法之一。PCC(pyridinium chlorochromate) PCC( chlorochromate) PCC 在盐酸溶液中的络合盐,又称Sarrett试 Sarrett试 是吡啶和 CrO3 在盐酸溶液中的络合盐 Sarrett 剂,是橙红色晶体,它溶于 CH2Cl2,在室温下便可将伯醇 氧化为醛。
9.3 酚的结构分类以及化学性质
酚羟基上的反应
有机化学 醇酚醚
酸性
ROH < H2O
碱性 RONa > NaOH ROH + NaOH CH3OH > 伯醇(乙醇) > 仲醇 > 叔醇 pKa 15.09 15.93 19
原因:烷基具有供电子的诱导效应+ I,烷基越多则氧原 子上的电子密度越高,氢氧键也越牢固,使酸性越小。
2、 与氢卤酸(羟基的取代):加热脱水得卤代烃,实验室制备卤 代烃的方 法。
第九章 醇、酚、醚
Alcohols, Phenols and Ethers
可以看成是水分子中的氢原子被 烃基取代的衍生物:
醇: 酚: 醚: R-OH (Alcohols) Ar—OH(Phenols) R—O—R’,Ar—O—R, Ar—O—Ar’)(Ethers)
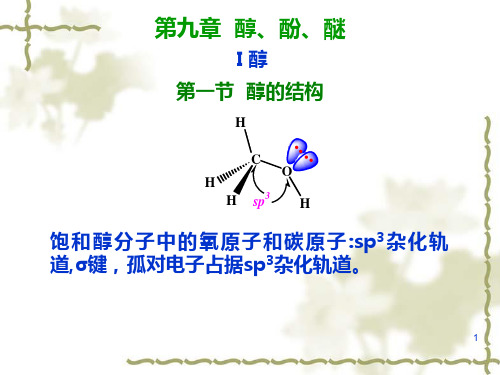
§9.1 醇 官能团是羟基(hydroxyl group) -OH
OH C
-羟基醛或-羟基酮也能被高碘酸氧化
C
R CH O CH R' OH
O
-COOH
R C OH O
或 CO 2
+
HIO4
+
H
C R' O
R CH CH CHO + 2 HIO4 OH OH
R C H + H C OH + H C OH O O O
R CH C OH O
CH2OH + 2 HIO4
R C H + CO2 + H C H O O
不相邻的醇 R-CH-CH2-CH-R
不反应
OH
OH
( 3 )频哪醇 ( 四烃基乙二醇 ) 与硫酸作用,生成片呐 酮。称为片呐醇重排:
(4)和磺酰卤作用,可生成磺酸酯
有机化学 醇酚醚

R O H H O R H R O H O R H R O
2. 溶解度:低级醇易溶于水.(可与水形成分子间氢键)
H H O H R O H H O H R O H H O
3. 低级醇可与MgCl2,CaCl2,CuSO4等形成结晶醇,此 结晶醇溶于水,不溶于有机溶剂.
9.2 醇的化学性质
H的酸性
H C C O H H
五、氧化成醛、酮或羧酸
O C H H
[O]
C
O
条件:有α-H的醇才能氧化 1.化学氧化
(1)用铬酸氧化
伯醇 仲醇
Na2Cr2O7,H2SO4,H2O Na2Cr2O7,H2SO4,H2O
醛 酮
酸
叔醇
不能被氧化
*选择性氧化剂PCC(氯铬酸吡啶盐):伯醇
C6H5N + CrO3 + HCl
CH3(CH2)6CH2OH PCC CH2Cl 2 CH3(CH2)6CHO
1. 与 HX的反应
ROH
+
HX
RX
+
H2 O
思考:为什么要在酸性条件下进行? (1).反应活性:酸的活性 HI > HBr > HCl >> HF
CH3CH2CH2CH2OH
+ HI(47%)
H2SO4
CH3CH2CH2CH2I
CH3CH2CH2CH2Br
+
H 2O
CH3CH2CH2CH2OH + HBr (48%)
B 催化加氢
MeO CHO
H2 Pt
MeO CH2OH
O H2 (CH3)2C=CHCH2CH2CCH3 Pt
OH (CH3)2CHCH2CH2CH2CHCH3
2. 溶解度:低级醇易溶于水.(可与水形成分子间氢键)
H H O H R O H H O H R O H H O
3. 低级醇可与MgCl2,CaCl2,CuSO4等形成结晶醇,此 结晶醇溶于水,不溶于有机溶剂.
9.2 醇的化学性质
H的酸性
H C C O H H
五、氧化成醛、酮或羧酸
O C H H
[O]
C
O
条件:有α-H的醇才能氧化 1.化学氧化
(1)用铬酸氧化
伯醇 仲醇
Na2Cr2O7,H2SO4,H2O Na2Cr2O7,H2SO4,H2O
醛 酮
酸
叔醇
不能被氧化
*选择性氧化剂PCC(氯铬酸吡啶盐):伯醇
C6H5N + CrO3 + HCl
CH3(CH2)6CH2OH PCC CH2Cl 2 CH3(CH2)6CHO
1. 与 HX的反应
ROH
+
HX
RX
+
H2 O
思考:为什么要在酸性条件下进行? (1).反应活性:酸的活性 HI > HBr > HCl >> HF
CH3CH2CH2CH2OH
+ HI(47%)
H2SO4
CH3CH2CH2CH2I
CH3CH2CH2CH2Br
+
H 2O
CH3CH2CH2CH2OH + HBr (48%)
B 催化加氢
MeO CHO
H2 Pt
MeO CH2OH
O H2 (CH3)2C=CHCH2CH2CCH3 Pt
OH (CH3)2CHCH2CH2CH2CHCH3
《医学有机化学教学课件》醇酚醚PPT课件

高级酚
在常温下呈固态的酚类化合物, 如愈疮木酚、焦性没食子酸等。
酚的结构与性质
酚的结构特点
酚的官能团是羟基(-OH),直接连在 苯环上,并且羟基的邻位和间位碳原 子上常有氢原子。
酚的性质
由于酚的羟基与苯环的π电子产生共轭 效应,使酚具有一些特殊的性质,如 酸性、亲电取代反应等。
酚的制备
01
02
03
烷基苯氧化法
通过烷基苯与氧气在催化 剂存在下反应,生成相应 的酚和酮。
芳香卤代烃水解法
通过芳香卤代烃与氢氧化 钠或氢氧化钾水溶液反应 ,生成相应的酚和卤化钠 或卤化钾。
芳香磺酸盐碱熔法
通过芳香磺酸盐与氢氧化 钠或氢氧化钾在高温下反 应,生成相应的酚和硫酸 钠或硫酸钾。
03
醚
醚的分类
芳香醚
脂肪醚
脂肪醚是指烃基直接与氧原子相 连的醚类,如甲基乙醚、乙基丙 醚等。
醇的性质
02
醇具有低毒、易溶于水、易燃等特点。
醇的化学反应
03
醇可以发生氧化、酯化、脱水等反应。
醇的制备
通过烃基的氧化制备
烃基在催化剂作用下被氧化成相应的醇。
通过酯的水解制备
酯在酸或碱的催化下水解生成相应的醇和羧酸。
通过卤代烃的水解制备
卤代烃在碱的作用下水解生成相应的醇。
02
酚
酚的分类
低级酚
在常温下呈气态或液态的酚类化 合物,如苯酚、甲酚等。
芳香醚是指芳香族化合物中的醚 类,如苯甲醚、硝基苯甲醚等。
单醚
单醚是指分子中只含有一个醚键 的醚类,如甲醚、乙醚等。
醚的分类
根据醚键两侧取代基的种类,醚 可以分为脂肪醚和芳香醚。根据 醚分子中氧原子数的不同,醚可 以分为单醚和多醚。
在常温下呈固态的酚类化合物, 如愈疮木酚、焦性没食子酸等。
酚的结构与性质
酚的结构特点
酚的官能团是羟基(-OH),直接连在 苯环上,并且羟基的邻位和间位碳原 子上常有氢原子。
酚的性质
由于酚的羟基与苯环的π电子产生共轭 效应,使酚具有一些特殊的性质,如 酸性、亲电取代反应等。
酚的制备
01
02
03
烷基苯氧化法
通过烷基苯与氧气在催化 剂存在下反应,生成相应 的酚和酮。
芳香卤代烃水解法
通过芳香卤代烃与氢氧化 钠或氢氧化钾水溶液反应 ,生成相应的酚和卤化钠 或卤化钾。
芳香磺酸盐碱熔法
通过芳香磺酸盐与氢氧化 钠或氢氧化钾在高温下反 应,生成相应的酚和硫酸 钠或硫酸钾。
03
醚
醚的分类
芳香醚
脂肪醚
脂肪醚是指烃基直接与氧原子相 连的醚类,如甲基乙醚、乙基丙 醚等。
醇的性质
02
醇具有低毒、易溶于水、易燃等特点。
醇的化学反应
03
醇可以发生氧化、酯化、脱水等反应。
醇的制备
通过烃基的氧化制备
烃基在催化剂作用下被氧化成相应的醇。
通过酯的水解制备
酯在酸或碱的催化下水解生成相应的醇和羧酸。
通过卤代烃的水解制备
卤代烃在碱的作用下水解生成相应的醇。
02
酚
酚的分类
低级酚
在常温下呈气态或液态的酚类化 合物,如苯酚、甲酚等。
芳香醚是指芳香族化合物中的醚 类,如苯甲醚、硝基苯甲醚等。
单醚
单醚是指分子中只含有一个醚键 的醚类,如甲醚、乙醚等。
醚的分类
根据醚键两侧取代基的种类,醚 可以分为脂肪醚和芳香醚。根据 醚分子中氧原子数的不同,醚可 以分为单醚和多醚。
第九章 醇酚醚

酚与酸酐或酰氯作用可得
酚与羧酸直接酯化困难
二、芳环上的反应
1. 卤代 芳卤的生成往往需在FeX3的催化下完成,但 苯酚的卤代不需催化即可立即与溴水作用,生 成 2,4,6 – 三溴苯酚.
OH + Br2
H2O
OH Br Br Br + (白 色) 3 HBr
该反应可用于酚的定性鉴定
9-3
9-3-1 醚的分类和命名
R
O H
Z n C l2 H C l
R C l + H
2
O
3o 醇 、烯丙醇、苄醇 2o 醇 1o 醇
室温下反应液立即混浊、分层 2 ~ 5 min.反应液混浊、分层 加热后反应液混浊、分层
§9-1-5
重要的醇
乙二醇制备:环氧乙烷水合法
9-2
酚
酚系指羟基(―OH)与苯环直接相连的化合物。
9-2-1 分类、命名和结构 酚的分类 — 按照酚类分子中所含羟基的 数目多少,分为一元酚和多 元酚。
。 3 RO H
SN2, 一般不重排 SN1, 有重排
C H3 H3C C C H3 H
+
C H3 C H2O H + HBr H3C C C H3 C H3 H3C C C H2+ H3C C H3 C
+
C H3 C H2Br + H3C C Br Br C H2C H3 C H2C H3
C H3
饱和醇
醇的异构与命名 醇的构造异构包括碳链异构和官能团异构。
碳链异构
CH3(CH2)2CH2OH正丁醇C来自3—CH—CH2OHCH3
异丁醇(2-甲基-1-丙醇)
• 官能团位置异构
CH3CH2CH2OH
酚与羧酸直接酯化困难
二、芳环上的反应
1. 卤代 芳卤的生成往往需在FeX3的催化下完成,但 苯酚的卤代不需催化即可立即与溴水作用,生 成 2,4,6 – 三溴苯酚.
OH + Br2
H2O
OH Br Br Br + (白 色) 3 HBr
该反应可用于酚的定性鉴定
9-3
9-3-1 醚的分类和命名
R
O H
Z n C l2 H C l
R C l + H
2
O
3o 醇 、烯丙醇、苄醇 2o 醇 1o 醇
室温下反应液立即混浊、分层 2 ~ 5 min.反应液混浊、分层 加热后反应液混浊、分层
§9-1-5
重要的醇
乙二醇制备:环氧乙烷水合法
9-2
酚
酚系指羟基(―OH)与苯环直接相连的化合物。
9-2-1 分类、命名和结构 酚的分类 — 按照酚类分子中所含羟基的 数目多少,分为一元酚和多 元酚。
。 3 RO H
SN2, 一般不重排 SN1, 有重排
C H3 H3C C C H3 H
+
C H3 C H2O H + HBr H3C C C H3 C H3 H3C C C H2+ H3C C H3 C
+
C H3 C H2Br + H3C C Br Br C H2C H3 C H2C H3
C H3
饱和醇
醇的异构与命名 醇的构造异构包括碳链异构和官能团异构。
碳链异构
CH3(CH2)2CH2OH正丁醇C来自3—CH—CH2OHCH3
异丁醇(2-甲基-1-丙醇)
• 官能团位置异构
CH3CH2CH2OH
有机化学+第九章醇酚醚2007
34
第七节 醚的化学性质
(1)钅羊盐的生成
醚遇到强无机酸(如,浓硫酸、浓氢卤酸等)可形成盐
R O R + HX
H R O R +X
浓酸中才稳定,遇到水马上分解,又析出醚。
35
(2)醚键的断裂
使醚键断裂最有效的试剂为浓氢卤酸或Lewis酸,通 常为HI、 HBr、AlCl3等。
CH3CH2OCH 2CH3 + HI
OH + CH3COCl
BF3.Et2O
OH +
OO CH3COCCH3
无水ZnCl2
OH
COCH3 OH
COCH3
33
III 醚 第六节 醚的结构与物理性质
醚可以看作 是水分子中 的两个氢都 被烃基取代 的衍生物
1.醚的结构
O R 110 。R'
R-O-R‘ Ar-O-Ar Ar-O-R
醚中的氧为sp3杂化,醚键的键 角近似等于110°
(一)、酸性开环
H3C
CH CH2 O
H
H3C
H2O (ROH)
HX H3C
CH CH2OH OH (OR)
CH CH2OH X
38
在酸性条件下,大多数是按SN1反应机制进行的 中 间体碳正离子稳定的(取代基较多的)先生成,所以
亲核试剂进攻含取代基较多的碳原子。
H
H3C CH CH2
H3C CH CH2
12
氢卤酸与大多数苄醇、烯丙醇、叔醇及仲醇按 SN1机理进行
ROH + HX
慢 ROH2
快 R +X
快 ROH2 + X
R + H2O RX
13
(二)和氯化亚砜及卤化磷的反应
高等教育有机化学 第九章

RCOOH
2CH3CH2OH + Cr2O7
橙红
+ Cr3+ 绿色 K2Cr2O7 CH3COOH
仲醇氧化生成酮
RCH 2OH OH
[O]
RCHO K2 Cr2 O7 - 稀H2 SO4
[O]
ROOH =O (85%)
——叔醇无α﹣氢原子,在碱性条件下不易被 氧化,在酸性(例:硝酸)条件下脱水生成烯 烃,然后氧化断链生成小分子化合物(无实用 价值)
CH3OH>RCH2OH>R2CHOH>R3COH
RCH2O-溶剂化作用大、稳定,因此RCH2OH中的
质子易于离解,酸性大;R3CO-溶剂化作用小, 不如RCH2O-稳定,因此R3COH中质子不易离解
醇金属
醇与金属钠反应发生氢氧键的断裂,放出氢
气,生成醇钠
ROH + M → ROM + H2↑ M = K、Na、Mg、Al
命名
酚的物理性质
纯净的苯酚是没有颜色的晶体,具有特殊气
味,熔点是 43℃。常温时,苯酚在水里溶解 度不大,当温度高于70℃时,能跟水以任意 比互溶。 苯酚易溶于乙醇、乙醚等有机溶剂。苯酚有 毒,它的浓溶液对皮肤有强烈的腐蚀性
一元酚的反应
1.弱酸性:
苯酚羟基上氢原子可有少量电离 而呈现弱酸性,其pKa=9.98。 a. 若苯环邻、对位有强吸电子基降低氧原 子电子云密度,酸性增强。 如:邻硝基酚pKa=7.23;2,4—二硝基苯的 pKa为4.0;2,4,6—三硝基苯酚pKa为 0.71,已属于有机强酸了。
CH3CH2OH + Na → CH3CH2ONa + H2↑ (CH3)3COH + K → (CH3)3COK + H2↑ CH3CH(OH)CH3 + Al → ((CH3)2CHO)3Al + H2↑
第九章 醇酚醚

CF3CH2OH
>
CCl3CH2OH
>
CH3CH2OH
pKa=12.4
Cl Cl C CH2OH Cl
pKa=15.9
3. 电负性大的取代基越多取代醇的酸性越强
>
H Cl C Cl
CH2OH
>
H2C Cl
CH2OH
>
H3 C
CH2OH
4.取代基距离羟基越近,取代醇的酸性越强
H CH2 C CH2OH H3C Cl
CH3CHCH2OH C6H5
2-丁醇
2-苯基-1-丙醇 6-甲基-5-乙基-3-氯-2-庚醇 (β-苯基丙醇)
(d)不饱和醇
选择含羟基及不饱和键的最长碳链作为主链,从离羟 基最近的一端开始编号。根据主链上碳原子的数目称为 “某烯醇”或“某炔醇”
1 2 4 CH3-CH-CH2-CH=CH2 OH 1 3 H3CH2CH2C CHCH2CH2OH HC CH2 4 5
H-O-H
CH3-O-H
CH3-O-CH3
9.1 醇的结构、分类和命名
9.1.1 醇的结构
•官能团:羟基(—OH)(又称醇羟基)。
甲醇的结构:
H
未共用 电子对
sp3杂化 C-O σ键
0.143 nm
CC
H H
O
H
H C O H H H 108.5°
两个—OH连在同一碳原子的醇,不稳定。 • —OH连在双键碳原子上的醇(烯醇),不稳定。
硝酸甲酯
CH2 CH CH2 OH OH + 3HO-NO2 OH
CH2 CH CH2
ONO2 ONO2 + 3H2O ONO2
>
CCl3CH2OH
>
CH3CH2OH
pKa=12.4
Cl Cl C CH2OH Cl
pKa=15.9
3. 电负性大的取代基越多取代醇的酸性越强
>
H Cl C Cl
CH2OH
>
H2C Cl
CH2OH
>
H3 C
CH2OH
4.取代基距离羟基越近,取代醇的酸性越强
H CH2 C CH2OH H3C Cl
CH3CHCH2OH C6H5
2-丁醇
2-苯基-1-丙醇 6-甲基-5-乙基-3-氯-2-庚醇 (β-苯基丙醇)
(d)不饱和醇
选择含羟基及不饱和键的最长碳链作为主链,从离羟 基最近的一端开始编号。根据主链上碳原子的数目称为 “某烯醇”或“某炔醇”
1 2 4 CH3-CH-CH2-CH=CH2 OH 1 3 H3CH2CH2C CHCH2CH2OH HC CH2 4 5
H-O-H
CH3-O-H
CH3-O-CH3
9.1 醇的结构、分类和命名
9.1.1 醇的结构
•官能团:羟基(—OH)(又称醇羟基)。
甲醇的结构:
H
未共用 电子对
sp3杂化 C-O σ键
0.143 nm
CC
H H
O
H
H C O H H H 108.5°
两个—OH连在同一碳原子的醇,不稳定。 • —OH连在双键碳原子上的醇(烯醇),不稳定。
硝酸甲酯
CH2 CH CH2 OH OH + 3HO-NO2 OH
CH2 CH CH2
ONO2 ONO2 + 3H2O ONO2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第九章
醇 R-OH
酚 醚
醇、酚和醚(P239)
(R-H)
Ar-OH R-O-R′或 R-O-Ar
醇、酚、醚都是烃的含氧衍生物 醇与酚有相同的官能团:羟基(-OH) 醚是醇或酚的衍生物
2014-12-28 1
2014-12-28
2
(一)醇
醇在自然界中含量丰富。例如:
• 乙醇:人类制造并且消费乙醇已经有超过千年的 历史,最初的制备手段来自于酒精饮料的发酵与 蒸馏。乙醇是一种透明可燃的液体,可用于工业 溶剂,汽车燃料及工业原料。 • 甲醇:是自然界中最简单的醇,最早通过蒸馏木 材得到,因此也称作“木醇”。其气味和特性类 似于乙醇,同时也是一种常用溶剂、燃料或工业 原料。不同于乙醇,甲醇具有高度的毒性:约 10mL的甲醇就可通过损坏光学神经而导致永久失 明,30ml甲醇则会导致死亡。
32
B) 弱氧化剂 ①沙瑞特试剂* :CrO3(C5H5N)2 可使伯醇氧化为醛,仲醇氧化为酮。重键不被氧化。
CH3(CH2)4C CCH2OH
沙瑞特试剂 CH2Cl2, 25 ℃
CH3(CH2)4C CCHO 84%
② MnO2
新制得的二氧化锰可选择性地氧化不饱和的伯醇 成醛,仲醇成酮,双键不被氧化破坏。
RO - Na + + HOH
较强碱 较强酸
Na + OH - + ROH
较弱碱 较弱酸
工业上生产醇钠,不使用昂贵的金属钠,而是利用上述平 衡反应。加苯带走水,使平衡朝着生成醇钠的方向进行。
2014-12-28 17
9.3.2
生成卤代烃(P244)
醇可与多种卤化试剂作用,羟基被卤素取代 生成卤代烃。 1、 与氢卤酸的反应
2014-12-28 3
•薄荷醇:植物所产生的高 挥发性精油,也就是薄荷 油的主要成分。
在很多产品中都包含薄荷醇,包括:喉 糖、止痒药物、轻微止痛麻醉药物、治疗晒 伤药物,因其清凉效果可用于香烟和口腔卫 生用品,如漱口水、牙膏、牙线、口香糖等。 也是一些饮料、甜食和香水的添加剂。
2014-12-28
② 与SOCl2反应
(制高沸点 £ RX) 。 105.8 C
醇与PX3、PX5、SOCl2的反应一般不重排。
是制备氯代烷的一个非常好的方法!
2014-12-28 23
9.3.3
(1) 与硫酸的反应
CH3O H + HO SO 2OH
生成酯(P246)
CH3OSO2OH + H2O
硫酸氢甲酯 酸性硫酸酯
31
硝酸氧化
伯醇可被稀硝酸氧化成羧酸;
仲醇和叔醇需在较浓的硝酸中氧化,同 时发生碳碳键的断裂,生成小分子羧酸;
环醇氧化发生断键,生成羧酸。
CHO H OH CH2OH
稀HNO3
COOH H OH COOH OH
50% HNO3 V2O5, 55~60 ℃
COOH COOH
2014-12-28
4
•木糖醇:是一种可以作为蔗糖替代物的 五碳糖醇,是木糖代谢的产物,木糖广 泛存在于各种植物中木糖醇的甜度与蔗 糖相当,但热量只有蔗糖的60%。
应用: 1、由于木糖醇不能被细菌分解,利用它来取代甜品中的糖 份以防止蛀牙。 2、木糖醇代谢时不需要胰岛素即可直接进入细胞,且代谢 速度快,不会引起血糖升高,是糖尿病患者理想的蔗糖替 代品。 3、木糖醇甜度与蔗糖相当,但是热量较低,且食用木糖醇 不会使血液中的中性脂肪增加,还可以抑制甘油、脂肪酸 的合成,因此具有减肥的功效。
。
。 20 C,1h不反应 加热才反应 !
卢卡氏试剂——浓HCl/无水ZnCl2
可用于区别伯、仲、叔醇:
¡ 1 ROH ¡ 2 ROH ¡ 3 ROH
¡¡ ¨¡¡¡ ¡¡
¨ ¡
¡¡ ¡ ¡¡¡¡«
ì ¬ ¡ RCl( ¡ ì ¬ ¡)¡ ¨¡¡¡¡¡ ì ¬ ¡ ¨¡ ¡ ì ¡¡¡¡
适用范围:只适于鉴别含6个碳以下的伯、仲、叔醇
CH3(CH2)3I + H2O CH3(CH2)3Br + H2O CH3(CH2)3Cl + H2O
19
¡¡ZnCl2
2014-12-28
②醇:烯丙醇或芐醇>3oROH>2oROH>1oROH>CH3OH
(原因:C+的稳定性:3©>2©>1©>CH3+)
例:
CH3 CH3-C-OH + HCl CH3
PKa=14
R O H
极性键,可异裂 活泼氢,有酸性, 但酸性更弱 (R斥电子) PKa=15-18
取代烷基越多,醇的酸性越弱
(CH3)3COH CH3CH2OH H2O CH3OH pKa 18.00 16.00 15.74 15.54 CF3CH2OH (CF3)3COH HCl 12.43 5.4 -7.0
9.3.4 脱水反应(P247)
A)分子内脱水成烯
① 反应取向:当有多个不同的β-H时,其主要产物 是双键碳上连有较多取代基的烯烃或共轭烯烃。
OH Al2O3 OH CH3
Al2O3
250℃
CH3
共轭烯烃为主要产物
查依采夫烯烃为主要产物
② 反应机理:E1,有重排。
③ 反应活性:烯丙醇>叔醇>仲醇>伯醇
2014-12-28
16
ROH + Na
RONa + 1 2 H2
醇钠
与金属反应
反应活性: (1) 随R ,反应活性 。 。 。 (2) CH3OH>1 >2 >3 ROH
6(CH3)2CHOH + 2Al 2[(CH3)2CHO]3Al + 3H2
(三)异丙醇铝
该反应可用于实验室销毁剩余金属钠。 醇的酸性比水弱,它与碱金属的反应速度比水慢。 醇钠遇水即水解:
13
9.2
的沸点较高。
CH3OH (M=32)
醇的物理性质 (P241)
¡ b.p 65 C ¡ b.p -88.6 C ¡ b.p=153.6 C
① 沸点:与相对分子质量相近的其它有机物相比,醇
CH3CH3 (M=30)
原因?
ROH分子间可形成氢键!
② 溶解度:C3以下醇与水混溶, C4以上随C数↑,溶解度↓ 原因? 醇与水可形成分子间氢键,随C数↑,R在
不饱和醇命名时应选择连有羟基和不饱和键在内 的最长碳链作主链,从靠近羟基一端开始编号。
2014-12-28 12
命名芳香醇时,可将芳基作为取代基加以命名。
多元醇的命名应选择包含尽量多的羟基碳 链做主链。依羟基的数目称二醇、三醇等。
1, 3-丙二醇
2014-12-28
3-羟甲基-1,7-庚二醇
CH2ONO2 CHONO2 + 3H2O CH2ONO2
硝化甘油 民用炸药 心血管扩张药 、
(3)与有机酸反应
CH3 SO2Cl
ROH
CH3COOH
p CH3 C6H4SO2 OR CH3COOR
磺酸酯中的酸根部分是很好的离去基团,因此,常通 2014-12-28 25 过磺酸酯将醇转化为卤代烃。
2014-12-28 21
重排现象—叔、仲和空间位阻大的伯醇 与HX反应时,常伴有重排现象(P245)
CH3 例1 CH3-C-CH2OH CH3
原因: CH3 CH3-C-CH2OH CH3 -C上有大的R ,
不利于SN 2 H+
HBr
CH3 CH3 CH3-C-CH2CH3 + CH3-C-CH2Br Br CH3 (主要产物) (次要产物)
R¡ ¡OH
反 应 历 程
2014-12-28 18
¡ HX
RX + H2O
¨¡¡« ¡ ¡¡¡
反应活性
ROH
+
HX
RX
+
H2O
① 氢卤酸: HI>HBr>HCl;
(原因:亲核性 I - > Br - >Cl-; 酸性:HI>HBr>HCl)
¡¡ CH3(CH2)3OH +
HI HBr HCl
¨H 2SO4 ¡
• 伯醇首先被氧化成醛,醛很易于被氧化成羧酸;仲醇被 氧化成酮;反应有MnO2沉淀析出,因此可用于鉴别。
伯醇
仲醇
叔醇:没有α-H,在通常情况下不被氧化。
2014-12-28 30
应用: 检测酒精
CH3CH2OH + K2Cr2O7
橙黄色
H2SO4 CH3COOH + Cr3+ H2O 绿色
2014-12-28
CH3OH
CH3OSO2OCH3 + H2SO4
硫酸二甲酯
(甲基化剂,剧毒)
醇作为亲核试剂进攻酸的带正电荷部分 而后醇的O-H键断裂。
2014-12-28 24
(2) 与硝酸的反应
CH3OH + HONO2
CH2O-H CHO H + 3HO-N CH2O-H O O
CH3ONO2 + H2O
¡¡¡¡¡
ROH中比例↑,而R一般是疏水的。
2014-12-28
14
9.3
醇的化学性质 (P243)
•醇的酸性
结构决定性质
R CH2 H
•α-H的氧化、β-H 的消除反 应
2014-12-28
O H
•亲核性
•羟基的反应:取代、酯化
15
9.3.1 醇的酸性 (P243)
极性键,可异裂 活泼氢,有酸性 H O H
+
..
CH 3CH 2OCH 2CH 3 + H
醇脱水成烯或成醚的反应是一对竞争反应。一般地, 较低温度有利于成醚,较高温度、叔醇有利于成烯。
醇 R-OH
酚 醚
醇、酚和醚(P239)
(R-H)
Ar-OH R-O-R′或 R-O-Ar
醇、酚、醚都是烃的含氧衍生物 醇与酚有相同的官能团:羟基(-OH) 醚是醇或酚的衍生物
2014-12-28 1
2014-12-28
2
(一)醇
醇在自然界中含量丰富。例如:
• 乙醇:人类制造并且消费乙醇已经有超过千年的 历史,最初的制备手段来自于酒精饮料的发酵与 蒸馏。乙醇是一种透明可燃的液体,可用于工业 溶剂,汽车燃料及工业原料。 • 甲醇:是自然界中最简单的醇,最早通过蒸馏木 材得到,因此也称作“木醇”。其气味和特性类 似于乙醇,同时也是一种常用溶剂、燃料或工业 原料。不同于乙醇,甲醇具有高度的毒性:约 10mL的甲醇就可通过损坏光学神经而导致永久失 明,30ml甲醇则会导致死亡。
32
B) 弱氧化剂 ①沙瑞特试剂* :CrO3(C5H5N)2 可使伯醇氧化为醛,仲醇氧化为酮。重键不被氧化。
CH3(CH2)4C CCH2OH
沙瑞特试剂 CH2Cl2, 25 ℃
CH3(CH2)4C CCHO 84%
② MnO2
新制得的二氧化锰可选择性地氧化不饱和的伯醇 成醛,仲醇成酮,双键不被氧化破坏。
RO - Na + + HOH
较强碱 较强酸
Na + OH - + ROH
较弱碱 较弱酸
工业上生产醇钠,不使用昂贵的金属钠,而是利用上述平 衡反应。加苯带走水,使平衡朝着生成醇钠的方向进行。
2014-12-28 17
9.3.2
生成卤代烃(P244)
醇可与多种卤化试剂作用,羟基被卤素取代 生成卤代烃。 1、 与氢卤酸的反应
2014-12-28 3
•薄荷醇:植物所产生的高 挥发性精油,也就是薄荷 油的主要成分。
在很多产品中都包含薄荷醇,包括:喉 糖、止痒药物、轻微止痛麻醉药物、治疗晒 伤药物,因其清凉效果可用于香烟和口腔卫 生用品,如漱口水、牙膏、牙线、口香糖等。 也是一些饮料、甜食和香水的添加剂。
2014-12-28
② 与SOCl2反应
(制高沸点 £ RX) 。 105.8 C
醇与PX3、PX5、SOCl2的反应一般不重排。
是制备氯代烷的一个非常好的方法!
2014-12-28 23
9.3.3
(1) 与硫酸的反应
CH3O H + HO SO 2OH
生成酯(P246)
CH3OSO2OH + H2O
硫酸氢甲酯 酸性硫酸酯
31
硝酸氧化
伯醇可被稀硝酸氧化成羧酸;
仲醇和叔醇需在较浓的硝酸中氧化,同 时发生碳碳键的断裂,生成小分子羧酸;
环醇氧化发生断键,生成羧酸。
CHO H OH CH2OH
稀HNO3
COOH H OH COOH OH
50% HNO3 V2O5, 55~60 ℃
COOH COOH
2014-12-28
4
•木糖醇:是一种可以作为蔗糖替代物的 五碳糖醇,是木糖代谢的产物,木糖广 泛存在于各种植物中木糖醇的甜度与蔗 糖相当,但热量只有蔗糖的60%。
应用: 1、由于木糖醇不能被细菌分解,利用它来取代甜品中的糖 份以防止蛀牙。 2、木糖醇代谢时不需要胰岛素即可直接进入细胞,且代谢 速度快,不会引起血糖升高,是糖尿病患者理想的蔗糖替 代品。 3、木糖醇甜度与蔗糖相当,但是热量较低,且食用木糖醇 不会使血液中的中性脂肪增加,还可以抑制甘油、脂肪酸 的合成,因此具有减肥的功效。
。
。 20 C,1h不反应 加热才反应 !
卢卡氏试剂——浓HCl/无水ZnCl2
可用于区别伯、仲、叔醇:
¡ 1 ROH ¡ 2 ROH ¡ 3 ROH
¡¡ ¨¡¡¡ ¡¡
¨ ¡
¡¡ ¡ ¡¡¡¡«
ì ¬ ¡ RCl( ¡ ì ¬ ¡)¡ ¨¡¡¡¡¡ ì ¬ ¡ ¨¡ ¡ ì ¡¡¡¡
适用范围:只适于鉴别含6个碳以下的伯、仲、叔醇
CH3(CH2)3I + H2O CH3(CH2)3Br + H2O CH3(CH2)3Cl + H2O
19
¡¡ZnCl2
2014-12-28
②醇:烯丙醇或芐醇>3oROH>2oROH>1oROH>CH3OH
(原因:C+的稳定性:3©>2©>1©>CH3+)
例:
CH3 CH3-C-OH + HCl CH3
PKa=14
R O H
极性键,可异裂 活泼氢,有酸性, 但酸性更弱 (R斥电子) PKa=15-18
取代烷基越多,醇的酸性越弱
(CH3)3COH CH3CH2OH H2O CH3OH pKa 18.00 16.00 15.74 15.54 CF3CH2OH (CF3)3COH HCl 12.43 5.4 -7.0
9.3.4 脱水反应(P247)
A)分子内脱水成烯
① 反应取向:当有多个不同的β-H时,其主要产物 是双键碳上连有较多取代基的烯烃或共轭烯烃。
OH Al2O3 OH CH3
Al2O3
250℃
CH3
共轭烯烃为主要产物
查依采夫烯烃为主要产物
② 反应机理:E1,有重排。
③ 反应活性:烯丙醇>叔醇>仲醇>伯醇
2014-12-28
16
ROH + Na
RONa + 1 2 H2
醇钠
与金属反应
反应活性: (1) 随R ,反应活性 。 。 。 (2) CH3OH>1 >2 >3 ROH
6(CH3)2CHOH + 2Al 2[(CH3)2CHO]3Al + 3H2
(三)异丙醇铝
该反应可用于实验室销毁剩余金属钠。 醇的酸性比水弱,它与碱金属的反应速度比水慢。 醇钠遇水即水解:
13
9.2
的沸点较高。
CH3OH (M=32)
醇的物理性质 (P241)
¡ b.p 65 C ¡ b.p -88.6 C ¡ b.p=153.6 C
① 沸点:与相对分子质量相近的其它有机物相比,醇
CH3CH3 (M=30)
原因?
ROH分子间可形成氢键!
② 溶解度:C3以下醇与水混溶, C4以上随C数↑,溶解度↓ 原因? 醇与水可形成分子间氢键,随C数↑,R在
不饱和醇命名时应选择连有羟基和不饱和键在内 的最长碳链作主链,从靠近羟基一端开始编号。
2014-12-28 12
命名芳香醇时,可将芳基作为取代基加以命名。
多元醇的命名应选择包含尽量多的羟基碳 链做主链。依羟基的数目称二醇、三醇等。
1, 3-丙二醇
2014-12-28
3-羟甲基-1,7-庚二醇
CH2ONO2 CHONO2 + 3H2O CH2ONO2
硝化甘油 民用炸药 心血管扩张药 、
(3)与有机酸反应
CH3 SO2Cl
ROH
CH3COOH
p CH3 C6H4SO2 OR CH3COOR
磺酸酯中的酸根部分是很好的离去基团,因此,常通 2014-12-28 25 过磺酸酯将醇转化为卤代烃。
2014-12-28 21
重排现象—叔、仲和空间位阻大的伯醇 与HX反应时,常伴有重排现象(P245)
CH3 例1 CH3-C-CH2OH CH3
原因: CH3 CH3-C-CH2OH CH3 -C上有大的R ,
不利于SN 2 H+
HBr
CH3 CH3 CH3-C-CH2CH3 + CH3-C-CH2Br Br CH3 (主要产物) (次要产物)
R¡ ¡OH
反 应 历 程
2014-12-28 18
¡ HX
RX + H2O
¨¡¡« ¡ ¡¡¡
反应活性
ROH
+
HX
RX
+
H2O
① 氢卤酸: HI>HBr>HCl;
(原因:亲核性 I - > Br - >Cl-; 酸性:HI>HBr>HCl)
¡¡ CH3(CH2)3OH +
HI HBr HCl
¨H 2SO4 ¡
• 伯醇首先被氧化成醛,醛很易于被氧化成羧酸;仲醇被 氧化成酮;反应有MnO2沉淀析出,因此可用于鉴别。
伯醇
仲醇
叔醇:没有α-H,在通常情况下不被氧化。
2014-12-28 30
应用: 检测酒精
CH3CH2OH + K2Cr2O7
橙黄色
H2SO4 CH3COOH + Cr3+ H2O 绿色
2014-12-28
CH3OH
CH3OSO2OCH3 + H2SO4
硫酸二甲酯
(甲基化剂,剧毒)
醇作为亲核试剂进攻酸的带正电荷部分 而后醇的O-H键断裂。
2014-12-28 24
(2) 与硝酸的反应
CH3OH + HONO2
CH2O-H CHO H + 3HO-N CH2O-H O O
CH3ONO2 + H2O
¡¡¡¡¡
ROH中比例↑,而R一般是疏水的。
2014-12-28
14
9.3
醇的化学性质 (P243)
•醇的酸性
结构决定性质
R CH2 H
•α-H的氧化、β-H 的消除反 应
2014-12-28
O H
•亲核性
•羟基的反应:取代、酯化
15
9.3.1 醇的酸性 (P243)
极性键,可异裂 活泼氢,有酸性 H O H
+
..
CH 3CH 2OCH 2CH 3 + H
醇脱水成烯或成醚的反应是一对竞争反应。一般地, 较低温度有利于成醚,较高温度、叔醇有利于成烯。
