对晶型转变的综述
溶剂介导的晶型转变

溶剂介导的晶型转变
溶剂介导的晶型转变是指在溶液中添加溶剂后,晶体的晶型发生改变的现象。
溶剂介导的晶型转变是一种溶剂效应的表现。
溶剂对晶体的晶型稳定性有重要影响,可以促使晶体从一种晶型转变为另一种晶型。
这种转变可以是温度变化、压力变化或溶剂浓度变化等因素引起的。
溶剂介导的晶型转变可以通过两种机制实现:溶剂分子与晶体分子之间的相互作用和溶解度差异引起的溶质浓度梯度。
在溶剂介导的晶型转变中,溶剂分子与晶体分子之间的相互作用是决定转变方向和速率的关键因素。
溶剂分子可以通过与晶体分子形成氢键、范德华力等相互作用来影响晶体的结构。
不同的溶剂对晶体的相互作用力不同,因此对晶型转变的影响也不同。
溶解度差异引起的溶质浓度梯度也可以导致晶型转变。
当晶体溶解度随溶剂浓度的变化而改变时,晶体在不同的溶剂浓度下可能发生晶型转变。
这是因为不同的晶型对溶剂的溶解度不同,当溶剂浓度超过某个临界值时,就会导致晶体转变为另一种晶型。
溶剂介导的晶型转变在药物制剂中具有重要意义。
药物的晶型对其物理性质和生物活性有重要影响,不同的晶型可能表现出不同的溶解度、稳定性和生物利用度。
通过选择适当的溶剂来
实现晶型转变,可以改变药物的性质,提高药物的溶解度、稳定性和生物利用度,从而提高药物的治疗效果。
药物晶型相转变的机理研究与应用开发

药物晶型相转变的机理研究与应用开发药物的晶型相转变是指药物在不同条件下由一种晶体结构转变为另一种晶体结构的过程,这种转变可以对药物的物理化学性质以及药效产生重要影响。
因此,研究药物晶型相转变的机理,并开发其在药物应用中的潜在价值具有重要意义。
本文将探讨药物晶型相转变的机理研究方法和应用开发的相关进展。
随着固体药物晶型相转变研究的不断深入,人们逐渐发现晶型转变的机制是一个复杂但规律可循的过程。
这一过程往往涉及晶体中分子的排列方式的改变,因此可以通过研究分子的相互作用力以及晶胞结构等因素来推测药物晶型相转变的机理。
目前,研究者们主要采用实验方法和计算模拟方法相结合的方式来探索药物晶型相转变的机理。
实验方法中,常用的手段包括X射线衍射、热分析和红外光谱等技术。
X射线衍射可以通过测定晶体中X射线的衍射图样来确定晶体的晶型结构,热分析可以研究药物在不同温度下的热稳定性以及相变温度,红外光谱则可以分析药物分子中的功能团以及分子之间的相互作用力。
这些实验手段可以为药物晶型相转变的机理研究提供直接的实验数据。
与此同时,计算模拟方法也成为研究药物晶型相转变的重要手段。
分子力学模拟可以通过对分子间相互作用力的定量计算来模拟晶体结构的变化,分子动力学模拟则可以模拟药物晶体的动态行为。
这些计算模拟方法可以帮助研究者更深入地理解药物晶型相转变的机理,并提供理论依据来指导实验设计。
药物晶型相转变的研究不仅对药物的物理化学性质有重要意义,同时也具有潜在的应用价值。
一方面,药物晶型相转变可以影响药物的生物利用度、疏水性、溶解度等性质,从而改善药物的药效。
例如,一些药物的溶解度随着晶型的转变而有所改变,从而可以调节药物的释放速率和血浆浓度。
另一方面,药物晶型相转变还可以用于药物的制剂设计。
例如,通过选择合适的晶型,可以改变药物的物理形态,提高药物的稳定性和制备工艺的可行性。
此外,药物晶型相转变还可以应用于药物控释系统的设计。
控释系统可以通过调节药物晶型的转变来实现药物的缓慢释放,从而提高治疗效果和减少副作用。
dsc在晶型转变的应用 -回复

dsc在晶型转变的应用-回复1. 什么是晶型转变晶型转变是指晶体结构在外界条件变化下从一种晶型转变为另一种的过程。
晶体结构的稳态晶型是由晶格、原子及离子排列所决定的,它们之间的相对位置和角度是特定的。
当外界条件如温度、压力和化学成分发生变化时,晶体的晶型也会随之改变。
2. 晶型转变的类型晶型转变可以分为两种类型:可逆转变和不可逆转变。
可逆转变是指晶体在外界条件变化下可以切换回原来的晶型。
这种转变常见于温度变化引起的转变,例如铁的铁磁性转变为顺磁性。
不可逆转变是指晶体结构发生永久性改变,无法回到原来的状态。
这种转变常见于高温或高压条件下的相变,例如金刚石的晶型转变为石墨。
3. 晶型转变的应用晶型转变在许多领域中都有广泛的应用,以下是几个典型的例子:(1) 材料科学和工程:晶型转变常常用于改变材料的物理和化学性质,从而获得所需的材料性能。
例如,通过晶型转变,金属和合金可以具有不同的硬度、强度和耐腐蚀性能。
此外,晶型转变还能够改变材料的导电性、磁性以及光学性质,使其适用于电子、磁性材料和光电器件等领域。
(2) 药物制剂和生物医学:晶型转变在药物制剂和生物医学领域中也有广泛应用。
药物的晶型转变可以改变其药效、溶解度、稳定性和可吸收性等性质,从而提高药物的吸收和疗效。
例如,通过晶型转变,药物可以从低溶解度晶型转变为高溶解度晶型,提高药物的溶解度和生物利用度。
此外,晶型转变还可以改变药物的释放速度和控制药物的缓释,实现药物的持续释放和目标导向输送。
(3) 能源和环境:晶型转变在能源和环境领域中的应用越来越重要。
通过晶型转变,可以改变材料的能量存储和转换性能,提高能源利用效率和储能密度。
例如,通过晶型转变,锂离子电池的电极材料可以实现高容量和长循环寿命。
此外,晶型转变还可以用于储氢材料、燃料电池、太阳能电池等能源转换装置。
而在环境领域,晶型转变可以应用于气体分离、催化剂设计以及污染物检测和治理等方面。
4. 晶型转变的研究方法研究晶型转变的方法有很多,其中常用的方法包括:(1) X射线衍射:X射线衍射是研究晶型转变的常用方法之一。
固体药物晶型转化现象以及工艺控制方法

产生原因
• 晶体中药物分子间的结合主要依靠分子间作 用力(如:氢键、盐键、配位键及范德华力 等),以此维系分子在空间的稳定排列。固 体药物在结晶过程中因重结晶条件的变化, 而产生其分子在晶胞中的对称规律的不同, 导致药物分子之间、药物分子与溶剂分子之 间相互作用力或结合方式的不同,以及某些 化合物的化学键旋转、局部构象变化等等, 这些因素均可使药物的晶体出现两种或两种 以上的空间群和晶胞参数,产生多晶型现象。
转化机制
• ③溶液相变:溶液相变存在于药物完全或部 分溶解于液体的过程及溶剂蒸发的过程中。 当药物溶解时, 如湿法制粒中加水 ,盐类 药物因溶解度较大,可部分溶解,蒸发溶剂 后,可形成另一种晶型;若增加溶剂,可形 成另一个物相。此机制的推动力是溶剂蒸发, 但只有溶解的部分,才可发生相转化,晶型 在稳念与亚稳态间转化。溶剂蒸发的快慢, 决定了产生晶核的速率和结晶的增长速率, 对于不溶解的药物,少量可溶的或不溶的辅 料或杂质会影响相转化。
转化方式
• 变体可逆转变与不可逆转变的原理: • 对于一个单元系统,各种变体的吉布斯自 由能G均服从下列关系式: • G = U + pV–TS • 式中U为该变体的内能;p是平衡蒸气压, 对于凝聚体系,p一般很小;V是体积,晶 型转变时,体积变化一般不大;pV项常可 忽略不计;T是绝对温度;S是一定晶型的 熵。绝对零度时,吉布斯自由能G基本由内 能项决定。因此,可得: • G=U
工艺控制方法
• 极少的水就可转化;若挤压力即可致使药 物相转化,则可制成胶囊,而不压成片剂。 还要控制工艺流程的条件, 对于水合物一 定要控制临界相对湿度、 温度、 湿法制粒、 干燥、 研磨和干法制粒等时的条件;针对 互变体系中的不同晶型,工艺流程温度也 需低于熔点。
晶型转变及其控制

对某一特定系统而言,这种相的自由能改变所 伴随的结构改变过程,叫做相转变或相变。英 文phase transition和transformation都用于表述相 变过程。
图3–1 稳定态、介稳态和不稳定态
2
同质异构体(polymorph)或变体(modification)和与同 质多晶或同质多相(polymorphism)现象
C为独立组元(组分)数,Φ为相数,2 代表温度和压力2个变量。
对于凝聚系统来说,压力的影响可以忽 略不计,于是温度成了惟一的外界条件。 在这种情况下,相律可写成
f * = C–Φ + 1, f *被称为条件自由度
4
§3.1 可逆与不可逆晶型转变
从热力学的角度看,一组同质多晶的变体中,吉布斯自由能最低的晶型是稳定的。 对于一个单元系统,各种变体的吉布斯自由能G均服从下列关系式:
晶型转变及其控制方法
2020/4/13
1
相
相变ห้องสมุดไป่ตู้
物质中具有相同化学成分和晶体结构的部分被称为相。相与相之间的转变叫相变。
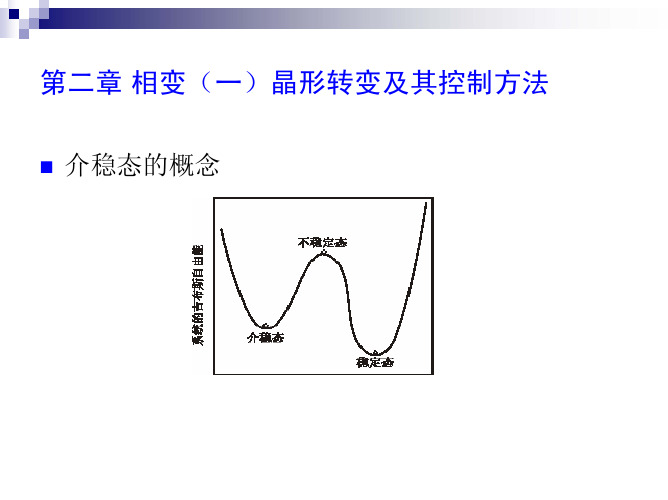
系统中存在的相,可以是稳定、介稳或不稳定的。稳定态指的是系统处在最低的 吉布斯自由能状态。在一定的热力学条件下,如果系统处在一个吉布斯自由能极 小值状态,而不是处在一个最小值状态,它就有可能转变到这个最小值状态;但 也可能会以原状态长期存在, 因为在局部的自由能极小值与最小值之间,存在 着一个势垒,这样的状态称为介稳态,如图2–1所示。当系统的温度、压力或对 系统的平衡发生影响的电场、磁场等条件发生改变时,这种介稳或不稳定状态下 的自由能会发生改变,相的结构(原子或电子分布)也相应地发生变化。
G = U + pV–TS,
(2–1)
式中U为该变体的内能;p是平衡蒸气压
尼莫地平晶型转变的研究

尼莫地平晶型转变的研究尼莫地平是一种具有广泛用途的药物,主要用于治疗高血压和心绞痛等心血管疾病。
尼莫地平结晶时,存在不同的晶型,包括非晶态、单斜晶型和转辐射晶型。
其中,尼莫地平的晶型转变对于其物理性质、溶解度和生物利用度等药物性能具有重要影响。
因此,研究尼莫地平的晶型转变对于药物设计和制剂开发具有重要意义。
尼莫地平晶型转变的研究主要集中在晶型的识别、控制和稳定性评价等方面。
首先,晶型的识别是研究的基础。
通过X射线衍射、热差示扫描仪和红外光谱等技术手段,可以确定尼莫地平的不同晶型,并分析晶体结构的差异。
其次,了解晶型的控制是关键。
通过控制结晶条件如溶剂、温度、浓度等因素,可以引导尼莫地平结晶为特定的晶型,从而调控药物的溶解度和稳定性。
最后,稳定性评价是判定晶型转变是否稳定的重要指标。
通过研究尼莫地平晶型在不同条件下的转变速度和转变机理等方面,可以评估晶型转变的稳定性,并为制剂工艺的优化提供依据。
晶型转变对尼莫地平的物理性质和溶解度等药物性能有直接影响。
不同晶型的尼莫地平具有不同的晶格结构和晶体形态,从而影响药物的溶解度和稳定性。
研究表明,转辐射晶型具有较强的晶体稳定性和溶解度,利于药物的吸收和利用。
因此,通过调控晶型转变,可以提高尼莫地平药物的溶解度和生物利用度。
尼莫地平晶型转变的研究还为药物设计和制剂开发提供了参考。
通过了解晶型转变的机理和影响因素,可以根据药物的特性选择合适的晶型,并对制剂工艺进行优化,提高药物的质量和稳定性。
此外,晶型转变的研究还可以帮助预测药物的溶解动力学和口服生物利用度,指导药物剂量和给药方案的设计。
总之,尼莫地平晶型转变的研究对于药物设计和制剂开发具有重要意义。
通过识别晶型、控制晶型和评价稳定性等方面的研究,可以提高尼莫地平药物的溶解度、稳定性和生物利用度,为药物研发和临床应用提供理论基础和实验依据。
尼莫地平晶型转变的研究不仅有助于深入理解药物的结晶行为,还为其他药物的研究和应用提供了新的思路和方法。
晶形的转变及控制方法

ZrO2的晶型转变
单斜ZrO2
YZZZ≈1ZZ47ZZ3KZZXZ ≈1 273K
四方ZrO2 YZZZ2 Z6Z43ZZKXZZ
立方ZrO2
立方和四方ZrO2的力学性能和杭热震性能优于单斜 相。
将立方相或四方相ZrO2保待至室温的方法
降低ZrO2的晶粒尺寸。
加入第二相氧化物以稳定ZrO2 。
943K
β–C2S
在硅酸盐水泥熟料烧成时,必须采 取急冷的工艺手段,使高活性的βC2S以介稳的形式保存下来。
(a)α–方石英;(b)α–鳞石英;(c)β–石英
重构式转变
会引量 较大,转变过程较慢。
2.3 SiO2的晶型转变和应用
SiO2一元相图
由克劳修斯-克拉佩龙方程判断转变时的体积变化
dp = ∆H dT T∆V
ΔH:相变热效应 ; ΔV:体积变化
位移式转变
1 273 +16.0 β–石英→α–石英
1 273 +15.4 γ–鳞石英→β–鳞石英
1 273 +15.5 β–鳞石英→α–鳞石英
1 273
+0.9 β–方石英→α–方石英
计算 采取 的温 度/K
在该温度 下转变时 的体积效
应/%
846
+0.82
390
+0.2
436
+0.2
423
+2.8
第二章 相变(一)晶形转变及其控制方法
介稳态的概念
晶型转变
当外界条件改变时,化学组成相同,晶体结构不同的 同质异构体(变体)之间发生的相互转变。
BaTiO3
2.1 可逆与不可逆晶型转变
晶形的转变及控制方法
ZrO2的晶型转变
单斜ZrO2
≈1 473K ≈1 273K
四方ZrO2
2 643K
立方ZrO2
立方和四方ZrO2的力学性能和杭热震性能优于单斜 相。 将立方相或四方相ZrO2保待至室温的方法
降低ZrO2的晶粒尺寸。 加入第二相氧化物以稳定ZrO2 。
ZrO2的相变增韧
陶瓷材料产生较大脆性的原因? 相变增韧
σ=
K1C Y L
利用部分稳定ZrO2存在于陶瓷基体里,在一定温度范围内可发 生由四方相向单斜相的晶形转变(伴有3-5%的体积变化), 通过微裂纹机制及应力诱导相变机制来改善陶瓷的强度和韧 性。 微裂纹机制 应力诱导相变机制
2.5 Ca2SiO4 (C2S)和Ca3SiO5 (C3S)的晶型转变 和水泥生产工艺控制
γ -C2 S
798 K
998 K
′ αL -C2 S
943K
1 433 K
′ αH -C2 S
1 K
液相
β–C2S
在硅酸盐水泥熟料烧成时,必须采 取急冷的工艺手段,使高活性的βC2S以介稳的形式保存下来。
表2–1
SiO2晶型转变时的体积变化
计算 采取 的温 度/K 1 273 1 273 1 273 1 273 在该温 度下转 变时的 体积效 应/% 计算 采取 的温 度/K 846 390 436 423 在该温度 下转变时 的体积效 应/% +0.82 +0.2 +0.2 +2.8
重构式转变
位移式转变
重构式转变
会引起化学键的断开以及原子的重新 组合,重新形成新的结构,所需能量 较大,转变过程较慢。
2.3 SiO2的晶型转变和应用
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
对晶型转变的综述
化学组成相同的固体,在不同的热力学条件下,常会形成晶体结构不同的同质异构体(polymorph)[1, 2]或称为变体(modification),这种现象叫同质多晶或同质多相(polymorphism)[2]现象。
当温度和压力条件变化时,变体之间会发生相互转变,此称为晶型转变。
显然,晶型转变是相变的一种,也是最常见的一种固–固相变形式。
由于晶型转变,晶体材料的力学、电学、磁学等性能会发生巨大的变化。
例如,碳由石墨结构转变为金刚石结构后硬度超强,BaTiO3由立方结构转变为四方结构后具有铁电性。
可见,通过相变改变结构可达到控制固体材料性质的目的。
晶型转变有可逆转变与不可逆转变之分。
图1表示具有可逆晶型转变的不同
图1 具有可逆晶型转变的某物质内能U与自由能G的关系[2],
其中U L>UⅡ>UⅠ,S L>SⅡ>SⅠ
变体晶型Ⅰ和晶型Ⅱ以及其液相L之间的热力学关系。
对上述物质进行加热或冷却时,发生了如下的晶型转变:
晶型Ⅰ晶型Ⅱ液相。
当晶型Ⅰ过热(超过Ttr)而介稳存在时,其自由能GⅠ的变化以虚线表示,同时,当液相过冷(低于TmⅡ)处于介稳态时,其自由能GL曲线也以虚线表示;与GL和GⅠ有关的两虚线交于TmⅠ,TmⅠ相当于晶型Ⅰ的熔点。
图1的特点是晶型转变温度Ttr低于两种变体的熔点(TmⅠ和TmⅡ)。
也有一些晶体的变体之间不可能发生可逆晶型转变。
图2表示具有不可逆晶
型转变的不同变体晶型Ⅰ、晶型Ⅱ及它们的液相L之间的热力学关系。
TmⅠ为晶型Ⅰ的熔点,TmⅡ相当于晶型Ⅱ的熔点。
虽然在温度轴上标出了晶型转变温度Ttr,但事实上是得不到的,因为晶体不可能在超过其熔点的温度下发生晶型转变。
此图的特点是,晶型转变温度Ttr高于两种变体的熔点(TmⅠ和TmⅡ)。
从图2可看出,三种晶型相互转变的过程可由下式表示.
晶型Ⅰ熔体
晶型Ⅱ
先经过中间的另一个介稳相(如晶型Ⅱ),才能最终转变成该温度下的稳定态(晶型Ⅰ)的规律,称为阶段转变定律。
可能的非平衡途径几乎总是有多种,而平衡的可能却只有1种。
从动力学过程和相结构改变的特点来看,晶型转变还可分为位移式(displacive)转变和重构式(也称重建式,reconstructive)转变两种类型。
在同系列的高低温变体中,不需要断开和重建化学键,仅发生键角的扭曲和晶格的畸变,属于位移式转变(快速转变),这种相变整体结构没有发生根本性变化。
由于不需要断开和重建化学键,所以这种相变活化能较低,转变速度较快。
通过化学键的断开而重建新的结构是重构式转变(慢速转变),这种转变通常活化能较高,转变速度较慢。
主要有以下三种可能的机理:
(1)纯固相的晶型转变:在转变温度前后,由于热起伏,晶体的某些局部可能会有新相的核胚生成,如果生成的核胚的直径超过某一临界值,核胚将继续长大,否则将重新融入原有的晶型中,这就是所谓的“成核和生长”机理。
此种相变和过冷液体结晶时的均匀成核情况相似。
(2)通过气相的晶型转变:若在相转变温度附近,新旧相间有较大的蒸汽压差,当局部出现过冷度时,高温稳定相由于其蒸汽压较高,难以凝成固相而保留较多气相;而低温稳定相的蒸汽压较低,易于冷凝,故通过“蒸发-冷凝”机理,低温稳定相不断生成和长大。
当局部出现过热度时,有利于高温稳定相的生成和长大。
(3)通过液相的晶型转变:若在相变温度附近,新旧相的溶解度不同,可以通过“溶解-沉淀”过程,自液相中长出新相。
