晶形的转变及控制方法
晶形的转变及控制方法

晶形的转变及控制方法晶体是指具有规则外形和内部结构的固体物质,晶体的形态表现出多样性,有三角形、立方体、六方、正八面体等等。
晶体的形态受到多种因素的影响,包括成分、温度、溶液浓度、晶体生长速率等等。
控制晶体形态的方法有很多种,下面将介绍几种常见的晶体形态控制方法。
一、溶液方法溶液方法是通过变化溶液的成分、浓度、pH值等来控制晶体的形态。
在溶液中添加一定的添加剂可以改变溶液中晶体生长的速率和方向,从而影响晶体的形态。
例如,在金属晶体的生长过程中,通过调节金属盐的浓度、酸度和温度等条件,可以控制晶体的形貌。
二、模板方法模板方法是利用一个具有特定形状和大小的模板来引导晶体的生长,使晶体的形态与模板一致。
一种常见的模板方法是利用聚合物微球作为模板,通过在微球表面沉积晶体材料,再去除微球模板,得到具有相同形状的晶体。
三、温度和压力方法温度和压力方法是通过调节晶体生长的温度和压力来控制晶体的形态。
当温度和压力变化时,晶体的生长速率和方向也会发生变化,从而导致晶体形态的改变。
例如,在化学气相沉积中,通过调节反应区的温度梯度,可以控制金属氧化物晶体的生长方向,从而改变晶体的形状。
四、表面活性剂方法表面活性剂方法是利用表面活性剂分子在溶液中的吸附作用来控制晶体的形态。
表面活性剂分子吸附在晶体的特定面上,在该面的生长速率较低,导致晶体在该方向上长得较慢,从而形成具有特定形状的晶体。
五、电化学方法电化学方法是利用电场和电流来控制晶体的形态。
通过在晶体生长过程中施加外加电压或电流,可以改变晶体的生长速率和方向,从而控制晶体的形态。
一种常见的电化学方法是电沉积,通过控制电沉积过程中的电流密度和沉积时间等参数,可以得到具有特定形状和尺寸的晶体。
总之,控制晶体的形态有多种方法,可以通过改变溶液条件、利用模板、调节温度和压力、使用表面活性剂和应用电化学方法等来实现。
对于不同的晶体材料和应用需求,选择适合的晶体形态控制方法非常重要,可以实现对晶体形态的精确控制,从而获得具有特定形状和性能的晶体材料。
固体药物晶型转化现象以及工艺控制方法

产生原因
• 晶体中药物分子间的结合主要依靠分子间作 用力(如:氢键、盐键、配位键及范德华力 等),以此维系分子在空间的稳定排列。固 体药物在结晶过程中因重结晶条件的变化, 而产生其分子在晶胞中的对称规律的不同, 导致药物分子之间、药物分子与溶剂分子之 间相互作用力或结合方式的不同,以及某些 化合物的化学键旋转、局部构象变化等等, 这些因素均可使药物的晶体出现两种或两种 以上的空间群和晶胞参数,产生多晶型现象。
转化机制
• ③溶液相变:溶液相变存在于药物完全或部 分溶解于液体的过程及溶剂蒸发的过程中。 当药物溶解时, 如湿法制粒中加水 ,盐类 药物因溶解度较大,可部分溶解,蒸发溶剂 后,可形成另一种晶型;若增加溶剂,可形 成另一个物相。此机制的推动力是溶剂蒸发, 但只有溶解的部分,才可发生相转化,晶型 在稳念与亚稳态间转化。溶剂蒸发的快慢, 决定了产生晶核的速率和结晶的增长速率, 对于不溶解的药物,少量可溶的或不溶的辅 料或杂质会影响相转化。
转化方式
• 变体可逆转变与不可逆转变的原理: • 对于一个单元系统,各种变体的吉布斯自 由能G均服从下列关系式: • G = U + pV–TS • 式中U为该变体的内能;p是平衡蒸气压, 对于凝聚体系,p一般很小;V是体积,晶 型转变时,体积变化一般不大;pV项常可 忽略不计;T是绝对温度;S是一定晶型的 熵。绝对零度时,吉布斯自由能G基本由内 能项决定。因此,可得: • G=U
工艺控制方法
• 极少的水就可转化;若挤压力即可致使药 物相转化,则可制成胶囊,而不压成片剂。 还要控制工艺流程的条件, 对于水合物一 定要控制临界相对湿度、 温度、 湿法制粒、 干燥、 研磨和干法制粒等时的条件;针对 互变体系中的不同晶型,工艺流程温度也 需低于熔点。
晶型转变及其控制

对某一特定系统而言,这种相的自由能改变所 伴随的结构改变过程,叫做相转变或相变。英 文phase transition和transformation都用于表述相 变过程。
图3–1 稳定态、介稳态和不稳定态
2
同质异构体(polymorph)或变体(modification)和与同 质多晶或同质多相(polymorphism)现象
C为独立组元(组分)数,Φ为相数,2 代表温度和压力2个变量。
对于凝聚系统来说,压力的影响可以忽 略不计,于是温度成了惟一的外界条件。 在这种情况下,相律可写成
f * = C–Φ + 1, f *被称为条件自由度
4
§3.1 可逆与不可逆晶型转变
从热力学的角度看,一组同质多晶的变体中,吉布斯自由能最低的晶型是稳定的。 对于一个单元系统,各种变体的吉布斯自由能G均服从下列关系式:
晶型转变及其控制方法
2020/4/13
1
相
相变ห้องสมุดไป่ตู้
物质中具有相同化学成分和晶体结构的部分被称为相。相与相之间的转变叫相变。
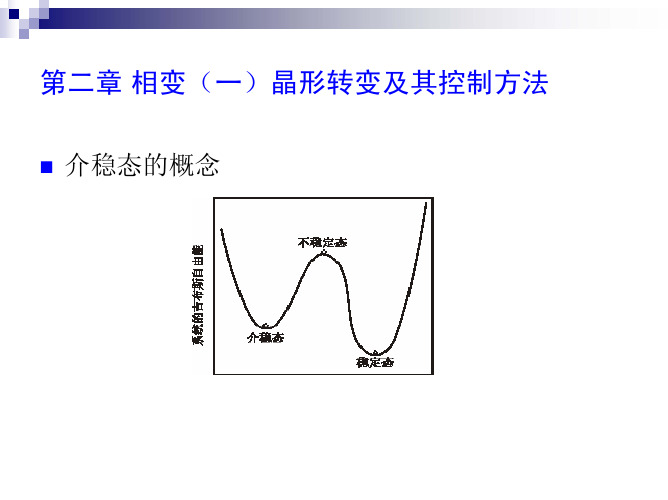
系统中存在的相,可以是稳定、介稳或不稳定的。稳定态指的是系统处在最低的 吉布斯自由能状态。在一定的热力学条件下,如果系统处在一个吉布斯自由能极 小值状态,而不是处在一个最小值状态,它就有可能转变到这个最小值状态;但 也可能会以原状态长期存在, 因为在局部的自由能极小值与最小值之间,存在 着一个势垒,这样的状态称为介稳态,如图2–1所示。当系统的温度、压力或对 系统的平衡发生影响的电场、磁场等条件发生改变时,这种介稳或不稳定状态下 的自由能会发生改变,相的结构(原子或电子分布)也相应地发生变化。
G = U + pV–TS,
(2–1)
式中U为该变体的内能;p是平衡蒸气压
药物晶型转化与控制的研究进展

$# ( > ( / B ( 00 , + ( ) * #D* *D) > ' A $Z " C & % % ( ) & * 0 / * 2 + 5 & % [( Z0 1 3 7 % 1 3 7 %- G % 3 1 ' 6 F 1 ' K 3 ! ; G ; 1 ', D & 2 * 0 , + / & */ + ( .$= 1 % 2 L 6 F7 E 6( 4 L < % 3 4 &( 4 L 1 2 4 &/ K < 6 3 K 6 H H 8L " 5 % 1 3 F 4 L < % 3% J, E < 3 4 !# * * 9 ! * 9 +# L E 6A < 4 3 < 3U 1 3 < K < 4 &( 4 L 1 2 4 & ; H # / K < 6 3 K 65 % 1 3 F 4 L < % 3! * ) 0 , P V 0 , * " # ) ) 4 3 F L E 6/ L 4 L 6W 6 4 7 % 2 4 L % 2 8X 8 # % J, E 6 I < K 4 &. 3 < 3 6 6 2 < 3 / W X ? , Y. ? * * V ) # \ G G!
0= < ;0
化工学报
"卷 第!
引言
多晶型是同一物质生成不同结构的晶体的一种 现象 " 它在有机药物中广泛存在 ( 据统计 "> @] 以 上的医药产品以固体形式存在 " 而且其中大部分是 晶体 ( 美国 药 典 ! # > 版# 片 剂 样 品 中 约 有 " )] 的 药物存在多晶型现象 ( 随着分析技术的发展 " 越来 越多的药物被发现存在多晶型现象 ( 对于多晶型药 物来说 " 同一药物不同晶型的产品可能存在晶体内 部分子间作用力以及表面性质的差异 " 其理化性质 如溶解度 % 熔点 % 密度 % 硬度 % 热容 % 晶体形态等 可能有所差异 " 这 不 仅 会 影 响 医 药 产 品 的 流 动 性 % 可压缩性 % 凝聚性能等加工性能 " 更重要的是还可 能引起药物溶出速率 % 溶出度 % 稳定性等的质量差 异 " 从而影响药物的生物活性与生物利用度 " 导致 临床疗 效 的 差 异 ( 如 抗 溃 疡 药 西 咪 替 丁 存 在 C% V%, 等多种晶型 " 仅 C 型最 有 效 " 而 国 产 西 咪 替 丁一般并 非 完 全 C 晶 型 " 从 而 影 响 了 疗 效 * 另 一 种抗溃疡药法莫替丁有 " 种晶型 " 其熔点 % 红外光 谱 及 理 化 性 质 差 异 明 显" 其 中 V 晶 型 的 活 性 明 显 大于 C 晶 型
晶形的转变及控制方法
ZrO2的晶型转变
单斜ZrO2
≈1 473K ≈1 273K
四方ZrO2
2 643K
立方ZrO2
立方和四方ZrO2的力学性能和杭热震性能优于单斜 相。 将立方相或四方相ZrO2保待至室温的方法
降低ZrO2的晶粒尺寸。 加入第二相氧化物以稳定ZrO2 。
ZrO2的相变增韧
陶瓷材料产生较大脆性的原因? 相变增韧
σ=
K1C Y L
利用部分稳定ZrO2存在于陶瓷基体里,在一定温度范围内可发 生由四方相向单斜相的晶形转变(伴有3-5%的体积变化), 通过微裂纹机制及应力诱导相变机制来改善陶瓷的强度和韧 性。 微裂纹机制 应力诱导相变机制
2.5 Ca2SiO4 (C2S)和Ca3SiO5 (C3S)的晶型转变 和水泥生产工艺控制
γ -C2 S
798 K
998 K
′ αL -C2 S
943K
1 433 K
′ αH -C2 S
1 K
液相
β–C2S
在硅酸盐水泥熟料烧成时,必须采 取急冷的工艺手段,使高活性的βC2S以介稳的形式保存下来。
表2–1
SiO2晶型转变时的体积变化
计算 采取 的温 度/K 1 273 1 273 1 273 1 273 在该温 度下转 变时的 体积效 应/% 计算 采取 的温 度/K 846 390 436 423 在该温度 下转变时 的体积效 应/% +0.82 +0.2 +0.2 +2.8
重构式转变
位移式转变
重构式转变
会引起化学键的断开以及原子的重新 组合,重新形成新的结构,所需能量 较大,转变过程较慢。
2.3 SiO2的晶型转变和应用
石英晶形转变存在的特点及其实际生产中应用

石英晶形转变存在的特点及其实际生产中应用石英晶形转变存在的特点及其实际生产中应用1.引言石英晶形转变是一个在矿物学与地球化学中非常重要的现象,它不仅影响着石英晶体的物理性质和化学性质,也对石英在实际生产中的应用产生深远影响。
本文将深入探讨石英晶形转变的特点及其在实际生产中的应用。
2.石英晶形转变的特点2.1 热力学性质石英在高温高压条件下会发生晶形转变,其原因主要是石英晶体结构中的硅原子和氧原子重新排列。
石英以α石英和β石英两种晶形存在,α石英具有六方晶系,而β石英则具有三方晶系。
这种晶形转变会导致石英晶体的物理性质和化学性质发生明显变化。
2.2 动力学特性除了受到温度和压力的影响外,石英晶形转变还受到外界应力的影响,这种应力可以促进或抑制石英的晶形转变。
因此在实际生产中,通过控制温度、压力和应力,可以实现对石英晶体晶形转变的精确控制,从而获得具有特定性质的石英晶体。
3.石英晶形转变在实际生产中的应用3.1 电子产品制造由于石英具有优异的压电性能和光学性能,因此被广泛应用于电子产品制造。
石英晶形转变可以改变石英晶体的物理特性,从而使其更加适用于不同的电子产品,如压电陶瓷、石英振荡器等。
3.2 导热材料制备通过控制石英晶形转变,可以获得具有良好导热性能的石英晶体,这对于制备高性能的导热材料非常重要。
在微电子、半导体等领域,这种高导热性能的石英晶体被广泛应用于散热器、散热片等导热材料的制备中。
3.3 岩石学研究石英晶形转变在岩石学研究中也具有重要意义,它可以帮助地质学家了解地球内部的温度、压力和构造变化,从而深入理解地球的演化历程和地质现象。
4.个人观点与理解通过对石英晶形转变的深入研究,我对石英晶体的应用和性质有了更深入的理解。
在实际生产中,通过精确控制石英晶形转变,可以获得具有特定性能的石英晶体,从而拓展了石英在电子产品制造、导热材料制备和岩石学研究中的应用领域。
5.总结与回顾本文深入探讨了石英晶形转变的特点及其在实际生产中的应用。
晶型转变及其控制方法

第二章晶型转变及其控制方法系统中存在的相,可以是稳定、介稳或不稳定的。
其吉布斯自由能如图2–1所示。
当系统的温度、压力或对系统的平衡发生影响的电场、磁场等条件发生改变时,这种介稳或不稳定状态下的自由能会发生改变,相的结构(原子或电子分布)也相应地发生变化。
此外,在一定的条件下,一种稳定相也可以转变成另一种稳定相,此即下文所说的可逆晶型转变。
对某一特定系统而言,相的自由能改变所伴随的结构改变过程,叫做相转变或相变。
图2–1 稳定态、介稳态和不稳定态化学组成相同的固体,在不同的热力学条件下,常会形成晶体结构不同的同质异构体(polymorph)[1, 2]或称为变体(modification),这种现象叫同质多晶或同质多相(polymorphism)[2]现象。
当温度和压力条件变化时,变体之间会发生相互转变,此称为晶型转变。
显然,晶型转变是相变的一种,也是最常见的一种固–固相变形式。
由于晶型转变,晶体材料的力学、电学、磁学等性能会发生巨大的变化。
例如,碳由石墨结构转变为金刚石结构后硬度超强,BaTiO3由立方结构转变为四方结构后具有铁电性。
可见,通过相变改变结构可达到控制固体材料性质的目的。
相律的表达式是自由度f= C–Φ+ 2,C为独立组元(组分)数,Φ为相数,数字2代表温度和压力2个变量。
对于凝聚系统来说,压力的影响可以忽略不计,于是温度成了惟一的外界条件。
在这种情况下,相律可写成f * = C–Φ+ 1,f * 被称为条件自由度。
对于单元(单组分)系统来说,C = 1,f * = 2–Φ。
由于所讨论的系统至少有1个相,所以单元凝聚系统条件自由度数最多等于1,系统的状态仅仅由温度1个独立变量所决定。
于是,在许多情况下,单元系统相变往往用流程图来表示,例如本章§2.3节对BaTiO3晶型转变所采用的表示法。
在另一些场合下,考虑压力变量的影响对讨论问题是有利的。
由于凝聚系统的平衡蒸气压实际上仍比大气压低得多,所以在讨论单元凝聚系统相图时,往往把压力坐标(纵标)加以夸大,画出来的相图中的曲线仅仅表示温度变化时系统中压力变化的大致趋势,这种情况如在本章§2.4~§2.6中所描述的SiO2、ZrO2和Ca2SiO4(C2S)单元系统带有晶型转变的相图。
石英的晶型转变

石英的晶型转变引言石英是一种常见的硅酸盐矿物,具有多种晶型。
晶型转变是指石英晶体在特定条件下由一种晶型转变为另一种晶型的过程。
本文将探讨石英晶型转变的机制、条件和应用。
石英的晶型石英的基本结构石英的化学式为SiO2,其晶体结构为正交晶系。
每个石英晶体分子构成了一个六角形晶胞,其中SiO4四面体是其基本结构单元。
α石英α石英是石英的稳定晶型,在自然界中最常见。
其晶体结构呈现紧密堆积的四面体结构,具有六方晶系特征。
α石英是一种透明无色或淡黄、浅紫色的矿物。
β石英β石英是石英的高温相,结构与α石英有所不同。
它具有三方晶系的特征,晶体结构较松散。
β石英呈现出一种不透明的白色或浅棕色,常见于高温高压的地质环境中。
石英晶型转变的机制石英晶型转变通常发生在高温或高压条件下。
下面探讨两种常见的石英晶型转变机制:α-β石英转变α-β石英转变是指α石英在高温下转变为β石英的过程。
该转变是可逆的,即β-α石英转变也可能发生。
以下是α-β石英转变的机制:1.压力释放机制:高温下,石英晶体内部压力减小,导致原子结构重新排列,形成β石英的晶型。
2.扭曲机制:高温下,由于原子热振动增强,石英晶体扭曲变形,产生β石英的晶型。
β-α石英转变β-α石英转变是指β石英在低温下转变为α石英的过程。
该转变在大气压力下发生。
以下是β-α石英转变的机制:1.形态分解机制:在低温下,β石英晶体内部压力增大,形成石英晶体的特殊形态,同时原子结构重新排列,形成α石英的晶型。
2.析晶机制:低温下,β石英晶体产生裂缝和断裂,最终析晶为α石英的晶型。
石英晶型转变的条件石英晶型转变的条件包括温度、压力和时间。
温度石英晶型转变的温度范围与晶型有关。
α-β石英转变温度约为573°C,而β-α石英转变温度约为870°C。
压力石英晶型转变的压力范围也与晶型有关。
α-β石英转变通常在高压条件下发生,而β-α石英转变在大气压力下发生。
时间石英晶型转变所需的时间取决于温度和压力。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ZrO2的晶型转变
单斜ZrO2
YZZZ≈1ZZ47ZZ3KZZXZ ≈1 273K
四方ZrO2 YZZZ2 Z6Z43ZZKXZZ
立方ZrO2
立方和四方ZrO2的力学性能和杭热震性能优于单斜 相。
将立方相或四方相ZrO2保待至室温的方法
降低ZrO2的晶粒尺寸。
加入第二相氧化物以稳定ZrO2 。
943K
β–C2S
在硅酸盐水泥熟料烧成时,必须采 取急冷的工艺手段,使高活性的βC2S以介稳的形式保存下来。
(a)α–方石英;(b)α–鳞石英;(c)β–石英
重构式转变
会引量 较大,转变过程较慢。
2.3 SiO2的晶型转变和应用
SiO2一元相图
由克劳修斯-克拉佩龙方程判断转变时的体积变化
dp = ∆H dT T∆V
ΔH:相变热效应 ; ΔV:体积变化
位移式转变
1 273 +16.0 β–石英→α–石英
1 273 +15.4 γ–鳞石英→β–鳞石英
1 273 +15.5 β–鳞石英→α–鳞石英
1 273
+0.9 β–方石英→α–方石英
计算 采取 的温 度/K
在该温度 下转变时 的体积效
应/%
846
+0.82
390
+0.2
436
+0.2
423
+2.8
第二章 相变(一)晶形转变及其控制方法
介稳态的概念
晶型转变
当外界条件改变时,化学组成相同,晶体结构不同的 同质异构体(变体)之间发生的相互转变。
BaTiO3
2.1 可逆与不可逆晶型转变
对于单元系统,各种变体的吉布 斯自由能G均服从下面这个关系
式 : G=U+pV-TS
可逆晶型转变
ZrO2的相变增韧
陶瓷材料产生较大脆性的原因?
σ = K1C
YL
相变增韧
利用部分稳定ZrO2存在于陶瓷基体里,在一定温度范围内可发 生由四方相向单斜相的晶形转变(伴有3-5%的体积变化), 通过微裂纹机制及应力诱导相变机制来改善陶瓷的强度和韧 性。
微裂纹机制
应力诱导相变机制
低温时,G由内能决定 高温时,TS项的影响重要
特点:晶型转变温度低于两 种变体的熔点
不可逆晶型转变
特点:晶型转变温度高于两 种变体的熔点
2.2 位移式与重构式晶型转变
位移式转变
不破坏化学键,可通过原子位置的微小位 移或键角的转动来实现,转变速度较快。
一级配位:最近邻 原子之间的键合 二级配位:次近邻 原子之间的相互作 用
从低温变体向高温变体转变时,为吸热过程,ΔH为正值,若相图 上曲线的斜率(dp/dT)也为正值,则ΔV为正值,即体积膨胀。
表2–1 SiO2晶型转变时的体积变化
重构式转变
α–石英→α–鳞石英 α–石英→α–方石英 α–石英→石英玻璃 石英玻璃→α–方石英
计算 采取 的温 度/K
在该温 度下转 变时的 体积效 应/%
2.5 Ca2SiO4 (C2S)和Ca3SiO5 (C3S)的晶型转变 和水泥生产工艺控制
γ -C2S YZZZ99Z8ZKZZXZαL′ -C2S YZZZ1 4ZZ33ZZKZXZZαH′ -C2S YZZZ1 6ZZ93ZZKZXZZα-C2S YZZZ2 Z4Z03ZZKZZXZ液相
798 K
2.4 ZrO2的晶型转变和陶瓷增韧
ZrO2陶瓷材料的主要特点及应用领域
是最耐高温的氧化物之一(熔点2680℃),具有很好 的热稳定性。
作为一种高温固体电解质,可用来做氧敏感传感器和 高温发热元件等。
用于高温结构陶瓷的增韧。 部分稳定氧化锆具有高的硬度和耐磨性,广泛用于耐
磨介质领域 。
