国内外标准测定依达拉奉注射液含量结果的对比研究
依达拉奉注射液的质量标准

依达拉奉注射液的质量标准
依达拉奉注射液是一种用于治疗风湿性关节炎和类风湿性关节炎的药物。
为了保证患者的用药安全和疗效,制定一份严格的质量标准至关重要。
下面是一份关于依达拉奉注射液的质量标准的示范,包括药物的外观、成分、纯度、稳定性以及生产工艺等方面的要求。
1. 外观要求
依达拉奉注射液应该是一种清澈、无色透明的液体,不得有悬浮物或沉淀物。
瓶身应干净完整,无破损或渗漏。
2. 成分及含量测定
(1)依达拉奉注射液的主要成分为依达拉奉。
(2)依达拉奉的含量应符合国家药典中规定的标准要求。
3. 纯度要求
(1)依达拉奉注射液中有关杂质的含量应符合国家药典中规定的限量要求。
(2)微生物限度应符合国家药典中规定的要求。
4. 稳定性
依达拉奉注射液在常温下应该能保持稳定,不分解、不氧化或不发生其他化学变化。
5. 生产工艺要求
(1)生产车间应符合GMP标准。
(2)所有原辅料应当有详细的质量控制记录。
(3)生产过程中的所有关键步骤均应定期进行验证。
(4)设备应当定期维护、清洁,并进行有效的验证。
6. 包装要求
依达拉奉注射液的包装材料应符合药物包装的相关要求,确保能有效地保护药品的质量和稳定性。
总结
依达拉奉注射液的质量标准应当覆盖药品的外观、成分、纯度、稳定性和生产工艺等方面,并严格按照国家药典的要求进行检测和验证。
生产企业在生产过程中应该始终遵守GMP等相关质量标准,并建立健全的质量管理体系。
这样才能确保依达拉奉注射液的质量稳定可靠,从而在临床应用中发挥出预期的疗效。
依达拉奉注射液安全性实验研究

有明确疗效,可明显提高患者自理能力,改善预后,其 机制与依达拉奉能增加超氧化物歧化酶活性,有效维 持线粒体的结构完整有关[6]。本试验的受试药物依达 拉奉注射液对红细胞未见明显溶血和凝集作用; 家兔 静脉注射给药后未见明显血管刺激性; 豚鼠静脉注射 后第 21 天未见明显全身主动过敏反应。以上结果提 示依达拉奉注射液安全性较好,可供临床静脉注射给 药。
1 材料与方法
1. 1 实验材料 依达拉奉注射液,规格: 7. 5 mg /5ml / 支( 合肥久诺医药科技有限公司,批号: 2009091541) ; 氯化 钠 注 射 液 ( 中 国 大 冢 制 药 有 限 公 司,批 号: OE75B) ; 白色家兔,体质量( 2. 4 ± 0. 19) kg; 白色豚鼠, 体质量 300 ~ 350 g,由安徽长临河医药科技有限公司
[关键词] 处方分析; 不合理用药; 门诊 doi: 10. 3969 / j. issn. 1000 - 0399. 2011. 09. 053
Analysis of irrational drug use in outpatient prescriptions Wang Tao,Xu Guosheng Department of Pharmacy,105 th Hospital of PLA,Hefei 230031,China [Abstract] Objective To investigate the quality of the outpatient prescriptions in our hospital and analyze the reasons for the irrational drug use. Methods 6 000 outpatient prescriptions were randomly selected for the analysis of prescription rationality. Results 371 ( 6. 18% ) prescriptions were found to be unqualified. The main problems laied in the unreasonable combination,repeated medication,incorrect medicine,incorrectness of dosage and administration and unreasonable dissolvent. Conclusion As the causes for irrational drug use vary and tend to be complicated,pharmacists should strengthen monitoring on rational use of prescription drugs. [Key words] Prescription analysis; Irrational drug use; outpatient department
依达拉奉注射液临床前研究工作综述

依达拉奉注射液临床前研究工作综述依达拉奉是日本日本三菱东京制药株式会社研制开发的新型脑保护剂,2001年4月经后生省批准在日本上市。
国外上市剂型为水针剂,规格为30mg/20ml,参照国外上市剂型及规格,按照我国《新药审批办法》的有关规定,完成以下研究工作:2.1、依达拉奉注射液完整处方主、辅料重量(g)依达拉奉30.0亚硫酸氢钠20.0L-半胱氨酸盐酸盐一水合物10.00.5mol/L氢氧化钠溶液调节至pH3.5~4.0注射用水加至20L制成 1000支2.2、制备工艺按处方量称取L-半胱氨酸盐酸盐一水合物置加有适量注射用水的配液罐中溶解,加入0.1%的针用活性炭,搅拌30分钟,过滤除炭,称取处方量依达拉奉加入上述滤液中,加热搅拌30分钟使依达拉奉完全溶解;另称取处方量亚硫酸氢钠溶解后,加入0.1%的针用活性炭过滤除炭,滤液加入依达拉奉和L-半胱氨酸盐酸盐一水合物溶液中,0.5mol/L氢氧化钠溶液调节至pH3.5~4.0,注射用水加至全量,0.45µm滤膜过滤。
中间体检查pH、含量等合格后,灌装到安瓿中,熔封,115℃热压灭菌30分钟,质量检查合格后包装,即得。
2.3、理化常数、纯度检查、含量测定等与质量标准研究有关的研究工作本品外观性状为无色的澄明液体。
本品的鉴别采用紫外法、化学法和高效液相色谱法。
本品纯度考察了装量、pH值、颜色和有关物质等,其它各项均符合注射液项下的有关各项规定。
含量测定采用了高效液相色谱法,经方法学考察,高效液相色谱法专属性强,灵敏度高,回收率好,可做为依达拉奉注射液的含量测定方法。
根据上述研究结果制定了质量标准。
2.4、制剂的初步稳定性研究本品经影响因素试验表明:本品对光照、40℃高温等条件,各项指标无影响;60℃高温条件下有关物质略有增加,其他各项指标无影响;加速试验六个月,各项指标均无变化;室温留样考察六个月,各项指标无变化。
因此本品应室温保存。
2.5、药理及毒理研究详见原料药资料。
依达拉奉注射液细菌内毒素检查的质量标准研究

依达拉奉注射液细菌内毒素检查的质量标准研究作者:许雷鸣顾倩武谷来源:《中国医药导报》2013年第05期[摘要] 目的统一依达拉奉注射液细菌内毒素检查限值,为依达拉奉注射液标准的提高提供参考。
方法按《中国药典》2010年版二部附录细菌内毒素检查法,采用2个不同厂家的鲎试剂对5个不同厂家的依达拉奉注射液样品进行研究。
结果依达拉奉注射液最大不干扰浓度为0.187 5 mg/mL,可将细菌内毒素检查限值在现行国家标准基础上统一提高至“每毫克小于0.33 EU”。
结论统一后的限值可行,可更严格控制产品中的内毒素。
[关键词] 依达拉奉注射液;细菌内毒素检查;干扰试验[中图分类号] R927.33 [文献标识码] A [文章编号] 1673-7210(2013)02(b)-0103-03依达拉奉是一种脑保护剂(自由基清除剂),可清除自由基,抑制脂质过氧化,从而抑制脑细胞、血管内皮细胞、神经细胞的氧化损伤。
临床上用于改善急性脑梗死所致的神经症状、日常生活活动能力和功能障碍。
目前,关于依达拉奉注射液的细菌内毒素检查限值不统一。
国家食品药品监督管理局标准YBH28302005中细菌内毒素检查限值为:每毫克依达拉奉中含内毒素的量应小于2.0 EU;国家食品药品监督管理局标准YBH01602008中细菌内毒素检查限值为:每毫升中含内毒素量应小于0.5 EU;国家食品药品监督管理局标准YBH10412008中细菌内毒素检查限值为:每毫克依达拉奉中含内毒素的量应小于3.33 EU;国家食品药品监督管理局标准YBH00372011中细菌内毒素检查限值为:每毫克依达拉奉中含细菌内毒素的量应小于2.5 EU。
查阅国外药典,未见收载该品种。
本实验参照依达拉奉注射液现行标准,《中国药典》2010年版二部“细菌内毒素检查法”[1]以及相关细菌内毒素检查的文献[2-10],考察了5个厂家的产品,研究本品对细菌内毒素检查试验的干扰情况,探讨提高本品细菌内毒素限值的可行性,在实验基础上统一细菌内毒素检查质量标准。
依达拉奉注射液检验报告
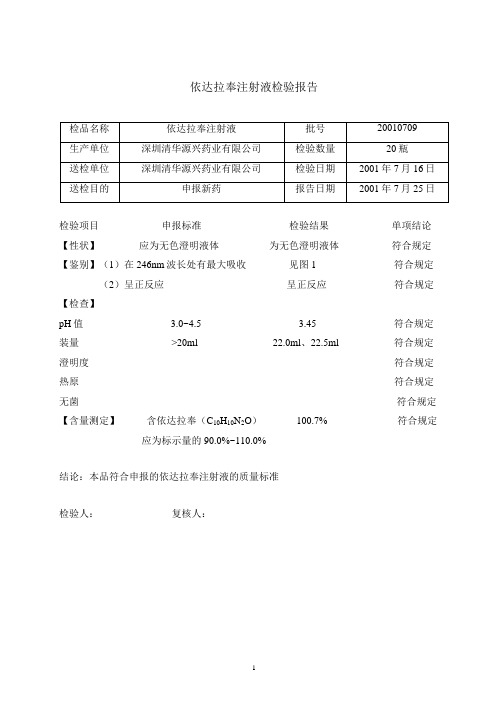
依达拉奉注射液检验报告检验项目申报标准检验结果单项结论【性状】应为无色澄明液体为无色澄明液体符合规定【鉴别】(1)在246nm波长处有最大吸收见图1 符合规定(2)呈正反应呈正反应符合规定【检查】pH值 3.0~4.5 3.45 符合规定装量 >20ml 22.0ml、22.5ml 符合规定澄明度符合规定热原符合规定无菌符合规定【含量测定】含依达拉奉(C10H10N2O) 100.7% 符合规定应为标示量的90.0%~110.0%结论:本品符合申报的依达拉奉注射液的质量标准检验人:复核人:依达拉奉注射液检验报告检验项目申报标准检验结果单项结论【性状】应为无色澄明液体为无色澄明液体符合规定【鉴别】(1)在246nm波长处有最大吸收见图2 符合规定(2)呈正反应呈正反应符合规定【检查】pH值 3.0~4.5 3.50 符合规定装量 >20ml 21.8ml、22.2ml 符合规定澄明度符合规定热原符合规定无菌符合规定【含量测定】含依达拉奉(C10H10N2O) 100.5% 符合规定应为标示量的90.0%~110.0%结论:本品符合申报的依达拉奉注射液的质量标准检验人:复核人:依达拉奉注射液检验报告检验项目申报标准检验结果单项结论【性状】应为无色澄明液体应为无色澄明液体符合规定【鉴别】(1)在246nm波长处有最大吸收见图3 符合规定(2)呈正反应呈正反应符合规定【检查】pH值 3.0~4.5 3.53 符合规定装量 >20ml 20.6ml、21.5ml 符合规定澄明度符合规定热原符合规定无菌符合规定【含量测定】含依达拉奉(C10H10N2O) 100.2% 符合规定应为标示量的90.0%~110.0%结论:本品符合申报的依达拉奉注射液的质量标准检验人:复核人:。
HPLC法测定依达拉奉注射液的含量

・ 1 9・
H P L C法测 定依 限公 司。 黑龙 江 哈 尔滨 1 5 0 0 2 5 ) 摘 要: 目的 建 立高效液相 色谱法测定依达拉奉 注射 液的含 量 ; 方法 采 用反 向高效液相 色谱 法 , 以十八烷 基硅 烷键 合硅胶为填 充 剂 ( 4 . 6 a r m× 1 5 0 m m ) ;流动相为 0 . 0 2 m o l / L的磷 酸二 氢钠 ( 用N a O H溶 液调 p H 6 . 8 ) 一甲醇溶液 ( 6 5 : 3 5 ) ;流速 为 1 m l / m i n ;检测波长 为
1 仪 器 和 试 剂
2 . 2 . 4稳定性试验
H P L C( 美 国安捷 伦 1 2 0 0 ) ,依达拉 奉 注射液 ( 2 0 1 1 0 3 0 1 、 取依 达拉奉 注射 液 5 m l , 照 含量 测定方法制备供试 品溶 液 , 每 小 时取 1 0 l 注入色谱仪 , 记 录色谱 图 , 8 h内测得峰面积 的 2 0 1 1 0 3 0 2 、 2 0 1 1 0 3 0 3 , 规格 2 0 m l : 3 0 m g ) , 磷 酸二氢钠 为分 析纯 , 甲醇 间隔 1
2 方 法 和 结 果
含量 。 2 . 2结果 2 . 2 . 1专属性实验
3 结 论
此法 测定依达拉奉注射液的含量 , 专属性强 , 线 性关 系 良好 , 精 准确度好 , 操作简便 , 灵敏 。 依处 方 比例称 取本 品制剂辅 料 , 不 加依达拉奉 , 配制空 白辅 料 密度 高 , 参考文献 注射 液 , 取空 白辅料注射液 5 m l , 照2 . 1 . 2 方法测定 , 记 录色谱 图 , 辅 『 1 ] A. G r a u l , J . C a s t a n e r ,D r u g s o f t h e F u t u r e , 1 9 9 6 , 2 1 ( 1 0 ) : 1 0 1 4 — 1 0 1 6 . 料峰不干扰依达拉奉含量测定 , 专属性强。 『 2 ] 日本后 生省审查报告——第 3期临床试验结果[ R ] . 2 . 2 . 2线性 试验 3 ] E d a r a v o n e日文说 明 书. 取经 1 0 5  ̄ C 干燥至恒重 的依达拉奉对照品约 0 . 1 5 g ,置 5 0 ml 容 『 4 ] 高效液相 色谱 法[ s 】 . 中国药典 , 2 0 1 0 . 量瓶 中, 加流动相适量使依达拉奉溶解 , 并 用流动相稀释至刻度 , 摇 [ 匀; 精 密量 取上述 溶液 2 , 3 , 4 , 5 , 6 , 7 m l , 分别置 于 5 0 m l 容 量瓶 中 , 加流动相稀释至刻度 , 摇匀。精 密量 取 1 O l 注入液相色谱仪 , 记 录 色 谱 图 ,峰 面 积 结果 见 表 1 。 试 验 结 果 表 明 依 达 拉 奉 在 1 1 8 ~ 4 1 3 g C ml 浓度范 围内呈线性关系 。
高效液相色谱法测定依达拉奉注射液中有关物质含量
液 -甲醇(25∶75,V/V,用 20%磷酸溶液调 pH至 3.0牘为流动相 B,梯度洗脱,流速为 1.0mL/min,柱温为 35℃,检测波长为 245nm。
以主成分自身对照法计算有关物质含量。结果 主成分与有关物质能完全分离,各杂质峰分离良好;各已知杂质不同质量浓度的平均回
收率均在 99.46% ~101.57%之间,RSD均小于 4.1%(n=9);各批次依达拉奉注射液中总杂质含量均不大于 0.3%。结论 该方法专
Abstract:Objective ToestablishanHPLCmethodforthecontentdeterminationofrelatedsubstancesinEdaravoneIniection.Methods The
chromatographic column wasTianhe KromailC18 column(250 mm×4.6 mm,5 μm),the mobile phase A consisted of0.02 mol/L ammonium dihydrogen phosphate-metቤተ መጻሕፍቲ ባይዱanol(55∶45,V/V,20% phosphoricacid wasused toadjustpH to3.0),themobilephaseB
consisted of0.02 mol/L ammonium dihydrogen phosphate-methanol(25∶75,V/V,20% phosphoric acid wasused to adjustpH to 3.0),gradientelution,theflow ratewas1.0 mL/min,thecolumn temperaturewas35 ℃ ,thedetection wavelength was245 nm.The
依达拉奉注射液检验报告
依达拉奉注射液检验报告依达拉奉(英文名Yidafen)是一种抗癌药物,主要用于治疗肺癌、胃癌、食管癌等恶性肿瘤。
依达拉奉注射液(以下简称“依达注射液”)是一种针剂,每支剂量为50mg,作为化疗的辅助药物使用。
作为一种抗癌药物,依达注射液的质量是非常重要的,因此需要进行严格的检验。
本次检验旨在验证依达注射液的药物成分、效力以及质量控制等方面的情况。
首先,我们对依达注射液的药物成分进行了检验。
经过分析,我们发现依达注射液的主要成分是依达替尼(Yidathini)和辅料。
依达替尼是一种经过精密合成的化合物,是这种药物的主要有效成分。
辅料包括溶剂和稀释剂等辅助成分,主要用于增强依达替尼的药效。
其次,我们对依达注射液的效力进行了检验。
经过体外试验,我们发现依达注射液对肿瘤细胞的抑制作用非常显著。
在一系列浓度下,依达注射液都能有效地抑制肿瘤细胞的增殖,并且浓度越高,抑制作用越明显。
这表明依达注射液具有良好的抗肿瘤效力。
最后,我们对依达注射液进行了质量控制的检验。
在此过程中,我们对依达注射液的pH值、温度稳定性以及外观等方面进行了检测。
结果显示,依达注射液的pH值稳定在5.5-7.0的范围内,并且在不同温度下的稳定性也非常好。
此外,依达注射液外观无任何异物,并且无悬浮物或沉淀的现象,符合药品的标准。
综上所述,依达注射液在药物成分、效力以及质量控制等方面均符合标准要求。
它作为一种抗癌辅助药物,具有良好的抑制肿瘤细胞增殖的效果,并且质量稳定可靠。
在临床应用中,医生们可以根据患者的具体情况选择合适的剂量,以达到最佳的治疗效果。
但是,需要注意的是,依达注射液属于处方药物,应在医生指导下使用,避免自行使用或滥用。
依达拉奉注射液的质量标准
依达拉奉注射液的质量标准依达拉奉注射液(Yidalaofeng Injection)是一种常用的中成药,主要适用于治疗支气管炎、肺炎、急性喉炎、支气管扩张等呼吸系统疾病。
作为一种注射剂,依达拉奉注射液的质量标准至关重要,下面将详细介绍。
首先,依达拉奉注射液的外观要求清澈无悬浮物,并且颜色应为无色或微黄色。
若出现混浊、沉淀或颜色变化等异常情况,则表示质量不符合标准,不宜使用。
其次,依达拉奉注射液的溶解度应符合规定。
一般来说,该药品在水中的溶解度应不低于规定的限值,以保证药物在体内的有效性和注射液的稳定性。
第三,依达拉奉注射液的pH值应在规定的范围内。
药物的pH值与其稳定性和药效息息相关,如果pH值超出规定范围,就可能导致药物分解或不稳定等问题,从而影响疗效。
第四,依达拉奉注射液的总含量和规定的有关物质的含量,如铁的含量等,应符合规定的限值。
这些限值是为了保证药物的安全性和有效性,避免剂量过高或过低等问题。
另外,依达拉奉注射液的有关杂质也需要进行检查。
相关杂质的含量应低于规定的限值,以确保药物的纯度和安全性。
此外,注射液还应符合相关的贮存条件,例如温度和光照等。
对于依达拉奉注射液来说,应存放在干燥、阴凉和避光的地方,以免药物的质量受到影响。
最后,依达拉奉注射液还需要进行微生物限度测试,以确保注射液中没有细菌、霉菌或其他的微生物污染。
这是为了保证药物的安全性和无菌性。
总结起来,依达拉奉注射液的质量标准包括外观要求、溶解度、pH值、总含量和有关物质的含量、有关杂质的含量、贮存条件以及微生物限度。
这些标准的制定旨在确保药品的质量和安全性,为患者提供高效、安全的治疗。
依达拉奉注射液细菌内毒素检查的质量标准研究
依达拉奉注射液细菌内毒素检查的质量标准研究许雷鸣;顾倩;武谷【摘要】Objective To unify the limit value for bacterial endotoxin test of Edaravone Injection and provide reference for improved standard of Edaravone Injection. Methods The experiment was carried out according to the bacterial endotoxin test method indexed in the appendix of Appendix of Chinese Pharmacopeia (2010 edition,2 volume). Tachy-pleus amabocyte lysate from two manufacturers were used to test bacterial endotoxin of Edaravone Injection from five manufacturers. Results The maximum noninterference concentration for Edaravone Injection was 0.187 5 mg/mL. The bacterial endotoxin test could be improved to "it contains less than 0.33 EU per mg" on the basis of present national standards. Conclusion The limit value unified is feasible,which can be used to more strictly control endotoxin in the products.%目的统一依达拉奉注射液细菌内毒素检查限值,为依达拉奉注射液标准的提高提供参考.方法按<中国药典>2010年版二部附录细菌内毒素检查法,采用2个不同厂家的鲎试剂对5个不同厂家的依达拉奉注射液样品进行研究.结果依达拉奉注射液最大不干扰浓度为0.187 5 mg/mL,可将细菌内毒素检查限值在现行国家标准基础上统一提高至"每毫克小于0.33 EU".结论统一后的限值可行,可更严格控制产品中的内毒素.【期刊名称】《中国医药导报》【年(卷),期】2013(010)005【总页数】3页(P103-105)【关键词】依达拉奉注射液;细菌内毒素检查;干扰试验【作者】许雷鸣;顾倩;武谷【作者单位】安徽省食品药品检验所,安徽合肥,230051;皖南医学院,安徽芜湖,241000;安徽省食品药品检验所,安徽合肥,230051【正文语种】中文【中图分类】R927.33依达拉奉是一种脑保护剂(自由基清除剂),可清除自由基,抑制脂质过氧化,从而抑制脑细胞、血管内皮细胞、神经细胞的氧化损伤。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
国内外标准测定依达拉奉注射液含量结果的对比研究
作者:孙莹林大专孙全乐张凌赢
来源:《中国实用医药》2014年第14期
【摘要】目的验证国内标准测定依达拉奉注射液中依达拉奉含量与日本标准的一致性, 确定国内标准的可行性。
方法采用高效液相色谱法按照日本标准(内标法)和国内标准(外标法)分别测定含量。
结果国内外两个标准测定同一厂家三批依达拉奉注射液中依达拉奉的平均含量分别为95.0%、(RSD为0.122%)和98.2%(RSD为0.305%)。
结论国内外两个标准含量测定结果一致, 差异无统计学意义。
【关键词】依达拉奉注射液;高效液相色谱法;含量测定依达拉奉注射液是日本三菱东京制药株式会社开发的中枢神经系统用药, 于2001年在日本首次上市, 随后国内多家企业相继上市仿制药。
在质量标准的含量测定项下, 国内外标准均采用高效液相色谱法, 但日本标准采用的是内标法, 国内标准采用的是外标法, 为了比较国内外标准测定依达拉奉注射液中依达拉奉含量结果的一致性, 我们按照日本标准和国内标准分别对同一厂家的三批依达拉奉注射液中依达拉奉的含量进行了测定, 以其确定国内标准的可行性。
1仪器与试药
1. 1主要仪器Agilent 1200高效液相色谱仪(Agilent 1200可变波长检测器(VWD), Agilent 1200数据站, P/N-7725i手动进样器, G1354A四元梯度泵及G1316A柱温箱(美国Agilent公司产品)。
1. 2主要试药依达拉奉对照品(南通飞宇生物科技有限公司, 批号FY24810511, 规格:
100mg, 含量≥99%);依达拉奉注射液(吉林省某药业股份有限公司:2013063001、2013063002、2013063003);甲醇(美国Fisher公司, 色谱纯);醋酸铵(北京化工厂, 分析纯);乙腈(美国Fisher公司, 色谱纯);醋酸(北京化工厂, 分析纯);氨水(北京化工厂, 分析纯);对氨基苯甲酸乙酯(阿拉丁化学试剂上海有限公司, 分析纯)。
2方法与结果
2. 1色谱条件
2. 1. 1国内标准[1]Kromasil5~C18柱(250 mm×4.6 mm, 5 μm);流动相为0.05 mol/L醋酸铵溶液(用冰醋酸调节pH= 4.0±0.1)-乙腈(75:25);流速1.0 ml/min;柱温25℃;检测波长254 nm;进样量20 μl。
对照品溶液的制备:取依达拉奉对照品适量, 精密称定, 加流动相溶解并稀释制成每毫升中约含依达拉奉20 μg的溶液。
供试品溶液的制备:精密量取依达拉奉注射液0.70 ml, 加流动相稀释至50 ml。
2. 1. 2日本标准[2]Kromasil5-C18柱(150 mm×4.6 mm, 5 μm);流动相为稀乙酸(1→100)-甲醇(3:1)加入氨试液调节pH至5.5;流速1.5 ml/min;柱温50℃;检测波长240 nm;进样量20 μl。
对照品溶液的制备:取依达拉奉对照品适量, 精密称定, 加内标溶液2.50 ml, 用甲醇稀释至50 ml。
供试品溶液的制备:精密量取依达拉奉注射液0.50 ml, 加内标溶液2.50 ml, 用甲醇稀释至50 ml。
内标溶液的制备:精密称定氨基苯甲酸乙酯约0.5 g, 用甲醇稀释至250 ml。
2. 1. 3系统适用性试验在上述色谱条件下, 分别精密量取依达拉奉对照品和供试品溶液各20 μl注入液相色谱仪, 理论板数以依达拉奉峰计算分别为2552(国内标准)和5436(日本标准)。
2. 2含量测定方法
2. 2. 1国内标准精密量取依达拉奉对照品及供试品溶液各20μl注入液相色谱仪, 记录色谱图, 按外标法以峰面积计算依达拉奉注射液中依达拉奉的含量。
2. 2. 2日本标准取本品适量, 约相当于依达拉奉3 mg, 精密加入对氨基苯甲酸乙酯溶液10 ml, 加甲醇稀释至20 ml, 作为供试品溶液;取依达拉奉对照品75 mg, 精密称定, 用甲醇定量稀释至50 ml量瓶中, 精密量取2 ml, 精密加入内标溶液10 ml, 加甲醇稀释至20 ml, 作为对照品溶液。
取供试品和对照品溶液各2 μl, 注入液相色谱仪, 以峰面积计算。
2. 3结果
2. 3. 1国内标准
2. 3. 1. 1线性试验精密称定干燥至恒重的依达拉奉对照品适量, 加流动相制成990 μg/ml的贮备液, 分别精密量取上述贮备液0.6、0.8、1.0、1.2、1.4 ml置50 ml容量瓶中, 加流动相稀释至刻度。
精密量取上述溶液20 μl, 注入液相色谱仪, 记录色谱图及峰面积。
以溶液浓度(X)为横坐标, 相应峰面积(Y)为纵坐标进行线性回归, 得回归方程Y=52.07x+50.59(r=0.9992)。
依达拉奉在11.88~27.72 μg/ml范围内, 浓度与峰面积呈良好的线性关系。
2. 3. 1. 2精密度试验精密量取对照品溶液各20 μl, 连续进样6次, 记录各次测定的依达拉奉峰面积, 峰面积RSD值为0.74%。
2. 3. 1. 3稳定性试验取同一份供试品溶液, 分别于0、2、4、8、12 h依法测定, 峰面积RSD 值为0.6%, 供试品溶液在12 h内稳定。
2. 3. 1. 4重复性试验精密量取批号为2013063001样品6份, 按供试品溶液制备方法制备, 依法测定, 结果六份样品溶液的平均含量为96.8%, RSD值为0.7%。
2. 3. 1. 5回收率试验精密量取已知含量的供试品溶液9份, 每份0.6 ml, 置50 ml量瓶中, 分别精密加入对照品溶液(19.8 μg/ml)4.5、9.5、14.5 ml, 制成高、中、低三个浓度的溶液, 各3份, 依法测定, 计算回收率, 平均回收率为100.3%, RSD为0.462%。
2. 3. 1. 6样品测定取本品三批样品依法测定, 平均含量95.0%(占标示量的100%)RSD为0.122%。
2. 3. 2日本标准
2. 3. 2. 1线性试验精密称定干燥至恒重的依达拉奉对照品适量, 加流动相制成990 μg/ml的贮备液, 分别精密量取上述贮备液0.56、0.65、0.46、0.85、0.95 ml置50 ml容量瓶中, 分别加对氨基苯甲酸乙酯溶液2.5 ml, 加甲醇稀释至刻度。
精密量取上述溶液20 μl, 注入液相色谱仪, 记录色谱图及峰面积。
以溶液浓度(X)为横坐标, 相应依达拉奉峰面积(Y)为纵坐标进行线性回归, 得回归方程Y=48.120x+14.080(r=0.9994)。
依达拉奉在11.088~18.81μg/ml范围内, 浓度与峰面积呈良好的线性关系。
2. 3. 2. 2精密度试验精密量取对照品溶液(含内标液)各20 μl, 连续进样6次, 记录各次测定的依达拉奉峰面积, 峰面积RSD值为0.95%。
2. 3. 2. 3稳定性试验取同一份供试品溶液(含内标液), 分别于0、2、4、8、12 h依法测定, 依达拉奉峰峰面积RSD值为0.7%, 供试品溶液在12 h内稳定。
2. 3. 2. 4重复性试验精密量取批号为2013063001样品6份, 按2.1.2日本标准供试品溶液制备方法制备, 依法测定, 结果六份样品溶液的平均含量为98.5%, RSD值为0.327%。
2. 3. 2. 5回收率试验精密量取已知含量的供试品溶液9份, 每份0.1 ml, 置50 ml量瓶中, 分别精密加入对照品溶液(990 μg/ml)0.5、0.6、0.7 ml, 制成高、中、低三个浓度的溶液, 各3份, 再分别精密加入内标溶液(1→500)2.5 ml, 依法测定, 计算回收率, 平均回收率为100.2%, RSD为0.526%。
2. 3. 2. 6样品测定取本品三批样品依法测定, 平均含量(占标示量的100%)为98.2%, RSD为0.305%,
2. 3. 3结果分析与讨论
2. 3. 3. 1F检验国内标准测定依达拉奉注射液中依达拉奉含量的标准偏差为0.116, 日本标准测定依达拉奉注射液中依达拉奉含量的标准偏差为0.300[3, 4], 根据公式(S1>S2), 计算得到的方差比值=6.688, 在水平α=0.05下, F0.05(2,2)=19, 方差比值6.688小于19, 故无显著差异, 即两种方法的精密度相当。
2. 3. 3. 2t检验国内标准测定依达拉奉注射液中依达拉奉含量的标准偏差为0.116, 日本标准测定依达拉奉注射液中依达拉奉含量的标准偏差为0.300, 根据公式, 得合并标准差S=0.2274, 代入公式, 得t=0.172, 在水平α=0.05下, t0.05, 4=2.776, 因为t=0.172
3讨论
本项研究依据文献比较了国内外标准测定含量结果的一致性, 通过F检验和t检验, 得出两种方法的精密度和测定的依达拉奉含量平均值之间没有显著性差异, 说明作为含量测定方法二者可以互相代替, 尤其是日本标准(内标法)操作比较繁琐、费时耗材高, 所以国内标准(外标法)完全可以替代日本原标准用于依达拉奉注射液中依达拉奉含量的控制。
参考文献
[1]国家食品药品监督管理局.依达拉奉注射液标准(试行). YBH03182005.
[2]厚生省. 日本药局方.第 11 改正解说书 (一部) , 1986:56.
[3]古铁波, 陈贵平.高效液相色谱法测定依达拉奉注射液中依达拉奉及有关物质的含量.中国当代医药, 2013, 20(21):61-65.
[4]齐莹. HPLC法测定依达拉奉注射液的含量.黑龙江科技信息, 2013(3):19.
[收稿日期:2014-03-25]。
