工程化学练习题答案12
化工生产技术练习题库(附参考答案)

化工生产技术练习题库(附参考答案)一、单选题(共50题,每题1分,共50分)1、三角形相图内任一点,代表混合物的( )个组分含量。
A、一B、三C、二D、四正确答案:B2、脱硫工艺中钙硫比(Ca/S) 是指注入吸收剂量与吸收二氧化硫量的( ))。
A、体积比B、质量比C、摩尔比D、浓度比正确答案:C3、缓冲容量的大小与组分比有关,总浓度一定时,缓冲组分的浓度比接近( )时,缓冲容量最大。
A、1 :1B、2 :1C、3 :1D、1 :2正确答案:A4、层流与湍流的本质区别是( )。
A、层流的雷诺数<湍流的雷诺数B、流道截面大的为湍流,截面小的为层流C、层流无径向脉动,而湍流有径向脉动。
D、湍流流速>层流流速正确答案:C5、气体的导热系数数值随温度的变化趋势为( )。
A、T 变化,λ 不变B、T 升高,λ 增大C、T 升高,λ 减小D、T 升高,λ 可能增大或减小正确答案:B6、结晶进行的先决条件是( )。
A、不饱和溶液B、过饱和溶液C、饱和溶液D、都可以正确答案:B7、有一段由大管和小管串联的管路,管内液体作连续稳定的流动.大管内径为D,而小管内径为 D /2 大管内流速为u,则小管内液体的流速为( )。
A、2uB、4uC、u正确答案:B8、蒸馏塔板的作用是( )。
A、停留液体B、热量传递C、热量和质量传递D、质量传递正确答案:C9、下列物质中不是化工污染物质的是( )。
A、硫铁矿渣B、酸、碱类污染物C、沙尘D、二氧化硫正确答案:C10、应用流体静力学方程式可以( )。
A、测定流量、测定液面B、测定流速、确定液封高度C、测定压强、测定液面正确答案:C11、浓硝酸系强氧化剂,严禁与( )接触。
A、陶B、硅铁C、铝制品D、木材、纸等有机物正确答案:D12、在总压不变的条件下,将湿空气与不断降温的冷壁相接触,直至空气在光滑的冷壁面上析出水雾,此时的冷壁温度称为( )。
A、露点B、绝对饱和温度C、湿球温度D、干球温度正确答案:A13、要准确量取一定量的液体,最适当的仪器是( )。
化学反应工程练习题
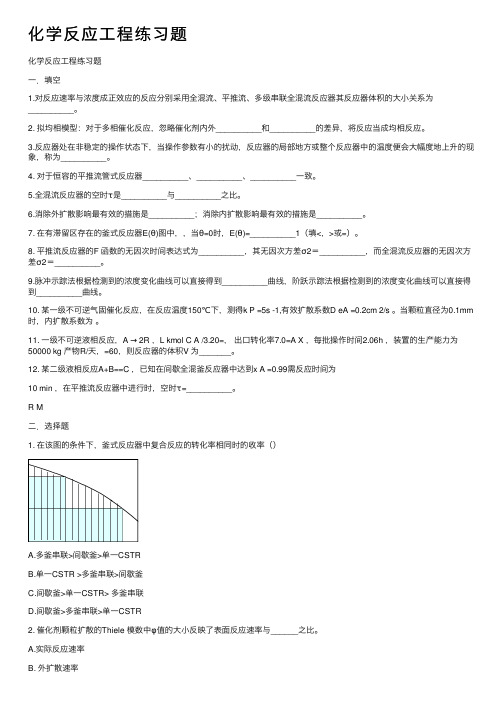
化学反应⼯程练习题化学反应⼯程练习题⼀.填空1.对反应速率与浓度成正效应的反应分别采⽤全混流、平推流、多级串联全混流反应器其反应器体积的⼤⼩关系为__________。
2. 拟均相模型:对于多相催化反应,忽略催化剂内外__________和__________的差异,将反应当成均相反应。
3.反应器处在⾮稳定的操作状态下,当操作参数有⼩的扰动,反应器的局部地⽅或整个反应器中的温度便会⼤幅度地上升的现象,称为__________。
4. 对于恒容的平推流管式反应器__________、__________、__________⼀致。
5.全混流反应器的空时τ是__________与__________之⽐。
6.消除外扩散影响最有效的措施是__________;消除内扩散影响最有效的措施是__________。
7. 在有滞留区存在的釜式反应器E(θ)图中,,当θ=0时,E(θ)=__________1(填<,>或=)。
8. 平推流反应器的F 函数的⽆因次时间表达式为__________,其⽆因次⽅差σ2=__________,⽽全混流反应器的⽆因次⽅差σ2=__________。
9.脉冲⽰踪法根据检测到的浓度变化曲线可以直接得到__________曲线,阶跃⽰踪法根据检测到的浓度变化曲线可以直接得到__________曲线。
10. 某⼀级不可逆⽓固催化反应,在反应温度150℃下,测得k P =5s -1,有效扩散系数D eA =0.2cm 2/s 。
当颗粒直径为0.1mm 时,内扩散系数为。
11. ⼀级不可逆液相反应,A → 2R ,L kmol C A /3.20=,出⼝转化率7.0=A X ,每批操作时间2.06h ,装置的⽣产能⼒为50000 kg 产物R/天,=60,则反应器的体积V 为_______。
12. 某⼆级液相反应A+B==C ,已知在间歇全混釜反应器中达到x A =0.99需反应时间为10 min ,在平推流反应器中进⾏时,空时τ=__________。
工程化学练习题答案1-(2)

工程化学练习题(一)一、判断题:1.系统的状态发生改变时,至少有一个状态函数发生了变化。
------------------- ()2.弹式量热计所测得的热效应,应是恒压热效应Q P。
-------------------------- ()3.金刚石和臭氧都是单质,因此它们△f H m○–值为零。
--------------------------- -( )4.指定单质在标准态时△f H m○–、△f G为零,但S m○–不为零。
---------------------()m5.有一理想晶体,微观粒子排列完整且有严格的顺序。
这种情况下,微观状态数只有一种,其熵值应该为零。
---------------------------------------------------------- ()6.△r S m○–为负值的反应均不能自发进行.------------------------------------ ( ) 7.如果反应的△r G m○–>0,则该反应在热力学上是不可能发生的。
----------------- -( ) 8.接近绝对零度时,所有的放热反应都将成为自发反应。
---------------------- ()9.盐的结晶过程使溶液的混乱度降低,所以结晶总是熵减的过程,是非自发的。
----()10.一般情况下,不管是放热反应还是吸热反应,温度升高,反应速率总是增加的。
---()11.温度升高,分子间的碰撞频率也增加,这是温度对反应速率影响的主要原因。
---()12.反应速率常数取决于反应温度,与反应物浓度无关。
-------------------------- -( ) 13.反应活化能越大,反应速率也越大。
-------------------------------------- ( ) 14. 正催化剂使正反应速率增加,逆反应速率减小。
------------------------------ ()15.平衡常数很大或很小的反应都是可逆程度很小的反应。
工程化学补充习题与思考题终稿

Ch1 绪论习题§1.4 一些基本概念P13~14练习题4,5,8,9Ch2 物质的化学组成与聚集状态习题§2.1物质的化学组成P32 练习题12. 写出下列配合物的化学式:(1) 三氯·一氨合铂(Ⅱ)酸钾(2) 高氯酸六氨合钴(Ⅱ)(3) 二氯化六氨合镍(Ⅱ) (4) 五氰·一羰基合铁(Ⅱ)酸钠(5) 一羟基·一草酸根·一水·一乙二胺合铬(Ⅲ)3. 以下配合物中心离子的配位数均为6,将浓度相等的下述溶液按溶液导电能力递增的顺序排列,并把配离子写在方括号内。
(1)Pt(NH3)6C14(2)Cr(NH3)4Cl3 (3)Co(NH3)6Cl3 (4)K2PtCl64.有下列三种铂的配合物,用实验方法确定它们的结构,其结果根据上述结果,写出上列三种配合物的化学式。
§2.2 固体P43 练习题2,3,4,5。
5. 下列物质中,试推测何者熔点最低?何者最高?(1) NaCl KBr KCl MgO (2) N2Si NH36. 今试推测下列物质分别属于哪一类晶体?物质 B LiCl BCl3熔点/℃2300 605 -107.37. (1)试推测下列物质可形成何种类型的晶体?O2H2S KCI Si Pt(2)下列物质熔化时,要克服何种作用力?AlN Al HF(s) K2S§2.3液体和液晶1. 将1 kg乙二醇与2 kg水相混合,可制得汽车用的防冻剂,试计算:(1) 25℃时,该防冻剂的蒸气压;(2) 该防冻剂的沸点;(3) 该防冻剂的凝固点。
已知乙二醇的相对分子质量为62;25℃时水的饱和蒸气压为3.18 kPa。
2. 人的体温是37℃,血液的渗透压是780.2kPa,设血液内的溶质全是非电解质,试估计血液的总浓度。
3.医学上输液时,要求注射液和人体血液的渗透压相等(即等渗溶液),现在欲配葡萄糖氯化钠水溶液的等渗注射液,若注射液1 mL 含食盐 5.85g,问需要再加入多少克葡萄糖才能配成这种等渗溶液?已知37℃,人体血液的渗透压是780kPa。
工程化学基础课后习题答案

第四章 第二节练习题
6. (1) <0 (2) >0 (3) <0 (4) <0 7. △rGm =△rGm θ=91.38 kJ/mol
T=980.58K
8. T=2128.9K
节练习题
1. (1) (2)
2. 降温 恒P 3. 吸热
4. C(CO2)=0.033mol/L 5. Ea=257.15kJ/mol
(2) SiO2 >BaO >CO2
第二章 第三节练习题
1. (1) 方向 饱和 降低 氢 氧 (2) 单位质量溶剂 (4) 8 润湿 14-18 o/w乳化剂 (5) 热致 溶致
2. (1) 降低 [H+]增加 (2) 升高 [H+]增加 (3) 下降 △T= Kf bB (4) 依次降低 (5) 一次升高
c(CO)=0.067mol/L
第四章 第四节练习题
1. (1) × (2) √ (3) × (4) √ 2. (1) c (2) a 3. Fe3+>Cu2+ >Fe2+ 4. Cl2>KMnO4>K2Cr2O7 5. (1) K θ=3.05 (2) c=0.075 6. (-) Pt / Fe3+, Fe2+ ∥ Ag+/ Ag (+)
7. m(CaO)=532kg m(CO2)=418kg
8. ξ(N2)= ξ(H2)= ξ(NH3)=4mol
ξ(N2)=2mol
9. N(H2)=1mol n(H2O)=1mol
第二章 第一节练习题
1. (1) 三氯·一氨合铂(Ⅱ)酸钾 (2) 四羟合锌(Ⅱ)酸钠 (3) 硫酸三乙二胺合镍(Ⅱ) (4) 氯化一氯·五氨合钴(Ⅲ) (5) 乙二胺四乙酸合钙(Ⅱ)酸钠 (6) 四羟合镍 (7) [Ag(NH3)2]Cl (8) K4[Fe(CN)6]
化学反应工程练习题解答

第一章习题1 有一反应在间歇反应器中进行,经过8min 后,反应物转化掉80%,经过18min 后,转化掉90%,求表达此反应的动力学方程式。
解2A A min 18A0min 8A0AA A0d d 219.019.0181)(218.018.081)(11kc tc kc kc x x c kt =-=-⋅==-⋅=-⋅=为假设正确,动力学方程2 在间歇搅拌槽式反应器中,用醋酸与丁醇生产醋酸丁酯,反应式为:()()()()S R B A O H H COOC CH OH H C COOH CH 2943SO H 94342+−−→−+反应物配比为:A(mol):B(mol)=1:4.97,反应在100℃下进行。
A转化率达50%需要时间为24.6min,辅助生产时间为30min,每天生产2400kg醋酸丁酯(忽略分离损失),计算反应器体积。
混合物密度为750kg·m-3,反应器装填系数为0.75。
解3313111111i 1.2m 0.750.8949总体积反应0.8949m 0.910.9834有效体积反应0.91hr6054.6折合54.6min 3024.6总生产时间hr 0.9834m 750737.5换算成体积流量hr 737.5kg 634.1103.4总投料量hr 634.1kg 744.97724.1B 4.97:1B :A hr 103.4kg 601.724折算成质hr 1.724kmol 0.50.862的投料量A ,则50%转化率hr 0.862kmol 116100hr 100kg 2400/24R 116 74 60 M S R B A ==⨯==+=⋅=+⋅=⨯⨯=⋅=⨯⋅=⋅=⋅=+→+-------器器投料量则量流量产量3 反应(CH 3CO)2O+H 2O →2CH 3COOH 在间歇反应器中15℃下进行。
已知一次加入反应物料50kg ,其中(CH 3CO)2O 的浓度为216mol ·m -3,物料密度为1050kg ·m -3。
工程化学第二章
第二章物质的化学组成和聚集状态一、基本概念1、配位化合物地基本概念(定义、命名);2、团簇(分子簇、离子簇、原子簇)3、整比化合物与非整比化合物;4、高分子化合物(结构和命名)5、晶体的基本类型(离子晶体、分子晶体、原子晶体、金属晶体、混合型晶体、过渡性晶体)6、非晶体(玻璃态、高弹态、粘流态、玻璃化温度、粘流化温度、分解温度)7、溶液的蒸气压、凝固点、沸点和渗透压(变化规律、计算)8、常见的表面活性物质的分类、结构(肥皂、洗衣粉)9、大气的相对湿度10、酸雨、温室效应、臭氧层空洞二、教材习题1、教材17页(配位化合物的命名举例)2、教材22页表2—1 (聚乙烯、聚丙烯、聚四氟乙烯、聚氯乙烯、聚环氧乙烷、聚丙烯晴)分子式;单体;重复单元;聚合度。
4、教材32页练习题1、2、3、4、5、6题。
5、教材43页练习题2、5、6题;44页思考题2、3题。
6、教材53页表2.116、教材62页例2.2;教材67页练习题4、5题。
补充习题一、判断对错并改正(正确的在括号内“∨”错误的“×”,并改正)1、分子晶体的晶格结点上交替排列着原子、离子、粒子间靠共价键结合。
()2、液态物质的分子间力越小,气化热越大,沸点就越高。
()3、一个原子的电负性越大,原子在分子中吸引电子的能力愈强。
()4、分子间力与化学键不同,是非直接相连的原子间,基团间和分子间相互作用力的总称。
在小分子中的分子间力则比较简单,可分为取向力、诱导力和色散力三种。
()5、配位化合物K[Pt(NH3)Cl3]中只有配位键()6、化学反应的反应进度是用来描述和表征化学反应进行程度的物理量。
()7、系统和环境的划分和确定是绝对的,而不是相对的。
()8、化学反应的反应进度是用来描述和表征化学反应进行程度的物理量。
()9、系统和环境的划分和确定是绝对的,而不是相对的。
()10、在一定条件下,晶体和非晶体可以互相转化。
()11、在离子晶体中,一个阳离子总是属于一个确定的阴离子。
化学反应工程练习题解答
第一章习题1有一反应在间歇反应器中进行,经过8min 后,反应物转化掉80%,经过18min 后,转化掉90%,求表达此反应的动力学方程式。
解2A A min 18A0min 8A0AA A0d d 219.019.0181)(218.018.081)(11kc tc kc kc x x c kt =-=-⋅==-⋅=-⋅=为假设正确,动力学方程 2在间歇搅拌槽式反应器中,用醋酸与丁醇生产醋酸丁酯,反应式为:()()()()S R B A O H H COOC CH OH H C COOH CH 2943SO H 94342+−−→−+反应物配比为:A(mol):B(mol)=1:4.97,反应在100℃下进行。
A 转化率达50%需要时间为24.6min ,辅助生产时间为30min ,每天生产2400kg 醋酸丁酯(忽略分离损失),计算反应器体积。
混合物密度为750kg·m -3,反应器装填系数为0.75。
解3313111111i 1.2m 0.750.8949总体积反应0.8949m 0.910.9834有效体积反应0.91hr6054.6折合54.6min 3024.6总生产时间hr 0.9834m 750737.5换算成体积流量hr 737.5kg 634.1103.4总投料量hr 634.1kg 744.97724.1B 4.97:1B :A hr 103.4kg 601.724折算成质hr 1.724kmol 0.50.862的投料量A ,则50%转化率hr 0.862kmol 116100hr 100kg 2400/24R 116 74 60 M S R B A ==⨯==+=⋅=+⋅=⨯⨯=⋅=⨯⋅=⋅=⋅=+→+-------器器投料量则量流量产量3反应(CH 3CO)2O+H 2O →2CH 3COOH 在间歇反应器中15℃下进行。
已知一次加入反应物料50kg ,其中(CH 3CO)2O 的浓度为216mol·m -3,物料密度为1050kg·m -3。
工程化学基础练习题答案
-OH、-CHO、-COOH、-NH2、-SO3H等,亲水基团是指与水有较大亲和力的原子团《工程化学基础》练习题答案绪论1.两相(不计空气);食盐溶解,冰熔化,为一相;出现AgCl ,二相;液相分层,共三相。
2.两种聚集状态,五个相: Fe(s),FeO(s),Fe2O3(s),Fe3O4(s),H2O(g)和H2(g)(同属一个相)。
3. 1.0 mol。
4. m(CaO) =532.38kg,m(CO2) =417.72kg。
5. 4 mol。
6.消耗掉1 molH2,生成1 molH2O。
第一章第一节1.见教材8页。
2.化学式见教材10页;均属于碳链高分子化合物。
3. 尼龙66:化学式见教材9页,属杂链高分子化合物。
聚二甲基硅氧烷:化学式见教材10页,属元素有机高分子化合物。
AAS :化学式参考教材10页ABS,属碳链高分子化合物。
4.(C H2-C H)n--中的链节、重复单元都是CH2-CH,聚合度是n。
有两个链节:,两个链节组成一个重复单元, 聚酰胺的聚合度是2n。
5. 配合物化学式名称中心体配位体配位原子配位数K[Pt(NH3)Cl3] 三氯一氨合铂(Ⅱ)酸钾Pt(Ⅱ) NH3,Cl-N,Cl 4Na2[Zn(OH)4] 四羟合锌(Ⅱ)酸钠Zn(Ⅱ) —OH O 4[Ni(en)3]SO4 硫酸三乙二胺合镍(Ⅱ) Ni(Ⅱ) en N 6[Co(NH3)5Cl]Cl2二氯化一氯五氨合钴(Ⅲ) Co(Ⅲ) NH3,Cl-N,Cl 6Na[CaY] 乙二胺四乙酸合钙(Ⅱ)酸钠Ca(Ⅱ) Y4-O,N 66. 见教材13~17页。
第二节1. MgO>CaO>CaF2>CaCl2 ,理由略。
12.提示:钠卤化物是离子晶体,而所列硅卤化物均为分子晶体。
3. SiC>SiBr4>SiF4,理由略。
4. (1)熔点由高到低为:BaCl2>FeCl2>AlCl3>CCl4因为BaCl2为典型的离子晶体,熔点较高;FeCl2和AlCl3同为过渡型晶体,FeCl2与FeCl3比较,FeCl2为低价态,而Al3+与Fe3+比极化力更大,能使AlCl3比FeCl3更偏向于分子晶体,即熔点更低;CCl4则为典型的分子晶体,熔点更低。
化工单元操作练习题库+答案
化工单元操作练习题库+答案一、单选题(共90题,每题1分,共90分)1、容易随着人的呼吸而被吸入呼吸系统,危害人体健康的气溶胶是()。
A、有毒气体B、烟C、有毒蒸汽D、不能确定正确答案:B2、化工生产中常用的“三酸二碱”是指( )A、硫酸、盐酸、硝酸和氢氧化钠、氢氧化钾B、硫酸、盐酸、磷酸和氢氧化钠、氢氧化钾C、硫酸、盐酸、硝酸和氢氧化钠、碳酸钠D、硫酸、盐酸、磷酸和氢氧化钾、碳酸钾正确答案:C3、化工生产过程的核心是( )。
A、分离B、化学反应C、混合D、粉碎正确答案:B4、符合化工管路的布置原则的是( )A、平行管路垂直排列时,冷的在上,热的在下B、各种管线成列平行,尽量走直线C、一般采用暗线安装D、并列管路上的管件和阀门应集中安装正确答案:B5、扑灭精密仪器等火灾时,一般用的灭火器为()。
A、二氧化碳灭火器B、卤代烷灭火器C、干粉灭火器D、泡沫灭火器正确答案:A6、主要化工污染物质有()。
A、大气污染物质B、以上两类物质C、水污染物质D、不能确定正确答案:C7、作为化工生产操作人员应该( )A、严格按照“操作规程”操作B、随机应变操作C、按照自己的理解操作D、按照师傅教的操作正确答案:A8、有关精馏操作的叙述错误的是( )。
A、精馏装置的主要设备有:精馏塔、再沸器、冷凝器、回流罐和输送设备等B、精馏的实质是多级蒸馏C、精馏塔以进料板为界,上部为精馏段,下部为提馏段D、精馏是利用各组分密度不同,分离互溶液体混合物的单元操作正确答案:D9、离心泵发生气蚀可能是由于( )。
A、离心泵未排净泵内气体B、所输送的液体中可能含有砂粒。
C、离心泵实际安装高度超过最大允许安装高度。
D、离心泵发生泄漏正确答案:C10、属于天然纤维的是下列哪种物质( )。
A、碳纤维B、胶黏纤维C、尼龙D、石棉正确答案:D11、精馏塔开车时,塔顶馏出物应该是()。
A、全回流B、部分回流部分出料C、应该低于最小回流比回流D、全部出料正确答案:A12、溶液能否用一般精馏方法分离,主要取决于()。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
工程化学练习题(一)一、判断题:1.系统的状态发生改变时,至少有一个状态函数发生了变化。
------------------- ()2.弹式量热计所测得的热效应,应是恒压热效应Q P。
-------------------------- ()3.金刚石和臭氧都是单质,因此它们△f H m○–值为零。
--------------------------- -( )4.指定单质在标准态时△f H m○–、△f G为零,但S m○–不为零。
---------------------()m5.有一理想晶体,微观粒子排列完整且有严格的顺序。
这种情况下,微观状态数只有一种,其熵值应该为零。
---------------------------------------------------------- ()6.△r S m○–为负值的反应均不能自发进行.------------------------------------ ( )7.如果反应的△r G m○–>0,则该反应在热力学上是不可能发生的。
----------------- -( ) 8.接近绝对零度时,所有的放热反应都将成为自发反应。
---------------------- ()9.盐的结晶过程使溶液的混乱度降低,所以结晶总是熵减的过程,是非自发的。
----()10.一般情况下,不管是放热反应还是吸热反应,温度升高,反应速率总是增加的。
---()11.温度升高,分子间的碰撞频率也增加,这是温度对反应速率影响的主要原因。
---()12.反应速率常数取决于反应温度,与反应物浓度无关。
-------------------------- -( ) 13.反应活化能越大,反应速率也越大。
-------------------------------------- ( )14. 正催化剂使正反应速率增加,逆反应速率减小。
------------------------------ ()15.平衡常数很大或很小的反应都是可逆程度很小的反应。
---------------------- ()16.达到平衡后的系统,只有外界变化改变平衡常数时,平衡才发生移动。
-----------()17.恒温恒容条件下,2SO2(g)+O2(g)2SO3(g)平衡体系中加入N2致使总压力增大,平衡向右移动。
-------------------------------------------------------------- -( ) 18.△r G m○–值越小,则说明反应的趋势越大,所以反应速率越大。
------------------ -( )19.催化剂只能改变反应的活化能,不能改变反应的热效应。
------------------ -- -( ) 20.某一反应平衡后,加入一些产物,在相同温度下再次达到平衡,则两次测得的平衡常数相等。
------------------------------------------------------------------- ()二、选择题:1.在下列物理量中,不是状态函数的是------------------------------------- ( c )A.U B.G C.Q D.S2.若某一封闭体系经过一系列变化,最后又回到初始状态,则体系的------------- ( C ) A.Q=0 W=0 △U=0 △H=0 B.Q≠0 W=0 △U=0 △H=QC.Q=-W △U=Q+W △H=0 D.Q≠-W △U=Q+W △H=03.估算下列反应中△r S m○–>0的是------------------------------------------- ( c ) A.CO(g)+Cl2(g)=COCl2(g) B.2SO2(g)+O2(g)=2SO3(g)C.NH4HS(s)=NH3(g)+H2S(g)D.2HBr(g)=H2(g)+Br2(l)4.盖斯定律认为化学反应热效应与过程无关,这种说法之所以正确是因为----------( D )A.反应在放热且恒温下进行B反应在吸热且恒温下进行C.反应在恒压(或恒容)无非体积功的条件下进行D.反应热是一个状态函数5.根据热力学规定,下列哪些物质的标准生成焓为零------------------------- ( A )A.C(石墨) B.Br2(g) C.红磷 D.CO2(g)6.298K 下,对指定单质的下列叙述中,正确的是----------------------------------------------( c )A. △f H m ○–≠0, △f G θm =0, S m ○–=0B. △f H m ○–≠0, △f G θm≠0, S m ○–≠0 C. △f H m ○–=0, △f G θm =0, S m ○–≠0 D. △f H m ○–=0, △f G θm =0, S m ○–=0 7.下列物质在OK 时的标准熵为0的是------------------------------------- -( c )A.理想溶液B.理想气体C.完美晶体D.纯液体8.某一反应△r H m ○–>0,△r S m ○– >0,假设△r H m ○–与△r S m ○–不随温度变化,则下列说------( A )A.高温自发,低温不自发 B 低温自发,高温不自发C 任何温度均不自发D 任何温度均自发9.化学反应中,其数值随温度变化而有较大变化的是 ------------------------ ( B )A. △r H m ○–B. △r G m ○–C.△r S mD.△r U m10.将固体溶于水中,溶液变冷,则该过程的△G , △H , △S 的符号依次为---------( D )A. + - - B + + - C - + - D - + +11. 反应CO(g)+H 2O(g)CO 2(g)+H 2(g),为提高CO(g)的转化率,可采取的措施是-( B )A.增加CO 的浓度B.增加H 2O(g)的浓度C.按1:1增加CO 和H 2O(g)的浓度D.以上三种方法均可12.在一定温度下某化学反应下列说法正确的是 ------------------------------- -( C )A.E a 越大,v 越大B.K ○–越大,v 越大C.反应物浓度越大,v 越大D. △r H ○–负值越大,v 越大13.不能引起反应速率常数变化的下列情形是---------------------------------- ( C )A.改变反应体系的温度B.改变反应体系所使用的催化剂C.改变反应物的浓度D.改变反应的途径14.在下列因素中,不影响化学反应速率大小的是---------------------------------------------( C )A.速率常数B.反应物浓度C.平衡常数D.活化能15.化学反应A+2B →C+E 的反应级数-----------------------------------------------------------( C )A.可根据方程式确定B.可按质量作用定律确定C.由实验确定 C.一定是316.一般说,温度升高,反应速率明显增加,主要原因是-----------------------------------( C )A.分子碰撞几率增加B.反应物压力增加C.活化分子百分数增加D.活化能降低17.一个反应达到平衡的标志是---------------------------------------------- ( C )A.各反应物和产物的浓度等于常数.B.各反应物和产物浓度相等.C.各物质浓度不随时间而改变.D. △r H m ○–=018.反应N 2O 4(g)2NO 2(g)的平衡常数为K 1○–,相同温度下,反应NO 2(g) 21N 2O 4的平衡常数K 2○–为 ------------------------------------------------------------------------------------( D )A.K 1○–B.1/K 1○– C.θ1K D.θ11K 19.一定温度下的反应2A(g)+B(g)2C(g), △r H m ○–<0,平衡时K ○–将---------- ( B )A.随温度升高而增大B.随温度升高而减小C.随产物的平衡浓度增大而增大D.随加压而减小20.在下列叙述中,不正确的是----------------------------------------------- ( D )A.标准平衡常数仅是温度的函数B.催化剂不能改变平衡常数的大小C.平衡常数改变,平衡必定移动D.平衡移动,平衡常数必定发生变化21.在一定温度下N2O4 (g)2NO2 (g)达到平衡,如N2O4的分解率为25%,此时混合气体总压力为分解前的------------------------------------------------------- ( B )A.0.25倍 B.1.25倍 C.0.50倍 D.1.50倍.22.反应X(g)+Y(g)Z(g),△r H m○–<0,为了提高产率,应采取的反应条件是----( D )A.高温高压 B.高温低压 C.低温低压 D.低温高压三、填空题:1.状态函数的性质之一是:状态函数的变化值与体系的始态和终态有关;与状态变化的途径无关。
在U、H、S、G、T、p、V、Q、W中,属于状态函数的是U、H、S、G、T、p、V。
2.按系统与环境间发生交换情况的不同,可将系统分为开放系统、封闭系统和孤立系统等三类。
2.下列变化过程中熵变值是(正或负):H2SO4溶于水:正,乙烯生成聚乙烯负,固体表面吸附气体: 负,干冰的升华: 正,海水淡化的反渗透技术:负,在冰中放入食盐,使冰熔化正。
3.反应A(g)+2B(g)→C(g)的速率方程为v=kc(A)c2(B)。
该反应为基元反应,反应级数为3 。
当B的浓度增加2倍时,反应速率将增加 4 倍;当反应容器的体积增大到原体积的3倍时,反应速率为原来的1/27 。
四、简答题:1.可用来描述化学反应方向的是哪一个状态函数?它怎么来表示化学反应的方向?答:可用来描述化学反应方向的是吉布斯自由能(G)。
△r G﹤0反应自发进行△r G =0反应达到平衡△r G﹥0反应不能自发进行,逆反应可以自发进行。
2.吕·查德里原理是化学平衡移动规律的总结,吕·查德里原理的内容是什么?举例说明。
