过渡元素通性
过渡元素成键特征讲解

(1)直线型端基配位
NO比CO多一个电子,在一些配位反应中,可将NO看作3电
子给予体, 即先将NO上的一个电子给予金属原子M, 使金属原 子氧化态降低1, NO变成NO+。 NO+和CO是等电子体,成键方
式与CO相同,NO+作为2e给予体与金属原子相结合(形成N-M
配位键),与此同时金属d轨道上的电子反馈到NO+ π*反键轨道 上,形成d π-π*(NO)反馈键。
N2的分子轨道
接受Ru2+的反馈d电子
(σ1s)2 (σ1s*)2 (σ2s)2 (σ2s*)2 (π2p)4 (σ2p )2 (π2p*)0 (σ2p*)0
x
给与Ru2+电子 形成双氮配合物时,N2分子最高占有轨道上的电子给予 金属空的d轨道 (M←N2), 形成σ配键; 同时金属M充满 电子的d轨道则向N2空的π轨道反馈电子 (M→N2), 形成
8.2 过渡元素的成键特征
8.2.1 羰基配合物:通常金属价态较低
1. 金属与羰基成键特征:以Ni(CO)4为例
Ni(0) 3d84s2 ↑↓ ↑↓ ↑↓ ↑ ↑ 3d Ni(CO)4 ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
—— —— ——
4s
4p
——
—— —— ——
×× ×× ×× ×× 四面体 sp3杂化
NO究竟是以直线型端基、弯曲型端基配位
还是以桥基配位可以通过红外光谱进行鉴别
3. 亚硝酸根配合物
金属与NO2-能以五种不同的方式配位 :
4. 硝酸根配合物
金属离子与 NO3-的配位方式有如下几种:
四硝酸钛Ti(NO3)4中有4个双齿硝酸根,是8配位钛化
合物(十二面体结构)。其中所有8个Ti—O键都是等同的。
过渡元素性质及其应用 金属配位

3. 水溶性: 重铬酸盐 > 铬酸盐 Ba2+ + Cr2O72- 或 CrO42- → BaCrO4↓ (黄色) Pb2+ + Cr2O72- 或 CrO42- → PbCrO4↓ (黄色) Ag+ + Cr2O72- 或 CrO42- → Ag2CrO4↓(砖红色)
4.重铬酸盐的强氧化性:
φ(Cr2O72-/Cr3+) = 1.33V φ(Cl2/Cl-) = 1.36V 例如: K2Cr2O7 + 14 HCl(浓) = 2 CrCl3+ 3 Cl2+ 2 KCl + 7 H2O
-
H
4
或加热
Cr(OH)3 呈两性
2. 碱介质中,Cr(OH)4- 可被氧化后CrO42例:2Cr(OH)4-+ 3Na2O2 = 2CrO42-+ 4OH- + 6Na+ + 2H2O
3.Cr3+ 形成配合物倾向:
Cr3+ 3d 3 CrL6 八面体 例:Cr(NH3)6 3+ 黄色, [Cr(SCN)6]3对比: Al 3+ + NH3 H 2O → Al(OH)3↓
Hg(NO3)2 + Na2CO3 HgO + CO2 + 2NaNO3
(10)金属有金属光泽或呈银白色,但金属粉末 都是黑色
5、过渡金属及其化合物的磁性
按照物质在外加磁场作用下的响应情况,可将 物质划分为:
抗或逆磁性物质
物质
顺磁性物质
铁磁性物质
物质的磁性与“成单电子数”有关。磁矩大小可 通过如下公式计算:
洗液:K2Cr2O7 + 浓H2SO4,利用了Cr(Ⅵ)强的氧 化性及H2SO4的强酸性。由于Cr(VI)污染环境,是致 癌性物质,因此停止使用。
第十三章 过渡金属一、二

4、Cr(Ⅲ)化合物 Cr2O3实验室制法: (NH4)2Cr2O7=Cr2O3+N2+4H2O Cr2O3的两性氧化物: Cr2O3+6H+→2Cr3++3H2O Cr2O3+2OH-+3H2O→2Cr(OH)4-(或CrO2-)
Cr3+在水溶液中以Cr(H2O)63+形式存在,为紫 色。铬盐溶液常呈绿色,这是因为内界H2O被 其他离子置换的缘故,如[Cr(H2O)6]Cl3为紫色。 [Cr(H2O)5Cl]Cl2· H2O为淡绿色, [Cr(H2O)4Cl2]· Cl· 2H2O为暗绿色。
第二十部分 过渡金属二
一、铁、钴、镍 1、常见氧化态 有+2、+3,但稳定性不同,Fe一般以+3稳定; +2较易被氧化;Co以+2稳定,+3是强氧化剂; Ni一般只呈现+2,碱性介质存在+3,但氧化 性较强。
2、铁、钴、镍化合物反应性比较 (1)Ni(OH)2只有在强氧化剂(如NaClO)作用 下才能氧化为黑色的NiO(OH) (2)硫氰化物 Fe3++nSCN-→[Fe(NCS)n]3-n n=1~6(血红色) Co2++4SCN-→[Co(NCS)4]2- (兰色) Ni2++4SCN-→[Ni(NCS)4]2- (亮绿色) Co(NCS)42-在水溶液中不太稳定,用有机溶 剂萃取后比较稳定。
(3)将Cr(OH)3在高温下灼烧
2Cr(OH)3=Cr2O3+3H2O
(4)用铝热剂还原Cr2O3
Cr2O3+2Al=2Cr+Al2O3
3、从辉钼矿(MoS2)中制备MoO3的主要步骤: (1)焙烧: 2MoS2+7O2=2MoO3+4SO2 (2)加氨水浸 取: MoO3+2NH3· H2O=(NH4)2MoO4+H2O (3)加(NH4)2S除Cu2+等杂质 Cu(NH3)42++(NH4)2S→CuS↓+2NH4++4NH3↑ (4)酸化析出钼 酸: (NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl (5)热解: H2MoO4=MoO3+H2O
元素化学 第六章过渡元素

V -1.2 (估算值) HNO3,HF 浓 H2SO4 Ni -0.25 稀 HCl H2SO4 等
Cr -0.86 稀 HCl H2SO4 Cu +0.34 HNO3,浓热 H2SO4
Mn -1.17 稀 HCl H2SO4 等 Zn -0.763 稀 HCl 7 H2SO4 等
M /M
2
(n-1)d 轨道与ns 轨道能级差较小。因此,d电子也能参与成键,能
形成大于族数的+2、+3氧化态化合物。它的多变价体现了过渡元素 的特性。
铜族元素化学活性远小于碱金属
这是由于标准电极电势比碱
金属大。且金属活性从Cu → Ag →Au 依次降低(与碱金属相反)。 ∵Z*显著↗,起主导作用;r也↗,但次要,以致离子势 ↗, ∴金 属性降低
单击此处编辑母版标题样式
1
过 渡 元 素
1 过渡元素概述
(1)过渡元素包括d区和ds区元素 周期系第ⅢB~ⅦB, Ⅷ, ⅠB~ⅡB元素;
Cr
轻过渡系
重过渡系
(2)价电子构型:(n-1)d1-9ns1-2, (n-1)d10ns1-2。 (3)镧系和锕系称为内过渡元素(电子主要是填充在更内 层的f轨道上,或f 区元素。
金只能溶于王水中 Au+4HCl+HNO3→H[AuCl4]+NO+2H2O Cu,Ag,Au不能置换稀酸中的H+(还原性差)
22
过 渡 元 素 —— 铜 银 金
2 铜的重要化合物 2. 1 氧化物 • 氧化铜(CuO):黑色 • 氧化亚铜(Cu2O):暗红色 制备:加热氢氧化铜、碱式碳酸铜、硝酸盐都能 得到氧化铜。
5 d区元素的磁性 过渡元素的原子或离子大多存在未成对电子,具 有顺磁性。 成单电子数越多,磁性越强。
第9章_过渡元素-1

a,半径大,易变形的阴离子易失电子,电荷跃迁越容易。 ,半径大,易变形的阴离子易失电子,电荷跃迁越容易。 b,电荷高,极化能力大的阳离子易得电子,电荷跃迁越 ,电荷高,极化能力大的阳离子易得电子, 容易。(跃迁容易的物质的颜色深) 容易。(跃迁容易的物质的颜色深)如: 。(跃迁容易的物质的颜色深 AgCl,AgBr,AgI
1)d - d电子跃迁 f - f电子跃迁
有于过渡金属离子的d规道在配位体的影响 下,发生分裂,其分裂能的大小相当于可见光 的能量范围。对于d1~d9组态的金属或金属离 子,d电子吸收可见光的能量后,可以在不同 的d轨道之间跃迁,即发生d-d跃迁,从而显色。 d-d跃迁吸收的能量与轨道分裂能有关,所以配合 跃迁吸收的能量与轨道分裂能有关, 跃迁吸收的能量与轨道分裂能有关 物的颜色与配位体有关。 物的颜色与配位体有关。 [CuCl4]2淡黄色 [Cu(NH3)4]2+深蓝色 [Cu(H2O)4]2+ 蓝色 [Cu(en)2]2+ 深蓝紫色
b, TiO2不溶于水和稀酸,能溶于氢氟酸和浓硫酸
TiO2+6HF=H2[TiF6]+2H2O TiO2+H2SO4=TiOSO4+H2O 水溶液中不存在Ti4+(aq),?
Ti4+有强烈的极化能力,水溶液中以氧钛离子的形式 存在。
c, 用途:颜料,油漆,橡胶,填充剂,消光剂, 催化剂。
2、钛酸盐 钛氧盐 TiO2+BaCO3
c,制备: 2TiCl4+H2 2TiCl3+2HCl 2TiO2++Zn+4H+=2Ti3+Zn2+2H2O 2Ti+6H+(浓)=2Ti3++3H2O
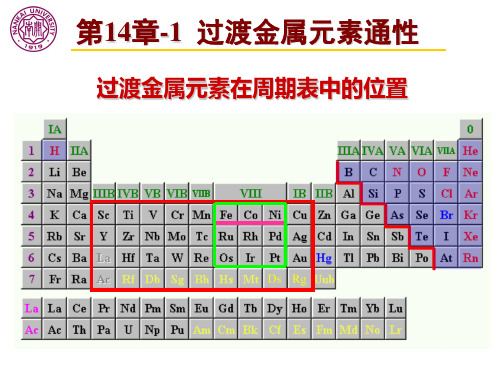
第14章-1过渡金属元素通性
Mn
Fe
717.4
759.4
1509.1
1561
3259
2957.4
Co
Ni Cu
758
736.7 746
1646
1753.0 1958
3232
3393 3554
二、电离能与氧化态
元素的电离能是衡量元素化学活泼性和说明元素 氧化态特征的参数之一:
1. 过渡金属的电离能随离子电荷的增加没有发生突变, 只是逐渐增大,(n-1)d电子与ns电子能量接近,都能起价 电子的作用,所以过渡金属表现出多种氧化态; 2. Fe3+离子的价电子构型为半充满的 3d5 稳定结构,所以 Fe具有比较小的第三电离能, Fe可直接氯化生成 FeCl3, 而 Fe 后的Co、Ni 由于第三电离能较大,直接氯化不能生 成三氯化物;
五、成键特征
过渡元素和主族元素成键特征的基本区别:
过渡元素化合物中,d轨道在成键中起主要作用,d电子 参加了价键的形成;主族元素化合物中,p轨道在成键中 起关键性作用,d轨道起次要作用; Cr 3d Cr3+ [Cr(H2O)6]3+ [CrF6]3 4p
4s
易 形 成 配 位 化 合 物
五、成键特征
2. 掌握Cr(Ⅲ)和Cr(Ⅵ)化合物的酸碱性、氧化还原性以 及Cr2O72-和CrO42-之间相互转化关系; 3. 掌握Mn(Ⅱ) 、Mn(Ⅳ)、 Mn(Ⅵ)和Mn(Ⅶ)重要化合物的 性质以及各价态锰之间相互转化关系;
4. 掌握Fe、Co、Ni的+2、+3氧化态稳定性规律以及反应 性上的差异;熟悉它们的重要配合物;
5. 掌握Cu、Ag单质及其重要化合物、配合物性质;
6. 了解Ti、V、Pt、 Au及其重要化合物性质;
过渡元素
过渡元素(一)(一) 过渡元素通性过渡元素一般是指原子的电子层结构中d轨道或f轨道仅部分填充的元素。
d区元素价电子构型为(n-1)d1~8ns1~2 (Pd 4d10和Pt 5d96s1例外), 最外两层电子均未填满。
由此构成了d区元素如下通性:(1)单质的相似性(2) 原子半径变化趋势(3) 有可变氧化态例1对同一族元素来说,随周期数增加,为什么主族元素低氧化态趋于稳定而过渡元素高氧化态趋于稳定?例如,处于同一纵列的Ni和Pt,前四个电离能为I1+I2/kJ·mol-1I1+I2/kJ·mol-1Ni 2.49 8.69Pt 2.66 6.70(3) 过渡元素的氧化物及氢氧化物的性质(4) 容易形成配合物(5)配离子大多有颜色d-d跃迁MnO4-、CrO42-、VO43-等:荷移跃迁(6) 具有磁性和催化性能例2Ziegler-Natta 催化剂(6)间充化合物如r.t.下用Pd吸收H2所得氢化钯中,氢的最大含量可达PdH0.8,其他如LaH-,CeH2.69等(为原子数比值)。
这种化2.76合物仍保持金属结构特征,其间除金属键外,还存在金属和B、C、N、H等的共价键。
(二) 几种晶格类型1.钙钛矿具有边长为3.84 Å的立方晶胞,Ca、Ti和O 原子分别处在它的顶角、体心和面心的位置上。
i)给出钙钛矿的化学计量式。
ii)计算晶体密度。
iii)描述三种离子的配位情况。
(ⅰ) CaTiO3(ⅱ) ρ= 3.99 g·cm―3(ⅲ) Ca2+12个O2―围绕12面体Ti(IV) 6个O2―围绕八面体O2―2个Ti4+和4个Ca2+围绕八面体2.Fe3O4的结构:反式尖晶石结构尖晶石的通式M II M2III O4常式尖晶石中,M II占据四面体位置,M III占据八面体位置反式尖晶石中,一半M III占据四面体位置,另一半M III和M II占据八面体位置,所以Fe3O4的结构可表示为[Fe III]t[Fe II Fe III]o O4其电导是Fe2O3的106倍例尖晶石是一种金属氧化物M3O4,它的氧离子接近于按密堆积排列。
第14章-1过渡金属元素通性分析
Mn
Fe
717.4
759.4
1509.1
1561
3259
2957.4
Co
Ni Cu
758
736.7 746
1646
1753.0 1958
3232
3393 3554
二、电离能与氧化态
元素的电离能是衡量元素化学活泼性和说明元素 氧化态特征的参数之一:
1. 过渡金属的电离能随离子电荷的增加没有发生突变, 只是逐渐增大,(n-1)d电子与ns电子能量接近,都能起价 电子的作用,所以过渡金属表现出多种氧化态; 2. Fe3+离子的价电子构型为半充满的 3d5 稳定结构,所以 Fe具有比较小的第三电离能, Fe可直接氯化生成 FeCl3, 而 Fe 后的Co、Ni 由于第三电离能较大,直接氯化不能生 成三氯化物;
第14章-1 过渡金属元素通性
过渡金属元素在周期表中的位置
第14章-1 过渡金属元素通性
过渡元素占据长周期的第4、5、6、7周期;从 第ⅢB 族的钪族开始,到第ⅠB 族的铜族为止, 共9个直列36个元素,不包括镧系和锕系元素; 填充d电子,亦称d区元素; 1. 单质相似性,同一周期金属性递变不明显; 2. 可变的氧化态,d电子可以参与成键;
二、电离能与氧化态
第一过渡系元素的电离能 (kJ· mol-1)
元素 K Ca Sc Ti V Cr 第一电离能 418.9 589.8 631 658 650 652.8 第二电离能 3051.4 1145.4 1235 1310 1414 1496 第三电离能 4411 4912.0 2389 2652.5 2828.0 2987
3. 易形成配合物,配离子大多有颜色;
4. 单质或化合物往往具有磁性和催化性;
第十二章 过渡元素(一)李
与稀酸
一般不反应 能溶于硝酸
配合物 与H2S反应
易形成 能
• 相关化学方程式:
• • • • • 2Cu+O2+H2O+CO2→Cu(OH)→Cu(OH)2·CuCO3 4Ag+2H2S+O2→2Ag2S+2H2O Cu+2H2SO4(浓)→CuSO4+SO2+2H2O 3Ag+4HNO3→3AgNO3+NO+2H2O Au+4HCl+HNO3→HAuCl4+NO+2H2O
第十二章 过渡元素(一) 过渡元素(
铜副族和锌副族 第一节、过渡元素的通性 第一节、 第二节、 第二节、铜副族元素 第三节、 第三节、锌副族元素
• 过渡元素都是金属元素,包括 ⅠB -- ⅧB族元素, 即d区和ds区元素,它们位于周期表中部,处在主 族金属元素(s区)和主族非金属元素(p区)之 间。 • 通常按周期表把过渡元素分为三个系列 • 第一过渡系 第四周期Sc--Zn • 第二过渡系 第五周期Y--Cd • 第三过渡系 第六周期Lu--Hg
2AgNO
3
440C → 2Ag + 2NO °
2
+ O
2
300C → 2Ag + 1 O Ag 2 O ° 2 2 1 hγ AgX → Ag + X 2 (X = Cl, Br, I) 2
• (3)银和许多配体易形成配合物
• 1、硝酸银——最重要的可溶性银盐 P296图表 、硝酸银 最重要的可溶性银盐
Cr3+ 蓝紫 Cr2+ 蓝色
Ni2+ 绿色 Co3+ 粉红
Mn3+ Fe2+ 红色 浅绿 Mn2+ Fe3+ 5 粉红 浅紫 为紫色,当有部分水合时为绿色。 注: Cr3+为紫色,当有部分水合时为绿色。 3+ Sc 、 Zn2+、 Cu+ 的单电子数为 0,离子无色。 ,离子无色。
过渡金属通性
子半径小、原子量大、s、d都参与成键
3-1 过渡元素的原子半径
ý É ª Ø Ó ë ¶ ¹ ¶ Ô Ë Ô ×°¾ 200 190 180 170 160 150 140 130 120 110 100 20
Sc Ti V Cr Y Zr Nb Mo La Hf Ta W
Mn Tc Re
Fe Co Ru Rh Os Ir
一方面,CO把一对电子填入Ni的sp3杂化轨道中形成σ键, 一方面又以空的π2p*轨道接受来自Ni d轨道的电子,形成π键, 从而增加配合物的稳定性,但削弱了CO内部成键,活化CO了 分子。
2. 羰基簇合物
过渡元素能和CO形成许多羰基簇合物。 羰基簇合物中金属原子多为低氧化态并具有适宜的d轨道。 双核和多核羰基簇合物中金属原子与羰基的结合方式有: 端基(1个CO和1个成簇原子相连);边桥基(1个CO与2个成 簇原子相连);面桥基(1个CO与3个成簇原子相连)。
Mn2(CO)10
5CO Mn2(CO)10 的 Mn(0):↑↓ ↑↓ ↑↓ ↑ —— Mn(0) : ↑↓ ↑↓ ↑↓ ↑ ——
—— —— —— ——
d2sp3
—— —— —— ——
5CO
Co2(CO)8:
三个CO孤电子对
Co2(CO)8中Co(0): ↑↓ ↑↓ ↑↓ ↑ ↑ ↑
—— —— ——
21-3
过渡金属的通性
具有部分填充d或f壳层电子的元素。 狭义:(n-1)d1~8ns1~2 ⅢB~Ⅷ 8列 10列
广义:(n-1)d1~10ns1~2 ⅢB~ⅡB
过渡元素全部为金属,其化合物颜色多、 变价多、 形成配合物多。与同周期碱金属或碱土金属比过渡 金属密度大、硬度大、熔沸点高,因为过渡金属原
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
100
族
Cs
250
过渡元素的原子半径
Ba
Rb
原子半径/ 原子半径 / pm
K Sr
200
Ca
Y
2. 同一周期元素从左到右原 第一过渡系 子半径缓慢减小, 子半径缓慢减小,到铜族 第二过渡系 元素又稍增大。 元素又稍增大。 第三过渡系
150
3. 有的过渡元素可形成氧化数 为0、-1、-2、-3的化合物 、 、 、 的化合物 如
配合物 [Ni(CO)4] [Co(CO)4][Cr(CO)5]2[Mn(CO)4]3形成体氧化数 0 -1 -2 -3
1313-1-5 非整比化合物
13-1-5 非整比化合物 过渡元素易形成非整比化合物
Fe2+ O2- Fe2+ O2O2O2- Fe2+
核 电 荷 增 加
,
轨 道 上 , 最 外 层 只 有
电 子 填 充
(n-1)d1
10ns1 2
在 1 个2 次 电 外征
13-1-1 过渡元素原子特征 1 2 价层电子构型为(n-1)d1~10ns ~ 价层电子构型为 原子半径变化规律
Cs
250
过渡元素的原子半径
Ti V Cr Mn Zr Nb Mo Tc
Fe Co Ni
铁系
Ag Cd 轻铂组 Os Ir Pt Hf Ta W Re 重铂组 Au Hg Rf Db Sg Bh Hs Mt Uun Uuu Uub
Ru Rh Pd
1313-1-1 过渡元素原子特征
13-1-1 过渡元素原子特征 1 2 价层电子构型为(n-1)d1~10ns ~ 价层电子构型为
无机化学多媒体电子教案
第十三章 过渡元素
第一节过渡元素概述
第一节 过渡元素概述
族 ⅢB ⅣB ⅤB ⅥB ⅦB 周 期
钪 钛 钒 铬 锰 分 分 分 分 分 族 族 族 族 族
Ⅷ
ⅠB ⅡB 铜 锌 分 分 族 族 Cu Zn
4(第一 第一 Sc 过渡系) 过渡系 5(第二 第二 Y 过渡系) 过渡系 6 (第三 La第三 过渡系) 过渡系 Lu 7(第四 Ac第四 过渡系) 过渡系 Lr
1313-1-8 磁性
多数过渡元素或离子具有顺磁性 13-1-8 磁性 多数过渡元素的原子或离子有 未成对电子, 未成对电子,所以具有顺磁性
离子 d电子数 电子数 未成对 电子数 磁矩 (µ)/B.M. VO2+ V3+ Cr3+ Mn2+ Fe2+ Co2+ Ni2+ Cu2+ 1 2 3 5 6 7 8 9 1 2 3 5 4 3 2 1 未成对d电子越多 电子越多, 未成对 电子越多,μ越大 1.73 2.833.835.924.903.872.831.73
ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ Ⅷ Ⅷ ⅠB ⅡB
100
族
1313-1-2 单质的物理性质
13-1-2 单质的物理性质 灰白色, 多呈银白色、灰白色,有金属光泽 为轻金属外, 除Sc、Ti为轻金属外,其它均为重 、 为轻金属外 金属
金属
Li
Sc Ti 其它
Os
Ir
Pt
密度 0.535 3.0 4.5 >5 22.61 22.65 21.45 -3 g·cm 最小 最大
如 1000℃时 ℃ FeO的实际组成为 的实际组成为 Fe0.89O ~ Fe0.96O
Fe2+ O2- Fe2+ O2O2- Fe2+ O2- Fe2+
1313-1-6
元 素
化合物颜色
13-1-6 化合物颜色 过渡元素形成的配离子大多有颜色
Sc Ti V CrMnFe Co Ni CuZn M2+中d电子数 - 2 3 4 5 6 7 8 9 10 电子数 [M(H2O)6]2+ - 褐紫天 浅 浅 粉 绿 浅 无 10构型 颜色 d0、d绿 红 蓝红 蓝 的离子无色 Sc Ti V CrMnFe Co Ni CuZn 元 素 M2+中d电子数 0 1 2 3 4 5 6 7 电子数 [M(H2O)6]3+ 无 紫 绿 蓝 红 浅 绿 粉 颜色 紫 紫 红
、
元素
Sc V Cr 13-1-3 Ti 金属活泼性
其活泼性减弱
3. 同族元素(除Sc分族外 自上往下 同族元素 除 分族外)自上往下 分族外 金属活泼性降低
ⅡBE (M2+/M)/V Ⅷ E (M2+/M)/V 第一过渡系 Zn 第二过渡系 Cd 第三过渡系 Hg -0.7626 -0.403 +0.8535 Ni Pd Pt -0.257 +0.92 +1.2
无机化学多媒体电子教案
第十三章 过渡元素
第一节结束
第一节 结束
La Zr Hg Sc Hf Cd Au Ta W Re Os Ir Pd Ag Ti Nb Mo Tc Ru Rh Pt V Cr Mn Fe Co Ni Cu Zn
ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ Ⅷ Ⅷ ⅠB ⅡB
100
族
Cs
250
Rb Ba
原子半径/ 原子半径 / pm
K Sr
1313-1-4 氧化数 具有多种氧化数
元素 Sc Ti V Cr Mn Fe Co Ni Cu Zn 3dn 3d1 3d2 3d3 3d5 3d5 3d6 3d7 3d8 3d9 3d10 +2 +2 +2 +2 +2 +1 +2 主 +2 要 +3 +3 +3 +3 +3 +3 +3 +3 +2 +4 +4 +4 氧 +5 化 +6 +6 数 +7 1.从左到右 元素最高氧化数升高 ⅦB后又降低 从左到右, 从左到右 元素最高氧化数升高, 后又降低 稳定氧化数 不稳定氧化数
1313-1-3 金属活泼性
Mn E (M2+/M)/V — -1.63 -1.13 -0.90 -1.18 可溶该金 各种 热HF 浓H2SO4 稀HCl 稀H2SO4 属的酸 酸 HCl HNO3 HF H2SO4 HCl等 HCl等 元素 Fe Co Ni Cu Zn E (M2+/M)/V -0.44 -0.277 -0.257 0.34 -0.7626 Sc、Y、La 是过渡元素中最活泼金属 、 、 HCl 稀 浓 稀HCl 稀H SO 可溶该金 H SO 稀HCl 2 4 H2SO4 等 2 4 属的酸 H2SO4等 HCl等 HCl等 缓慢) 等 (缓慢 缓慢 2. 第一过渡系金属除 外, E (M2+/M)均为负值 增大, 同一周期元素从左到右总趋势 E (M2+/M)增大 增大 1. 第一过渡系金属除Cu外 均为负值
1313-1-6
化合物颜色
过渡元素形成的配离子大多有颜色 同一中心离子与不同配体形成配合物时, 同一中心离子与不同配体形成配合物时 由于晶体场分裂能不同, 由于晶体场分裂能不同 d-d跃迁时所需 跃迁时所需 能量不同, 而显不同的颜色 能量不同 而显不同的颜色
[Ni(H2O)6]2+ [Ni(NH3)6]2+ 配合物 d-d 跃迁时吸收光 1176 925 波长(λ)/nm 波长 配离子颜色 绿 蓝
200
Ca
3. 同族元素从上往下原子半径 过渡元素的原子半径 增大,但五、六周期(除 增大,但五、六周期 除ⅢB) 外由于镧系收缩使其同族元 第一过渡系 素原子半径十分接近, 素原子半径十分接近,导致 第二过渡系 第三过渡系 其元素性质相似。 其元素性质相似。 Y
150
La Zr Hg Sc Hf Cd Au Ta W Re Os Ir Pd Ag Ti Nb Mo Tc Ru Rh Pt V Cr Mn Fe Co Ni Cu Zn
1313-1-7 配位催化
过渡元素易形成配合物 13-1-7 配位催化 过渡元素的原子或离子具有部分 催化剂 反应 空的(n-1)d,空的 、np轨道 空的 ,空的ns、 轨道 Fe/Mo 合成氨 可接受配体的孤电子对 Pt/Rh 氨氧化为NO 氨氧化为 过渡元素的离子一般具有较高的 V2O5 SO2氧化为SO3 氧化为 电荷、较小的半径,极化力强, 电荷、较小的半径,极化力强, Pd Raney Ni催化加氢 催化加氢 对配体有较强的吸引力 过渡元素及化合物有催化特性
13-1-4 ⅦB 氧化数 Ⅷ 族 ⅢB ⅣB ⅤB ⅥB
ⅠB ⅡB
具有多种氧化数 族 ⅢBⅣBⅤBⅥB ⅦB Ⅳ Ⅴ Ⅵ Ⅷ ⅠBⅡB Ⅱ 一过渡系 Sc Ti V Cr Mn Fe Co Ni Cu Zn +3 +3 +4 +3 +2 +2 +2 +2 +1 +2 主要 +2 +4 +5 +6 +4 +3 +6 氧化数 +7 二过渡系 Y Zr Nb Mo Tc RuRhPd Ag Cd 主要氧化数 +3 +4 +5 +6 +7 +4 +3 +2 +1 +2 三过渡系 Lu Hf Ta W Re Os Ir Pt Au Hg +3 +4 +5 +6 +7 +8 +3 +2 +1 +1 主要氧化数 +4 +4 +3 +2 2. 从上往下 高氧化数化合物稳定性增加 从上往下,
Ba
