过渡金属元素
第10章过渡金属元素

例:八面体配合物[Cr(NH3)2(H2O)2Br2]+
例:顺-[CoCl2(en)2]+
动植物体内含有许多具有旋光活性的有机 化合物,这类配合物对映体在生物体内的生理 功能有极大的差异。例如存在于烟草中左旋尼 古丁的毒性要比人工合成出来的右旋尼古丁毒 性大的多。旋光异构体的拆分及合成研究是目 前研究热点之一。
配合物的化学组成相同,而配体在空间的 排列位置不同而产生异构现象称为的立体异 构。立体异构又称为空间异构。立体异构又分 为几何异构和旋光(对映)异构两类。
1.几何异构
几何异构中最常见是顺反异构。 如四配位的MA2B2四边形和六配位的MA2B4 八面体中,均存在顺反异构现象。
例:平面四边形配合物[PtCl2(NH3)2]
(3)由杂化类型确定配合物空间构型(参 照下表)
杂化 类型
空间 构型
sp
直线 型
sp2
三角 形
sp3
正四 面体
dsp2
正方 形
sp3d dsp3
三角 双锥
sp3d2 d2sp3
正八 面体
(4)由杂化类型确定是内轨型还是外轨型 (只要有(n-1)d轨道参与杂化就是内轨型配合物, 否则为外轨型配合物),成单电子数为0或1等 低电子数的为低自旋配合物,成单电子数多的 (一般>2)为高自旋配合物。
3.不能解释[Cu(H2O)4]2+的正方形构形等。 4.很难满意地解释夹心型配合物,如二茂 铁、二苯铬等的结构。
10.3 配合物的晶体场理论
10.3.1 基本要点 10.3.2 晶体场中的能级分裂 10.3.3 晶体场中的d电子排布
—高自旋与低自旋 10.3.4 晶体场稳定化能 10.3.5 晶体场理论的应用
元素周期表中的过渡金属元素及其性质研究

地壳中过渡金属元素的种类和分布
地壳中过渡金属元素的开采难度和成本
地壳中过渡金属元素的应用领域和价值
地壳中过渡金属元素的丰度排名
过渡金属元素在自然界中的分布:主要存在于地壳中,如铁、铜、锌等
开采方法:根据元素性质和矿床类型选择合适的开采方法,如露天开采、地下开采等
镍的化合物:硫酸镍、氯化镍、硝酸镍等
Hale Waihona Puke 铜元素:原子序数29,位于元素周期表第四周期
铜的物理性质:红色金属,具有良好的导电性和导热性
铜的化学性质:在空气中稳定,不易氧化,但在高温下可与氧气反应生成氧化铜
铜的化合物:包括氧化铜(CuO)、硫酸铜(CuSO4)、氯化铜(CuCl2)等,具有不同的物理和化学性质
汇报人:
元素周期表中的过渡金属元素及其性质研究
目录
添加目录标题
过渡金属元素概述
过渡金属元素的物理性质
过渡金属元素的化学性质
常见过渡金属元素及其化合物
过渡金属元素在自然界中的存在和开采
添加章节标题
过渡金属元素概述
过渡金属元素位于周期表的第4、5、6周期
过渡金属元素包括铁、钴、镍、铜、锌、钼、钨、钽、铌、钌、铑、钯、银、金、铂、汞等
过渡金属元素在工业上广泛应用,如铁、铜、铝等
过渡金属元素在生物体内具有重要作用,如铁、锌等
过渡金属元素在环保领域也有广泛应用,如铬、锰等
过渡金属元素在化学实验中常用作催化剂,如镍、铂等
过渡金属元素的物理性质
过渡金属元素的原子结构:原子半径、电离能、电子亲和能等
电子排布:过渡金属元素的电子排布规律和特点
原子结构对物理性质的影响:如熔点、沸点、导电性等
化学教学:过渡金属元素

配位化合物
6-3.2
配位化合物
配位化合物-混成轨域与几何形状
具有平面四边形及八面体形结构之错合物,有可 能具有几何异构物。
例如:二氯二氨铂,
具有顺式与反式两种异构物,如图:
例如:卤素离子、氰离子、硫氰离子 (SCN-)、 一氧化碳、氨和水等。
若配位子中有两个以上的原子具有孤对电子,可同时 和中心金属形成键结,则称为 多牙 配位子,
例如: 乙二胺( 化学式: H2N-CH2-CH2-NH2 ),
• 常以 en 表示, • 分子中两个氮原子皆具有一对孤对电子,可分别与中心金
6-3.1 常见过渡金属元素的性质
一.Fe
由鼓风炉炼铸而得的铁称为生铁,又称铸铁, 含有约2 ∼ 4.5%的碳,
质脆缺乏韧性及强度。 再经由一连串的热处理程序,可使其中的含碳
量减少,并使其结构重组,而形成所谓碳钢; 碳钢依其含碳量可分为:
低碳钢、中碳钢及高碳钢, 其机械性质不同,各有不同用途。如表: 炼铁产生的熔渣则可用来制造水泥。
动画:金属错合物
第二价称为配位数 (coordination number),
即中心金属与配位子间的键结数目。
例如:黄血盐 K4[Fe(CN)6], 中心为氧化数+2 的亚铁离子,其配位数为 6。
6-3.2
配位化合物
常见过渡金属离子的配位数
配位数多寡与中心金属的大小、电荷数与电子组 态有关,
一般最常见到之配位数为 6, 其次则为 4 配位和 2 配位。
为强调配位化合物中错离子的部分, 一般会以 [ ] 括号标记。
6-3.2
配位化合物
配位化合物的发现
配位化合物早在 1700 年代即被发现,但直至1890
过渡元素金属性变化规律

过渡元素金属性变化规律金是元素周期表中的第79号元素,是一种重要的过渡金属元素。
金具有许多特殊性质,其中包括其独特的金色、良好的导电性和导热性等。
金的属性很大程度上取决于其化学环境和物理状态。
在本文中,我们将探讨过渡元素金的属性变化规律。
金的基本性质金的原子序数为79,原子量为197,具有原子序数较高的特点。
金的化学符号为Au,是元素周期表中的d区过渡金属元素之一。
金是一种稀有金属,自古以来就被用作珍贵的贵金属。
金的金属特性使其具有良好的导电性和导热性。
金具有优秀的化学稳定性,不容易被氧化或腐蚀。
因此,金常被用于珠宝、金币、电子器件等领域。
金的物理性质金是一种黄金色的金属,具有较高的密度和较高的熔点。
在常温下,金为固体,具有良好的延展性和韧性。
金具有优异的光学性能,可用于反射镜、光学镜片等光学器件。
金的密度为19.32克/立方厘米,熔点达到1064摄氏度,沸点约为2856摄氏度。
金是一种化学稳定的金属,不容易与其他元素发生化学反应。
金的化学性质金是一种化学不活跃的元素,通常以+1和+3的价态存在。
金通常被用作催化剂、电极和电镀等材料。
金在水中不溶解,但可以与氰化物形成配合物。
金的氧化性较低,对许多酸和碱都不会发生化学反应。
金可以与银、铜、铂等金属形成合金,提高其物理性能。
金的属性变化规律金在化学环境和物理状态下表现出不同的属性。
在不同温度和压力下,金的密度、熔点和电导率等性质会发生变化。
金在不同价态下的化合物也具有不同的化学性质。
金的属性变化规律受到化学环境和外部力的影响。
金的物理性质会随着温度和压力的变化而发生改变,这些变化反映了金在不同条件下的稳定性和活性。
综上所述,金作为一种过渡元素具有丰富的属性和特性,其属性变化规律受到多种因素的影响。
深入研究金的属性变化规律有助于更好地理解金的特性和应用。
元素周期表中的过渡金属

医学应用
01
02
03
药物合成
过渡金属在药物合成中发 挥重要作用,如铂、钴、 镍等金属的配合物用于治 疗癌症的药物研发。
诊断试剂
某些过渡金属离子如铁、 铜、锌等参与生物体内的 代谢过程,可作为生物标 记物用于诊断疾病。
医疗器械
一些具有特殊物理和化学 性质的过渡金属及其合金 用于制造医疗器械,如手 术刀具、植入物等。
环境治理
污水处理
过渡金属化合物在污水处理中具有重要作用 ,能够有效去除水中的重金属离子和有害物 质,保障水质安全。
大气治理
利用过渡金属化合物去除大气中的有害气体 ,如二氧化硫、氮氧化物等,有助于改善空
气质量。
谢谢您的聆听
THANKS
元素周期表中的过渡金属
CONTENTS
• 过渡金属的概述 • 过渡金属的化学性质 • 过渡金属的物理性质 • 过渡金属的应用 • 过渡金属的发现与开采 • 过渡金属的未来发展
01
过渡金属的概述
定义与特性
定义
过渡金属是元素周期表中d区和ds区 的金属元素,它们具有未填满的d电 子壳层。
特性
过渡金属具有多种氧化态,可以形成 多种复杂的化合物,具有丰富的化学 性质和物理性质。
功能材料
过渡金属化合物在磁性、光学、电学 等方面具有优异性能,可用于信息存 储、光电器件、传感器等领域。
新能源开发
燃料电池催化剂
过渡金属(如铂、钯等)具有良好的催化性能,是燃料电池中重要的催化剂,有助于提 高燃料电池的效率和稳定性。
太阳能电池
过渡金属化合物在太阳能转换方面具有潜在应用价值,能够提高太阳能电池的光电转换 效率和稳定性。
详细描述
过渡金属具有多种氧化态,这是因为它们的d电子可以轻易地参与成键,形成不 同的价态。此外,由于d电子的存在,使得相邻氧化态间的电离能差较小,这使 得过渡金属在化学反应中容易发生氧化还原反应。
第14章-1过渡金属元素通性分析
Mn
Fe
717.4
759.4
1509.1
1561
3259
2957.4
Co
Ni Cu
758
736.7 746
1646
1753.0 1958
3232
3393 3554
二、电离能与氧化态
元素的电离能是衡量元素化学活泼性和说明元素 氧化态特征的参数之一:
1. 过渡金属的电离能随离子电荷的增加没有发生突变, 只是逐渐增大,(n-1)d电子与ns电子能量接近,都能起价 电子的作用,所以过渡金属表现出多种氧化态; 2. Fe3+离子的价电子构型为半充满的 3d5 稳定结构,所以 Fe具有比较小的第三电离能, Fe可直接氯化生成 FeCl3, 而 Fe 后的Co、Ni 由于第三电离能较大,直接氯化不能生 成三氯化物;
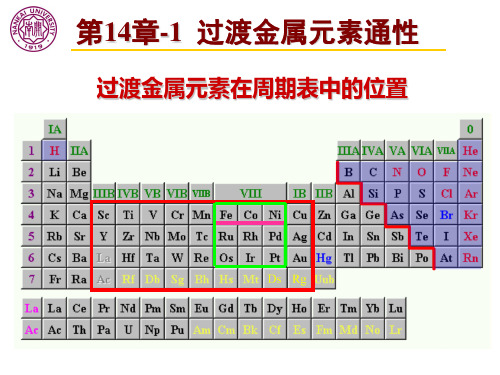
第14章-1 过渡金属元素通性
过渡金属元素在周期表中的位置
第14章-1 过渡金属元素通性
过渡元素占据长周期的第4、5、6、7周期;从 第ⅢB 族的钪族开始,到第ⅠB 族的铜族为止, 共9个直列36个元素,不包括镧系和锕系元素; 填充d电子,亦称d区元素; 1. 单质相似性,同一周期金属性递变不明显; 2. 可变的氧化态,d电子可以参与成键;
二、电离能与氧化态
第一过渡系元素的电离能 (kJ· mol-1)
元素 K Ca Sc Ti V Cr 第一电离能 418.9 589.8 631 658 650 652.8 第二电离能 3051.4 1145.4 1235 1310 1414 1496 第三电离能 4411 4912.0 2389 2652.5 2828.0 2987
3. 易形成配合物,配离子大多有颜色;
4. 单质或化合物往往具有磁性和催化性;
过渡金属Fe,Al,Cu
I.铁Fe一、铁的结构和性质1.铁是26号元素,位于第四周期第训I族,属于过渡元素。
原子结构示意图:主要化合价:+2, +32.铁在金属的分类中属于黑色金属,重金属,常见金属。
纯净的铁是光亮的银白色金属,密度为7.86g/cm 3,熔沸点高,有较好的导电、传热性,能被磁铁吸引,也能被磁化。
还原铁粉为黑色粉末。
3.铁是较活泼的金属元素,在金属活动性顺序表中排在氢的前面。
①跟非金属反应:点燃点燃△3Fe+2O2 == Fe3O42Fe+3Cl2 ==2FeCl3 Fe+S= FeSFe+I2= FeI2②跟水反应:3Fe+4H20==(高温)==Fe3O4+4H2炼铁料化学原理铁矿石、焦炭、石灰石、空气在高温下用还原剂从铁矿石里还原出来I①还原剂的生成炼钢生铁、空气(或纯氧、氧化铁)、生石灰、脱氧剂在高温下用氧化剂把生铁里过多的碳和其它氧化为气体或炉清除去I ______________________________________________________________________________________①氧化:2Fe+02fBi温 2FeOC+O2=CO2CO +C 同温2CO 2FeO氧化铁水里的Si、Mn、C等。
如 C+FeO②铁的还原亘ie+COTFe2O3+3CO )高2Fe+3CO2②造渣:生成的硅锰氧化物得铁水里的硫、磷跟造渣材料反应形成炉渣排出。
③炉渣的生成③脱氧,并调整Mn、Si含量CaCO3向温 CaO+CO22FeO+SiEL=E2Fe+SiO2③跟酸作用:Fe+2H+=Fe2++H t (遇冷浓硝酸、浓硫酸钝化;与氧化性酸反应2不产生H2,且氧化性酸过量时生成Fe3+)④与部分盐溶液反应:Fe+Cu2+=Fe2++Cu Fe+2Fe3+=3Fe2+4.炼铁和炼钢的比较1.过渡元素位于周期表中中部从niB〜ii B族十个纵行,分属于第四周期至第七周期。
过渡元素都是金属,又叫过渡金属。
元素周期表中的主族元素与过渡金属元素
元素周期表中的主族元素与过渡金属元素元素周期表是化学领域里最重要的工具之一,用于分类和组织已知的化学元素。
它根据元素的原子数和电子排布等特征将元素分为不同的类别。
其中,主族元素和过渡金属元素是两个重要的类别。
本文将对这两类元素进行详细介绍,并探讨它们的性质和应用。
一、主族元素主族元素又称为主族化学家族,包括了元素周期表中1A、2A、3A、4A、5A、6A和7A族的元素。
这些元素具有相似的化学性质,主要是由于它们拥有相似的电子排布。
1.1 原子结构和电子排布主族元素的原子结构和电子排布有一些共同特点。
它们的原子核周围的电子层分别填充有相同数量的电子。
例如,1A族的元素(氢、锂、钠等)具有一个电子在最外层(K层);2A族的元素(铍、镁、钙等)具有两个电子在最外层(L层);以此类推。
1.2 化学性质和应用主族元素的化学性质与其电子排布密切相关。
由于它们外层电子数量相对较少,主族元素通常表现出较低的电负性,并倾向于失去或共享电子,以达到稳定的电子结构。
主族元素在生活中有着广泛的应用。
例如,氧(O)是生命所必需的元素,广泛存在于空气和水中;氢(H)在燃料电池中被用作清洁能源;氯(Cl)和钠(Na)被用于制备食盐等。
此外,主族元素还在药品、化妆品、农药和材料科学等领域得到了广泛应用。
二、过渡金属元素过渡金属元素是元素周期表中位于3B至2B族的元素,它们的特点是较为复杂的电子排布和多样的化学性质。
2.1 原子结构和电子排布过渡金属元素的原子结构较复杂,其电子填充在d轨道中。
这些轨道能容纳不同数量的电子,因此过渡金属元素可以具有不同的氧化态,从而展现出多样的化学性质。
2.2 化学性质和应用过渡金属元素具有许多特殊的化学性质,例如良好的导电性、热稳定性和反应活性等。
这些性质使得过渡金属元素被广泛应用于许多领域。
过渡金属元素常用于催化剂的制备。
钯(Pd)和铂(Pt)等过渡金属催化剂在化学反应中具有高效率和选择性,广泛应用于化学工业和环境保护等领域。
过渡金属元素
2. 羰基簇合物 (分子中含有M—M键的化合物)
过渡元素能和CO形成许多羰基簇合物。 羰基簇合物中金属原子多为低氧化态并具有适宜的d轨道。 双核和多核羰基簇合物中羰基与金属原子的结合方式:
(1) 端基(1个CO和1个成簇原子相连);(2) 边桥基(1个CO
与2个成簇原子相连);(3) 面桥基(1个CO与3个成簇原子相 连)。
第7章 过渡金属元素
表7-1 过渡金属元素(d 区元素除第七周期外, 共23种)
周期\族
四
IIIB
Sc
IVB
Ti
VB
Ⅴ
VIB
Cr
VIIB
Mn Fe
VIII
Co Ni
五
六
Y
La
Zr
Hf
104Rf
Nb
Ta
105Db
Mo
W
106Sg
Tc
Re
107Bh
Ru
Os
108Hs
Rh
Ir
109Mt
Pd
Pt
110Uun
近时, 两个Re3+的dz2轨道以
“ 头碰头 ”重叠形成σ键; 两 个Re3+ 的dxz轨道、dyz轨道以
“ 肩并肩 ”重叠形成两个 d—d
π键; 而两个Re3+ 的dxy轨道以 “面对面”重叠形成δ键,说明 Re与Re之间形成四重键。
26
Re 5d56s2
-3e
Re3+ 5d4
dsp2杂化
5d4 (dsp2)0( dsp2)0( dsp2)0( dsp2)0 σ σ σ σ (3px)2 (3px)2 (3px)2 (3px)2 Cl Cl Cl Cl
过渡金属的配位数
过渡金属的配位数一、过渡金属的基本概念过渡金属,又称过渡元素,是一类在周期表中位于d区元素的统称。
它们具有不完全充满的d轨道,因此表现出较强的金属性。
过渡金属广泛应用于催化剂、磁性材料、合金等领域。
二、过渡金属的配位数定义与分类过渡金属的配位数是指一个过渡金属原子与周围配体原子形成的化学键的数量。
根据配体与过渡金属原子之间的键的复杂程度,过渡金属配位数可以分为简单配位数和复杂配位数。
1.简单配位数简单配位数指的是过渡金属原子与周围配体原子通过单一化学键相连的情况。
在这种情况下,过渡金属原子与配体原子之间的相互作用较弱,配位数较低。
2.复杂配位数复杂配位数是指过渡金属原子与周围配体原子通过多种化学键(如单键、双键、三键等)相连的情况。
在这种情况下,过渡金属原子与配体原子之间的相互作用较强,配位数较高。
三、过渡金属配位数的计算方法过渡金属配位数的计算方法主要有以下几种:1.配体电子对数法:根据配体的电子构型,计算其提供的电子对数,从而确定配位数。
2.配体原子数法:统计配体中与过渡金属原子形成化学键的原子数量,即为配位数。
3.晶体场理论法:根据晶体场理论,分析过渡金属原子在晶体中的环境,确定其配位数。
四、过渡金属配位数在实际应用中的重要性过渡金属配位数在实际应用中具有重要意义,它直接影响着过渡金属化合物的性质和功能。
例如,在催化剂领域,过渡金属配位数会影响催化剂的活性、选择性和稳定性;在磁性材料领域,过渡金属配位数会影响材料的磁性性能等。
五、常见过渡金属化合物的配位数举例1.铁(Fe)催化剂:常见的铁催化剂有Fe-EDTA(配位数6)、Fe-CN(配位数4)等。
2.钴(Co)催化剂:常见的钴催化剂有Co-PN(配位数6)、Co-BIPY (配位数6)等。
六、总结与展望过渡金属的配位数研究对于理解过渡金属化合物的性质和功能具有重要意义。
随着科学技术的不断发展,过渡金属配位数的研究将不断深入,为指导实际应用提供理论依据。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
对比主族元素:恰好相反。 IIIA 第六周期 Tl (Ⅲ) IVA Pb(Ⅳ) 强氧化性 (低稳定性) VA Bi(Ⅴ)
6s2 惰性电子对效应
9
§17-1 过渡元素的通性(续)
三、原子半径
影响原子半径的因素
Z* ↗, r ↘ 同亚层:电子数↑,r↑ 主量子数n = 电子层数↑,r↑
1. 同一周期
Re3+
↑ ↑ ↑ ↑ —— dz2 dxy dyz dxz dx2-y2
σ
Re3+
δ
π
π
σ成键
π成键
δ键
↑ ↑ ↑ ↑ —— dz2 dxy dyz dxz dx2-y2 | 头 碰 头 | 面 对 面 | 肩 并 肩
27
Re-Re成键情况
3. 双氮配合物与N2分子的活化
端基配位——以σ电子给予金属M N2形成配合物 M···N≡N M···N≡N···M
20
接受Ni的d电子 CO的分子轨道式 (1σ)2 (2σ)2 (3σ)2 (4σ)2 (1π)4 (5σ)2 (2π)0 (6σ)0
给予Ni的sp3杂化轨道
CO的一对电子填入Ni的sp3杂化轨道中形成σ键,同时又以空的π2p*轨道接受 来自Ni 的d轨道的电子,形成d → π*反馈π键,从而加强了Ni-C键并增大了 配合物的稳定性,但削弱了CO内部成键,活化了CO分子。 Ni(CO)4 IR吸 收光谱中伸缩振动频率(CO)红移。
13
镧系收缩 — 从57 La – 71 Lu,随着原子序数递增,增加的电 子进入(n-2) f(即4f)轨道(4f 0 ~145d 0~16s2);对于最外层6s电 子而言,4f 电子位于次外层, Z*增加很小,因此 (1)相邻两元素原子半径仅略为缩小 (Δr ≈ 1pm); (2) 但57 La – 71 Lu共15种元素,累积的原子半径缩小值Δr相 当大,达 14.2 pm 。 镧系收缩的影响: (1)第五周期,IIIB族元素钇(Y)成为“稀土”一员 : 63Eu 4s76s2 39Y 4d15s2 64Gd 4f75d16s2 四 Sc 五 Y 198.3 180.3 180.1 pm 67Ho3+ 39Y3+ 68Er3+ 六 La-Lu 89.4 89.3 88.1 pm 习惯上,把Y列入“重稀土”。
1
d区、ds区和f区元素
2
§17-1 过渡元素的通性
一、价电子构型;二、氧化态的规律;三、原子半径;四、第一电离能I1的变化; 五、物理性质的变化规律;六、过渡金属及其化合物的磁性;七、过渡元素氧化 物水合物的酸碱性;八、配合物:九、形成多碱、多酸倾向。
一、价电子构型
通式:(n-1)d1~9ns1~2
决定原子轨道能量的因素 由Z, n, l 决定。 (屏蔽常数 由n和l决定,n和l竞争) L. Pauling 原子轨道近似能级图:(牢记) 1s; 2s 2p ; 3s 3p; 4s 3d 4p; 5s 4d 5p; 6s 4f 5d 6p ; 7s 5f 6d 例外:Z = 24,41 ~ 46: 41Nb铌 4d45s1 42W 钨 5d46s2 44Ru钌 4d75s1 45Rh铑 4d85s1 46Pd钯 4d105s0 不是4d35s2 不是4d55s1 不是4d65s2 不是4d75s2 不是4d85s2 暂时不能 合理解释
端基
边桥基
面桥基Βιβλιοθήκη 22金属-金属键(M-M) 是原子簇合物最基本的共同特点。 金属-金属键(M-M) 见后
23
金属-金属键
(1)单键 Mn: 3d5 4s2
—— —— —— ——
Mn2(CO)10 5 CO
Mn2(CO)10 的 Mn(0):↑↓ ↑↓ ↑↓ ↑ —— Mn(0) : ↑↓ ↑↓ ↑↓ ↑ ——
但VIII族:多数最高氧化态 < 族数 仅见 Ru(VIII) 和 Os(VIII) 例如: RuO4 OsO4 Fe(VI) 和 Ni(VI) 具有强氧化性 FeO42- 高铁酸根 NiO42- 高镍酸根 Z *↑,不是所有(n-1)d电子都参与成键。
6
3. 氧化态的稳定性 (1) 同一周期 IIIB VIIB VIII 最高氧化态 +3 +7 +6 最高氧化态氧化性↗ 最高氧化态稳定性↘ 低氧化态稳定性↗ 例 :第一过渡系列 氧化性:Sc3+<TiO2+ < VO2+ < Cr2O72 - < MnO4- < FeO42稳定性:Sc3+>TiO2+>VO2+ > Cr2O72- > MnO4- > FeO42其中:ΦA / V Cr2O72 -/ Cr3+ MnO4- / Mn2+ FeO42- / Fe2+ NiO42- / Ni2+
21
2. 羰基簇合物 (分子中含有M—M键的化合物)
过渡元素能和CO形成许多羰基簇合物。 羰基簇合物中金属原子多为低氧化态并具有适宜的d轨道。 双核和多核羰基簇合物中羰基与金属原子的结合方式:
(1) 端基(1个CO和1个成簇原子相连);(2) 边桥基(1个CO
与2个成簇原子相连);(3) 面桥基(1个CO与3个成簇原子相 连)。
14
镧系收缩的影响(续)
(2)紧随镧系之后的第六周期几种元素Hf(铪),Ta(钽) 和(钼)与同族第五周期元素原子半径相近,性质相似,难 以分离: Ⅲ Ⅳ Ⅴ Ⅵ 五 Y Zr Nb Mo 六 La-Lu Hf Ta W
(3)同一副族(VB ~ VIII)第一电离能I1 : 第五周期 < 第六周期 第五周期 r相近,第六周期元素Z*↑↑ 第六周期 见教材p.221-222, 表8-2 –表8-4. 2. 同一副族原子半径:第四周期元素 < 五 ~ 六
铁磁性物质:强顺磁性, 外磁场撤消后仍永久保留磁性
如: Fe、Co、Ni及其合金Nd-Fe-B(第三代永磁材料)
17
七、过渡元素氧化物水合物的酸碱性
1. 最高氧化态氧化物的水合物 IIIB IVB Sc(OH)3 Y(OH)3 La(OH)3 VB VIIB VIIIB HMnO4 HTcO4 HReO4
15
四、第一电离能I1的变化(理解)
影响因素
1. 同一周期 Z*, I1 r , I1
左
r↘,Z*↗,I1和(I1 + I2)↗,(总趋势)
右
2. 同一副族 原子半径 r 有效核电荷 Z* 第一电离能 I1 第四周期 < 第五周期 ~ 第六周期 第四周期 < 第五周期 < 第六周期 第四周期 ~ 第五周期 < 第六周期
同一元素低价态化合物碱性比高价态碱性强。
八、配合物:
形成配合物倾向 比主族Mn+大得多: ① (n-1) d 与 ns 能量相近,(n-1)d电子参与成键; ② d 区 Mn+: (9 17)e构型, (强极化力 + 大变形性)。 与配体互相极化,使M-L键共价性↑
19
过渡元素的配合物
1. 羰基配合物:通常金属氧化态较低(0, -1, +1)。
七
Ac
金卢
金杜
金喜
金波
金黑
金麦
ⅢB~ⅤⅢ族,d 区 (n-1)d1~9ns1~2 (例外 Pd 4d105s0 ) 57La 4f 05d1 6s2 Δ Z = 1 ,增加的电子填入(n-2)f 亚层 镧系 57La ~ 71Lu(15种元素) 4f 0~145d 0-1 6s2 内过渡元素 锕系 89Ac~103Lr铹(15种元素) 5f 0~146d0~17s2
1.33 1.51 1.84 1.75
1. 水溶液以氧基阳离子形式存在: TiO2+ ,VO2+有颜色(荷移跃迁); 2. 低氧化态的化合物有颜色(d-d跃 迁)。
7
(2) 同一族 氧 化 性 ↘
VI CrO42-/Cr3+ MoO4-/M3+ WO42-/W3+
VII MnO4-/Mn2+ TcO4-/Tc+3 ReO4-/Re3+
第17章 过渡金属元素
表17-1 过渡金属元素(d 区元素除第七周期外, 共23种)
周期\族
四
IIIB
Sc
IVB
Ti
VB
Ⅴ
VIB
Cr
VIIB
Mn Fe
VIII
Co Ni
五
六
Y
La
Zr
Hf
104Rf
Nb
Ta
105Db
Mo
W
106Sg
Tc
Re
107Bh
Ru
Os
108Hs
Rh
Ir
109Mt
Pd
Pt
110Uun
金属与羰基成键特征:以Ni(CO)4为例。
Ni 3d84s2 ↑↓ ↑↓ ↑↓ ↑ ↑ 3d 3
调整, sp 杂化
↑↓
——
—— —— ——
4s
—— —— ——
4p
CO CO
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
↓↑ ↓↑ ↓↑ ↓↑
CO CO
Ni(CO)4 四面体
问 实测:Ni—C键长184 pm,理论:Ni—C键长198 pm; 题 CO把电子给予Ni,Ni上负电荷过剩,使该化合物不稳定, 而事实Ni(CO)4十分稳定。
12
三 、原子半径
周期 Z
*
ns或np
(n-1)d (n-2)f
Z*
r/pm
二、三
四、五、六(d) 镧系
1
1 1
0.35
0.85 1
0.65
0.15 很小
