第10章过渡金属元素优秀课件
合集下载
第十章 过渡金属元素(II)(VIIIB族)

② Co(NH3)62+、Co(CN)64-、Co(OH)2、Fe(OH)2
难以在水溶液中稳定存在, 空气中的即可将它们氧化, 尤其Co(CN)64-水即可氧化之: 2Co(CN)64- + 2H2O === 2Co(CN)63- + H2 + 2OHCo2+、Fe3+、Co(OH)3、Fe(OH)3、Co(CN)63-、 Co(NH3)63+、Fe(CN)63-、Fe(CN)63在水溶液中可以稳定存在.
2. M2+的相似性及差异性
① 形成CN = 6的sp3d2杂化的八面体结构的外轨型.
顺磁性水合氧离子,且具有颜色:
Ni(H2O)62+(亮绿色) Co(H2O)62+(粉红色 )
Fe(H2O)62+(浅绿色) d—d轨道跃迁所致.
② 盐水溶解性相似
它们的SO42-、Cl-、NO3- etc的盐易溶解于水,
BaFeO4(紫红色)强氧化剂. 4. Fe、Co、Ni的配合物— 会用HOT、CFT解释有关的问题.
5.除铁方法 在生产中除去产品中含有的铁杂质的常用方法 是用H2O2氧化Fe2+为Fe3+.调pH值使Fe(OH)3沉淀析出. 但方法的主要缺点: 在于Fe(OH)3具有胶体性质 ,吸附杂质, 沉降速率慢,过滤困难.
此配合物水溶液中稳定性差,加入Hg2+可形成兰色沉淀.
(6) 与丁二酮肟的反应 ------主要是Ni2+的特征反应 生成鲜红色的内配盐沉淀.——定性鉴定Ni2+.
(7).与NO3-的配位作用.——Co2+的特性
Co2+与NO3-能形成一种很有趣的配离子Co(NO3)42CN = 8 十二面体结构, NO3-起双齿配体的作用 (8) 与NO2-的反应
《过渡金属元素》课件

佩戴防护设备:如防护服、 手套、口罩等
遵守操作规程:严格按照 操作规程进行操作
定期进行安全培训:提高 员工安全意识和技能
建立应急处理机制:应对 突发安全事故
遵守法律法规:遵守国家 及行业相关法律法规
定期进行安全检查:及时 发现并消除安全隐患
过渡金属元素废弃物的分类和处理方法 资源化利用的技术和设备 资源化利用的经济效益和社会效益 资源化利用的法律法规和政策支持
氧化还原反应是 化学反应中常见 的反应类型
过渡金属元素在 氧化还原反应中 具有较高的活性
过渡金属元素在氧 化还原反应中能够 形成多种化合物
过渡金属元素在化学反应中具有催化作用 催化作用可以提高化学反应速率 催化作用可以降低化学反应的活化能 催化作用可以改变化学反应的方向和产物
PART FIVE
过渡金属元素在合金 材料中的作用:提高 合金的强度、硬度、 耐磨性等性能
有重要作用
过渡金属元素在自然界中主要以矿物和矿石的形式存在 常见的过渡金属矿物有铁、铜、镍、钴等 矿石是含有过渡金属元素的岩石,如铁矿石、铜矿石等 过渡金属元素在矿石中的含量和分布会影响其经济价值
过渡金属元素在自然界中主要 以矿物形式存在
提取方法:物理提取法、化学 提取法、生物提取法等
纯化方法:溶剂萃取法、离子 交换法、电化学法等
纯化程度:根据应用需求选择 合适的纯化程度
PART FOUR
配位键:过渡 金属元素与配 体形成的化学
键
作用:稳定过 渡金属元素的 电子结构,增 强其化学活性
应用:在化学 反应中,配位 键可以促进过 渡金属元素的
反应速率
例子:铁离子 与水形成配位 键,生成氢氧
化铁沉淀
过渡金属元素在 氧化还原反应中 起到重要作用
《过渡金属的特性》PPT课件
SO2(g) + H2O(l) → H2SO3(aq) 还原性和氧化性
SO2(g) + Br2(aq) → Br-(aq) + SO4-(aq) 2SO2(g) + O2(g) △→ 2SO3(g), slow reaction, catalyzed V2O5 SO3(g) + H2O(l) → H2SO4(aq) 酸雨(Sox, Nox, H2O) H2SO4, 无色腐蚀油状液体;强酸,脱水剂,氧化剂。 SO3(g) + H2SO4(l) → H2S2O7(l) (Oleum, 发烟硫酸) 化肥(2/3),石化产品,染料,清洁剂。
a) Before magnetization, the spins are almost randomly aligned.
b) After magnetization the spins are aligned in the same direction.
9
Trends in Chemical Properties
Cr(II)O basic
Cr2(III)O3 amphoteric
Cr(VI)O3
acidic
10
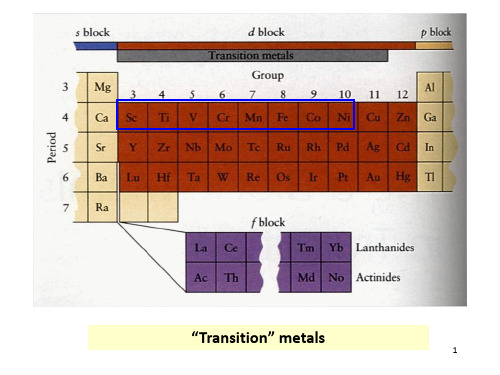
周期 四 五 六
11
These three artifacts represent the progress that has been made in the extraction of d-metals.(a) An ancient bronze (青铜,Cu/Sn) chariot axle cap from China, made from an alloy of metals hat are easy to extract. (b) A nineteenth-century iron steam engine made from a metal that was moderately easy to extract once high temperatures could be achieved. (c) A 20-century airplane engine with titanium components that had to await advanced, hightemperature technology before the element became widely 12 available.
SO2(g) + Br2(aq) → Br-(aq) + SO4-(aq) 2SO2(g) + O2(g) △→ 2SO3(g), slow reaction, catalyzed V2O5 SO3(g) + H2O(l) → H2SO4(aq) 酸雨(Sox, Nox, H2O) H2SO4, 无色腐蚀油状液体;强酸,脱水剂,氧化剂。 SO3(g) + H2SO4(l) → H2S2O7(l) (Oleum, 发烟硫酸) 化肥(2/3),石化产品,染料,清洁剂。
a) Before magnetization, the spins are almost randomly aligned.
b) After magnetization the spins are aligned in the same direction.
9
Trends in Chemical Properties
Cr(II)O basic
Cr2(III)O3 amphoteric
Cr(VI)O3
acidic
10
周期 四 五 六
11
These three artifacts represent the progress that has been made in the extraction of d-metals.(a) An ancient bronze (青铜,Cu/Sn) chariot axle cap from China, made from an alloy of metals hat are easy to extract. (b) A nineteenth-century iron steam engine made from a metal that was moderately easy to extract once high temperatures could be achieved. (c) A 20-century airplane engine with titanium components that had to await advanced, hightemperature technology before the element became widely 12 available.
过渡金属元素ppt课件

过渡金属元素
(ⅢB~ⅤⅢ族,d 区)
(n-1)d1~9 ns1~2 (例外 Pd 4d10 5s0 )
表 过渡金属元素(d 区元素共 25 种)
周期\族 ⅢB ⅣB ⅤB ⅥB ⅦB
Ⅷ
四 Sc Ti Ⅴ Cr Mn Fe Co Ni
五 Y Zr Nb Mo Tc
Ru Rh Pd
六 La Hf Ta W Re
4f 2~145d 0-1 6s 2 锕系 89Ac~103Lr 铹(15 种元素)
5f 0~146d 0~1 7s 2
→“内过渡元素”
1
过渡元素的通性
一、价电子构型
通式:(n-1)d1~9 ns1~2
中性原子的原子轨道能量随原子序数的变化:n 和 l 竞争。
例外:Z = 24,41 ~ 46:“能量最低原理”
H2O O OH2 \ /\ /
Fe
Fe
2 个八面体共棱
/ \/ \
H2O H2O
O OH2 H H2O
pH ↗ 胶体溶液 pH ↗ Fe2O3·xH2O↓
Cr3+、Al3+、类似 Fe3+
15
八、形式多碱、多酸倾向
(二)多酸
由含氧酸缩合脱 H2O 而形成“多酸”
例:
O
O
Cr
Cr
/ \ /\
(一)同一周期:
r↘,Z*↗,I1 和(I1+I2)↗,(总趋势)
左
右
(二)同一副族:
原子半径 r 第四周期
^ 第五周期
∫ 第六周期
有效核电荷 Z* ^ ^
第一电离能 I1 交错(基态电子构型不同)
^
图 7-1 第一、二、三过渡系列金属元素第一电离能变化
(ⅢB~ⅤⅢ族,d 区)
(n-1)d1~9 ns1~2 (例外 Pd 4d10 5s0 )
表 过渡金属元素(d 区元素共 25 种)
周期\族 ⅢB ⅣB ⅤB ⅥB ⅦB
Ⅷ
四 Sc Ti Ⅴ Cr Mn Fe Co Ni
五 Y Zr Nb Mo Tc
Ru Rh Pd
六 La Hf Ta W Re
4f 2~145d 0-1 6s 2 锕系 89Ac~103Lr 铹(15 种元素)
5f 0~146d 0~1 7s 2
→“内过渡元素”
1
过渡元素的通性
一、价电子构型
通式:(n-1)d1~9 ns1~2
中性原子的原子轨道能量随原子序数的变化:n 和 l 竞争。
例外:Z = 24,41 ~ 46:“能量最低原理”
H2O O OH2 \ /\ /
Fe
Fe
2 个八面体共棱
/ \/ \
H2O H2O
O OH2 H H2O
pH ↗ 胶体溶液 pH ↗ Fe2O3·xH2O↓
Cr3+、Al3+、类似 Fe3+
15
八、形式多碱、多酸倾向
(二)多酸
由含氧酸缩合脱 H2O 而形成“多酸”
例:
O
O
Cr
Cr
/ \ /\
(一)同一周期:
r↘,Z*↗,I1 和(I1+I2)↗,(总趋势)
左
右
(二)同一副族:
原子半径 r 第四周期
^ 第五周期
∫ 第六周期
有效核电荷 Z* ^ ^
第一电离能 I1 交错(基态电子构型不同)
^
图 7-1 第一、二、三过渡系列金属元素第一电离能变化
过渡金属元素ppt课件

其中:ΦA / V
Cr2O72 -/ Cr3+
1.33
MnO4- / Mn2+
1.49
FeO42- / Fe2+ NiO42- / Ni2+
1.84 1.75
5
(三)氧化态的稳定性
2.同一族
高稳氧 氧定化 化性性 态↗↘
Ⅵ
CrO42-/Cr3+ MoO4-/M3+ WO42-/W3+
Ⅶ
MnO4-/Mn2+ TcO4-/Tc+3 ReO4-/Re3+
ⅢB ⅦB Ⅷ
+3 +7 +6 最高氧化态氧化性↗ 最高氧化态稳定性↘
低氧化态稳定性↗
例 第一过渡系列:
氧化性 稳定性
Sc3+ < TiO2+ < VO2+ < Cr2O72 - < MnO4- < FeO42Sc3+ > TiO2+ > VO2+ > Cr2O72- > MnO4- > FeO42-
例:r / pm 57 La 187.7, 71 Lu 173.5
Δr
187.7 173.5 = 71 57
≈ 1 pm
9
三、原子半径:
“镧系收缩”
——从 57 Ln – 71 Lu,随着原子序数递增,增加的电子进入 (n-2) f(即 4f)轨道(4f 0 ~145d 0~16s 2);对于最外层 6s 电子而言,4f 电子位于次外层, Z*增加很小,因此
过渡金属元素
(ⅢB~ⅤⅢ族,d 区)
(n-1)d1~9 ns1~2 (例外 Pd 4d10 5s0 )
《过渡元素化学》课件

器件
化学工业:用 航空航天工业: 于制造催化剂、 用于制造耐高 染料、农药等 温、耐腐蚀的
合金材料
核工业:用于 制造核燃料和 核反应堆的部
件
环保工业:用 于处理废水、 废气等污染物
过渡元素在生物体内 的作用:如铁、铜、 锌等在血液、骨骼、 神经等系统中的作用
过渡元素在药物中 的应用:如铁、铜、 锌等在药物中的作 用
汇报人:
原子结构:过渡元素原子核外电子排布具有周期性规律 电子排布:过渡元素原子核外电子排布具有周期性规律 电子排布特点:过渡元素原子核外电子排布具有周期性规律 电子排布规律:过渡元素原子核外电子排布具有周期性规律
金属性:过渡元素中,金属性最强的是铼,最弱的是铋 非金属性:过渡元素中,非金属性最强的是铋,最弱的是铼 电离能:过渡元素中,电离能最高的是铼,最低的是铋 过渡元素的物理性质与其金属性和非金属性有关,电离能是衡量元素化学性质的重要指标
磁性:过渡 元素具有磁 性,其中铁、 钴、镍等元 素具有较强 的磁性
热导率:过 渡元素的热 导率较高, 其中铜、银 等元素具有 较高的热导 率
电导率:过 渡元素的电 导率较高, 其中铜、银 等元素具有 较高的电导 率
熔点:过 渡元素的 熔点较高, 其中钨、 钼等元素 具有较高 的熔点
硬度:过 渡元素的 硬度较高, 其中钨、 钼等元素 具有较高 的硬度
应用:氧化物和氢氧化物在工业、化学实验和日常生活中有广泛的应用,如催化剂、颜料、药物等
盐类:过渡元素与 酸或碱反应生成的 化合物,如氯化铁、 硫酸铜等
络合物:过渡元素 与有机配体形成的 化合物,如铁氰化 钾、铜氨络合物等
性质:盐类和络合物 具有不同的物理和化 学性质,如颜色、溶 解度、稳定性等
化学工业:用 航空航天工业: 于制造催化剂、 用于制造耐高 染料、农药等 温、耐腐蚀的
合金材料
核工业:用于 制造核燃料和 核反应堆的部
件
环保工业:用 于处理废水、 废气等污染物
过渡元素在生物体内 的作用:如铁、铜、 锌等在血液、骨骼、 神经等系统中的作用
过渡元素在药物中 的应用:如铁、铜、 锌等在药物中的作 用
汇报人:
原子结构:过渡元素原子核外电子排布具有周期性规律 电子排布:过渡元素原子核外电子排布具有周期性规律 电子排布特点:过渡元素原子核外电子排布具有周期性规律 电子排布规律:过渡元素原子核外电子排布具有周期性规律
金属性:过渡元素中,金属性最强的是铼,最弱的是铋 非金属性:过渡元素中,非金属性最强的是铋,最弱的是铼 电离能:过渡元素中,电离能最高的是铼,最低的是铋 过渡元素的物理性质与其金属性和非金属性有关,电离能是衡量元素化学性质的重要指标
磁性:过渡 元素具有磁 性,其中铁、 钴、镍等元 素具有较强 的磁性
热导率:过 渡元素的热 导率较高, 其中铜、银 等元素具有 较高的热导 率
电导率:过 渡元素的电 导率较高, 其中铜、银 等元素具有 较高的电导 率
熔点:过 渡元素的 熔点较高, 其中钨、 钼等元素 具有较高 的熔点
硬度:过 渡元素的 硬度较高, 其中钨、 钼等元素 具有较高 的硬度
应用:氧化物和氢氧化物在工业、化学实验和日常生活中有广泛的应用,如催化剂、颜料、药物等
盐类:过渡元素与 酸或碱反应生成的 化合物,如氯化铁、 硫酸铜等
络合物:过渡元素 与有机配体形成的 化合物,如铁氰化 钾、铜氨络合物等
性质:盐类和络合物 具有不同的物理和化 学性质,如颜色、溶 解度、稳定性等
过渡金属ppt
The atomic radii remains almost constant from V to Cu.
First ionisation energy
There is little change in the first ionisation energy of transition elements from Ti to Cu. This is because : a) the atomic radii remains almost constant. b) the attractive forces on the outer electrons remains almost constant.
Sc3+ :
Sc3+ ion has no d electrons
Zn2+ :
Zn has full 3d subshell
They have very similar physical and chemical properties.
Metals with high melting and boiling point. High densities.
Due to strong metallic bonds. Transition elements have a lot of electrons (from 3d and 4s
subshells) which can be used for metallic bonding.
Atomic Radii
agents. E.g :
maximum oxidation state increases from Sc to Mn and decreases from Mn to Zn due to decrease in num. of single electrons in the 3d subshell and the 4s electrons.
First ionisation energy
There is little change in the first ionisation energy of transition elements from Ti to Cu. This is because : a) the atomic radii remains almost constant. b) the attractive forces on the outer electrons remains almost constant.
Sc3+ :
Sc3+ ion has no d electrons
Zn2+ :
Zn has full 3d subshell
They have very similar physical and chemical properties.
Metals with high melting and boiling point. High densities.
Due to strong metallic bonds. Transition elements have a lot of electrons (from 3d and 4s
subshells) which can be used for metallic bonding.
Atomic Radii
agents. E.g :
maximum oxidation state increases from Sc to Mn and decreases from Mn to Zn due to decrease in num. of single electrons in the 3d subshell and the 4s electrons.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
配合物的化学组成相同,而配体在空间的 排列位置不同而产生异构现象称为的立体异 构。立体异构又称为空间异构。立体异构又分 为几何异构和旋光(对映)异构两类。
1.几何异构
几何异构中最常见是顺反异构。 如四配位的MA2B2四边形和六配位的MA2B4 八面体中,均存在顺反异构现象。
例:平面四边形配合物[PtCl2(NH3)2]
第10章过渡金属元 素
第10章 过渡金属元素
10.1 配合物的结构和异构现象 10.2 配合物的价键理论 10.3 配合物的晶体场理论 10.4 3d过渡金属 10.5 4d和5d过渡金属
10.1 配合物的结构和异构现象
10.1.1 配合物的空间构型 10.1.2 配合物的异构现象
10.1.1 配合物的空间构型
过渡金属配合物的常见空间构型
配位 中心原子轨 空间构 结构示 数 道杂化类型 型 意图
实例
2spLeabharlann 直线型[Ag(NH3)2]+ [Cu(NH3)2]+
3
sp2
平面三 角形
[CuCl3]2-, [HgI3]-
4
sp3
四面体
[CoCl4]2-,
[Ni(CO)4], [Zn(CN)4]2-
平面正
4
dsp2
如卤素、氧等配位原子电负性较高,不 易给出孤对电子,它们倾向于占据中心体 的最外层轨道,易形成外轨型配合物。如 [FeF6]3-。
2.内轨型配合物
中心体使用内层的(n-1)d空轨道参加杂化 所形成的配合物称为内轨型配合物。
方形
5
dsp3
三角双 锥
5
d2sp2 正方锥
(d4s)
形
6
d2sp3 正八面
(sp3d2)
体
[Pt(NH3)2Cl2] [PtCl4]2-
[Ni(CN)4]2-
Fe(CO)5 [CuCl5]2[Cu(bipy)2I]+
[Co(CN)5]3− [TiF5]2-(d4s)
[Fe(CN)6]4[PtCl6]2-
例:
[NiCl4]2−
[NiCl4]2−的空间构型是正四面体;
[Ni(CN)4]2-
[Ni(CN)4]2-的空间构型呈平面正方形。
10.2.3 外轨型(高自旋)和内轨型(低自旋)配合物
1.外轨型配合物
中心离子的电子结构不发生变化,仅用外 层的空轨道ns,np,nd进行杂化生成能量相 同,数目相等的杂化轨道与配体结合。
否则为逆(抗)磁性。磁性可用磁矩来描述。
磁 矩: n(n2) (B.M.)玻尔磁子
n —— 未成对电子数
n 01 2 3 4 5 µ/B.M. 0 1.73 2.83 3.87 4.90 5.92 例:[Ti(H2O)6]3+ Ti3+:3d1 µ=1.73 n=1
K3[Mn(CN)6] Mn3+:3d4 µ=3.18 n=2 K3[Fe(CN)6] Fe3+: 3d5 µ=2.40 n=1
配体异构:
例:组成为CrCl3·6H2O的配合物有三种结 构异构体:
[Cr(H2O)6]Cl3(紫色) [CrCl(H2O)5]Cl2·H2O(灰绿色) [CrCl2(H2O)4]Cl·2H2O(深绿色) 键合异构:
[Fe(SCN)]2+ (硫氰酸铁) [Fe(NCS)]2+ (异硫氰酸铁)
10.1.2.2 立体异构
配合物的空间构型: 把围绕中心原子的配位原子看作点,并以
线(注意并非实际存在的共价键)连接各点, 得到的多面体就称为配位多面体。通常用配位 多面体用来描述配合物的空间构型。
配合物分子或离子因配位数的不同,为了 形成稳定的结构,采取一定的空间构型。所以 配合物分子或离子的空间构型与配位数的多少 密切相关。
例:八面体配合物[Cr(NH3)2(H2O)2Br2]+
例:顺-[CoCl2(en)2]+
动植物体内含有许多具有旋光活性的有机 化合物,这类配合物对映体在生物体内的生理 功能有极大的差异。例如存在于烟草中左旋尼 古丁的毒性要比人工合成出来的右旋尼古丁毒 性大的多。旋光异构体的拆分及合成研究是目 前研究热点之一。
10.2 配合物的价键理论
10.2.1 基本要点 10.2.2 中心原子轨道杂化类型
与配合物的磁性
10.2.3 外轨型(高自旋)和内轨型 (低自旋)配合物
10.2.4 价键理论的局限性
10.2.1 基本要点
(1)中心原子以空轨道接受配体的孤对电 子,形成配键键。即ML共价键。
(2)中心原子能量相近的价层空轨道进行 杂化,形成具有一定空间伸展方向的、能量相 同的杂化轨道,每一个空的杂化轨道接受配位 原子的一对孤对电子形成配位键。
[Co(NH3)6]3+ [Mn(H2O)6]2+
10.1.2 配合物的异构现象
配合物的组成相同而结构不同的现象称为 配合物的异构现象,组成相同而结构不同的配 合物称为异构体。常见的异构现象有结构异构 和立体(或空间)异构两种。
10.1.2.1 结构异构
结构异构又称为构造异构。如配合物内外 界分配不同,或键合异构等。这类异构体通常 在物理和化学性质上均差异很大。
PtCl2(NH3)2(顺式)
偶极矩≠0
PtCl2(NH3)2(反式) 偶极矩=0
平面正方形配合物的几何异构体的数目
类型
MA1B3 MA2B2 MABC2 MABCD
异构体数目 1
2
2
3
例: 八面体配合物[CoCl2(NH3)4]
[CoCl2(NH3)4] 顺式
[CoCl2(NH3)4] 反式
正八面体配合物几何异构体的数目
类型
MA5B MA4B2 MA3B3 MA3B2C MA2B2C2
异构体数目 1
2
2
3
5
面式-[Co(NH3)3(NO2)3]
经式-[Co(NH3)3(NO2)3]
2. 对映异构
对映异构又称旋光异构或手性异构,是指 两种异构体的对称关系类似于人的左手和右 手,互成镜像关系。
一对旋光异构体的熔点、折光率、溶解 度、热力学稳定性等都几乎没有差别,但却 可使平面偏振光发生方向相反的偏转,其中 一种称为右旋旋光异构体(用符号D表示),另 一种称为左旋旋光异构体(用符号L表示)。
(3)中心原子杂化轨道的伸展方向决定了 配位键的方向,也就决定了配合物的空间构型。
10.2.2 中心原子轨道杂化类型与配合物的磁性
1.杂化轨道和空间构型
sp sp2 sp3
dsp 2 sp2d dsp 3 d3sp d2sp2 d4s
sp3d2 d2sp3
d4sp
d3sp3
2 配合物的磁性 配合物中存在未成对电子时表现顺磁性,
1.几何异构
几何异构中最常见是顺反异构。 如四配位的MA2B2四边形和六配位的MA2B4 八面体中,均存在顺反异构现象。
例:平面四边形配合物[PtCl2(NH3)2]
第10章过渡金属元 素
第10章 过渡金属元素
10.1 配合物的结构和异构现象 10.2 配合物的价键理论 10.3 配合物的晶体场理论 10.4 3d过渡金属 10.5 4d和5d过渡金属
10.1 配合物的结构和异构现象
10.1.1 配合物的空间构型 10.1.2 配合物的异构现象
10.1.1 配合物的空间构型
过渡金属配合物的常见空间构型
配位 中心原子轨 空间构 结构示 数 道杂化类型 型 意图
实例
2spLeabharlann 直线型[Ag(NH3)2]+ [Cu(NH3)2]+
3
sp2
平面三 角形
[CuCl3]2-, [HgI3]-
4
sp3
四面体
[CoCl4]2-,
[Ni(CO)4], [Zn(CN)4]2-
平面正
4
dsp2
如卤素、氧等配位原子电负性较高,不 易给出孤对电子,它们倾向于占据中心体 的最外层轨道,易形成外轨型配合物。如 [FeF6]3-。
2.内轨型配合物
中心体使用内层的(n-1)d空轨道参加杂化 所形成的配合物称为内轨型配合物。
方形
5
dsp3
三角双 锥
5
d2sp2 正方锥
(d4s)
形
6
d2sp3 正八面
(sp3d2)
体
[Pt(NH3)2Cl2] [PtCl4]2-
[Ni(CN)4]2-
Fe(CO)5 [CuCl5]2[Cu(bipy)2I]+
[Co(CN)5]3− [TiF5]2-(d4s)
[Fe(CN)6]4[PtCl6]2-
例:
[NiCl4]2−
[NiCl4]2−的空间构型是正四面体;
[Ni(CN)4]2-
[Ni(CN)4]2-的空间构型呈平面正方形。
10.2.3 外轨型(高自旋)和内轨型(低自旋)配合物
1.外轨型配合物
中心离子的电子结构不发生变化,仅用外 层的空轨道ns,np,nd进行杂化生成能量相 同,数目相等的杂化轨道与配体结合。
否则为逆(抗)磁性。磁性可用磁矩来描述。
磁 矩: n(n2) (B.M.)玻尔磁子
n —— 未成对电子数
n 01 2 3 4 5 µ/B.M. 0 1.73 2.83 3.87 4.90 5.92 例:[Ti(H2O)6]3+ Ti3+:3d1 µ=1.73 n=1
K3[Mn(CN)6] Mn3+:3d4 µ=3.18 n=2 K3[Fe(CN)6] Fe3+: 3d5 µ=2.40 n=1
配体异构:
例:组成为CrCl3·6H2O的配合物有三种结 构异构体:
[Cr(H2O)6]Cl3(紫色) [CrCl(H2O)5]Cl2·H2O(灰绿色) [CrCl2(H2O)4]Cl·2H2O(深绿色) 键合异构:
[Fe(SCN)]2+ (硫氰酸铁) [Fe(NCS)]2+ (异硫氰酸铁)
10.1.2.2 立体异构
配合物的空间构型: 把围绕中心原子的配位原子看作点,并以
线(注意并非实际存在的共价键)连接各点, 得到的多面体就称为配位多面体。通常用配位 多面体用来描述配合物的空间构型。
配合物分子或离子因配位数的不同,为了 形成稳定的结构,采取一定的空间构型。所以 配合物分子或离子的空间构型与配位数的多少 密切相关。
例:八面体配合物[Cr(NH3)2(H2O)2Br2]+
例:顺-[CoCl2(en)2]+
动植物体内含有许多具有旋光活性的有机 化合物,这类配合物对映体在生物体内的生理 功能有极大的差异。例如存在于烟草中左旋尼 古丁的毒性要比人工合成出来的右旋尼古丁毒 性大的多。旋光异构体的拆分及合成研究是目 前研究热点之一。
10.2 配合物的价键理论
10.2.1 基本要点 10.2.2 中心原子轨道杂化类型
与配合物的磁性
10.2.3 外轨型(高自旋)和内轨型 (低自旋)配合物
10.2.4 价键理论的局限性
10.2.1 基本要点
(1)中心原子以空轨道接受配体的孤对电 子,形成配键键。即ML共价键。
(2)中心原子能量相近的价层空轨道进行 杂化,形成具有一定空间伸展方向的、能量相 同的杂化轨道,每一个空的杂化轨道接受配位 原子的一对孤对电子形成配位键。
[Co(NH3)6]3+ [Mn(H2O)6]2+
10.1.2 配合物的异构现象
配合物的组成相同而结构不同的现象称为 配合物的异构现象,组成相同而结构不同的配 合物称为异构体。常见的异构现象有结构异构 和立体(或空间)异构两种。
10.1.2.1 结构异构
结构异构又称为构造异构。如配合物内外 界分配不同,或键合异构等。这类异构体通常 在物理和化学性质上均差异很大。
PtCl2(NH3)2(顺式)
偶极矩≠0
PtCl2(NH3)2(反式) 偶极矩=0
平面正方形配合物的几何异构体的数目
类型
MA1B3 MA2B2 MABC2 MABCD
异构体数目 1
2
2
3
例: 八面体配合物[CoCl2(NH3)4]
[CoCl2(NH3)4] 顺式
[CoCl2(NH3)4] 反式
正八面体配合物几何异构体的数目
类型
MA5B MA4B2 MA3B3 MA3B2C MA2B2C2
异构体数目 1
2
2
3
5
面式-[Co(NH3)3(NO2)3]
经式-[Co(NH3)3(NO2)3]
2. 对映异构
对映异构又称旋光异构或手性异构,是指 两种异构体的对称关系类似于人的左手和右 手,互成镜像关系。
一对旋光异构体的熔点、折光率、溶解 度、热力学稳定性等都几乎没有差别,但却 可使平面偏振光发生方向相反的偏转,其中 一种称为右旋旋光异构体(用符号D表示),另 一种称为左旋旋光异构体(用符号L表示)。
(3)中心原子杂化轨道的伸展方向决定了 配位键的方向,也就决定了配合物的空间构型。
10.2.2 中心原子轨道杂化类型与配合物的磁性
1.杂化轨道和空间构型
sp sp2 sp3
dsp 2 sp2d dsp 3 d3sp d2sp2 d4s
sp3d2 d2sp3
d4sp
d3sp3
2 配合物的磁性 配合物中存在未成对电子时表现顺磁性,
