循环伏安法在测定电极反应性质方面的应用
循环伏安法判断电极过程实验报告

循环伏安法判断电极过程实验报告循环伏安法判断电极过程实验报告引言:循环伏安法是一种常用的电化学测试方法,用于研究电极材料的电化学行为。
本实验旨在通过循环伏安法测定电极材料的氧化还原反应特性,并分析实验结果,探讨其在电化学领域的应用前景。
实验材料与方法:实验所用材料为铂电极和铜电极,实验仪器为循环伏安仪。
首先,将铂电极和铜电极分别清洗并抛光,以确保电极表面的纯净度和光滑度。
然后,将电极插入电解质溶液中,并设置循环伏安仪的扫描速度和电位范围。
接下来,进行循环伏安法测试,记录电流与电位之间的关系曲线。
实验结果与分析:通过循环伏安法测试,我们得到了铂电极和铜电极的电流-电位曲线。
根据曲线的形状和特点,我们可以得到以下结论和分析:1. 铂电极的电流-电位曲线呈现出典型的双电极峰形状,其中一个峰对应氧化反应,另一个峰对应还原反应。
这说明铂电极在测试条件下发生了氧化还原反应,具有良好的电化学活性。
这一特性使得铂电极在催化剂、电池等领域有着广泛的应用前景。
2. 铜电极的电流-电位曲线呈现出单峰形状,没有出现双电极峰。
这说明铜电极在测试条件下只发生了一种氧化还原反应,具有较低的电化学活性。
然而,铜电极在电化学合成、电镀等领域仍然有着重要的应用,其特殊的电化学行为可以被利用。
3. 通过对电流-电位曲线的分析,我们可以得到电极反应的动力学参数,如峰电位、峰电流等。
这些参数可以进一步用于计算电极的表面积、电荷转移速率等重要参数,为电极材料的性能评价提供参考。
结论:本实验通过循环伏安法测试了铂电极和铜电极的电流-电位曲线,并对实验结果进行了分析。
通过曲线的形状和特征,我们可以了解电极材料的氧化还原反应特性和电化学活性。
这对于电化学领域的研究和应用具有重要意义。
循环伏安法作为一种常用的电化学测试方法,具有广泛的应用前景,可以用于研究各种电极材料的性能,并为相关领域的发展提供支持。
总结:循环伏安法是一种重要的电化学测试方法,通过测定电流-电位曲线,可以研究电极材料的氧化还原反应特性和电化学活性。
实验10循环伏安法测定电极反应参数

实验10 循环伏安法测定电极反应参数一、实验目的(1)了解循环伏安法的基本原理、特点和应用。
(2)掌握循环伏安法的实验技术和有关参数的测定方法。
二、实验原理(1)循环伏安法是电化学分析中重要的一种分析方法。
在电化学分析中,凡是以测量电解过程的电流-电位(电压)曲线为目的,都称为伏安分析法。
按施加激励信号的方式、波形及种类的不同,伏安法又分为多种技术,其中线性扫描伏安法,是在工作电极和对电极上施加一随时间线性变化的直流电压(图1),并记录相应的电流-电势曲线(图2)。
线性电位扫描法分小幅度运用和大幅度运用两类。
小幅度运用一般用于测定双电层电容和反应电阻。
大幅度运用的电位扫描范围宽,可在感兴趣的整个范围进行,所以使用的范围较广,如测定电极参数,判断电极过程的可逆性/控制步骤/反应机理,研究电极的吸(脱)附现象等。
图1 图2循环伏安法就是将线性扫描电位扫到某电位E m后,再回扫至原来的起始电位值E i,电位与时间的关系如图3所示。
电压扫描速度可从每秒毫伏到伏量级。
所用的指示电极有悬汞电极、铂电极或玻璃碳电极等。
主要用于研究电极反应的性质、机理和电极过程动力学参数等。
图3 图4当溶液中存在氧化态物质O 时,它在电极上可逆地还原生成还原态物质R ,O + ne → R当电位方向逆转时,在电极表面生成的R 则被可逆地氧化为O,R → O + ne一个三角波扫描,可以完成还原与氧化两个过程,记录出如图4所示的循环伏安曲线。
在循环伏安法中,阳极峰电流i P a 、阴极峰电流i P c 、阳极峰电位E pa 、阴极峰电位E P c 是最重要的参数,对可逆电极过程来说, 峰电位不随扫描速度变化,且 5763E E E mV n∆=pa pc -= (1) 即阳极峰电势(E pa )与阴极峰电势(E pc )之差为57/n 至63/n mV 之间,确切的值与扫描过阴极峰电势之后多少毫伏再回扫有关。
一般在过阴极峰电势之后有足够的毫伏数再回扫,△E P 值为58/n mV 。
循环伏安法测定电极反应参数教案设计

循环伏安法测定电极反应参数-教案设计一、教学目标:1. 理解循环伏安法的原理及其在电化学分析中的应用。
2. 学会使用循环伏安法测定电极反应参数。
3. 能够分析循环伏安图,并解读实验结果。
二、教学内容:1. 循环伏安法的原理介绍。
2. 循环伏安法实验步骤及操作方法。
3. 循环伏安图的解析与实验结果分析。
三、教学准备:1. 实验室用具:循环伏安仪、电极、电解质溶液、导线等。
2. 教学材料:教案、PPT、实验指导书等。
四、教学过程:1. 导入:通过引入电化学分析法,引导学生了解循环伏安法在电化学分析中的应用。
2. 讲解循环伏安法的原理,包括法拉第电解定律、电极反应等基本概念。
3. 演示循环伏安法的实验步骤,并讲解操作方法。
4. 分组讨论:学生分组进行实验,观察并记录循环伏安图。
5. 解析循环伏安图,引导学生掌握图谱的解读方法。
6. 总结实验结果,分析电极反应参数。
五、教学评价:1. 学生能理解循环伏安法的原理及其应用。
2. 学生能熟练操作循环伏安仪,完成实验并记录数据。
3. 学生能分析循环伏安图,并正确解读实验结果。
4. 学生能运用所学知识,解决实际问题。
六、教学重点与难点:重点:1. 循环伏安法的原理及其在电化学分析中的应用。
2. 循环伏安法实验步骤及操作方法。
3. 循环伏安图的解析与实验结果分析。
难点:1. 循环伏安图的解析与实验结果分析。
2. 电极反应参数的确定与计算。
七、教学方法:1. 采用讲授法讲解循环伏安法的原理和实验操作方法。
2. 使用演示法展示实验过程,引导学生观察循环伏安图。
3. 分组讨论法:学生分组进行实验,交流讨论实验现象和结果。
4. 案例分析法:分析实际案例,帮助学生理解循环伏安法在实际应用中的重要性。
八、教学步骤:1. 循环伏安法的原理讲解:通过PPT展示循环伏安法的原理和相关概念。
2. 实验操作演示:演示循环伏安法的实验步骤,包括溶液准备、电极安装、仪器设置等。
3. 学生实验操作:学生分组进行实验,操作循环伏安仪,观察并记录循环伏安图。
循环伏安法及应用

循环伏安法及应用电池反应实际上是一个氧化还原反应。
反应粒子在电极表面上进行的氧化(失去电子)反应叫阳极反应;相应的还原(获得电子)反应叫阴极反应。
电极电位可表示氧化还原反应的难易程度。
由左图可知,电极反应速度一般由以下几个因素来控制:(1)物质传递;(2)吸附与脱附过程;(3)电子传递过程电极表面电化学反应示意图电荷移动速度k和物质传输速度m对电流电位曲线的影响反应慢,具有足够的传输能力为了使反应加速必须加电压反应快,受到传输能力限制为了增加传输能力必须增加反应物浓度或进行搅拌循环伏安法三角波电位进行扫描,所获得的电流响应与电位信号的关系,称为循环伏安扫描曲线。
开始扫描,工作电极电位电位不断变负,物质在负极还原;反向扫描时,物质在电极发生氧化反应。
因此,在一个三角波扫描中可完成个还原氧化过程的循环。
原理:在电极上施加一个线性扫描电压,以恒定的变化速度扫描,当达到某设定的终止电位时,再反向回归至某一设定的起始电位,循环伏安法电位与时间的关系(见图)循环伏安法若电极反应为O+e→R,反应前溶液中只含有反应粒子O、且O、R在溶液均可溶,控制扫描起始电势从比体系标准平衡电势正得多的起始电势φ处开始势作正向电扫描,电流响i应曲线则如右图所示。
当电极电势逐渐负移到φ0附近时,O开始在电极上还原,并有法拉第电流通过。
平由于电势越来越负,电极表面反应物O的浓度逐渐下降,因此向电极表面的流量和电,然后电流逐渐下流就增加。
当O的表面浓度下降到近于零,电流也增加到最大值Ipc降。
当电势达到φ后,又改为反向扫描。
r随着电极电势逐渐变正,电极附近可氧化的R粒子的浓度较大,在电势接近并通时,表面上的电化学平衡应当向着越来越有利于生成O的方向发展。
于是R开过φ0平,随后又由于R的显著消耗而引起电流衰始被氧化,并且电流增大到峰值氧化电流Ipa降。
整个曲线称为“循环伏安曲线”。
循环伏安法的特征1、Ipc 与反应物O的本体浓度成正比,与扫描速率v的平方根(即v1/2)成正比。
循环伏安法测定电极反应

循环伏安法测定电极反应一、实验目的1、学习循环伏安法测定电极反应的基本原理和方法。
2、熟悉电化学工作站的使用并根据所测数据验证并判断电极反应是否是可逆反应。
二、实验原理伏安分析法是在一定电位下测量体系的电流,得到伏安特性曲线。
根据伏安特性曲线进行定性定量分析。
循环伏安法是将对称的三角波扫描电压(如图一)施加于电解池的电极上,记录工作电极上的电流随电压变化的曲线。
在三角波的前半部分,电极上若发生还原反应(阴极过程),得到一个峰形的阴极波;而在三角波的后半部分,则得到一个峰形的阳极波。
一次三角波电压扫描,电极上完成一个氧化还原循环。
当工作电极被施加的扫描电压激发时,其上将产生响应电流。
以该电流(纵坐标)对电位(横坐标)做图,就得到了循环伏安图(如图二所示)。
图一图二E pc、E pa分别为阴极峰值电位与阳极峰值电位。
i pc、i pa分别为阴极峰值电流与阳极峰值电流。
这里p代表峰值,a代表阳极,c代表阴极。
[Fe(CN)6]3--[Fe(CN)6]4-体系氧化还原电对的标准电极电位为:[Fe(CN)6]3- + e- = [Fe(CN)6]4-φθ= 0.36V电极电位与电极表面活度的Nernst方程式为:φ=φθ+ nRT/Fln(αOx/αRed)。
若已知γ为活度系数,则αOx=γ•C Ox,αRed=γ•C Red。
在实验中,通常采用添加离子调节液(如KNO3溶液、Na2SO4溶液等)的方法来固定离子强度,此时γ可视为定值,则φ=φθ+ nRT/Fln(C Ox/C Red)。
用循环伏安法正扫时(由正向负的扫描)为阴极扫描,产生还原电流:Fe(CN)63- + e- = Fe(CN)64-反扫时(由负向正的扫描)为阳极扫描,产生氧化电流:Fe(CN)64- - e- = Fe(CN)63-两峰之间的电位差值为:(1)对于一个体系,循环伏安图中的阴极峰电流是由电极上吸附反应物的还原和溶液中反应物扩散到电极表面还原两部分组成。
实验二-循环伏安法测定电极反应参数
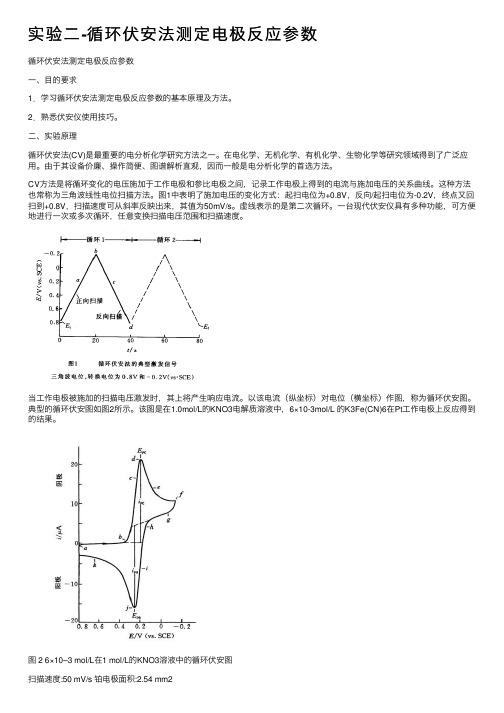
实验⼆-循环伏安法测定电极反应参数循环伏安法测定电极反应参数⼀、⽬的要求1.学习循环伏安法测定电极反应参数的基本原理及⽅法。
2.熟悉伏安仪使⽤技巧。
⼆、实验原理循环伏安法(CV)是最重要的电分析化学研究⽅法之⼀。
在电化学、⽆机化学、有机化学、⽣物化学等研究领域得到了⼴泛应⽤。
由于其设备价廉、操作简便、图谱解析直观,因⽽⼀般是电分析化学的⾸选⽅法。
CV⽅法是将循环变化的电压施加于⼯作电极和参⽐电极之间,记录⼯作电极上得到的电流与施加电压的关系曲线。
这种⽅法也常称为三⾓波线性电位扫描⽅法。
图1中表明了施加电压的变化⽅式:起扫电位为+0.8V,反向/起扫电位为-0.2V,终点⼜回扫到+0.8V,扫描速度可从斜率反映出来,其值为50mV/s。
虚线表⽰的是第⼆次循环。
⼀台现代伏安仪具有多种功能,可⽅便地进⾏⼀次或多次循环,任意变换扫描电压范围和扫描速度。
当⼯作电极被施加的扫描电压激发时,其上将产⽣响应电流。
以该电流(纵坐标)对电位(横坐标)作图,称为循环伏安图。
典型的循环伏安图如图2所⽰。
该图是在1.0mol/L的KNO3电解质溶液中,6×10-3mol/L 的K3Fe(CN)6在Pt⼯作电极上反应得到的结果。
图 2 6×10–3 mol/L在1 mol/L的KNO3溶液中的循环伏安图扫描速度:50 mV/s 铂电极⾯积:2.54 mm2从图可见,起始电位E i为+0.8V(a点),电位⽐较正的⽬的是为了避免电极接通后Fe(CN)63–发⽣电解。
然后沿负的电位扫描(如箭头所指⽅向),当电位⾄Fe(CN)63–可还原时,即析出电位,将产⽣阴极电流(b点)。
其电极反应为:Fe(III)(CN)63– + e–——?Fe(II)(CN)64–随着电位的变负,阴极电流迅速增加(b g d),直⾄电极表⾯的Fe(CN)63-浓度趋近零,电流在d点达到最⾼峰。
然后迅速衰减(d g g),这是因为电极表⾯附近溶液中的Fe(CN)63-⼏乎全部因电解转变为Fe(CN)64-⽽耗尽,即所谓的贫乏效应。
简述循环伏安法实验技术的应用

简述循环伏安法实验技术的应用循环伏安法实验技术是一种重要的化学实验技术,它在研究化学反应、电化学过程和材料性能等方面有着广泛的应用。
本文将简述循环伏安法实验技术的原理、实验步骤、实验结果和分析以及实验总结等方面,以帮助读者更好地了解该实验技术的应用。
循环伏安法实验技术的原理是基于电池原理的。
在电池中,电流通过电极和电解质,电子从阳极流向阴极,从而使得化学反应得以发生。
而循环伏安法实验技术则是将电池中的化学反应进行逆转,即通过外加电压的方式使得电子从阴极流向阳极,从而使得化学反应得以在电极表面反复进行。
这种方法可以用来研究反应的动力学过程、测定反应速率常数以及研究电极表面上的吸附过程等。
设定测量条件。
需要设定扫描速度、扫描范围、温度和电解质浓度等条件。
这些条件的设定需要根据实验的具体需求进行调整。
选择合适的测试方法。
循环伏安法常用的测试方法有线性扫描伏安法、循环伏安法、阶梯伏安法等。
选择合适的测试方法对于获得准确的实验结果非常重要。
进行测量数据采集。
在实验过程中,需要实时记录电流随电压变化的数据,并确保数据采集的准确性和稳定性。
处理和分析。
对采集到的数据进行处理和分析,包括绘制伏安曲线、计算反应速率常数、分析反应机理等。
通过循环伏安法实验技术,可以获得反应过程中的电流-电压曲线,即伏安曲线。
通过对曲线的分析,可以得出反应动力学参数、电极表面吸附性质等相关信息。
例如,如果曲线中出现明显的氧化还原峰,说明电极表面发生了相应的化学反应;如果峰电流随扫描速度的增加而增加,则说明反应是扩散控制的;如果峰电流随扫描速度的增加而减小,则说明反应是动力学控制的。
还可以通过计算得出反应速率常数,并与已知文献值进行比较,以评估实验结果的准确性。
循环伏安法实验技术在研究化学反应、电化学过程和材料性能等方面有着广泛的应用,是一种非常有效的化学实验技术。
通过对实验结果的分析,可以得出反应动力学参数、电极表面吸附性质等相关信息,为进一步的研究提供可靠的依据。
循环伏安法测定电极反应参数

循环伏安法测定电极反应参数一目的要求1掌握用循环伏安法判断电极过程的可逆性。
2学会使用循环伏安仪。
3测量峰电流和峰电位。
二原理循环伏安法与单扫描极谱法相似。
在电极上施加线形扫描电压,当到达某设定的终止电压后,再反向回扫至某设定的起始电压,若溶液中存在氧化态O,电极上将发生还原反应:O+Ze == R反向回扫时,电极上生成的还原态R将发生氧化反应:R == O+Ze峰电流可表示为:ip=KZ3/2D1/2m2/3t2/3v1/2c其峰电流与被测物质浓度C、扫描速率v等因素有关。
从循环伏安图可确定氧化峰峰电流ipa 和还原峰峰电流ipc,氧化峰峰电位φpa 和还原峰峰电位φpc值。
对于可逆体系,氧化峰峰电流与还原峰峰电流比:1=pcpaii氧化峰峰电位与还原峰峰电位差:)(058.0Vzpcpa=-=∆ϕϕϕ条件电位φo’:2pcpaOϕϕϕ+='由此可判断电极过程的可逆性。
三仪器与试剂仪器 CHI660C 电化学工作站;x-y函数记录仪器;金属盘电极、铂圆盘电极或玻璃碳电极,铂丝电极和饱和甘汞电极。
试剂 1.00×10-2mol/L K3Fe(CN)6;1.0mol/L KNO3。
四实验步骤1金属圆盘电极(或铂圆盘电极、玻璃碳电极)的预处理。
用Al2O3粉(或牙膏)将电极表面抛光(或用抛光机处理),然后用蒸馏水清洗,待用。
也可用超声波处理。
2 K3Fe(CN)6溶液的循环伏安图在电解池中放入含0.1mol/LKNO3的铁氰化钾标准溶液,插入玻碳圆盘电极(或金圆盘)工作电极、铂丝辅助电极和饱和甘汞电极,通N2除O2。
打开CHI660C伏安仪和计算机的电源。
屏幕显示清楚后,再打开测量窗口;测量铁氰化钾试液:置电极系统于10ml小烧杯的铁氰化钾试液里;打开ESTUP 的下拉菜单,在Technique项中选择Cyclic voltammetry方法,在Parameters 项内选择参数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
循环伏安法在测定电极反应性质方面的应用聂凯斌(环境与化学工程学院应用化学ys1310202011)摘要:本文主要利用电化学工作站进行循环伏安法(Cyclic Voltammetry)在测定电极反应性质方面的应用的研究,循环伏安法是一种常用的电化学研究方法,该法控制电极电势以不同的速率,随时间以三角波形一次或多次反复扫描,电势范围是使电极上能交替发生不同的还原和氧化反应,并记录电流-电势曲线。
本文主要介绍循环伏安法的基本原理,以及通过循环伏安法,对电极反应进行电化学分析,根据曲线形状可以判断电极反应的可逆程度,中间体、相界吸附或新相形成的可能性,以及偶联化学反应的性质等。
常用来测量电极反应参数,判断其控制步骤和反应机理,并观察整个电势扫描范围内可发生哪些反应,及其性质如何。
对于一个新的电化学体系,首选的研究方法往往就是循环伏安法,可称之为“电化学的谱图”。
本法除了使用汞电极外,还可以用铂、金、玻璃碳、碳纤维微电极以及化学修饰电极等。
关键词:循环伏安法,电极,可逆1 循环伏安法的基本原理及研究进展如以竿腰三角形的脉冲电压(如图1)加在工作电极上,得到的电流- 电压曲线包括两个分支,如果前半部分电位向阴极方向扫描,电活性物质在电极上还原,产生还原波,那么后半部分电位向阳极方向扫描时,还原产物又会重新在电极上氧化,产生氧化被。
因此一次三角波扫描,完成一个还原和氧化过程的循环,故该法称为循环伏安法,其电流一电压曲线称为循环伏安图(如图2)。
图1 三角波电压图2循环伏安极化曲线循环伏安法(Cyclic V oltammetry)一种常用的电化学研究方法。
该法控制电极电势以不同的速率,随时间以三角波形可以判断电极反应的可逆程度,中间体、相界吸附或新相形成的可能性,以及偶联化学反应的性质等。
常用来测量电极反应参数,判断其控制步骤和反应机理,并观察整个电势扫描范围内可发生哪些反应,及其性质如何。
对于一个新的电化学体系,首选的研究方法往往就是循环伏安法,可称之为“电化学的谱图”。
实验中使用的工作电极除了使用汞电极外,还可以用铂电极、金电极、玻璃电极、悬汞、汞膜电极、碳纤维微电极以及化学修饰电极等。
2 循环伏安法的运用2.1 循环伏安法分析系统的三电极体系①工作电极:指在测试过程中可引起试液中待测组分浓度明显变化的电极,又称研究电极,是指所研究的反应在该电极上发生。
一般来讲,对工作电极的基本要求是:工作电极可以是固体,也可以是液体,各式各样的能导电的固体材料均能用作电极。
(1)所研究的电化学反应不会因电极自身所发生的反应而受到影响,并且能够在较大的电位区域中进行测定;(2)电极必须不与溶剂或电解液组分发生反应;(3)电极面积不宜太大,电极表面最好应是均一平滑的,且能够通过简单的方法进行表面净化等等。
工作电极的选择:通常根据研究的性质来预先确定电极材料,但最普通的“惰性”固体电极材料是玻碳(铂、金、银、铅和导电玻璃)等。
采用固体电极时,为了保证实验的重现性,必须注意建立合适的电极预处理步骤,以保证氧化还原、表面形貌和不存在吸附杂质的可重现状态。
在液体电极中,汞和汞齐是最常用的工作电极,它们都是液体,都有可重现的均相表面,制备和保持清洁都较容易,同时电极上高的氢析出超电势提高了在负电位下的工作窗口记被广泛用于电化学分析中。
②辅助电极:又称对电极,辅助电极和工作电极组成回路,使工作电极上电流畅通,以保证所研究的反应在工作电极上发生,但必须无任何方式限制电池观测的响应。
由于工作电极发生氧化或还原反应时,辅助电极上可以安排为气体的析出反应或工作电极反应的逆反应,以使电解液组分不变,即辅助电极的性能一般不显著影响研究电极上的反应。
但减少辅助电极上的反应对工作电极干扰的最好办法可能是用烧结玻璃、多孔陶瓷或离子交换膜等来隔离两电极区的溶液。
辅助电极本身电阻要小,并且不容易极化,同时对其形状和位置也有要求。
③参比电极:是指一个已知电势的接近于理想不极化的电极。
参比电极上基本没有电流通过,用于测定研究电极(相对于参比电极)的电极电势。
在控制电位实验中,因为参比半电池保持固定的电势,因而加到电化学池上的电势的任何变化值直接表现在工作电极/电解质溶液的界面上。
实际上,参比电极起着既提供热力学参比,又将工作电极作为研究体系隔离的双重作用。
参比电极需要具备的一些性能:(1)具有较大的交换电流密度,是良好的可逆电极,其电极电势符合Nernst 方程;(2) 流过微小的电流时电极电势能迅速恢复原状;(3)应具有良好的电势稳定性和重现性等。
在测量过程中提供一个恒定的电极电位标准,常使用饱和甘汞电极或Ag/AgCl 电极:2.2 电极的可逆性的判断当工作电极被施加对称的三角波扫描电压激发时,其上将产生响应电流,以电流对电位作图为循环伏安图。
氧化峰电流(i pa ) 氧化峰电位(E pa )还原峰电流(i pc ) 还原峰电位(E pc )对于可逆电极过程: R O c c Ln E E nF RT +=θ循环伏安图上可逆电极过程的峰电位与标准电极电位(E0),有如下的关系:nFRT 1.1E E pc -=θ (1) nF RT 1.1E E pa +=θ (2) (1)+(2)得:2/E E E pc pa )(+=θ (3)可见对于可逆电极过程,用循环伏安法测定条件电极电位是很方便的。
对于不可逆电极过程,(3)式不适用 。
(1)-(2)得:mV n58nF RT 2.2E E E pc pa ==-=∆ (4) 式(4)是判断电极过程可逆性程度的重要指标之一,△Ep 的理论值为58/n (mV ),这是可逆体系的循环伏安曲线所具有的特征值。
应该指出,△Ep 的确切值与扫描过阴极峰电位之后多少毫伏再回扫有关,一般在57/n (mV )--63n/(mV )之间。
也可根据循环伏安图由式(4)估测电极反应的电子转移数,帮助判断电极反应机理。
对于可逆电极过程,阴极和阳极峰的峰电流公式相同,如下:i p =2.69×105n 3/2AD 1/2v 1/2c (5)i pa / i pc =1 (6)式(6)是判别电极反应是否可逆体系的另一重要指标。
由式(5)可知:ip 与c 呈正比,因此循环伏安法也可用于定量分析。
ip 与A 呈正比,可根据已知可逆体系循环伏安图上的峰电流测定工作电极的有效面积。
2.3 循环伏安法在其他方面的运用2.3.1 定量分析方面的运用在循环伏安实验中,某物质在电极上具有明显的氧化峰电流,而且在一定浓度范围内,某物质的氧化峰电流与其浓度呈线性关系。
则可以跟据该物质在某一氧化峰电流,由线性关系反推出该物质的浓度,从而计算出该物质的含量。
此方法一般是用于微量分析。
目前,利用循环伏安法进行定量分析主要用于药物的成分分析上,如姚程炜等[2]在pH=8.0 NH 4Cl- NH 3·H 2O 的缓冲溶液中,采用循环伏安法测定中药葛根中葛根素的含量;包晓玉等[3]在pH=1.8的B-R 缓冲溶液中,采用循环伏安法测定抗菌药物磺胺嘧啶的含量;崔书亚等[4]在pH=3.5的HCI 一柠檬酸钠缓冲液中,采用循环伏安法测定三黄片中黄芩苷的含量;许秀琴等[5]在pH=8.0 NH4Cl- NH 3·H 2O 的缓冲液中,采用循环伏安法测定维生素B 6 药片中VB 6 的含量。
2.3.2 电极的制备实验技术手段的发展也体现在循环伏安法在电极制备方面的应用。
如过家好等[6]采用循环伏安法成功制备了Pt -Sn/GC 电极,并用电化学方法研究了Pt -Sn/GC 电极对乙醇的电催化氧化。
屈耀辉,高立军[7]在Pb(NO 3)2和HNO 3的混合电镀液中,采用循环伏安法成功在石墨板基底上沉积PbO 2薄膜电极,而且此法制备的石墨基PbO 2电极在超级电容中具有很好的电化学性能。
3 展望循环伏安法中电压的扫描过程包括阴极与阳极两个方向,因此从所得的循环伏安法图的氧化波和还原波的峰高和对称性中可判断电活性物质在电极表面反应的可逆程度。
若反应是可逆的,则曲线上下对称,若反应不可逆,则曲线上下不对称。
电极反应机理的判断循环伏安法还可研究电极吸附现象、电化学反应产物、电化学—化学耦联反应等,对于有机物、金属有机化合物及生物物质的氧化还原机理研究很有用。
循环伏安法作为一种常用的电化学实验方法,其应用方面的发展是迅速的,其应用领域也在不断拓展。
例如其在定量分析方面的应用,一经成功便迅速发展到各个领域。
相信循环伏安法在以后的科研工作中将会发挥更大的作用。
参考文献[1] 刘约权,等. 现代仪器分析<第二版> 高等教育出版社2005[2] 姚程炜,任小敏,严正雄,等. 葛根素的循环伏安测定及其电化学行为研究[J]. 分析测试技术与仪器,2010,16(2):97-99[3] 包晓玉,曹书杰,陈欣,等. 循环伏安法测定磺胺嘧啶[J]. 应用化学,2006,23(8):858-861[4] 崔书亚,黄铱泠. 循环伏安法测定三黄片中黄芩苷的含量[J]. 绵阳师范学院学报,2008,27(11):48-50[5] 许秀琴,蔡铎昌,邹如意,等. 循环伏安法测定维B6[J]. 应用化学,2004,21 (10) :1016-1019[6] 过家好,黄国强,何晓英. Pt、Sn 催化剂的电化学制备及催化性能研究[J]. 安徽科技学院学报,2011,25( 5) : 47 - 51[7] 屈耀辉,高立军. 循环伏安法沉积石墨基PbO2 电极及其超级电容器应用[J]. 南昌大学学报(理科版),2011, 35(2)。
