1,3-偶极环加成反应
1,3一偶极环加成反应在叠氮推进剂中的应用

周环反应有电环化反应,环加成反应,和σ 移位反应。而其中的 环加成反应又分为[2+1]环加成,[2+2]环加成,[4+1]环加成。1,3偶极加成和[4+2]环加成即Diels-Alder反应。 本文主要介绍1,3一偶极环加成反应的基础上,综述了该反应在 聚叠氮基缩水甘油醚(GAP)侧基改性、叠氮化合物固化以及在GAP推进 剂中的应用情况。
含有叠氮侧基的聚醚粘合剂可以与含有乙炔基的化合物 通过环加成反应形成三唑粘合剂。在铜催化剂的作用下, 通过环加成反应形成三唑粘合剂。在铜催化剂的作用下,这种 反应简单且非常有效,直接使用GAP可以合成一系列的1 GAP可以合成一系列的 反应简单且非常有效,直接使用GAP可以合成一系列的1,2,3 一三唑基缩水甘油聚合物及衍生物。 一三唑基缩水甘油聚合物及衍生物。
[3+2]环加成(1,3-偶极环加成)中常见1,3-偶极体
R
C N O 腈氧化物
+
-
R
N NR' C 腈亚胺
+
-
R
N O CH2
+
-
N 氧化醛亚胺
1,3一偶极环加成反在叠氮推进剂中的应用
常用的含能叠氮黏合剂
叠氮粘合剂是侧链带有叠氮基团的含能预聚物,常用的含能粘合 剂有聚叠氮基缩水甘油醚(GAP)、双叠氮甲基氧杂丁烷聚醚(BAMO)和 叠氮甲基氧杂丁烷聚醚(AMMO)等。 这类粘合剂应用在推进剂中,能够提高推进剂的比冲和燃速,改善 温度敏感系数,是高能低特征信号、低易损性推进剂理想的含能粘合 剂。
对GAP高聚物叠氦侧基改性 高聚物叠氦侧基改性
尽管含能粘合剂GAP在能量性能方面具有优势, 尽管含能粘合剂GAP在能量性能方面具有优势,但在固体 GAP在能量性能方面具有优势 冲压发动机中,GAP推进剂在低压条件下的燃烧性能差 推进剂在低压条件下的燃烧性能差。 冲压发动机中,GAP推进剂在低压条件下的燃烧性能差。为了 改善燃烧性能, 改善燃烧性能,可以通过添加弹道改良剂或者燃速调节剂来改 变压强对GAP燃烧性能的影响,从而获得较好的燃烧性能。 GAP燃烧性能的影响 变压强对GAP燃烧性能的影响,从而获得较好的燃烧性能。
偶极环加成反应

1 背景介绍
2 各项反应
3
总结
BREAD PPT DESIGN
背景介 绍 1,3-偶极环加成反应(1,3-dipolar
cycloaddition)是发生在1,3-偶极体和烯烃、炔烃或 相应衍生物之间的环加成反应,产物是一个五元杂环化 合物。烯烃类化合物在反应中称亲偶极体。德国化学家 Rolf Huisgen首先广泛应用此类反应制取五元杂环化合 物,因此它也称为Huisgen反应。
BREAD PPT DESIGN
通过2-芳亚甲基-6,7-二氢-5H-噻唑并[3,2-a]嘧啶-3酮与靛红、肌氨酸的l,3-偶极环加成反应,合成了一系列新 的螺噻唑并嘧啶类化合物,以期为药物筛选提供先导化合物。
李筱芳 ,于贤勇 ,冯亚青1,3-偶极环加成反应合成螺噻唑并[3,2-a]嘧啶类化合物, 有机化学2010年第30卷第5期,735-739
BREAD PPT DESIGN
反应介 绍
通过1-苄基-3,5-双芳亚甲基哌啶-4-酮与靛 红、脯氨酸的1,3-偶极环加成反应,合成了一系 列新的螺哌啶-六氢吡嗪类化合物。
令玉林,刘彬,李筱芳,于贤勇,易平贵 1,3一偶极环加成反应合成螺哌啶 一六氢吡嗪
类化合物 中图分类号:062 文献标识码:A 文章编号:1672—9102(2010)04一0101-03
BREAD PPT DESIGN
在氧化剂存在下吡啶叶立德与查尔酮进行1,3-偶 极环加成反应,一锅法合成2-苯基-3-乙酰基中氮茚, 以及用类似的一锅法合成1-苯甲酰基-2-苯基-3-乙酰基 吡咯并[2,I-a]异喹啉化合物。
王炳祥,徐助雄,吴婧 吡啶叶立德与查尔酮1,3.1偶极环加成反应制备2-苯基-3乙酰基中氮茚 有机化学 2006年第26卷第11期,1587~1589
化学反应列表含简介及链接(最全)

Allan-Loudon喹啉合成 (Allan-Loudon quinoline synthesis)Allan-Robinson反应 (Allan-Robinson reaction)邻羟基芳酮与芳香酸酐作用环合生成黄酮或异黄酮。
Allen反应 (Allen reaction)Allen-Millar-Mathey重排反应 (Allen-Millar-Mathey rearrangement)Alper羰基化反应 (Alper carbonylation)van Alphen-Hüttel吡唑重排反应 (van Alphen-Hüttel pyrazole rearrangement)Amadori重排反应 (Amadori rearrangement)N-取代的醛糖胺转变成1-氨基-1-去氧-2-酮糖的同分异构反应。
Anderson-Fuchs反应 (Anderson-Fuchs reaction)Ando扁桃酸合成 (Ando mandelic acid synthesis)Andreasch噻唑合成 (Andreasch thiazole synthesis)Andrussov氧化反应 (Andrussov oxidation)Anelli氧化反应 (Anelli oxidation)Angeli呋咱氧化物重排反应 (Angeli furazan oxide rearrangement)Angeli-Rimini合成 (Angeli-Rimini synthesis)d'Angelo不对称麦克尔加成反应 (d'Angelo's asymmetric Michael addition)Anschütz蒽合成 (Anschütz anthracene synthesis)Anschütz羟基香豆素合成 (Anschütz hydroxycoumarin synthesis)Anschütz-Scholl邻羟基苯乙酮合成 (Anschütz-Scholl hydroxyacetophenone synthesis)Appel反应 (Appel reaction)用三苯基膦和四氯化碳将醇转化为氯代烃。
手性配体金属络合物催化的1_3_偶极环加成反应讲解

秦伟艳等,手性配体金属络合物催化的1,3-偶极环加成反应Vol.27.No.4,2005・244・手性配体金属络合物催化的1,3-偶极环加成反应秦伟艳,刘波,由君(哈尔滨理工大学化学与环境工程学院,黑龙江哈尔滨150080)摘要:综述了手性配体金属络合物催化剂催化1,3-偶极环加成反应的研究进展。
主要介绍了唑硼烷催化剂以及αα,,αα’,’-四芳基-1,3-二氧戊环-4,5-二甲醇、双唑啉、联萘二酚等手性配体的金属络合物在不同反应中的立体选择性。
关键词:1,3-偶极环加反应;不对称合成;立体选择性;手性配体;络合物中图分类号:TQ426192文献标识码:A文章编号:1001-0017(2005)04-0244-041,3-DipolarCycloadditionReactionsCatalyzedbyChiralLigandsMetalComplexes QINWei-yan,LIUBoandYOUJun (CollegeofChemicalandEnvironmentalEngineering,HarbinUniversityofScienceand,Harb in,H150080,China)Abstract:Theresearchadvancesofthechiralligandsmetalcomplexescatalysts1,3reactionsw erereviewedinthispaper.thecatalystsofoxazaborolidinoneaswellasthestereoselectiveityofplexes,,-tetraaryl-1,3-diox2alane-4,5-dimethanol(TADDOL),bisoxazoline,1,1-2-oKeywords:1,3-dipolar;;chiralligands;complexes前言1,3-偶极环加成反应是合成五元杂环化合物后,Murahash等人开始研究此类反应的不对称合成,但是不对称性是由底物的手性诱导的[2,3]。
1,3-偶极环加成反应产物构型的推定

1,3-偶极环加成反应产物构型的推定金杰;李菲菲;陈广美;刘瑾【摘要】1,3-偶极环加成反应有多种选择性,因此产物往往也是由多个异构体组成.天然产物青藤碱进行1,3-偶极环加成反应杂环化时,产物理论上有四个异构体,实验中只发现两个异构体.本文分析了青藤碱1,3-偶极环加成反应中的选择性,再根据产物的1H NMR、13C NMR、NOESY相关谱、电子效应、空间效应的分析,结合理论计算和软件模拟,最终确定了所得两种产物异构体-1和异构体-2的构型.本文的推定方法,在判定具有类似电子效应和空间效应的1,3-偶极环加成反应产物结构时,能起到一定的借鉴作用.【期刊名称】《安徽师范大学学报(自然科学版)》【年(卷),期】2013(036)005【总页数】4页(P466-469)【关键词】1,3-偶极环加成;异构体;构型;选择性;青藤碱【作者】金杰;李菲菲;陈广美;刘瑾【作者单位】安徽建筑大学材料与化学工程学院,安徽合肥230601;安徽建筑大学材料与化学工程学院,安徽合肥230601;安徽建筑大学材料与化学工程学院,安徽合肥230601;安徽建筑大学材料与化学工程学院,安徽合肥230601【正文语种】中文【中图分类】O626.21,3-偶极环加成反应是基于三原子4π电子偶极体系与亲偶极体的重键发生[3+2]加成,生成五元杂环(特别是五元含氮杂环)的一种非常重要的有机反应[1-5].在对天然药物青藤碱的1-位进行杂环化时,我们使用间甲基苯基腈氧化物与青藤碱1-位C=C取代物1进行了1,3-偶极环加成反应(Scheme 1).此反应理论上有四个异构体A1、A2、B1、B2.Scheme 1 青藤碱衍生物的合成Scheme 1 Synthesis of sinomenine derivatives但在实验中我们只得到了其中的两个异构体:异构体-1和异构体-2.那么异构体-1和异构体-2分别对应A1、A2、B1、B2四个异构体中的哪两个呢?通常情况下,培养产物的单晶,再做单晶衍射,就会得到产物的绝对构型,但这种方法不仅花费大,而且需要首先培养出产物的单晶.本文将说明如何根据1,3-偶极环加成反应选择性,以及产物的1H NMR、13C NMR、NOESY相关谱,结合理论计算和软件模拟,来分析和确定异构体-1和异构体-2的构型.1,3-偶极环加成反应表现出三种选择性[2](Fig. 1):区域选择性(regioselectivity),生成一对区域异构体A、B;非对映选择性(diastereoselectivity,这里是endo/exo selectivity),比如区域异构体A是endo-A、exo-A一对非对映异构体;对映选择性(enantioselectivity),比如endo-A又是endo-Aa、endo-Ab一对对映异构体.Fig.1 1,3-偶极环加成的选择性Fig.1 Selectivities of 1,3-dipolar cycloadditon对于由芳基腈氧化物参加的1,3-偶极环加成反应,同样也存在区域选择性.由于偶极体的中心N原子在产物异口恶唑啉中是以C=N双键形式存在,其3位取代基与环在同一个面上,产物的endo型和exo型相同,因此,非对映选择性消失,只有对映选择性.但是,如果重键带有具有手性中心的取代基时,由于手性中心不能相互呈镜像关系,则其对映选择性将会转变成为非对映选择性(diastereoselectivity,这里是diastereofacial selectivity),见Fig. 2.青藤碱是一个多环体系,并且含有手性原子,可以看作一个手性的取代基。
1,3-偶极环加成反应产物构型的推定

l , 3一偶极 环加 成 反应 是基 于三 原子 4 电子( ) 偶 极 体系 与亲 偶极 体 的重 键 发 生 [ 3 +2 ] 加成 , 生成 五 元杂 环 ( 特 别是 五元 含 氮杂 环 ) 的一种 非常 重要 的有 机 反应 [ 卜5 1 . 在 对 天然 药 物青 藤 碱 的 1一位 进 行 杂 环化 时, 我们 使用 间 甲基 苯基 腈氧 化物与 青藤碱 1 一位 c=C取代 物 1 进行 了 l , 3 一偶 极环加 成 反应 ( S c h e me 1 ) .
1 , 3一偶 极 环 加 或反 应 表 现 出 三 种 选 择 性 J ( F i g .1 ) : 区域 选 择 性 ( r e g i o s e l e c t i v i t y ) , 生
o
ch S e me 1 青藤碱衍生物的合成
Sc h e me 1 Sy n t h e s i s o f s i n o me n i n e d e r i v a t i v e s
此反 应理 论 上有 四个异构 体 A1 、 A 2、 B 1 、 B 2 .
但在 实验 中我 们 只得 到 了其 中的两 个 异构 体: 异构体 一l和异构 体 一2 . 那 么异 构 体 一1和 c o 异 构体 一2分别 对应 A1 、 A 2 、 B 1 、 B 2四个 异构 体 中的哪两 个 呢?通 常 情 况下 , 培 养 产物 的单 晶 , O 再 做单 晶衍 射 , 就会 得 到产 物 的绝对 构 型 , 但这 种方 法不 仅 花 费 大 , 而 且 需 要 首 先 培养 出 产 物 的单 晶 . 本 文将说 明如何 根据 1 , 3 一偶 极环 加成
收 稿 日期 : 2 0 1 3 —0 6 —0 8
1,3-偶极环加成反应-精品文档

BREAD PPT DESIGN
通过2-芳亚甲基-6,7-二氢-5H-噻唑并[3,2-a]嘧啶-3酮与靛红、肌氨酸的l,3-偶极环加成反应,合成了一系列新 的螺噻唑并嘧啶类化合物,以期为药物筛选提供先导化合物。
李筱芳 ,于贤勇 ,冯亚青1,3-偶极环加成反应合成螺噻唑并[3,2-a]嘧啶类化合物, 有机化学2019年第30卷第5期,735-739
BREAD PPT DESIGN
通过六氢-4-芳基-lH-比喃[2,3-d]并嘧啶-2(8aH)硫酮与丁炔二酸二甲(DMAD)的加成反应,合成了一系列新 的吡喃一嘧啶并噻唑类化合物。
姚飞,曾荣今,王慧,沈鹏飞 1,3一偶极环加成反应合成新型的吡喃一嘧啶并噻唑类化 合物 中图分类号:062 文献标识码:A 文章编号:1672—9102(2019)02—0101—04
叠氮基参与 的1,3-偶极 环加成反应 含能盐 含能基团的修饰 新型含能聚合物
池俊杰,夏宇,张晓勤,曲贵晨,常伟林,王建伟 1,3一偶极环加成反应 在含能材料中的应用 中图分类号:0621.3;TJ55 文献标识码:A 文章 编号:1672—2191(2019)03—0025—04
BREAD PPT DESIGN
BREAD PPT DESIGN
叠氮基与碳-碳双 键、碳-碳三键或碳氮三键的1,3一偶极 环加成反应通常有很 多优点。
反应模块化 高产率 反应条件简单 后处理简单
BREAD PPT DESIGN
立体选择性
此类反应是经典点击化学(Click Chemistry) 的精华 。故自2019年诺贝尔化学奖获得者K.B.Sharpless提出 点击化学的概念以来,叠氮基参与的1,3一偶极环加成反 应就在药物合成、分子印迹、超支化聚合物制备、 纳米材料的修饰等众多领域引起了国内外科学家的重视。 含能材料黏合剂
环加成反应和机理
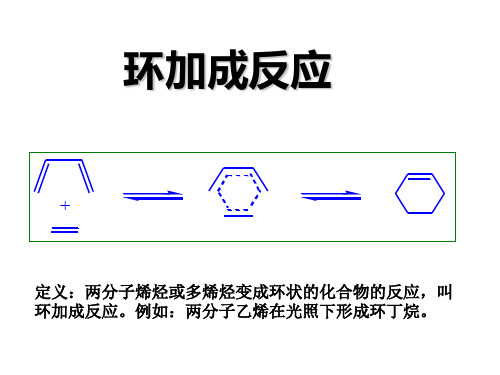
一般环加成为同面环加成
同面环加成
异面环加成 (antarafacial cycloaddition)
(suprafacial cycloaddition)
对称允许的[4π+2π 对称允许的[4π+2π]热环化加成反应
Ψ2(A)
Ψ3(S)
Ψ2(A)
Ψ1(S) (S)
对称禁阻的[4+2]π光环化加成反应 对称禁阻的[4+2]π光环化加成反应
hv S SOMO= SOMO=
R Y R X
A S 对称性不匹配 不 能成 环
A SOMO'=
R
SOMO'=
对称允许的[2π 对称允许的[2π+2 π]光环化加成反应 光环化加成反应
+
hv
SOMO=
R X
A S 对称 性匹配 可 以成 环
A SOMO=
R
SOMO'=
S SOMO'=
对称禁阻的 对称禁阻的[2 π +2 π]热环化加成反应 热环化加成反应
重要知识点!! 重要知识点!!
[2 + 2] Cycloaddition Reaction
H
课堂练习: 课堂练习:试写出
、
在光照条件下的环加
成产物,后者可能有几种立体异构? 成产物,后者可能有几种立体异构?其顺式异构体 进一步发生环加成反应将生成何物? 进一步发生环加成反应将生成何物?
CH2
CH CH
CH2
CH2
CH2
SO2
N N
CH2 CH2
SO2
CO2Me CO2Me
1,3-偶极加成: 1,3-偶极加成: CH2 N N
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
冯亚青1 偶极环加成反应合成螺噻唑并[3 [3, a]嘧啶类化合物 嘧啶类化合物, 李筱芳 ,于贤勇 ,冯亚青1,3-偶极环加成反应合成螺噻唑并[3,2-a]嘧啶类化合物, 有机化学2010年第30卷第5 2010年第30卷第 735有机化学2010年第30卷第5期,735-739
BREAD PPT DESIGN
BREAD PPT DESIGN
Yamada等利用 酮亚胺与钴(III) (III)阳离子的络合 Yamada等利用 B-酮亚胺与钴(III)阳离子的络合 物催化氮-芳亚甲基苯基氧化胺(2,R2=Ar,R3 =Ph)与 物催化氮-芳亚甲基苯基氧化胺(2, =Ar, =Ph)与 (2 甲酰基- 环戊烯的1 偶极环加成反应。 1-甲酰基-1-环戊烯的1,3-偶极环加成反应。在反应 液中加入NaBH4的乙醇溶液猝灭环加成反应, NaBH4的乙醇溶液猝灭环加成反应 液中加入NaBH4的乙醇溶液猝灭环加成反应,将环加成 产物的醛基转化为更稳定的醇,产物19保持了1 19保持了 产物的醛基转化为更稳定的醇,产物19保持了1,3-偶 极环加成反应的收率、非对映选择性和对映选择性。 极环加成反应的收率、非对映选择性和对映选择性。
BREAD PPT DESIGN
通过六氢- 芳基-lH-比喃[2, d]并嘧啶-2(8aH)通过六氢-4-芳基-lH-比喃[2,3-d]并嘧啶-2(8aH)[2 并嘧啶 硫酮与丁炔二酸二甲(DMAD)的加成反应, (DMAD)的加成反应 硫酮与丁炔二酸二甲(DMAD)的加成反应,合成了一系列新 的吡喃一嘧啶并噻唑类化合物。 的吡喃一嘧啶并噻唑类化合物。
BREAD PPT DESIGN
叠氮基与碳叠氮基与碳-碳双 碳三键或碳键、碳-碳三键或碳氮三键的1 氮三键的1,3一偶极 环加成反应通常有很 多优点。 多优点。
反应模块化
高产率
反应条件简单
立体选择性
后处理简单
BREAD PPT DESIGN
此类反应是经典点击化学(Click Chemistry)的精华 的精华。 此类反应是经典点击化学(Click Chemistry)的精华。 故自2001年诺贝尔化学奖获得者K 2001年诺贝尔化学奖获得者 Sharpless提出点 故自2001年诺贝尔化学奖获得者K.B.Sharpless提出点 击化学的概念以来,叠氮基参与的1 击化学的概念以来,叠氮基参与的1,3一偶极环加成反应 就在药物合成、分子印迹、超支化聚合物制备、纳 等众多领域引起了国内外科学家的重视。 米材料的修饰等众多领域引起了国内外科学家的重视。 含能材料黏合剂 叠氮基参与 的1,3-偶极 环加成反应 含能盐 含能基团的修饰 新型含能聚合物
BREAD PPT DESIGN
通过2 芳亚甲基通过2-芳亚甲基-6,7-二氢-5H-噻唑并[3,2-a]嘧啶-3二氢-5H-噻唑并[3, a]嘧啶[3 嘧啶 酮与靛红、肌氨酸的l 偶极环加成反应, 酮与靛红、肌氨酸的l,3-偶极环加成反应,合成了一系列新 的螺噻唑并嘧啶类化合物,以期为药物筛选提供先导化合物。 的螺噻唑并嘧啶类化合物,以期为药物筛选提供先
1,3-偶极环加成反应是合成五元杂环化合物的常 用方法。其中,以硝酮为1 偶极化合物、1,2用方法。其中,以硝酮为1,3-偶极化合物、1,2-二取 代烯烃为亲偶极体的1 代烯烃为亲偶极体的1,3-偶极环加成反应是合成异嗯 唑烷衍生物的重要途径。 唑烷衍生物的重要途径。
池俊杰,夏宇,张晓勤,曲贵晨,常伟林, 池俊杰,夏宇,张晓勤,曲贵晨,常伟林,王建伟 1,3一偶极环加成反应 中图分类号:0621. 文献标识码: 在含能材料中的应用 中图分类号:0621.3;TJ55 文献标识码:A 文章 编号:1672—2191(2011)03—0025— 编号:1672—2191(2011)03—0025—04
本工作以低廉的氯化苄和取代氯化苄为原料, 本工作以低廉的氯化苄和取代氯化苄为原料,替代通 常的溴化物,合成了苄叠氮(3a) 对甲基苄叠氮(3b) (3a), (3b), 常的溴化物,合成了苄叠氮(3a),对甲基苄叠氮(3b),对 氰基苄叠氮(3c) 对氟基苄叠氮(3d) (3c), (3d), 4'氰基苄叠氮(3c),对氟基苄叠氮(3d),4,4'-联苯二苄叠 氮等(3e ),有效降低反应成本。 氮等(3e ),有效降低反应成本。
在氧化剂存在下吡啶叶立德与查尔酮进行1 在氧化剂存在下吡啶叶立德与查尔酮进行1,3-偶 极环加成反应,一锅法合成2 苯基- 乙酰基中氮茚, 极环加成反应,一锅法合成2-苯基-3-乙酰基中氮茚, 以及用类似的一锅法合成1-苯甲酰基-2-苯基-3-乙酰基 以及用类似的一锅法合成1 苯甲酰基- 苯基吡咯并[2 [2, a]异喹啉化合物 异喹啉化合物。 吡咯并[2,I-a]异喹啉化合物。
手性Lewis酸催化硝酮与烯烃的1 Lewis酸催化硝酮与烯烃的 胡晓芬 冯亚青冰 李筱芳 手性Lewis酸催化硝酮与烯烃的1,3.偶极环加成反应 2005年第25卷第 年第25卷第1 有机化学 2005年第25卷第1期,1~7
BREAD PPT DESIGN
总结: 总结:
1-苄基-3,5-双芳亚甲基哌啶-4-酮与由靛红及脯氨酸原位反 苄基双芳亚甲基哌啶应生成的甲亚胺叶立德的1 应生成的甲亚胺叶立德的1,3-偶极环加成具有反应时间短 (20min)、收率高(>86 的特点,反应具有较好的选择性, (>86% (20min)、收率高(>86%)的特点,反应具有较好的选择性,仅生 成一种产物。 成一种产物。 通过六氢- 芳基-1H-吡喃[2 [2, d]并嘧啶 2(8aH)并嘧啶通过六氢-4-芳基-1H-吡喃[2,3-d]并嘧啶-2(8aH)-硫酮与 丁炔二酸二甲酯的加成、 丁炔二酸二甲酯的加成、环合反应得到一系列新化合物甲基 (2Z)-[5-(4-芳基) 羰基-5a, 9a-四氢-5H,6H-吡喃[2 [2, (2Z)-[5-(4-芳基)-3-羰基-5a,7,8,9a-四氢-5H,6H-吡喃[2, d][1,3]并噻唑[3, a]并嘧啶 2(3I-i)-甲叉基]乙酯。 并噻唑[3 并嘧啶3-d][1,3]并噻唑[3,2-a]并嘧啶-2(3I-i)-甲叉基]乙酯。具有 反应时间短(2 3h)、副反应少、后处理简单、收率高(>90 (2(>90% 反应时间短(2-3h)、副反应少、后处理简单、收率高(>90%)的 特点。理论上该反应只生成一种产物。 特点。理论上该反应只生成一种产物。 芳亚甲基. 二氢.5H-噻唑并[3 [3, a]嘧啶 嘧啶. 2-芳亚甲基.6,7-二氢.5H-噻唑并[3,2-a]嘧啶.3-酮与 由靛红及肌氨酸原位反应生成的甲亚胺叶立德的1 由靛红及肌氨酸原位反应生成的甲亚胺叶立德的1,3-偶极环加 成反应具有立体选择性和区域选择性,对反应液的TLC TLC检测表明 成反应具有立体选择性和区域选择性,对反应液的TLC检测表明 只有一种产物生成。 只有一种产物生成。
BREAD PPT DESIGN
谢谢!
BREAD PPT DESIGN
反应介 绍
通过1 苄基通过1-苄基-3,5-双芳亚甲基哌啶-4-酮与靛 双芳亚甲基哌啶脯氨酸的1 偶极环加成反应, 红、脯氨酸的1,3-偶极环加成反应,合成了一系 列新的螺哌啶-六氢吡嗪类化合物。 列新的螺哌啶-六氢吡嗪类化合物。
令玉林,刘彬,李筱芳,于贤勇, 令玉林,刘彬,李筱芳,于贤勇,易平贵 1,3一偶极环加成反应合成螺哌啶 一六氢吡嗪 中图分类号: 文献标识码: 文章编号:1672—9102(2010)04一0101类化合物 中图分类号:062 文献标识码:A 文章编号:1672—9102(2010)04一0101-03
姚飞,曾荣今,王慧, 姚飞,曾荣今,王慧,沈鹏飞 1,3一偶极环加成反应合成新型的吡喃一嘧啶并噻唑类化 中图分类号: 文献标识码: 文章编号:1672—9102(2011)02—0101— 合物 中图分类号:062 文献标识码:A 文章编号:1672—9102(2011)02—0101—04
BREAD PPT DESIGN
王炳祥,徐助雄, 吡啶叶立德与查尔酮1 偶极环加成反应制备2 苯基王炳祥,徐助雄,吴婧 吡啶叶立德与查尔酮1,3.1偶极环加成反应制备2-苯基-32006年第26卷第11期 年第26卷第11 乙酰基中氮茚 有机化学 2006年第26卷第11期,1587~1589
BREAD PPT DESIGN
在硝酮与缺电子烯烃的1,3在硝酮与缺电子烯烃的1,3-偶极环加成反应的研究 1,3 常用的亲偶极体为3 (3-取代丙烯酰) 嗯唑烷中,常用的亲偶极体为3-(3-取代丙烯酰)-嗯唑烷-2-酮。
HU.Yan— LIU,Shi— TONG,Qin— HUANG,Fa—Rong,SHEN, HU.Yan—Hong ,LIU,Shi—Ling TONG,Qin—Yu HUANG,Fa—Rong,SHEN, Yong— QI,Hui—Min,DU,Lei。 1benzy1)Yong—Jia QI,Hui—Min,DU,Lei。 Synthesis of 1-(Substituted benzy1)1. 1,2,3-triazoles by 1.3-Dipolar Cycloaddition Reaction
浅析1,3浅析1,3-偶极环加成反应的应用和发展 1,3
安晓霞 应用化学1103 1103班 应用化学1103班 2111101151
目录
CONTENTS
1
背景介绍
2
各项反应
3
总结
BREAD PPT DESIGN
背景介 绍
1,31,31,3-偶极环加成反应(1,3-dipolar
cycloaddition)是发生在1,3-偶极体和烯烃、 cycloaddition)是发生在1,3-偶极体和烯烃、炔烃或 1,3 相应衍生物之间的环加成反应, 相应衍生物之间的环加成反应,产物是一个五元杂环化 合物。烯烃类化合物在反应中称亲偶极体。 合物。烯烃类化合物在反应中称亲偶极体。德国化学家 Huisgen首先广泛应用此类反应制取五元杂环化合 Rolf Huisgen首先广泛应用此类反应制取五元杂环化合 因此它也称为Huisgen反应。 Huisgen反应 物,因此它也称为Huisgen反应。 以前曾认为1,3 1,3以前曾认为1,3-偶极环加成反应是经过一个双自由 基的中间体完成的,但现在大多认为1,3 1,3基的中间体完成的,但现在大多认为1,3-偶极环加成反 应经过五元环的过渡态,是总电子数6π 6π体系的协同反 应经过五元环的过渡态,是总电子数6π体系的协同反 它受溶剂的极性影响很少, 应。它受溶剂的极性影响很少,而且是立体专一的顺式 加成反应。分子内或逆向的1,3 1,3加成反应。分子内或逆向的1,3-偶极环加成反应都是可 以发生的。 以发生的。
