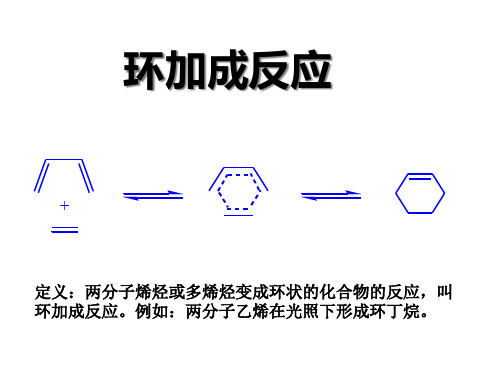
环加成反应
光催化[2+2]环加成反应原理
![光催化[2+2]环加成反应原理](https://img.taocdn.com/s3/m/e671f2ef3086bceb19e8b8f67c1cfad6195fe9bf.png)
光催化[2+2]环加成反应原理
光催化[2+2]环加成反应是一种基于光催化的有机合成反应,
其原理基于分子间的光化学规律。
在光催化[2+2]环加成反应中,两个共轭烯烃分子通过光照条
件下的光激发,形成致密的四环烷化合物。
这个反应过程可以通过以下步骤进行解释:
1. 激发状态:光照条件下,共轭烯烃分子中的π电子被光激发到高能的激发态,形成“激发态共轭烯烃”。
2. 互相吸引:激发态共轭烯烃分子之间的电子云相互吸引,并开始接近。
3. [2+2]加成:电子云的相互吸引促使两个共轭烯烃分子之间
形成一个高度亚稳定的过渡态结构,其中两对π电子通过一个反贯通的过渡状态结合在一起,形成一个致密的四环烷化合物。
4. 产物形成:过渡态结构极快地回到基态,形成一个新的四环烷化合物。
需要注意的是,光催化[2+2]环加成反应发生的光激发是经过
选择性的吸收特定波长的光,即光敏感分子(例如染料、催化剂)在紫外光或可见光区域内吸收光能,使其电子激发到高能态。
光催化[2+2]环加成反应的原理可以通过分子轨道理论和光化
学反应动力学等方法进行深入研究和解释。
这种反应的应用非常广泛,可以用于有机合成中的环合成和立体选择性控制等方面,在药物合成和材料科学等领域有广泛的应用前景。
环加成反应和机理精品PPT课件
写在最后
经常不断地学习,你就什么都知道。你知道得越多,你就越有力量 Study Constantly, And You Will Know Everything. The More
You Know, The More Powerful You Will Be
结束语
感谢聆听
不足之处请大家批评指导
在分子轨道中,已填充电子的轨道中能级最高的π分子轨道称为“最 高已占轨道”,简称 HOMO;而未填充电子的空π轨道中能级最低的分子 轨道称为“最低未占轨道”,简称 LUMO。 HOMO 和 LUMO 统称为“前 线轨道”,简称 FMO。处在前线轨道上的电子称为“前线电子”。
分子的 HOMO 对其电子的束缚较为松弛,具有电子给予体的性质;而 LUMO 对电子的亲和力较强,具有电子接受体的性质。
前线轨道理论认为前线电子的作用类似于单个原子中的价电子,前线 轨道在分子型反应中起着主要作用。
环加成反应的解释
环加成反应的定义:在光或热的作用下,两个或多个带双键、 共轭双键或孤对电子的分子相互作用,生成一个稳定的环状化 合物。 环加成反应的逆反应称环消除,亦统称环加成。
FMO理论认为,在双分子热反应中,起决定作用的是前线 分子,即一分子出LUMO,另一分子出 HOMO。两个起作用的 轨道必须具有相同的对称性且能量相近才能重叠。
Please Criticize And Guide The Shortcomings
讲师:XXXXXX XX年XX月XX日
[小结] 环加成反应的立体选择性(同面-同面) W-H规则二
电子数(m + n ) 4n+2 4n
热反应 允许 禁阻
光反应 禁阻 允许
环加成反应是两个分子的前线分子轨道作用。
有机化学中的环加成反应

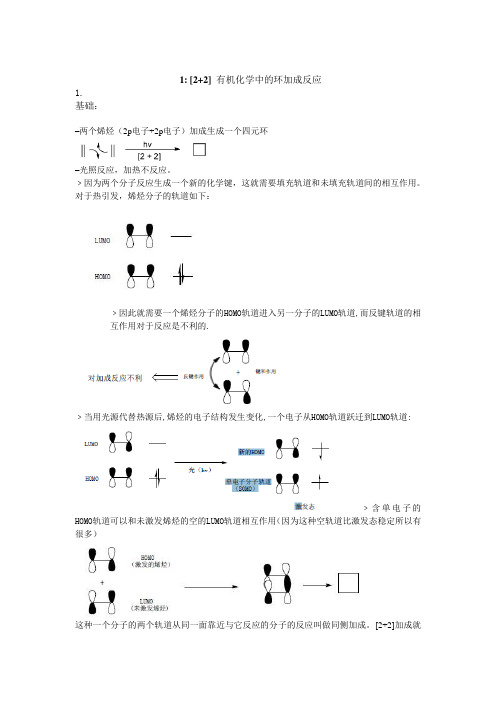
1: [2+2] 有机化学中的环加成反应1.基础:–两个烯烃(2p电子+2p电子)加成生成一个四元环–光照反应,加热不反应。
﹥因为两个分子反应生成一个新的化学键,这就需要填充轨道和未填充轨道间的相互作用。
对于热引发,烯烃分子的轨道如下:LUMOHOMO﹥因此就需要一个烯烃分子的HOMO轨道进入另一分子的LUMO轨道,而反键轨道的相互作用对于反应是不利的.+键和作用反键作用对加成反应不利﹥当用光源代替热源后,烯烃的电子结构发生变化,一个电子从HOMO轨道跃迁到LUMO 轨道:LUMOHOMO光(hv)新的HOMO单电子分子轨道(SOMO)激发态﹥含单电子的HOMO轨道可以和未激发烯烃的空的LUMO轨道相互作用(因为这种空轨道比激发态稳定所以有很多)+HOMO(激发的烯烃)LUMO(未激发烯烃)这种一个分子的两个轨道从同一面靠近与它反应的分子的反应叫做同侧加成。
[2+2]加成就是同面加成。
–为什么异测进攻不利?﹥反式进攻是一个分子的轨道加到与之相护作用的另一个分子的异侧。
顶部反式进攻﹥对于2+2加成反应反式进攻是最不可能的(如果这种反式进攻是可行的,那么对于热引发的[2+2]反应也是可行的。
但是由于垂直键不可能作用,这种跨环进攻是严重受阻的)2. 反应物和产物之间的结构关系–让我们看一下反-丁烯的二聚:“上”“上”“下”“下”–反-丁烯和顺-丁烯的反应:反式顺式“上”“下”“下”“下”–当有一个烯烃是环状时,顺式加成。
顺式 加成物3.例子!!!–第一个关于[2+2]环加成反应的报道G. Ciamician, P. Silber (1908):OO1年!香芹酮 香芹酮樟脑O –Paterno-Buchi反应。
有机化学中的环加成反应
1: [2+2] 有机化学中的环加成反应
1.
基础:
–两个烯烃(2p电子+2p电子)加成生成一个四元环
–光照反应,加热不反应。
﹥因为两个分子反应生成一个新的化学键,这就需要填充轨道和未填充轨道间的相互作用。
对于热引发,烯烃分子的轨道如下:
﹥因此就需要一个烯烃分子的HOMO轨道进入另一分子的LUMO轨道,而反键轨道的相
互作用对于反应是不利的.
﹥当用光源代替热源后,烯烃的电子结构发生变化,一个电子从HOMO轨道跃迁到LUMO轨道:
﹥含单电子的HOMO轨道可以和未激发烯烃的空的LUMO轨道相互作用(因为这种空轨道比激发态稳定所以有很多)
这种一个分子的两个轨道从同一面靠近与它反应的分子的反应叫做同侧加成。
[2+2]加成就
是同面加成。
Jeewoo Lim 1-2
–为什么异测进攻不利?
﹥反式进攻是一个分子的轨道加到与之相护作用的另一个分子的异侧。
﹥对于2+2加成反应反式进攻是最不可能的
(如果这种反式进攻是可行的,那么对于热引发的[2+2]反应也是可行的。
但是由于垂直键不可能作用,这种跨环进攻是严重受阻的)
2.反应物和产物之间的结构关系
–让我们看一下反-丁烯的二聚:
–反-丁烯和顺-丁烯的反应:
–当有一个烯烃是环状时,顺式加成。
顺式加成物
Jeewoo Lim 1-3
1.
例子!!!
–第一个关于[2+2]环加成反应的报道
香芹酮香芹酮樟脑
–Paterno-Buchi反应。
有机合成中的环加成反应研究

有机合成中的环加成反应研究在有机合成领域中,环加成反应是一类重要的化学反应,能够有效地构建复杂的有机分子结构。
该反应的研究对于新药发现、化学生物学和材料科学等领域具有重要意义。
本文将介绍环加成反应的基本原理、应用领域以及当前的研究进展。
一、环加成反应的基本原理环加成反应是指通过在有机分子中引入新的环结构来构建更复杂的有机化合物。
这类反应通常涉及两个或多个反应底物之间的键形成和断裂过程。
在环加成反应中,通常需要一个环加成剂(也称为亲核试剂)和一个底物(也称为亲电试剂)。
亲核试剂通过提供一对电子共享,攻击底物分子上的一个电荷云,从而形成新的共价键。
底物则引发反应的开展,并提供电子空穴,使亲核试剂能够加成到底物分子上。
二、环加成反应的应用领域环加成反应在有机合成中具有广泛的应用领域。
它可以用于构建天然产物的骨架、合成药物活性分子、制备高分子材料以及探索新的化学反应等。
1. 天然产物的合成许多天然产物具有复杂的环结构,这些环结构对于它们的生物活性至关重要。
通过环加成反应,可以高效地合成天然产物的结构模块,进而实现天然产物的全合成。
2. 药物合成药物合成中,环加成反应可以构建药物分子的骨架结构,并引入不同的官能团以增强其药理活性。
这对于新药开发具有重要意义。
3. 高分子材料合成通过环加成反应可以合成具有特定结构的高分子材料,如聚合物、液晶材料等。
这些高分子材料在材料科学领域具有广泛的应用前景。
4. 新反应的探索环加成反应的基础研究也涉及到新反应的发现与开发。
通过对反应的机理和控制因素的深入理解,可以发现新的环加成反应,丰富有机合成的方法学。
三、环加成反应的研究进展随着合成化学和有机合成领域的发展,环加成反应得到了广泛的研究。
以下是一些当前的研究进展:1. 新型亲核试剂的设计与合成研究人员通过设计和合成新的亲核试剂,以改善环加成反应的反应性和选择性。
这方面的研究包括利用手性催化剂、设计新的反应底物等。
2. 反应条件的优化与绿色化为了提高环加成反应的产率和效果,研究人员致力于优化反应条件。
Diels-Alder反应

• 1928年,德国化学家狄尔斯(Diels, O.) 和阿尔德(Alder, K.)在研究1,3−丁二烯 和顺丁烯二酸酐的互相作用时发现了一类 反应——共轭双烯与含有烯键或炔键的化 合物互相作用,生成六元环状化合物的反 应。这类反应称为狄尔斯−阿尔德 (Diels−Alder)反应。又称为双烯合成。
电子反向的Diels-Alder反应
• 双烯的 LUMO和亲双烯体的HOMO能量差, 小于双烯的HOMO 和亲双烯体的LUMO能量 差值,在反应过程中,双烯的LUMO和亲双烯 体的HOMO 起主要作用,叫做电子反向的 Diels-Alder反应。双烯分子的吸电子取代基 和亲双烯体中的给电子取代基使这类反应加快。
环加成反应具有以下选择性规则:
Diels-Alder反应机理
+
双烯体
亲双烯体 环状过渡态
产物
对双烯体的要求:
(1)双烯体的两个双键必须取S-顺式构象。 (2)双烯体1,4位取代基位阻较大时,不能发 生该反应。
HOMO
LUMO
LUMO
HOMO
• 丁二烯和乙烯进行Diels-Alder反应,并不 很顺利,烯烃双键的碳原子上带有吸引电 子集团如 –CHO,-CN,-COOH等,反应就可 以顺利的进行。这是为什么呢?
烯LUMO能量差值增大。一般来说,两个分子进行反应,只要有一份子的 HOMO和另一个分子的LUMO对称性匹配,能量相近,反应就可沿此途径
进行。
正常的Diels-Alder反应
• 双烯的HOMO和亲双烯体的LUMO能量差,小 于双烯的LUMO和亲双烯体的HOMO能量差值, 在反应过程中,双烯的HOMO和亲双烯体的 LUMO起主要作用,叫做正常的Diels-Alder反 应。双烯分子的给电子取代基和亲双烯体中的 吸电子取代基使这类反应加快。
husigen环加成反应

husigen环加成反应
又称为面内环加成反应(IHC),是一种分子有机化学反应,是在苯
环上通过硝酸铵等催化剂发生的构建化学反应,也是苯环共轭反应的一种,是一种间接通过改变芳环结构而控制其物性的高效可控制反应方式。
IHC
过程主要分三个步骤:1.选择一定的苯环化合物的反应组份;2.引入卤化
盐催化剂和氯化钠辅助;3.经由芳环碳氢键的取代反应,最终形成新的环
状结构。
IHC通常使用硝酸铵作为催化剂,氯化钠作为辅助剂,通过氯代取代
原有芳环上的共价键,构建出新的环状化合物,从而达到改变芳环分子的
性质的目的。
IHC的特点是可以利用反应的内能,将反应的热能转化为化
学能量,减少反应的不稳定性,降低反应热,提高反应的热力学可逆性,
减少反应的持续时间,增加反应的高分子量。
IHC反应可以以低温高效率,室温室温反应,在不变的状态下实现芳环分子上取代芳环,同时可以调节
芳环分子上物性和活性,提高芳环分子的利用率,实现高浓度,绿色环境
友好的反应。
环加成反应、环合反应、电环化反应与环化反应的区别

环加成反应、环合反应、电环化反应与环化反应的区别
环加成反应、环合反应、电环化反应与环化反应都是有机化学中常见的反应类型,它们的区别如下:
1. 环加成反应:是指两个或多个分子中的一个分子中的双键与另一个分子中的原子或官能团形成新的碳-碳键,从而形成环状结构的反应。
如环丙烯和丙烯酸酯反应得到环戊酮。
2. 环合反应:指两个或多个分子中的官能团在分子内部相互反应,形成环状结构的反应。
如羧酸和醛或酮反应生成内酯或内酰胺。
3. 电环化反应:是指通过电子转移或质子转移,使分子中的一个双键或三键环化为环状结构的反应。
如苯环化反应。
4. 环化反应:是指分子中的某个部分发生内部反应形成环状结构的反应。
如酮的烷基迁移环化反应。
总的来说,这些反应都是通过形成环状结构来改变分子结构和性质的。
它们的区别主要在于反应的起始物质和反应机理。
- 1 -。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
协同反应:新键的形成与旧键的断裂是协同 进行的一步反应。例如:Diels-Alder反应、 SN2反应。 例如Diels-Alder反应:
电环化反应:
3
三类有机反应主要区别
类型 离子反应 自由基反应 协同反应 中间体 正、负离子 自由基 无 与溶剂关系 极性溶剂有利 关系小,气相允许 关系小,气相允许
21
CH3 H H H
CH3 CH3 H H
反-1,3-戊二烯
4-甲基-1,3-戊二烯
ห้องสมุดไป่ตู้
反应速度 =1000
Ph
:
1
Ph
反应速度 ≈1000
:
1
22
C(CH3)3
C(CH3)3
反应速度 = 0.05
(CH3)3C H H H (CH3)3C H H
:
1
H
反应速度 = 27
(CH3)3C (CH3)3C
CH2
CH2
CH CH
R2C:
CH2
CH2
R
CH2
SO2
N N
CH2
R
[2+2]环加成: CH2
[4+1]环加成: CH2
SO2
CO2Me CO2Me
1,3-偶极加成: CH2 N N [4+2]环加成: CH2
CH CH
CHCO2Me CHCO2Me
CH2 CH2
12
新键的生成在反应体系的同面叫同面环加成 (suprafacial cycloaddition)
H H C H3C H C H3C C CH3 C CH3 H h ν CH3 CH3 CH3 CH3
π 2s π 2s
H C H3C H3C C H C C
H CH3 CH3 CH3 H h ν CH3
π 2s π 2s
CH3 CH3
一般环加成为同面环加成
13
新键的生成在反应体系的异面叫异面环加成 (antarafacial cycloaddition)
15
2+2(4n)体系的环加成反应只有 在光照条件下易于发生,而在加热条 件下难于发生。
补充: 例题、
光
16
(乙)[4+2]环加成反应即Diels-Alder反应
X Y
双烯体 亲双烯体
k1 k2
X Y
加合物
4+2 体系的环加成在加热条件下易于进 行,在光照条件下难于进行。
17
(a)Diels-Alder反应是可逆反应
H CH3 H CH3
CH3
△
对旋
顺旋
HH CH3
7
(Z,E)-2,4-hexadiene
H
hv
对旋
H
H
H
H
△
80℃
顺旋
H
8
(乙)4n+2个π电子体系
CH3 H CH3 H
(Z,Z,E)-2,4,6-octatriene
△
CH3 H
H CH3
CH3 h ν
顺旋
对旋
H H CH3
CH3
CH3 H H CH3
:
(CH3)3C
1
C(CH3)3
23
(d)Diels-Alder反应的活性
影响因素主要有两方面:立体因素和电子因素。 立体因素:一切有利于S-顺构象稳定的因素都有利 于反应的活性的提高,反之活性下降。 电子因素:一般情况下,双烯体含有供电基,亲双 烯体含有吸电基,反应活性高。对亲双烯体而言 (苯醌>顺酐>硝基烯 > α,β-不饱和酯(酮、腈) 但是,当双烯体缺电子时,亲双烯体含有供电基反 而对反应有利。
第十四章 周环反应
1
第十四章 周环反应 (一) 周环反应
(1)电环化反应 (2)环加成反应 (3)σ 移位反应
(二) 周环反应的理论及其应用
(1)前线轨道理论及其应用举例 (2)能级相关理论及其应用举例 (3)芳香性过渡态理论及其应用举例 在此主要讲前线轨道理论及其应用。
2
周环反应:不经过活性中间体,只经过环状
2 CH2 C O
H3C H3C C O
△
H2C
O O
△
CH2 C O
CH3 H3C O O
R' CH CH2
CH2 C O
△
R' R O
烯酮的热环加成为异面环加成, 而以下讲的环加成都是同面加成
14
(甲)[2+2]环加成反应
hν
Ph COOH
Ph hν
Ph
Ph
COOH
COOH COOH COOH Ph
(E,Z,E)-2,4,6 -octatriene
△
CH3 CH3
h ν
顺旋
对旋
H H
H CH3 H
H3C CH 3
9
H
H
× △
H
H H
△
H
H
△
对旋
H
顺旋
H
H
△
H H
对旋
10
基态下电环化反应选律
关环方式 顺旋关环 对旋关环 体系 4n 允许 禁阻 4n+2
禁阻
允许
11
(2)环加成反应
[2+1]环加成: CH2
对双烯体系而言,生成 S-顺式构象是Diels-Alder 反应先决条件,例如下列二烯烃都不能进行DielsAlder反应。
如丁二烯
S-顺-1,3-丁二烯
S-反-1,3-丁二烯
20
所有能稳定 S- 顺构象的因素都能加速反应,反之则对 反应不利。
例如:
顺-1-取代双烯体s-顺式不稳定,活性低; 反-1-取代双烯体和2-取代双烯体活性高。
H C CH2
O O O O O O
24
Cl Cl Cl
Cl Cl Cl
Cl Cl Cl Cl
Cl Cl
补充:
O + 2 O
O
O
25
(e) Diels-Alder反应的立体化学 顺式加成规则:(实质是同面--同面加成)
COOR COOR
顺丁烯二酸酯 COOR COOR 反丁烯二酸酯
COOR ROOC
COOR COOR
26
内向加成(endoaddition)规则:
4
说明:除以上表格列出的区别外,催化
剂对三类反应的影响各不相同。离子型反应 对酸碱催化剂比较敏感,而自由基反应对自 由基引发剂和自由基阻聚剂比较敏感,而酸 碱催化剂、自由基引发剂和自由基阻聚剂对 协同反应都几乎没有影响。
5
协同反应具有高度立体专一性,用于 合成特定结构碳骨架。
O O
O O
O hν
正反应二级;逆反应一级
υ=k1[双烯体][亲双烯体] υ逆=k2[加合物]
18
(b)Diels-Alder反应的定向作用
Ph Ph CHO CH O
Ph CHO
+
CH3 CHO H3C CH
主要产物
H3C
O
少量
CHO
主要产物
CHO
两个取代基在邻位或对位的 产物为主要产物。
+
CHO
19
少量
(c)双烯体活性
hν 对旋
O
H
O O O
H
H
H H H
Na2CO3 水溶液
Pb(OAc)4
篮烯(basketene) 6
(一)周环反应
(1)电环化反应
(甲)4n个π电子体系
CH3 HH CH3 h ν
H
H
△
H H CH3 CH3
对旋
CH3 顺旋 CH3
(E,E)-2,4-hexadiene
H H CH3 CH3 h ν
