缩醛和羟醛缩合
羟醛缩合

第3章羟醛缩合和有关的反应3.1 引言开链化合物的立体控制反应在现代有机化学中是一个备受关注的问题,已发展出许多有用的方法用于具有刚性构象的复杂分子(如大环内酯合多环醛抗生素)的立体控制合成。
醛醇缩合反应在生物合成中是一种基本的键形成反应,因而受到特别的注意。
醛醇反应,即亲核试剂与亲电的羰基基团(及类似基团)的缩合反应,是构建不对称C-C键的最简单的,同时能满足不对称有机合成方法学的最严格要求的一类化学转化。
在复杂分子的合成和在光学活性的小分子砌块的制备中,可以找到许多不对称醛醇缩合反应的实例[1].在复杂的天然产物的合成中,常常会遇到制备具有多个相邻的手性中心的中间体的任务。
这类化合物的最有效的合成策略,是那种在连接二个反应片断的同时又建立起毗邻立体中心的策略。
在每一个前述的策略中,希望对于相对的(syn/anti)以及绝对的(R/S)立体化学都能实行控制 . 已有许多研究者报道了非对映选择性(对映选择性)醛醇缩合反应的结果。
这些不对称醛醇缩合反应中的主要变化因素是金属抗衡离子、与这些离子键合的配体以及反应条件。
下述几种方法可用于对醛醇反应进行不对称控制:105(1)底物控制:非手性烯醇盐或烯丙基金属试剂对手性醛的加成(一般在α-位).在这种情况下,按照Cram-Felkin-Ahn规则由优势过渡态来决定非对映选择性[2].(2)试剂控制:手性烯醇盐或烯丙基金属试剂对非手性醛的加成.最通用的获得手性烯醇盐的方法是通过手性辅剂以酯、酰胺(噁唑啉)、酰亚胺(噁唑烷酮)或硼烯醇盐的形式结合;手性烯丙基金属试剂通常也与手性配体结合.(3)双不对称反应:手性烯醇盐或烯丙基金属试剂对手性醛的加成.当醛和试剂显示互补的面优先性(匹配对的情况)时,能够提高立体选择性;反之当它们的面优先性相反(错配对)时,立体选择性降低.当与合适的配体配位时,许多金属抗衡离于(诸如Li,Mg,Zr,B,AI,Sb,Si,Ti)在不对称醛醇缩合反应中能提供良好的立体选择性.锂或镁形成络台物,它们通过Cram-Felkin-Ahn规则或配位控制加成提供选择性.钛的应用得到了极巧妙的、多样性的好结果,它与手性配体络合提供对映选择性的转化.硼烯醇盐由于其高对映选择性的传递性质而被证明具有广泛的用途.杂双金属催化剂和双核中心催化剂既能活化亲核试剂又能活化亲电试剂,它们贯穿了本章的讨论内容.可以说,只是从20世纪80年代早期开始,本论题才获得显著的进展.在本章中,我们试图介绍金属烯醇盐和有关的烯丙基金属衍生物对碳基化合物的加成反应的一些最重要的进展,如图3.1中的途径A和途径B所示的。
第三章:羟醛缩合

4.2 Shibasaki体系
大多数不对称羟醛缩合反应都涉及手性或非手性烯醇 盐对手性醛或非手性醛的亲核加成,并且烯醇盐的制备 是反应的关键步骤。 Shibasaki首次发展了一种不涉及 烯醇盐而直接催化的羟醛缩合反应。
M * O M O * O M O O O M *
M * Ba(OPr)2
+
O O M O *
O O O M
* (R)-BaBM
OMe OH M
O RCHO + Ph
5%mol.(R)-BaBM DME, -20oC, 2day R
OH
O Si Ph
----------------------------------------------------R Y% e.e% ----------------------------------------------------t-Bu 77 67 PhCH2(CH3)2C 77 55 C6H11 87 54 i-Pr 91 50 BnOCH2(CH3)2C 83 69 BnO(CH2)2C 99 70 ----------------------------------------------------
favorite
O
H
R'' R'''' O M L L M O R''''
(H)R'''
R'' R' H
unfavorite
L
L
羰基化合物的优势构象
O Y Y H H H H H O H H H
O H Y H H Y O H
Y=Me>Et,MeO,PhO>Me2CH>Ph,Cl>Br>Me3C>MeS
生物体系中的羟醛加成反应和羟醛缩合反应
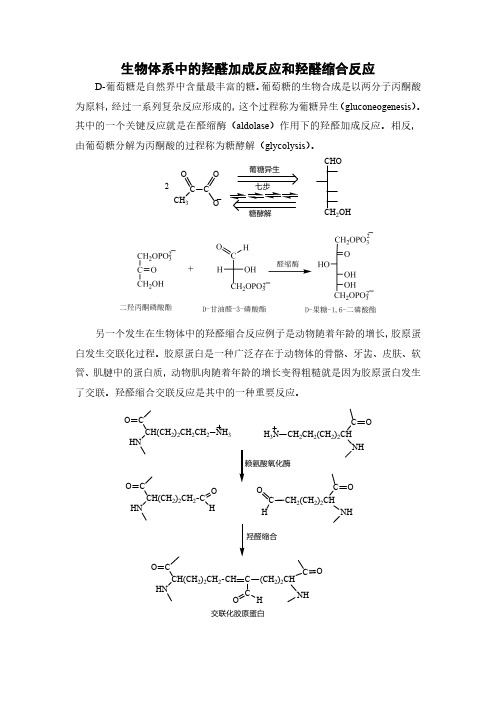
生物体系中的羟醛加成反应和羟醛缩合反应D-葡萄糖是自然界中含量最丰富的糖。
葡萄糖的生物合成是以两分子丙酮酸为原料,经过一系列复杂反应形成的,这个过程称为葡糖异生(gluconeogenesis)。
其中的一个关键反应就是在醛缩酶(aldolase)作用下的羟醛加成反应。
相反,由葡萄糖分解为丙酮酸的过程称为糖酵解(glycolysis)。
CH3C
O
C
O
O 2
葡糖异生
糖酵解
七步
CHO
CH2OH
另一个发生在生物体中的羟醛缩合反应例子是动物随着年龄的增长,胶原蛋白发生交联化过程。
胶原蛋白是一种广泛存在于动物体的骨骼、牙齿、皮肤、软管、肌腱中的蛋白质,动物肌肉随着年龄的增长变得粗糙就是因为胶原蛋白发生了交联。
羟醛缩合交联反应是其中的一种重要反应。
C
O
CH(CH2)2CH2CH2NH3 HN H3N CH2CH2(CH2)2CH
C O
NH
C O
CH(CH2)2CH2 HN
CH2(CH2)2CH
C O
NH
C
O
H
C
O
H
羟醛缩合
C O
CH(CH2)2CH2 HN CH C(CH2)2CH
C
O H
C
NH
O
交联化胶原蛋白。
甲醛乙醛羟醛缩合反应方程式

感谢百度文库让我们在这里与你相见,您的下载就是我们最大的动力。
甲醛乙醛羟醛缩合反应方程式
一、甲醛乙醛羟醛缩合反应方程式
1. 首先得知道啥是羟醛缩合反应。
简单说呢,就是在稀碱或者稀酸的催化作用下,含有α - 氢原子的醛可以发生自身的加成反应,这就是羟醛缩合反应啦。
那对于甲醛和乙醛呢,反应就更有趣啦。
2. 甲醛的结构是HCHO,乙醛的结构是CH₃CHO。
在碱的催化下,乙醛的α - 氢原子(就是和醛基相连的碳上的氢原子)比较活泼,它会先失去一个氢原子,形成一个碳负离子。
这个碳负离子就像一个小调皮鬼,它特别想找个东西结合。
3. 这个时候甲醛就登场啦。
甲醛的羰基(C = O)部分就像一个小陷阱,碳负离子就一头扎进去,和甲醛发生加成反应。
具体的反应方程式是:CH₃CHO + HCHO → CH₂OHCH₂CHO。
这个反应过程就像是一场小小的化学舞会,每个分子都在找自己的舞伴呢。
4. 如果反应继续进行,生成的产物还可以继续发生反应。
不过这就是更深入的内容啦。
概括来说这个反应在有机化学里可是很重要的哦,它能合成很多有用的有机化合物呢。
比如说在制药、香料合成等方面都有很大的用处。
要是没有这个反应,很多我们熟悉的药物和香香的香料可能就没法合成啦。
第 1 页共 1 页。
有机化学:第十章 醛 酮(1)
(2) O
O
C OC2H5
H+
O
HOCH2CH2OH
O
O C OC2H5
LiAlH4 (C2H5)2O
O
O
CH2OH H+, H2O
O
CH2OH + HOCH2CH2OH
上海交通大学化学化工学院
(3) 维尼纶:聚乙烯醇含有多个亲水基团,为了提高其耐水性能,可用 甲醛使其部分缩醛化,得到性能优良的合成纤维——维尼纶。
(Ph)3P
- R1 C
R2
上海交通大学化学化工学院
G.Wittg于1953年开始系统研究了它与醛酮的反应,并应用在合 成上。建立了独特的结构和合成方法。
R1 C O + Ph3P C
R2
Ph3P + C
O- C
(Ph)3PO +
R1 CC
R2
缩醛对氧化剂、还原剂、碱稳定,对酸不稳定。
上海交通大学化学化工学院
应用:保护羰基。
(1) CH2 CHCHO
CH2 CH CHO OH OH
2C2H5OH
CH2 CHCH
OC2H5
[O]
OC2H5 H2O
H+, H2O
CH2 CH OH OH
OC2H5 OC2H5
SJTU
第十章 醛 酮
上海交通大学化学化工学院
(一)结构和命名:
1. 结构:
通式:CnH2nO ,醛、酮互为同分异构体。
官能团:
O
O
C H 醛基
C
羰基
碳原子采用sp2 杂化,三个σ键共 平面,羰基碳原子和氧原子上的p轨道 在侧面重叠生成π键 ,氧原子上还有 两对未共用电子。
羟醛缩合和克莱森缩合

羟醛缩合和克莱森缩合本文将介绍羟醛缩合和克莱森缩合这两个在有机合成中常用的反应。
首先会介绍这两种反应的基本概念和原理,然后详细讨论它们的条件、机理以及应用。
最后,将对这两个反应进行比较,探讨它们的区别和优缺点。
一、羟醛缩合羟醛缩合是一种重要的有机反应,其主要特点是在碱性条件下,由两个羟醛分子发生缩合反应,生成糖醇。
常用的羟醛缩合反应有aldol缩合和Cannizzaro反应。
1. aldol缩合aldol缩合是通过α-碳上的羰基和另一个由羰基中的氢原子去质子化的醛或酮分子发生羟醛缩合反应,生成一个具有α,β-不饱和酮或醛基团的化合物。
它是一种重要的C-C键形成反应,广泛应用于有机合成中。
在aldol缩合反应中,首先碱性条件下,羰基中的一个氢被去质子化,生成一个负离子中间体。
然后负离子中间体发生亲核加成反应,攻击另一个羰基上的C=O,形成新的C-C键。
最后,经过脱水和再次质子化的步骤,得到目标产物。
aldol缩合的具体条件取决于底物的结构以及所需合成的产物。
一般来说,碱性条件有利于反应进行,常见的碱催化剂有氢氧化钠、氢氧化钾等。
此外,溶剂的选择也很重要,常用的溶剂有乙醚、二甲基亚砜等。
2. Cannizzaro反应Cannizzaro反应是一种特殊的羟醛缩合反应,发生在没有活泼的氢可以质子化的分子上。
在这种反应中,一个醛分子被氧化为相应的羧酸,而另一个醛分子则被还原为相应的醇,生成两种不同的产物。
Cannizzaro反应需要碱性条件,可使用强碱如氢氧化钠或氧化钠。
此外,反应温度对反应速率也有很大影响,通常在室温下进行。
二、克莱森缩合克莱森缩合是一种醛或酮与酸性条件下的恶性酯发生缩合反应,生成β-羰基酮或醛的重要方法之一。
在这个反应中,通过醛或酮中的羰基与底物中的α-碳上的氢发生去质子化,形成负离子中间体,然后负离子中间体与酸反应,进行缩合,得到目标产物。
克莱森缩合是一种实用的有机合成方法,广泛应用于天然产物合成和药物合成等领域。
基础有机化学反应总结

基础有机化学反应总结一、烯烃1、卤化氢加成(1)【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排(2)【特点】反马氏规则【机理】自由基机理(略)【注】过氧化物效应仅限于HBr、对HCl、HI无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】2、硼氢化—氧化【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】【例】3、X2加成【机理】【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
不对称的烯烃,亲核试剂进攻主要取决于空间效应。
【特点】反式加成4、烯烃的氧化1)稀冷高锰酸钾氧化成邻二醇。
3H 33H3稀冷KMnO 433M nO OOO H 2O 3H 33H 3 2)热浓酸性高锰酸钾氧化3)臭氧氧化4)过氧酸氧化5、烯烃的复分解反应【例】6、共轭二烯烃1)卤化氢加成2)狄尔斯-阿德尔(Diels-Alder )反应【描述】共轭二烯烃和烯烃在加热的条件下很容易生成环状的1,4加成产物。
【例】二、脂环烃1、环丙烷的化学反应【描述】三元环由于张力而不稳定,易发生加成反应开环,类似碳碳双键。
【特点】环烷烃都有抗氧化性,可用于区分不饱和化合物。
【注】遵循马氏规则【例】2、环烷烃制备1)武兹(Wurtz)反应【描述】通过碱金属脱去卤素,制备环烷烃。
【例】2)卡宾①卡宾的生成A、多卤代物的α消除B、由某些双键化合物的分解②卡宾及烯烃的加成反应【特点】顺式加成,构型保持【例】③类卡宾【描述】类卡宾是一类在反应中能起到卡宾作用的非卡宾类化合物,最常用的类卡宾是ICH2ZnI。
【特点】顺式加成,构型保持【例】三、炔烃1、还原成烯烃1)、顺式加成2)、反式加成2、亲电加成1)、加X 2【机理】中间体Br+R 2R 1【特点】反式加成 2)、加HXR R HBr RR Br H (一摩尔的卤化氢主要为反式加成)3)、加H 2O【机理】【特点】炔烃水合符合马式规则。
3.11 缩合反应资料

4、应用实例:
CH3(CH2)8 CH3 C O + H H C COOEt Cl CH3 C O C2H5ONa -HCl CH3(CH2)8 CH3 C O -CO2 CH3 H CH3(CH2)8 C C O H 2-甲基十一醛 H C COOEt
NaOH
H+
CH3(CH2)8
H C COOH
4、反应分类 (1)酯-酯Claisen缩合 酯自缩合:
CH3 O C + H OC2H5 CH2 O OH2 O C2H5ONa C CH3 C C C OC2H5 + C2H5OH OC2H5
反应历程为:
C2H5ONa + HCH2 O C OC2H5
O Na CH2-C-OC2H5 + C2H5OH
O OH OH
O
茜素(染料)
(二)Knoevenagel – Doebner反应
1、概念:含活泼亚甲基的化合物(如丙二酸、丙二酸酯、氰乙酸酯、 乙酰乙酸酯等)在它们的羧酸盐或吡啶、哌啶等有机碱的催化作用 下,与醛、酮即可发生缩合,生成α,β-不饱和化合物的反应。 2、反应通式:
R1 C O + H2C R2 Y X R1 C R2 C Y X + H2O
(四)反应机理
以乙醛在碱催化下的自缩合为例:
稀 NaOH 2 CH3CHO CH3CH(OH)CH2CHO -羟基丁醛 O CH3 C H O CH3 C H OHH C C H H O C -H2O H CH3CH=CH-CHO + CH2 C H O fast CH3 + OH
-
3、Tollens 缩合(羟基化反应):由于甲醛不含α-氢,与其他含α-氢
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
缩醛和羟醛缩合
缩醛和羟醛缩合是有机化学中的两种重要的反应类型。
它们在合成
有机分子的过程中有着广泛的应用。
一、缩醛反应
缩醛反应是一种酸催化的加成-消除反应。
其反应的原理在于,醛或酮
通过酸催化和另一个醇缩合,生成半缩醛或半缩酮,然后通过分子内
消除的方式,生成α,β-不饱和酮或醛。
缩醛反应的优点在于,它可以使用室温下的酸催化剂,反应速度快,
并且产率高。
缺点是它只适用于不含α,β-不饱和双键的醛或酮。
二、羟醛缩合反应
羟醛缩合反应是一种羟基醛和羰基化合物之间的缩合反应。
其反应的
原理在于,当羟基醛和另一个羰基化合物在碱性条件下反应时,它们
会发生缩合反应,并且生成α-羟基酮或α,β-不饱和酮。
羟醛缩合反应的优点在于,它不需要强酸催化剂,而是使用碱性条件,因此产生的废物较少,更为环保。
但是,该反应需要较高的反应温度
和反应时间,反应产物的产率较低。
三、应用
缩醛反应和羟醛缩合反应在有机合成中有着广泛的应用。
例如,在糖
化学领域,羟醛缩合反应可用于单糖的合成。
在药物合成中,缩醛反
应可用于合成部分药物分子骨架。
总的来说,缩醛反应和羟醛缩合反应是两种非常有用的有机合成反应类型,它们的应用范围广泛,可以用于合成各种复杂的有机分子。
