醛,酮的反应与制备
醛、酮的亲核加成反应

缩醛(酮 ),双醚结构。 对碱、氧化剂、还原剂稳定, 可分离出来。 酸性条件下易水解
醛较易形成缩醛,酮在一般条件下形成缩酮较困难,用 1,2-二醇或1,3-二醇则易生成缩酮。
上述反应可以看成是1mol醛与2mol醇分子间脱去1mol水,生 成缩醛。
比如:
H3C C
H
H OC2H5 O+
H OC2H5
2.与饱和亚硫酸氢钠(40%)的加成
R C O + H SO3Na
(CH 3)H
R C
(CH 3)H
OH SO3Na
α -羟基磺酸盐
产物α -羟基磺酸盐为白色结晶,不溶于饱和的亚硫酸氢钠 溶液中,容易分离出来;与酸或碱共热,又可得原来的醛、 酮。故此反应可用以提纯醛、酮。
α- 羟基磺酸钠如果在酸或碱存在下,加水稀释,产物又可 分解成原来的醛或酮。
例题: 2-己酮中含有少量3-己酮,试将其分离除去。
CH3CCH2CH2CH2CH3 O
2-己 酮
CH3CH2CCH2CH2CH3 O
3-己 酮
(1)加 NaHSO3饱 和 溶 液
(2)分 离
沉淀
滤液
SO3Na
CH3CCH2CH2CH2CH3
OH
(1)加 HCl溶 液
CH3CH2CCH2CH2CH3 , H2O, NaHSO3 O
CH3CHCH2 CH3
CH2OH
(3)写出合成路线。
HCHO + CH3CHCH2MgBr 干 醚 CH3
CH3CHCH2CH2OMgBr CH3
H2O CH3CHCH2CH2OH CH3
若合成仲醇 OH 因连有羟基的碳原子上R和Rˊ两个烃基故
RCHR'
经典化学合成反应标准操作醛酮的合成

经典化学合成反应标准操作醛酮的经典合成目录1.前言 (4)2.由醇合成醛酮 (4)2.1铬(VI)试剂 (4)2.1.1 Jones氧化(Cr2O3/H2SO4/acetone) (4)2.1.2 Collins氧化(Cr2O3.2Py) (5)2.1.3 PCC(Pyrindium Chlorochromate)氧化 (8)2.1.4 PDC(Pyrindium Dichromate)氧化 (9)2.2 用活性MnO2氧化 (10)2.2.1 用活性MnO2氧化示例一: (10)2.3用DMSO氧化 (11)2.3.1 DMSO-(COCl)2氧化(Swern Oxidation) (11)2.3.2 DMSO-SO3-Pyridine (12)2.4 用氧铵盐氧化 (13)2.4.1 用氧铵盐氧化示例: (13)2.5 用高价碘试剂氧化 (14)2.5 .1 Dess-Martin氧化反应示例: (14)2.5.2 IBX氧化反应示例: (15)2.6 亚硝酸钠和醋酐氧化 (15)2.6.1 亚硝酸钠和醋酐氧化示例 (15)2.6 TPAP-NMO 氧化 (16)2.6.1 TPAP-NMO 氧化示例 (16)2.7 1,2-二醇的氧化 (16)2.7.1 1,2-二醇的氧化示例一: (17)2.7.1 其他1,2-二醇的氧化相关文献: (18)3.由卤化物合成醛酮 (18)3.1 由伯卤甲基和仲卤甲基的氧化合成醛酮 (18)3.1.1 用DMSO氧化(Kornblum反应) (18)3.1.2用硝基化合物氧化(Hass反应) (20)3.1.3用乌洛托品氧化(Sommelet反应) (21)3.1.4用对亚硝基二甲苯胺氧化吡啶翁盐氧化(Kröhnke反应) (22)3.1.5用胺氧化物氧化 (22)3.2 由二卤甲基或二卤亚甲基合成醛酮 (23)3.2.1 由二卤甲基合成醛反应示例: (23)3.3 由有机金属化合物的酰化合成醛酮 (24)3.3.1 由有机金属化合物的酰化合成醛酮示例 (25)3.4 由Pd催化反应合成醛 (25)4.由活泼甲基或活泼亚甲基烷烃合成醛酮 (25)4.1 用SeO2氧化合成醛酮 (26)4.1.1 用SeO2氧化合成醛酮示例 (26)4.2用空气氧化合成酮 (26)4.2.1用空气氧化合成酮反应示例: (27)4.3 用铬酸氧化合成酮 (27)4.3.1 用铬酸氧化合成酮示例 (27)4.4用高锰酸盐氧化合成酮 (29)4.5 用醌氧化合成酮 (29)5.由羧酸及其衍生物合成醛酮 (30)5.1由羧酸合成醛 (30)5.1.1用金属氢化物还原 (30)5.1.2由脱CO2合成醛 (31)5.1.3由羧酸合成酮 (31)5.2由酰氯及酸酐合成醛酮 (33)5.2.1用Rosenmund法合成 (33)5.2.2用金属氢化物还原 (34)5.3由酯及内酯合成醛 (35)5.3.1 酯通过DIBAL还原为醛示例: (36)5.4由酰胺合成醛酮 (36)5.4.1 由酰胺合成醛酮 (37)5.4.2 McFadyen-Stevens Reaction (38)5.5由酯或酰氯经Weinreb酰胺合成醛酮 (39)5.5.1 由Weinreb酰胺还原合成醛反应示例一 (40)5.5.2由Weinreb酰胺还原合成酮反应示例: (41)5.6由氰合成醛酮 (41)5.6.1DIBAL 还原腈到醛示例(最重要的方法) (42)5.6.2Li(EtO)3AlH 还原腈到醛示例(较重要的方法) (43)5.6.3Ranney Ni 加氢还原氰到合成醛示例 (43)5.6.4有机金属试剂对腈加成合成酮示例 (44)6. 由烯烃、芳环合成醛酮 (46)6.1 由烯烃臭氧氧化合成醛 (46)6.2 烯烃用OsO4/NaIO4氧化合成醛 (47)6.3 烯烃经由有机硼化合物中间体的烯烃甲酰化合成醛 (47)6.5 由烯烃的甲酰化合成醛 (48)6.5.1 Vilsmeyer反应 (48)6.5.2 Duff’s 甲酰化 (51)6.5.3 Reimer-Tiemann 甲酰化 (52)6.5.4 Gattermann甲酰化 (53)6.5.5 多聚甲醛/甲醇镁苯酚甲酰化 (53)6.5.6氯化锡/多聚甲醛苯酚甲酰化 (54)6.5.7重氮化后甲酰化 (54)6.6烯烃经加成-氧化反应合成酮 (56)6.6.1 烯烃经加成-氧化反应合成酮示例 (56)7. 由炔烃合成醛酮 (57)7.1 由加成-氧化反应合成醛酮 (57)7.2 由氧化反应合成酮 (57)7.3 由加成-水解反应合成酮 (58)7.4 由加成-还原反应合成酮 (59)7.5 由加成-烷基化,酰化等反应合成酮 (59)8. 由醚及环氧化合物合成醛酮 (59)8.1 Claisen重排 (59)8.2酸催化下环氧化物重排 (61)8.2.1 酸催化下环氧化物重排合成醛酮示例一 (61)8.3氧化法 (61)8.4 水解法缩醛或酮合成醛酮 (61)9. 由胺合成醛 (62)9.1胺的氧化 (62)9.1.1 胺的氧化合成醛反应示例: (63)9.2 由胺经由西佛碱的方法 (64)9.2.1 由胺经由西佛碱合成醛示例 (64)9.3 自苯胺衍生物合成 (64)10. 由硝基化合物合成醛酮 (64)11. 由Friedel-Crafts反应合成芳基酮 (65)11.1 由Friedel-Crafts反应合成芳基酮示例 (68)12. Dieckmann 缩合脱酸 (69)13. 由合成子合成醛酮 (71)14. 由砜合成醛酮 (71)15. Michael 反应和类似反应(Addition, Condensation) (71)1.前言醛和酮是一类重要的有机化合物,其合成在有机合成中占有非常重要的地位。
有机化学第十一章 醛酮

NaCl + SO2↑ + H2O
Na2CO3 NaHCO3 + Na2SO3
(C)转化成α-羟基腈 α-羟基磺酸钠与NaCN作用,其磺酸基则被氰基取代生成α-
羟基腈。如:
CHO NaHSO3
OH C
Na C N
SO3Na
OH C
CN
HCl H2O
OH C
COOH
优点:可以避免使用易挥发、有毒的HCN,且产率较高。
O
O
CH3-C-CH2-C-CH3
2,4 戊二酮
H3C O
3 甲基环戊酮
练习
命名下列化合物。
O CH3 CH3CCH2C=CH2
4-甲基-4-戊烯-2-酮
CH3CHCH2CHO OH
3-羟基丁醛
O CH3CHCH2CCH3
Cl
4-氯-2-戊酮
O CCH3
CHO
CHO
苯乙酮
CH2CHO
苯甲醛
CH3
3-甲基苯甲醛
= = R
++ δ
δ
R δ+ δ
CO >
CO
H
R
羰基碳原子连有基团的体积↑,空间位阻↑,不利于亲核试剂
进攻,达到过渡状态所需活化能↑,故反应活性相对↓。
综上所述,下列醛、酮进行亲核加成的相对活性为:
Cl3C C=O
H
> C=O
> CH3 C=O
R
> C=O
Ar
> C=O
>
H
H
H
H
H
= CH3 C O >
α -二醛或酮:两个羰基直接相连。 β -二醛或酮:两个羰基间隔一个碳原子。
第九章 醛和酮

2 卤化-水解 4 加特曼-科赫反应
烯烃
炔烃
芳烃
醇
1 氧化 2 频哪醇重排
醛 酮
氧化
羧酸
取代
羧酸衍生物
还原
乙醛和丙酮的工业制备
一、羰基的亲核加成反应
1. 与氢氰酸加成(碱催化下)
R C (CH3)H O + H CN
OH-
R C (CH3)H
OH
H+
R C
OH COOH
CN
(CH3)H
α-羟基腈(氰醇)
RCH2OH
甲醛 伯醇
R
CH OH R1
R1
醛 仲醇
R1 RMgX +
H2O H
+
R
C OH 酮
叔醇
R2
该反应在有机合成中是增长碳链的方法。
5.与氨的衍生物加成—缩合反应
上式也可直接写成:
C O + H2 N Y C N Y + H2O
反应一般控制在弱酸性溶液(醋酸)中进行
Y: OH NH2 NH NH NO2 NO2
1、还原成醇
O H __ __ R C H( R ) OH R CH H( R )
__ __
(1)用金属氢化物还原 金属氢化物(NaBH4、 LiAlH4等)还原剂,具有选 择性,只还原羰基,不还原 C=C双键
CH3CH CHCHO
NaBH4
CH3CH CHCH2OH
(2)催化加氢 常用的催化剂是镍、钯、铂 产率高,选择性不强,不饱和基团同时被还原, 此法常用来制备饱和醇。
O O __ __ H R C__ H Ar C__ H
单酮 酮 混酮
酮分子中的羰基称为酮基。醛分子中的 称为醛基,醛基可以简写为—CHO。
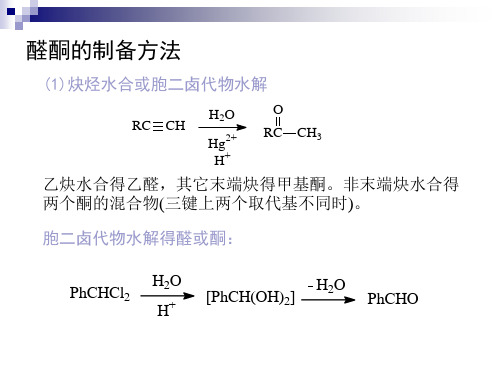
醛酮的制备方法.
要控制氧化条件防止醛的进一步氧化。用CrO3-醋酐能防止醛
的氧化:
O
CH3
CH(OCCH3)2
CHO
CrO3-Ac2O
H2O
HOAc/H2SO4
Br
Br
Br
在这里生成的中间物二乙酸酯不易继续被氧化,它水解后即 得芳醛。
(4) 由醇氧化或脱氢(见醇酚醚章) (5) Friedal-Crafts酰基化(见芳香烃章) (6) Gattermann-Koch反应(见芳香烃章) (7) Reimer-Tiemann反应(见醇酚醚章) (8) Rosenm炔烃水合或胞二卤代物水解
RC CH
H2O
Hg2+ H+
O RC CH3
乙炔水合得乙醛,其它末端炔得甲基酮。非末端炔水合得 两个酮的混合物(三键上两个取代基不同时)。
胞二卤代物水解得醛或酮:
PhCHCl2
H2O H+
[PhCH(OH)2]
H2O
PhCHO
(2) 由烯烃制备 (a)烯烃氧化
i) 烯烃臭氧化然后还原水解得醛或酮 ii) 氢甲醛化
RCH=CH2
例如:
H2, CO, Co2(CO)8 加热,加压
RCH2CH2CHO (主) + RCHCH3 (次) CHO
H2, CO, Co2(CO)8 加热,加压
CHO 65%
(3) 由芳烃氧化
CH3 MnO2
65% H2SO4
CHO 40%
O RCCl + H2
Pd+BaSO4 喹啉+S
O RCH
(9) 酰氯与烷基铜锂作用
COCl + Me2CuLi
醚 78°C
COMe 81%
原创——醛、酮化学反应归纳

原创——醛、酮化学反应归纳醛、酮化学反应归纳一、与RMgX加成甲醛产生一级醇,其他的醛生成二级醇。
酮生成三级醇。
羰基两旁的基团太大时,酮不能正常地反应。
会发生烯醇化反应或还原反应:烯醇化反应:还原反应:当格式试剂反应结果不好时,用烷基锂反应可以得到较好的结果。
Cram规则一:大基团L与R呈重叠型,两个较小的基团在羰基两旁呈邻交叉型,与格式试剂(包括氢化铝锂等)反应时,试剂从羰基旁空间位阻较小的基团S一边接近分子,故(i)是主要产物,(ii)为副产物。
R与L处于重叠型为最有利的反应时的构象。
二、与HCN反应(碱性条件下)生成的,—羟基腈可用于制备,—羟基酸,羟基酸可进一步失水变为,,,—不饱和酸(如有机玻璃)。
氢氧根可以增加氰离子的浓度,但碱性不能太强。
该反应符合Cram规则一。
Cram规则二:当醛、酮的,—C上有—OH,—NHR时,由于它们能与羰基氧形成氢键,反应物主要为重叠型构象,发生亲核加成反应时,亲核试剂主要从S基团的一侧进攻。
Strecker(斯瑞克)反应:羰基化合物与氯化铵、氰化钠生成,—氨基腈、再水解制备,—氨基酸的反应三、与炔化物的反应四、与含氮亲核试剂的加成A、与NH或RNH反应(与一级胺生成亚胺,又称西弗碱)(弱酸性条件) 32亚胺在稀酸中水解,可得原羰基化合物与胺:故该反应可用来保护羰基。
B、与RNH反应(生成烯胺) 2要使反应完全,需将水除去。
在稀酸水溶液中烯胺可水解得到羰基化合物与二级胺。
可发生氮烷基化与碳烷基化反应。
C、与氨衍生物的反应a.与羟胺的反应(生成肟)肟与亚硝基化合物发生互变异构。
亚硝基化合物与酮肟的互变异构:亚硝基化合物与醛肟的互变异构:亚硝基化合物在没有,氢时是稳定的,有,氢时有利于平衡肟。
肟的Z构型一般不稳定。
Beckmann(贝克曼)重排反应:酮肟在酸性催化剂中重排生成酰胺的反应催化剂:HSO、多聚磷酸、PCl、PhSOCl(苯磺酰氯)、SOCl (亚硫酰氯)24532 反应特点:离去与迁移基团处于反式;基团的离去与迁移是同步的;迁移基团在迁移前后构型不变。
醛和酮亲核加成反应附加答案

醛和酮亲核加成反应附加答案醛和酮亲核加成反应⼀、基本要求1.掌握醛酮的命名、结构、性质;醛酮的鉴别反应;不饱和醛酮的性质 2.熟悉亲核加成反应历程及其反应活性规律;醛酮的制备⼆、知识要点(⼀)醛酮的分类和命名(⼆)醛酮的结构:醛酮的官能团是羰基,所以要了解醛酮必须先了解羰基的结构。
C=O 双键中氧原⼦的电负性⽐碳原⼦⼤,所以π电⼦云的分布偏向氧原⼦,故羰基是极化的,氧原⼦上带部分负电荷,碳原⼦上带部分正电荷。
(三)醛酮的化学性质醛酮中的羰基由于π键的极化,使得氧原⼦上带部分负电荷,碳原⼦上带部分正电荷。
氧原⼦可以形成⽐较稳定的氧负离⼦,它较带正电荷的碳原⼦要稳定得多,因此反应中⼼是羰基中带正电荷的碳。
所以羰基易与亲核试剂进⾏加成反应(亲核加成反应)。
此外,受羰基的影响,与羰基直接相连的α-碳原⼦上的氢原⼦(α-H )较活泼,能发⽣⼀系列反应。
亲核加成反应和α-H 的反应是醛、酮的两类主要化学性质。
1.羰基上的亲核加成反应醛,酮亲核加成反应的影响因素:羰基碳上正电性的多少有关,羰基碳上所连的烃基结构有关,亲核试剂的亲核性⼤⼩有关。
(1)与含碳的亲核试剂的加成○1氰氢酸:○2 炔化物O 116.5。
杂化键键近平⾯三⾓形结构πσC CO δδ酸和亲电试剂进攻富电⼦的氧碱和亲核试剂进攻缺电⼦的碳涉及醛的反应氧化反应()αH 的反应羟醛缩合反应卤代反应C OHCN 羟基睛○3 有机⾦属化合物:(2)与含氮的亲核试剂的加成○11o 胺○2 2o 胺○3氨的多种衍⽣物:(3)与含硫的亲核试剂的加成-------亚硫酸氢钠产物α-羟基磺酸盐为⽩⾊结晶,不溶于饱和的亚硫酸氢钠溶液中,容易分离出来;与酸或碱共热,⼜可得原来的醛、酮。
故此反应可⽤以提纯醛、酮。
反应围:醛、甲基酮、⼋元环以下的脂环酮。
反应的应⽤:鉴别化合物,分离和提纯醛、酮。
(4)与含氧的亲核试剂的加成○1⽔○2醇醛较易形成缩醛,酮在⼀般条件下形成缩酮较困难,⽤12⼆醇或13-⼆醇则易⽣成缩酮。
醛与酮的反应规律与化学合成

醛与酮的反应规律与化学合成醛和酮是有机化合物中常见的官能团。
它们在化学反应中具有独特的特性和反应规律,这为有机合成提供了广泛的应用。
在本文中,我们将讨论醛和酮的反应规律以及它们的化学合成方法。
一、醛与酮的反应规律1. 加成反应:醛和酮可以与亲电试剂进行加成反应,形成新的官能团或化合物。
常见的加成反应有羟醛和酮的羟醛反应、醛和酮的氨基反应、醛和酮的亚胺反应等。
2. 氧化反应:醛可以被氧化剂氧化为羧酸,而酮则稳定,不容易被氧化剂氧化。
常用的氧化剂有高锰酸钾(KMnO4)、过氧化氢(H2O2)等。
3. 还原反应:醛和酮可以被还原剂还原为醇。
常用的还原剂有氢气(H2)、亚磷酸盐(H3PO2)等。
4. 缩合反应:酮可以和醛发生缩合反应,生成β-羟醛。
二、醛与酮的化学合成1. 直接氧化法:一些醛可以通过直接氧化法进行合成。
例如,甲醛可以通过甲烷的催化氧化得到。
2. 羰基化合物的还原:一些醛和酮可以通过还原羰基化合物得到。
例如,醛可以通过还原酮得到。
3. 羧酸的还原:一些羧酸可以通过还原得到醛。
例如,乙酸可以通过还原得到乙醛。
4. 醇的氧化:一些醇可以通过氧化反应得到醛。
例如,乙醇可以通过氧化得到乙醛。
5. 羟醛的羰基还原:一些羟醛可以通过羰基还原反应得到醛。
例如,葡萄糖可以通过羰基还原反应得到葡萄糖醛。
总结起来,醛和酮具有丰富的反应规律和化学合成方法。
通过选择合适的试剂和反应条件,可以实现对醛和酮的控制合成,得到目标化合物。
这为有机合成提供了重要工具和方法。
在工业生产和实验室合成中,醛和酮的合成方法广泛应用于药物合成、有机合成、材料合成等领域。
研究醛和酮的反应规律和化学合成方法,对于新化合物的发现和合成具有重要意义。
结论本文讨论了醛和酮的反应规律以及化学合成方法。
通过加成反应、氧化反应、还原反应和缩合反应,可以实现对醛和酮的控制合成。
选择合适的试剂和反应条件,可以得到目标化合物,为有机合成提供了重要工具和方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
醛,酮的反应与制备
醛,酮的反应与制备
它可分为三类:与亲核试剂的加成反应;α-H反应;氧化还原反应
1.与亲核试剂的加成反应(1)与含碳亲核试剂的加成
① 它与有机金属(格氏试剂、烷基锂)反应,然后水解得到各种醇
②与氢氰酸反应在碱性条件下与醛,酮生成α-羟基腈③与炔化物加成继而水解生成
炔醇
④ Wittig使醛、酮和磷的内部盐反应生成烯烃(2)与含氧亲核试剂加成① 与水反
应
②与醇反应,得到的产物称为半缩醛,半缩酮,酸性条件下,与醇继续反应生成缩醛,缩酮。
(3)与含氮亲核试剂的加成①与羟胺反应生成肟
② 与肼或氨基脲反应,产物分别为腙和氨基脲
③与伯胺反应生成亚胺;与仲胺反应生成烯胺;与叔胺不反应④与未取代的氨反应产
物复杂
rrco+h2n-yrrcn-y+h2oh2n-y=h2n-oh,h2n-r,h2n-nhconh2,h2n-nhc6h3(no2)2-
2,4
(4)与含硫亲核试剂的加成反应①与亚硫酸氢钠反应②与硫醇反应2.α-h的反应
(1) H的α-酸度:羰基和烯醇形式的互变异构
(2)α-h的卤代:与卤素自动生成α-卤代产物,副产物卤化氢起催化作用
(3)羟醛缩合:在碱存在下,通过分子间缩合反应β-羟醛缩合反应生成醛。
在类
似的条件下,酮也可以缩合。
(4)曼尼希反应:在酸性条件下,带有活性氢的醛和酮可
以与甲醛和胺一起形成β-氨基醛、酮。
3.氧化还原反应
(1)氧化反应:醛被过酸氧化得到羧酸,酮被过酸氧化得到酯,这种反应叫做拜耳-
维利格反应。
(2)还原反应:在过渡金属催化下加氢,或用硼氢化钠、铝锂氢化物等还原剂还原
成醇。
酮也可在乙醇钠中用金属钠还原成仲醇,而在弱酸环境下,可以用铁粉或锌粉还原
醛类。
用金属钠或镁汞齐在非质子溶剂中还原酮,得到双分子还原产物邻二醇。
在盐酸中,锌汞齐可以将醛和酮的羰基还原为亚甲基,这被称为克莱门斯还原法。
在高温、高压和碱
的存在下,以肼为还原剂,醛和酮的羰基也能还原成亚甲基,称为沃尔夫-卡西纳还原法。
(3) Connie Charlotte反应:Noα-在碱性条件下,H的一个醛分子被氧取代
化成酸,一分子辈还原成醇。
若有甲醛,则甲醛优先被氧化。
(4)安息香缩合反应:两分子苯甲醛在cn-存在下缩合生成安息香。
其他没有α-h的醛也缩合
(5)默克-默里还原偶联反应:在氯化钛(TiCl3或TiCl4)存在下,用锌铜偶联剂
还原醛和酮,得到双分子偶联烯烃。
这个反应叫做j.e.麦克默里还原偶联反应。
通常,会得到顺式和反式异构体的混合物。
多官能团的醛,酮
1.1,2-二酮(α-二酮)
(1)被高碘酸氧化而发生两个羰基之间共价键的断裂,生成两分子羧酸
(2) 2.1,3-二酮在碱性条件下发生二苯羟基乙酸重排(β-二酮)
在碱存在下可以完全转化为烯醇盐,这种烯醇盐能和卤代烃或酰氯作用转化成亚甲基
上的烷基化和酰化产物。
3.α,β-不饱和醛,酮
(1) HCN添加:始终为1,4-添加。
HCN被添加到双键中。
通常情况下,不添加双键。
(2)迈克尔(michael)加成反应:
(3)与有机金属的反应:有机锂,仅1,2加成;有机铜锂,1,4加成;有几种镁,1,2加成和1,3加成。
