群体进化-基于简化基因组测序
诺禾致源2014产品手册

CONTENTS
建库测序
06 建库测序服务
基因组测序
08 动植物基因组测序 10 基因组特征评估 11 基因组de novo测序 14 泛基因组测序(pan-genome) 16 动植物重测序 17 变异检测(基于全基因组重测序) 19 变异检测(基于简化基因组测序) 21 单个性状定位 24 遗传图谱(基于全基因组重测序) 26 遗传图谱(基于简化基因组测序) 28 群体进化(基于全基因组重测序) 30 群体进化(基于简化基因组测序)
[2] Zhi X Y, Yao J C, Li H W, et al. Genome-wide identification, domain architectures and phylogenetic analysis provide new insights into the early evolution of shikimate pathway in prokaryotes[J]. Molecular phylogenetics and evolution, 2014, 75: 154-164.
[8] Xu X, Dong G X, Hu X S, et al. The genetic basis of white tigers[J]. Current Biology, 2013, 23(11): 1031-1035. [9] Jiang W, Liu Y, Xia E, et al. Prevalent role of gene features in determining evolutionary fates of whole-genome duplication duplicated genes in flowering plants[J]. Plant physiology, 2013, 161(4): 1844-1861. [10] Zhang G, Cowled C, Shi Z, et al. Comparative analysis of bat genomes provides insight into the evolution of flight and immunity[J]. Science, 2013, 339(6118): 456-460. [11] Fan Y, Huang Z Y, Cao C C, et al. Genome of the Chinese tree shrew[J]. Nature communications, 2013, 4: 1426. [12] Wang M Y, Zhao P M, Cheng H Q, et al. The Cotton transcription factor TCP14 functions in auxin-mediated epidermal cell differentiation and elongation[J]. Plant physiology, 2013, 162(3): 1669-1680. [13] Lu S, Zong C, Fan W, et al. Probing meiotic recombination and aneuploidy of single sperm cells by wholegenome sequencing[J]. Science, 2012, 338(6114): 1627-1630. [14] Guo S, Zhang J, Sun H, et al. The draft genome of watermelon (Citrullus lanatus) and resequencing of 20 diverse accessions[J]. Nature genetics, 2013, 45(1): 51-58. [15] Li S, Li R, Li H, et al. SOAPindel: Efficient identification of indels from short paired reads[J]. Genome research, 2013, 23(1): 195-200. [16] Li M, Wu H, Luo Z, et al. An atlas of DNA methylomes in porcine adipose and muscle tissues[J]. Nature communications, 2012, 3: 850. [17] Fan W, Li R. Test driving genome assemblers[J]. Nature biotechnology, 2012, 30(4): 330. [18] Liu C M, Wong T, Wu E, et al. SOAP3: ultra-fast GPU-based parallel alignment tool for short reads[J]. Bioinformatics, 2012, 28(6): 878-879. [19] Hvilsom C, Qian Y, Bataillon T, et al. Extensive X-linked adaptive evolution in central chimpanzees[J]. Proceedings of the National Academy of Sciences, 2012, 109(6): 2054-2059. [20] Zhang G, Fang X, Guo X, et al. The oyster genome reveals stress adaptation and complexity of shell formation[J]. Nature, 2012, 490(7418): 49-54.
基于简化基因组测序的大黄鱼耐高温性状全基因组关联分析

基于简化基因组测序的大黄鱼耐高温性状全基因组关联分析陈小明;李佳凯;王志勇;蔡明夷;韩芳;刘贤德【期刊名称】《水生生物学报》【年(卷),期】2017(041)004【摘要】利用Illumina HiSeqTM 2500测序平台,对通过高温胁迫实验筛选得到的20尾耐高温和20尾不耐高温的大黄鱼(Larimichthys crocea)进行了简化基因组测序(SLAF-seq),每个样本的平均测序深度达到10.26×,共获得419211个高质量的群体单核苷酸多态性(SNP)位点.利用TASSEL软件的混合线性模型(MLM)进行全基因组关联分析(GWAS),共筛选到38个与大黄鱼耐高温性状显著相关的SNP 位点(P<2.39E–08).利用BLAST程序定位每个SNP位点在大黄鱼基因组中的位置,并分析其周围的功能基因.结果在38个SNPs附近共找到26个已知的功能基因,这些基因主要与细胞转录、代谢、免疫等功能相关.研究结果可为下一步大黄鱼耐高温分子机制解析及耐高温品种的选育提供参考.%Twenty thermal-tolerant and twenty thermal-sensitive individuals ofLarimichthys crocea were sequenced using specific-locus amplified fragment (SLAF-seq) technology based on Illumina HiSeqTM2500 platform. 419211 SN-Ps were identified with an average read depth of 10.26× for each sample. Thirty-eight SNPs(P<2.39E–08) signifi-cantly related with thermal tolerance trait were identified according to association analysis. The SNP locations in large yellow croaker genome were identified using BLAST program, and functional genes around SNP were annotated. Twenty-six genes with known functions were discovered around 38 SNPs, which mainly regulatecell transcription, metabolism and immunity. These results provide basic information to analyze thermal-tolerant molecular mechanism and develop thermal-tolerant lines ofLarimichthys crocea in the future.【总页数】6页(P735-740)【作者】陈小明;李佳凯;王志勇;蔡明夷;韩芳;刘贤德【作者单位】集美大学水产学院,农业部东海海水健康养殖重点实验室,厦门361021;集美大学水产学院,农业部东海海水健康养殖重点实验室,厦门 361021;集美大学水产学院,农业部东海海水健康养殖重点实验室,厦门 361021;集美大学水产学院,农业部东海海水健康养殖重点实验室,厦门 361021;集美大学水产学院,农业部东海海水健康养殖重点实验室,厦门 361021;集美大学水产学院,农业部东海海水健康养殖重点实验室,厦门 361021【正文语种】中文【中图分类】Q344+.1【相关文献】1.基于简化基因组测序技术和基因芯片技术比较研究黄羽肉鸡基因组选择 [J], 刘天飞;罗成龙;王艳;周广源;马杰;舒鼎铭;苏国生;瞿浩2.基于MAGIC群体的水稻抽穗期和产量相关性状全基因组关联分析 [J], 魏秀彩;李小湘;刘金栋;刘利成;黎用朝;潘孝武;董铮;刘文强;熊海波;闵军3.基于50K SNP芯片技术对金华猪和嵊县花猪繁殖性状的全基因组关联分析 [J], 蔡薇;罗才玉;项云;章啸君;徐宁迎;郭晓令4.基于简化基因组测序的红罗非鱼低温体色变异全基因组关联分析 [J], 徐鸿飞;朱华平;陈诏;黄彩林;袁宗伟;赵何勇;李华;杨宾兰;周大颜;苏换换5.基于SNP标记的小麦籽粒性状全基因组关联分析 [J], 张芳;任毅;曹俊梅;李法计;夏先春;耿洪伟因版权原因,仅展示原文概要,查看原文内容请购买。
简化基因组测序

新一代高密度分子标记图谱实现基因资源的高效开发和利用
1
简化基因组深度测序技术——SLAF-seq
4
一.技术原理
4
二.技术应用过程
5
三.技术应用领域
8
四.技术优势
9
基于SLAF-seq技术分子标记图谱的功能基因组学研究解决方案 12
一.基于SLAF-seq技术的单体型图谱绘制
12
二.基于SLAF-seq技术的遗传图谱绘制
HWUSI-EAS1767:32:7:36:45680:9021:1#0-B/1 + Simple_A
GGAGTAATAAATTTATTACATCATCATCAGAGTTTTAGCAXXXXXXXXXXTTGGTTGCCAAAAGCACTAGCTGAGTCTAAAAATCAAGTT
三.技术应用领域
大规模种质资源研究
对目标物种的全部重要种质资源进行筛选,如整 体选取1000个以上品种,在个体水平上开发全基 因组分子标记,利用分子标记定义物种的重要单 体型区段,一次性获得该物种全部重要种质资源 的海量分子标记数据库,为该物种搭建分子遗传 进化研究平台。
高密度遗传连锁图谱构建
...
图1. SLAF-seq基本技术流程图
BIOMARKER TECHNOLOGIES 4
二.技术应用过程
研究基础
整理目标物种已有 的研究基础,包括 基因组相关信息、 转录组相关信息、 群体材料性状调查 信息及近缘物种相 关信息等。
SLAF-SEQ TECHNOLOGY
基因组信息 BAC序列
DNA
Digestion
Fragment Selection
High-throughput Sequencing
群体进化-基于全基因组重测序

DNA样品总量: ≥3 μg 适用范围样品要求文库类型测序策略与深度分析内容项目周期 群体进化(基于全基因组重测序)标准分析时间为120天,个性化分析需根据项目实际情况进行评估HiSeq PE150推荐测序深度≥5X/个体350 bp小片段DNA文库1. 已有参考基因组序列的物种中不同亚群(自然群体)2. 各亚群间划分明显,同一亚群内的个体有一定代表性3. 每个亚群选取10个样本左右(推荐动物≥10个,植物≥15个)4. 总体不少于30个样本与参考基因组比对群体SNP检测、注释及统计系统进化树构建群体遗传结构分析群体主成分分析连锁不平衡分析选择消除分析候选基因GO和KEGG富集构建单体型图谱种群历史和有效群体大小技术参数针对已有参考基因组的物种,对其各亚种进行全基因组重测序获得基因组信息,通过与参考基因组比对,得到大量高准确性的SNP、InDel、SV等变异信息,讨论群体的遗传结构、遗传平衡和影响遗传平衡的因素,从而从分子层面揭示该物种的进化机制、环境适应性等系列问题。
该技术能精准地得到全基因组内所有遗传信息,最大程度地挖掘出群体内遗传变异。
诺禾具有丰富的群体遗传学项目经验,研究成果发表于Nature Genetics(Li, M, et al. 2013& Zhou, XM,et al. 2014)等。
参考文献[1] Li M, Tian S, Jin L, et al . Genomic analyses identify distinct patterns of selection in domesticated pigs and Tibetan wild boars [J]. Nature genetics, 2013, 45(12): 1431-1438.[2] Zhan S, Zhang W, Niitepo ~ld K, et al . The genetics of monarch butterfly migration and warning colouration [J]. Nature, 2014.案例解析[案例一] 家猪和藏猪的群体进化分析[1]2013年,诺禾致源科技服务团队与四川农业大学研究者合作发表该成果。
动植物全基因组重测序简介

全基因组重测序是对已知基因组序列的物种进行不同个体的基因组测序,并在此基础上对个体或群体进行差异性分析。
基于全基因组重测序技术,人们可以快速进行资源普查筛选,寻找到大量遗传变异,实现遗传进化分析及重要性状候选基因的预测。
随着测序成本降低和拥有参考基因组序列物种增多,全基因组重测序成为动植物育种和群体进化研究迅速有效的方法。
简化基因组测序技术是对与限制性核酸内切酶识别位点相关的DNA进行高通量测序。
RAD-seq(Restriction-site Associated DNA Sequence)和GBS (Genotyping-by-Sequencing)技术是目前应用最为广泛的简化基因组技术,可大幅降低基因组的复杂度,操作简便,同时不受参考基因组的限制,可快速鉴定出高密度的SNP位点,从而实现遗传进化分析及重要性状候选基因的预测。
简化基因组技术尤其适合于大样本量的研究,可以为利用全基因组重测序技术做深度信息挖掘奠定坚实的基础。
全基因组重测序和简化基因组测序技术可广泛应用于变异检测、遗传图谱构建、功能基因挖掘、群体进化等研究,具有重大的科研和产业价值。
产品脉络图。
基于简化基因组测序的大黄鱼耐高温性状全基因组关联分析

doi: 10.7541/2017.91基于简化基因组测序的大黄鱼耐高温性状全基因组关联分析陈小明李佳凯王志勇蔡明夷韩芳刘贤德(集美大学水产学院, 农业部东海海水健康养殖重点实验室, 厦门 361021)摘要: 利用Illumina HiSeq TM 2500测序平台, 对通过高温胁迫实验筛选得到的20尾耐高温和20尾不耐高温的大黄鱼(Larimichthys crocea)进行了简化基因组测序(SLAF-seq), 每个样本的平均测序深度达到10.26×, 共获得419211个高质量的群体单核苷酸多态性(SNP)位点。
利用TASSEL软件的混合线性模型(MLM)进行全基因组关联分析(GWAS), 共筛选到38个与大黄鱼耐高温性状显著相关的SNP位点(P<2.39E–08)。
利用BLAST程序定位每个SNP位点在大黄鱼基因组中的位置, 并分析其周围的功能基因。
结果在38个SNPs附近共找到26个已知的功能基因, 这些基因主要与细胞转录、代谢、免疫等功能相关。
研究结果可为下一步大黄鱼耐高温分子机制解析及耐高温品种的选育提供参考。
关键词: 大黄鱼; 高温胁迫; 简化基因组测序; 单核苷酸多态性; 全基因组关联分析中图分类号: Q344+.1 文献标识码: A 文章编号: 1000-3207(2017)04-0735-06大黄鱼(Larimichthys crocea)是我国重要的海洋经济鱼类, 在自然海区分布于30—60 m水深, 适应温度在10—32℃, 最适生长温度在18—25℃[1, 2]。
当前, 大黄鱼的养殖模式仍以浅海网箱养殖为主,网箱深度为4—6 m。
由于水深较浅, 夏季大黄鱼处在(或接近)其可耐受高温的时间较长, 持续高温会导致大黄鱼生长减缓、抗病力下降, 加上病原生物感染, 常常引发大黄鱼大量发病死亡。
因此, 开展大黄鱼耐高温选育的研究, 对提高养殖大黄鱼的度夏成活率具有重要的参考意义。
全基因组关联分析-基于全基因组重测序
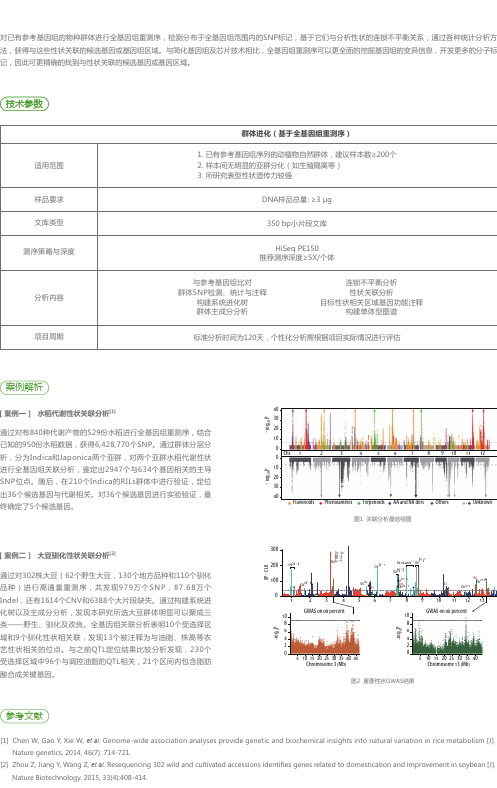
图2 重要性状GWAS结果
参考文献
[1] Chen W, Gao Y, Xie W, et al. Genome-wide association analyses provide genetic and biochemical insights into natural variation in rice metabolism [J]. Nature genetics, 2014, 46(7): 714-721.
对已有参考基因组的物种群体进行全基因组重测序,检测分布于全基因组范围内的SNP标记,基于它们与分析性状的连锁不平衡关系,通过各种统计分析方 法,获得与这些性状关联的候选基因或基因组区域。与简化基因组及芯片技术相比,全基因组重测序可以更全面的挖掘基因组的变异信息,开发更多的分子标 记,因此可更精确的找到与性状关联的候选基因或基因区域。
ቤተ መጻሕፍቲ ባይዱ
与参考基因组比对 群体SNP检测、统计与注释
构建系统进化树 群体主成分分析
连锁不平衡分析 性状关联分析
目标性状相关区域基因功能注释 构建单体型图谱
标准分析时间为120天,个性化分析需根据项目实际情况进行评估
案例解析
[案例一] 水稻代谢性状关联分析[1]
通过对有840种代谢产物的529份水稻进行全基因组重测序,结合 已知的950份水稻数据,获得6,428,770个SNP。通过群体分层分 析,分为Indica和Japonica两个亚群,对两个亚群水稻代谢性状 进行全基因组关联分析,鉴定出2947个与634个基因相关的主导 SNP位点。随后,在210个Indica的RILs群体中进行验证,定位 出36个候选基因与代谢相关。对36个候选基因进行实验验证,最 终确定了5个候选基因。
番茄遗传图谱与基因定位研究进展

DOI:10.3969/J.ISSN.1672 7983.2020.03.004番茄遗传图谱与基因定位研究进展杜海东,游 茜,李毅丰,毛秀杰,张 宁,王 帅(河北科技师范学院园艺科技学院,河北秦皇岛,066600)摘要:对国内外关于番茄遗传图谱的构建以及叶色突变、果实质量、果实形态、果实品质、抗病性等重要性状基因定位研究进行了归纳总结,并对今后的研究趋势进行了展望。
关键词:番茄;遗传图谱;基因定位;研究进展中图分类号:S641.201 文献标志码:A 文章编号:1672 7983(2020)03 0020 06番茄(SolanumlycopersicumL.)是研究植物遗传学、分类学、生理学、分子生物学等学科的重要实验材料。
现阶段番茄育种目标主要集中在:增产量、提品质、多抗性、促早熟等[1]。
但传统育种技术对土地面积需求较大、容易受外界环境条件影响、育种效率低、周期长;而分子标记辅助选择(MolecularMarkerAssistedSelection,MAS)育种可以在分子水平上直接反应遗传本质的优点,快速、准确地筛选出目标性状,缩短育种时间,加快种质资源创新进程。
分子标记辅助选择育种将会成为现代作物遗传育种的主要潮流,而获得与目的基因紧密连锁的分子标记是分子标记辅助选择育种的重要基础,实现这一目标的主要手段便是构建高密度遗传图谱[2]。
遗传图谱是依据染色体交换与重组,以多态性的遗传标记为“路标”,以标记间重组率为“图距”,确定不同多态性标记位点在每条连锁群上排列顺序和遗传距离的线性连锁图谱[3,4]。
高密度、高分辨率遗传图谱的构建是进行基因定位、基因克隆、基因结构与功能研究和标记辅助选择育种的前提。
构建遗传图谱包括:(1)选择用于建立作图群体的亲本组合;(2)构建研究所需的暂时或永久性作图群体;(3)选择合适的对群体基因型进行鉴定的多态性分子标记;(4)对标记基因型数据进行连锁分析,应用作图软件绘制遗传图谱[5]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
X. malinche X. birchmanni
ቤተ መጻሕፍቲ ባይዱ
B
X. nezahualcoyotl
X. montezumae
X. nigrensis
X. multilineatus
X. pygmaeus
X. continens
C
X. alvarezi
X. signum
X. mayae
X. hellerii
X. kallmani X. mixei
minor allele frequency
Sword Intermediate No sword
X. meyeri
X. gordoni
X. couchianus
X. variatus
X. evelynae
A
X. milleri
X. xiphidium
X. andersi
X. maculatus
X. cortezi
参考基因组未知
tag聚类、局部组装 SNP检测及统计 构建系统进化树 群体主成分分析 群体遗传结构分析
标准分析为90天,个性化分析需根据项目实际情况进行评估
案例解析
[案例一] RAD-seq 研究剑尾鱼属的系统发生关系[1] 剑尾鱼属(花鳉科)包括26种来自中美洲的热带小型淡水鱼,外 型上最吸引人的莫过于雄鱼的剑尾。关于剑尾鱼属的系统发生关 系一直存在争议,本文用RAD-seq来解决这一问题。26种鱼每种 测5个个体,作为外群的3种鱼每种测2-7个个体,共测序143个个 体,平均每个个体每个位点覆盖深度为15X,找到约66,000个 SNP,以从未有的精度构建了剑尾鱼属的系统发育树。
利用RAD-seq或GBS简化基因组技术,对物种的各亚种个体进行测序,获得酶切位点附近基因序列信息,进而检测大量高准确性的SNP变异信息,以进行群 体亲缘关系、群体结构分析等。目前RAD-seq和GBS两种简化基因组技术在群体分析中已得到广泛应用,其不受参考基因组限制,且极大的简化了基因组, 成本大幅降低,尤其适合大样本量或基因组较大物种的群体遗传学研究。
D
X. clemenciae
X. monticolus
Priapella intermedia
Gambusia holbrooki
Heterandria formosa
图1 剑尾鱼属祖先的剑尾状态重建
图2 最小等位基因频率(MAF)分布
参考文献
[1] Jones J C, Fan S, Franchini P, et al. The evolutionary history of Xiphophorus fish and their sexually selected sword: a genomewide approach using restriction site-associated DNA sequencing [J]. Molecular ecology, 2013, 22(11): 2986-3001.
[案例二] GBS技术:一种新型、高效、高性价比的牛的基因分型 方法[2]
高通量基因分型方法推动了动物复杂性状的研究,但是高昂成本 仍然是动物大规模遗传改良的瓶颈。作者采用GBS技术对产7种牛 磺酸的47种牛进行基因分型研究,表明GBS技术是一种新型、灵 活、高通量、高性价比,并能够对基因组选择或全基因组关联研 究提供足够标记密度的分型方法。
技术参数适用范围 样品要求 酶切处理 类型 测序策略与深度分析内容
项目周期
RAD-seq
GBS
某一物种中的不同亚群(自然群体); 各亚群间划分明显,同一亚群内的个体有一定代表性 ; 每个亚群选取10个样本左右(推荐动物≥10个,植物≥15个),总体不少于30个样本。
DNA样品总量: ≥3 μg
EcoR≥5X,比对样本≥1X
DNA样品总量: ≥2 μg
Mse I、EcoR I、Nla III≥10万,平均8X/Tag
参考基因组已知
与参考基因组比对 SNP检测、注释及统计
构建系统进化树 群体主成分分析 群体遗传结构分析
