有机化学讲座-6
(浙江选考)高考化学二轮复习 专题七 第6讲 有机化学实验教案-人教版高三全册化学教案
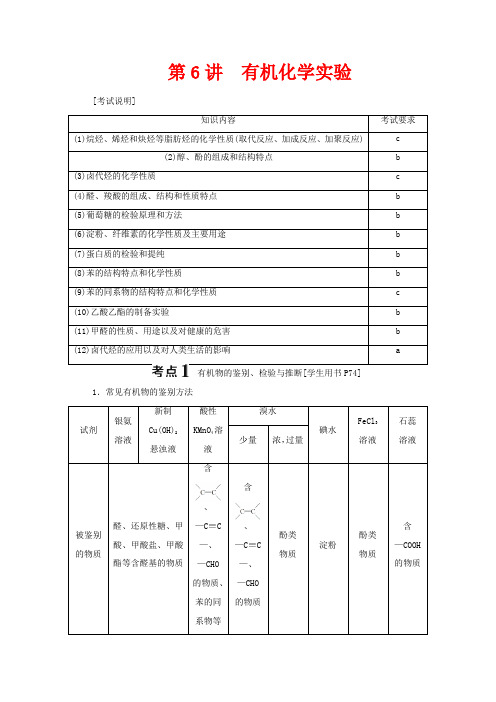
第6讲有机化学实验[考试说明]知识内容考试要求(1)烷烃、烯烃和炔烃等脂肪烃的化学性质(取代反应、加成反应、加聚反应) c(2)醇、酚的组成和结构特点 b(3)卤代烃的化学性质 c(4)醛、羧酸的组成、结构和性质特点 b(5)葡萄糖的检验原理和方法 b(6)淀粉、纤维素的化学性质及主要用途 b(7)蛋白质的检验和提纯 b(8)苯的结构特点和化学性质 b(9)苯的同系物的结构特点和化学性质 c(10)乙酸乙酯的制备实验 b(11)甲醛的性质、用途以及对健康的危害 b(12)卤代烃的应用以及对人类生活的影响 a有机物的鉴别、检验与推断[学生用书P74] 1.常见有机物的鉴别方法试剂银氨溶液新制Cu(OH)2悬浊液酸性KMnO4溶液溴水碘水FeCl3溶液石蕊溶液少量浓,过量被鉴别的物质醛、还原性糖、甲酸、甲酸盐、甲酸酯等含醛基的物质含、—C≡C—、—CHO的物质、苯的同系物等含、—C≡C—、—CHO的物质酚类物质淀粉酚类物质含—COOH的物质(1)卤代烃中卤族元素的检验 ①原理⎭⎪⎬⎪⎫R —X +NaOH ――→H 2O △R —OH +NaX NaX +AgNO 3===AgX ↓+NaNO 3 ⇒根据沉淀AgX 颜色判断X 是Cl 、Br 还是I⎭⎪⎬⎪⎫R —CH 2—CH 2—X +NaOH ――→醇△R —CH===CH 2+NaX +H 2O NaX +AgNO 3===AgX ↓+NaNO 3 ⇒同上原理判断X 的类型(此方法只适用于能发生消去反应的卤代烃)②步骤:取少量卤代烃―→加NaOH(醇)溶液―→加热―→冷却―→加足量稀HNO 3―→加AgNO 3。
(2)淀粉水解程度的推断①原理:(C 6H 10O 5)n +n H 2O ――→H 2SO 4微热n C 6H 12O 6; 淀粉遇碘水变蓝;CH 2OH(CHOH)4CHO +2Ag(NH 3)2OH ――→水浴加热 CH 2OH(CHOH)4COONH 4+H 2O +2Ag↓+3NH 3。
2020全国高中化学竞赛辅导-有机化学(决赛篇)-有机合成反应:α-卤代酮的合成和杂环的酚羟基或醚的

R
COOCH2CF3
COOCH2CF3
HO R'
R'
R
COOCH2CF3
DEAD, PPh3
COOCH2CF3
NO2
HO R' R
NO2
R
CN
CN
DEAD, PPh3
R'
30
小结
➢ 一般手性醇翻转成其他氧,氮,硫衍生物时需要用 Mitsunobu反应
➢ 反应产物极性与副产物相差较大,效果较好。内部期刊 上有一篇怎样除去副产物的文摘。
O H3C
1. i-Pr2NLi, THF
O
2. p-TsCl, 0'C H3C
Cl
O Ph
CH3 COOEt
1. NaH, DMSO 2. CuBr
O CH3
Ph
Br
COOEt
另外,甲基酮可用甲基格式试剂与相应的Weinreb 酰胺来制备, 如下例即是先 合成甲基酮,后溴化来合成α-溴代酮的。
O
DCC, DMAP, NHMeOMe
33
2. 氯代
杂环的酚羟基的氯代一般用三氯氧磷1,2,3或三氯氧磷与五氯化磷混合 4,5处理。使用五氯化磷的条件更强,用于难以发生的杂环的酚羟基 的氯代反应。杂环烷氧基的氯代也可用三氯氧磷直接处理
2.1 杂环的酚羟基的用三氯氧磷氯代反应示例1
O2N
I
N OH
POCl3
O2N
I
N Cl
34
2.2 杂环的酚羟基用三氯氧磷与五氯化磷混合处理氯代 反应示例
3.1 应用重氮酮(由酰氯和重氮甲烷反应而来)合成α-溴化酮示例
(COCl)2 COOH
1. CH2N2/Et2O 2. HBr/AcOH COCl
高三有机复习专题讲座课件

感谢观看
THANKS
加成反应
芳香烃在催化剂作用下与氢气、卤素或卤化氢等发生加成反应, 生成新的化合物。
氧化反应
芳香烃在常温下与氧气反应,生成苯甲酸等氧化物。
醇、醚、醛、酮、羧酸等其他有机化合物的化学反应机理
醚的裂化反应
在高温和催化剂作用下,醚会 发生裂化反应,生成醇和烯烃 。
酮的氧化反应
酮在常温下与氧气反应,生成 羧酸。
萃取法
利用不同物质在两种不混溶溶剂中的 溶解度差异进行分离,常用于分离固 体和液体混合物。
有机合成与分离技术的应用实例
药物合成
通过有机合成方法制备具有治疗作用的化合物,如抗生素、抗癌 药物等。
精细化学品生产
利用有机合成技术生产表面活性剂、染料、香料等精细化学品。
天然产物提取与修饰
通过分离和提纯技术从天然产物中提取有效成分,并对其进行结构 修饰以改进其性能。
详细描述
有机化学是化学的一个重要分支,主要研究有机化合物的结构、性质、合成和反应机理 。有机化合物是指含碳元素的化合物,除了碳的氧化物、碳酸盐、碳酸氢盐等无机化合 物外,其他的含碳化合物均属于有机化合物。有机化学在化学工业、医药工业、农业等
领域中有着广泛的应用,对于推动人类社会的发展和进步具有重要意义。
04
有机化学在生活中的应用
有机化学在医药领域的应用
药物合成
有机化学在药物合成中发挥着重要作用,通过合成有机分子,可以 开发出具有治疗作用的药品。
药物筛选
利用有机化学的方法和手段,可以对大量的化合物进行筛选,寻找 具有潜在治疗作用的先导化合物。
药物代谢
有机化学还可以研究药物在体内的代谢过程,了解药物的作用机制和 代谢途径。
有机化学b教学课件-第6章卤代烃金属有机化合物-课后更新

有机化学B第六章卤代烃基本内容和重点要求z卤代烃的结构特点、化学性质代结构特性z亲核取代反应的类型、机理及影响因素亲核取代反应的类型机理及影响因素z消除反应的类型、机理及影响因素z卤代烃与活泼金属的反应及应用重点要求掌握卤代烃的重要反应。
亲核取代反应、消除反应机理及影响因素。
概念及应用卤代烃可以看作是烃分子中一个或多个氢原卤代烃可以看作是烃分子中个或多个氢原子被卤原子取代后所生成的化合物。
应用:制冷剂、干洗剂、涂改液、不粘锅涂层、人造血液等。
卤代烃分类z烃基:饱和卤代烃、不饱和卤代烃和芳香卤代烃。
代烃z卤素数目:一卤、二卤、多卤代烃。
z卤素所连接的碳原子不同:一级、二级、三级卤代烃1.选择主链系统命名法中卤代烃与烷烃命名类似,将卤素视为取代基。
2.主链编号3取代基列出顺序写出名称3.取代基列出顺序、写出名称1375642137564224-45-2,4-二甲基-5-氯庚烷4,5-二甲基-2-溴庚烷顺-1-甲基-2-溴环己烷(1S, 2R)-1-甲基-2-溴环己烷(1S2R)12卤代烃的物理性质z除氯甲烷、氯乙烷、溴甲烷、氯乙烯、溴乙烯外,15个碳以下的卤代烃都是液体。
外15个碳以下的卤代烃都是液体z沸点:碘代烃>溴代烃>氯代烃(同种烷基) z密度:一氯代烃<水;溴代烃,碘代烃,多卤代烃>水溴代烃碘代烃多卤代烃z卤代烃无色,碘代烃常显棕红色,是因为碘代烷易分解生成游离的碘。
烯烃加卤化氢++ 烯烃加卤素烷烃卤代反应++ 醇的卤代反应HCl+乙醚,0 o C卤代烷的结构δ+δ−H 2.1F 4.0Li 1.0Be1.5B2.0C2.5N3.0O3.5Cl3.0Br2.8诱导效应I2.5卤代烷的反应H 具有酸性,可与X C −H:415KJ/mol X :离去基团δ基团同时离去,消除反应。
H: 415 KJ/mol C −C: 347 KJ/mol C −Cl: 326 KJ/mol δ+δ−C −Br: 285 KJ/mol C −I: 213 KJ/molαβ带正电荷,具有负电荷及孤对电子的分子进攻,亲核取代反应。
有机化学ppt课件完整版

重排反应通常发生在含有不稳 定结构或官能团的化合物中, 需要加热或加入催化剂。在重 排过程中,分子的骨架结构可 能发生变化。
重排反应在有机合成中具有重 要的应用价值,可以用于合成 具有特定结构或官能团的有机 化合物。同时,重排反应也是 研究有机化合物结构和性质的 重要手段之一。
08
有机化学在生活中的应 用
定义
特点
加成反应在有机合成中具有重要的应用价值,可以用 于合成各种烯烃、醇、醛、酮等有机化合物。
应用
加成反应通常发生在分子中的不饱和键上,需要一定 的反应条件和催化剂。
消除反应
定义
消除反应是指有机化合物分子中 失去一个小分子(如水、卤化氢
等),形成不饱和键的反应。
种类
包括脱水消除、脱卤化氢消除、 热消除等。
反应。此外,醇还可以与酸反应生成酯,是重要的有机合成原料。
酚类化合物结构与性质
结构特点 酚类化合物的分子中含有苯环和羟基(-OH)官能团,通 式为Ar-OH,其中Ar为苯基或其衍生物。
物理性质 酚类化合物一般为无色或淡黄色的固体或液体,具有特殊 的气味和较强的毒性。酚的熔点和沸点较高,易溶于有机 溶剂。
化学性质
03
可发生加成、氧化、还原等反应,如与氢气加成生成醇,被弱
氧化剂氧化成酸。
酮类化合物结构与性质
结构特点
羰基(C=O)两侧连接烃基或芳基,无双键性质。
物理性质
沸点较高、难溶于水、易溶于有机溶剂。
化学性质
主要发生加成和还原反应,如与氢气加成生成醇,被还原剂还原 成仲醇。
醌类化合物结构与性质
结构特点
04
醇、酚、醚类化合物
醇类化合物结构与性质
01
结构特点
李艳梅有机化学课件第六章

影 同族元素:原子越小,原子核对电子的控制越牢,可极化性越小:
响
因
RI > RBr > RCl > RF
素 孤对电子比成键电子结合得松散,可极化性更强,反应易发生在孤
对电子上。
RO
H
弱键电子比强键电子结合松散,可极化性更强,更易发生反应。
可极化性更强的 键通常更易反应
Elimination occurs when this bond broken
Chapter Alkyl halides 6
第六章 卤代烷
精选可编辑ppt
Organic Chemistry A (1) By Prof. Li Yan-Mei Tsinghua University
1
Content
6.1 Classification, nomenclature and isomers 6.2 Physical property & Spectrum data 6.3 Chemical properties 6.4 Mechanism of nucleophilic substitution 6.5 Elimination reaction vs nucleophilic
A The charge distribution of a molecule changes under exoteric
electric field. The capacity of charge distribution change is then called “Polarizable nature”
2、共用电子并不完全转移到另一原子,只是电子云密度发 生变化。 即:键的极性发生变化(与C-H键比较)
3、沿碳链传递,并随着链的增长而迅速减弱或消失。 经过三根共价键后,其影响就极弱,可忽略不计。
加热、冷却与干燥
电炉
电炉可代替酒精灯和煤气灯用于一般加热。按功率大 小有500W、800W、1000w等规格,温度高低可通过调节 电阻来控制。加热时容器与电炉间隔一块石棉网,保证 受热均匀。
马福炉又叫箱形电炉,炉膛呈长方形,用电热丝
或硅碳棒来加热,最高温度可达 1300℃,使用时将物 质放在坩埚内送入炉膛中加热,温度由温度控制器控制 ,用于灰化滤纸和有机物成分,不允许加热液体和其它 易挥发的腐蚀性物质,也不可用来熔炼金属。
有机化学 试管内液体的量不能超过试管容积的1/3,以防止沸腾时液体外溢, 加热前,试管外壁应该擦干,保持干躁。用试管夹夹住,夹在离试管口约 1/3处。加热时,试管与桌面成45度角,试管口不能对着人。加热时,先 使试管均匀受热,后加热液体的中上部再慢慢向下移,不时的移动试管, 以免局部过热而爆沸。用酒精灯加热时要用外焰加热。固体的加热试管口 应稍向下,防止水回流炸裂试管。 2.烧杯、烧瓶中液体的加热 对较多的液体加热可用烧杯,液体的量应以容积的1/3~2/3为宜,加 热前外壁应该擦干,保持干躁。烧杯须采用石棉网。烧瓶中液体的量不 超过其容积的1/2,必要时加入沸石1-2粒。
注意事项: ① 水浴锅内存水量应保持在总体积的 2/3。 ② 受热玻璃器皿不能触及锅壁和锅底。 ③ 加热时热浴的液面应略高于容器中的液面 。
水浴加热
有机化学实验技能专题讲座
油浴加热
加热温度在80℃~250℃之间可选择油浴。传热介质—油的 种类决定油浴所能达到最高温度。常用油类有植物油、液体石 蜡、甘油、硅油等。其中甘油和邻苯二甲酸二丁酯的混合液适 用于加热到140~180℃。植物油如菜油、花生油和蓖麻油,可 以加热到220℃,常在植物油中加入1%的对苯二酚等抗氧剂, 以增加其热稳定性。液体石蜡也可加热到220℃,但温度稍高则 易燃烧。硅油和真空泵油在250℃以上时较稳定,是理想的传热 介质,但价格贵。 注意事项: ①要在油浴中放温度计(温度计不要触及锅底),便于调节和 控制温度。 ②油浴所用的油中不能溅入水,防止加热时产生暴溅。 ③特别要注意的是,油浴过程中要防止火灾发生和油蒸气污染 环境。
高中化学选修五鲁科版专题讲座(六)羟基的性质
专题讲座(六)羟基的性质羟基与不同的烃基相连性质有很大的差别1.与脂肪烃基相连为醇。
(1)可以发生取代反应,由此反应可实现—OH转化为—X(X=卤素原子)、生成酯基或醚键。
(2)若与羟基相连的碳原子上有氢原子,则可发生催化氧化反应。
(3)若与羟基相连的碳原子的邻位碳原子上有氢原子,则可发生消去反应。
2.与苯环相连为酚。
(1)酚羟基不能发生消去反应,如果要引入其他的官能团,可考虑先使苯环与氢气发生加成反应,再考虑消去反应,生成双键后引入其他官能团。
(2)—OH的酸性明显增强。
[练习]_____ ___________________________________1.下图表示4-溴-1-环己醇所发生的4个不同反应,其中产物只含有一种官能团的是()A.②③B.①④C.①②④D.①②③④答案:A2.按以下步骤可从合成(部分试剂和反应条件已略去)。
请回答下列问题:(1)分别写出B、D的结构简式:B________;D.________。
(2)反应①~⑦中属于消去反应的是____(填反应代号)。
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到E的可能的结构简式为___________________________________________________。
(4)写出第④步C→D的化学方程式(有机物写结构简式,注明反应条件)_________________________________________________ _。
解析:解答此题的关键在于反应试剂的改变。
和H2反应,只能是加成反应,所以A为;而B是由A与浓硫酸加热得到,且能与Br2反应,B为;C为,而D能与Br2反应生成E,E与H2可再反应,所以D 中应有不饱和键,综合得出D为,E为,F 为。
答案:(1) (2)②④。
有机化学PPT课件
目录
• 有机化学简介 • 有机化学基础知识 • 有机化学反应 • 有机化学的应用 • 有机化学的未来发展
01 有机化学简介
有机化学的定义
总结词
有机化学是一门研究有机化合物 的组成、结构、性质、合成和反 应的学科。
详细描述
有机化学主要关注碳氢化合物及 其衍生物,即有机化合物,它们 是构成生命体的基本物质。
将有机化学与计算机科学、数学等学科交叉融合,利用计算机模拟和预测有机化学反应和 分子的性质,为有机化学研究和应用提供新的工具和手段。
THANKS FOR WATCHING
感谢您的观看
有机化学的发展历程
总结词
有机化学的发展经历了从天然有机化学到合成有机化学的演变,并不断推动着 人类社会的进步。
详细描述
早期的有机化学主要研究天然有机物,如动植物体内的化合物。随着科技的发 展,合成有机化学逐渐崛起,人们开始能够合成大量原本自然界不存在的有机 化合物,从而极大地丰富了人类的物质生活。
农业领域
1 2
农药合成
有机化学在农药合成中扮演着关键角色,通过设 计并合成新的农药分子,可以开发出更安全、更 有效的农药。
植物生长调节剂
有机化学也可用于合成植物生长调节剂,通过调 节植物生长代谢,提高作物产量和品质。
3
转基因作物
利用有机化学手段,可以修改作物的基因组,培 育出抗逆性更强、产量更高的转基因作物。
举例
乙醇被氧化生成乙醛。
04 有机化学的应用
医药领域
药物合成
有机化学在药物合成中发挥着重要作用,通过设计并合成新的有 机分子,可以开发出具有治疗作用的创新药物。
药物代谢
有机化学也涉及药物代谢的研究,了解药物在体内的代谢过程有助 于优化药物的疗效和降低副作用。
有机化学ppt课件完整版
有机化学ppt课件完整版目录•绪论•有机化合物的结构与性质•烃类化合物•烃的衍生物•有机合成与反应机理•生物活性有机化合物绪论碳氢化合物研究碳氢化合物(烃)的结构、性质、合成和反应机理。
碳氢化合物的衍生物研究烃的衍生物,如醇、醛、酮、羧酸、酯等有机化合物的结构、性质、合成和反应机理。
生命体系中的有机化合物研究生物体内的氨基酸、蛋白质、核酸、多糖等生命物质的结构、性质和功能。
经典时期19世纪初到20世纪初,以经验规律为指导,通过大量的实验总结出了许多有机化学的基本概念和原理。
萌芽时期从远古时期到18世纪,人们开始使用天然有机物,如木材、植物、动物等。
现代时期20世纪至今,以量子力学和统计力学为基础,发展出了现代有机化学的理论和方法,如分子轨道理论、价键理论、反应机理理论等。
环境领域有机化学在环境保护方面发挥着重要作用,如研究大气污染物、水体污染物的来源和治理方法等。
同时,有机化学也致力于开发环保材料和清洁能源。
材料领域合成纤维、塑料、橡胶等高分子材料广泛应用于服装、家居用品、交通工具等领域。
医药领域合成药物如抗生素、抗癌药物等对于治疗疾病具有重要意义。
同时,天然药物中提取的有效成分也是有机化学的研究对象。
农业领域合成农药和化肥对于提高农作物产量具有重要作用。
此外,生物农药和生物肥料的研发也需要有机化学的支持。
有机化学与生产生活的关系有机化合物的结构与性质碳原子通过四个共价键与其他原子或基团相连,形成复杂的有机分子结构。
碳原子的四价性键的极性空间构型碳原子与其他原子形成的共价键具有不同的极性,影响有机物的物理和化学性质。
有机化合物分子中的原子或基团在空间的排列方式不同,导致同分异构现象的产生。
030201有机化合物的结构特点03同分异构体的性质差异由于结构上的差异,同分异构体在物理性质、化学性质以及生物活性等方面表现出明显的不同。
01构造异构分子式相同但连接方式不同,如正丁烷和异丁烷。
02立体异构分子式相同、连接方式也相同,但空间构型不同,如顺反异构、对映异构等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+
Br2
Br X
C
C
Br X CH2CH3
CH2=CH
CH2
C
CH
Br2
CH2—CH CH2 Br X Br X
C
CH
2、亲核加成 、
O KOH HC CH
+
CH3COOH
CH2=CH—O — CCH3
乙酸乙烯酯
CuCN HC CH
+ HCN
RC=CH2 CN
3、酸性 、 PKa
HC C
HC≡CH ≡ ~25
H
H
三、单烯烃、二烯烃 单烯烃、
1、单烯烃亲电加成(AE) 、单烯烃亲电加成( 亲电加成
Nu
C
H
C
H C H H
结构: 键 结构:л-键 ----- 易亲电 加成
C
E
C
C
+ E+Nu-
C
亲电加成试剂: 、 亲电加成试剂:HX、HOSO3H、H2O、X2、I—Cl、I—Br等 、 、 、 等 1) 与卤化氢加成 )
旋 光 异 构 构 异 映
对
3
结构决定性质;性质反映结构 结构决定性质; 1、物理性质 : 状态、沸点、熔点、溶解度、相对密度、折射 、 状态、沸点、熔点、溶解度、相对密度、 率等。 率等 。 b.p 正戊烷 36.1℃ . ℃ 正戊烷 36.1℃ . ℃ 己烷 62.7℃ . ℃ 异戊烷 25℃ ℃ 相对分子质量) 庚烷 (相对分子质量) 98.4℃ . ℃ 新戊烷 直链>支链 直链> 9℃ ℃
1
几何异 构 因共价 键旋 转受阻 而产生 单键“ 自由” 旋转而 产生的立体异构。
H H CH3 H H CH3 CH3 H CH3 H H H CH3 CH3
旋光异 构
因分子中手酸因素而产生的立体异构。
Br CH3 C C2H5 Cl Br H5C2 CH3 C Cl Cl CH3 C Br C2H5
NH2 NHR > ? NR2 OH
强活化基
Cl + HNO 3
O NHCR OR
中等活化基
Cl H2SO4 NO 2 + NO 2
>
Ph R
>
H
>
F、Cl、Br、I
弱活化基
Cl
弱钝化基
m — 产物>40%,为间位定位基: 产物> ,为间位定位基:
NO 2 CN COOH CHO
强钝化基
NO2 + Br2 FeBr3
结构决定性质; 结构决定性质;性质反映结构
§3 有机化合物的性质与制备
一、链状烷烃
通式: 通式:CnH2n+2 C4H12 : 同分异构体的数目? 同分异构体的数目? C10H22 : 75个 C11H24 : 159个 C30H62 : 4 111 646 763个 个 个 个 同分异构体: 同分异构体: 构造异构: 碳干异构、官能团位置异构、官能团异构、 构造异构: 碳干异构、官能团位置异构、官能团异构、 互变异构 立体异构: 构型异构(顺反异构、旋光异构) 立体异构: 构型异构(顺反异构、旋光异构) 构象异构
卤代
C H
KMnO4 / H+ or K2Cr2O7 / H+
COOH
萘(naphthalene) )
60
SO3H 0~60℃
84% α — 萘 萘 萘
+ H2SO4
165℃
165℃ SO3H
β— 萘 萘 萘
61
六、卤代烃 R—X:RCH2X 伯卤代 : R2CHX 仲卤代 R3CX 叔卤代
HC
CNa +
Br
45
五、芳香烃、多环芳烃、杂环芳烃 芳香烃、多环芳烃、
1、结构 、
1 5 3 5 1 3
共振式(共振论) 共振式(共振论) 稳定的结构(稳定化能) 稳定的结构(稳定化能)
共轭效应
46
芳香性: 芳香性: 环上所有原子共面;环上所有原子参与共轭; 环上所有原子共面;环上所有原子参与共轭; 共轭电子数符合4n+2 共轭电子数符合 芳香性的判断: 芳香性的判断:
+ +
------休克尔规则 ------休克尔规则
H N
O
S
47
2、性质 、
H C H
难加成、 取代、 难加成、易取代、 α—氢易氧化及取代 氢易氧化及取代
1)苯环上的亲电取代(ArSE): )苯环上的亲电取代( 卤代、硝化、磺化、 反应、 卤代、硝化、磺化、F—C反应、氯甲基化等。 反应 氯甲基化等。
300 ~ 400℃
CH4 + CI2
or h ν
CH3CI + CH2CI2 + CHCI3 + CCI4
+ CH3CH3 + CH3CH2CI
5
反应机理 ⅰ链的引发 ⅱ链的增长
hν or △ CI2
CI· + CH4
2CI·
HCI + · CH3
· CH3
+ CI2
CICH3 + CI·
HCI
CH
NaI
O
NaCN H2O RCN RCOOH + H NaOAc O ROCCH3
R— C
CH
RI
卤素交换
1、亲核取代 SN (nucleophilic substitution) 、 R—X + ∶Nu— → RNu + X- 底物 亲核试剂 离去基团
-C
亲核试剂: 亲核试剂:
OH- OR- HS- I- CH3COO- H2O ROHNH3
CI· + HCH2CI
· CH2 CI + CI2
+ · CH2 CI
ⅲ链的终止
· CH3
· CH3
+
· · ·
CI2CH2 + CI·
· CH3
· · ·
CH3CH3
CH3CI
6
+ CI·
hν
CH4
+ CI2
hν
2CI·
CH3CI
机理: 机理:
CI2
CI·
·
+
CH4
·
CH3
CH3 + CI2
CH3CI
H E
+
E+ Nu-
+
NuH
48
机理: 机理:
+
Br 2
FeBr 3
Br
FeBr3 +
+
Br2
Br+ Br H + +
Br+
+
FeBr4
-
Br H
+
Br H
+
Br H
-H +
Br
σ—络合物 络合物
CH3 + Br2 FeBr3
CH3 Br +
CH3
o / p —产物>60% 产物> 产物
Br
硝化反应
CH3 + Na
H2O ~ 15
NaC
NH3 ~ 34
CCH + H2 3
RC
C-Na+
+
Br
RC
C — CH2CH2CH3
合成
4、催化氢化 、
Na CH3C CCH3 NH3( l )
CH3 H
H C C CH3
44
炔烃的制备
EtOK EtOH NaNH2
CH2 X
CH2 X
CH2
CHX
HC
CH
H
自由基的结构 :一般为平面型
H H
sp2
7
二、环烷烃 (CnH2n) 小环
C3~4 1、环烷烃的结构与稳定性 、
普通环 C5~7
中环 C8~11
大环 ≥C12
小环C—C弯曲键(香蕉键): 交盖程度小,不稳定。 弯曲键(香蕉键) 交盖程度小,不稳定。 小环 弯曲键
C C 105
o
由热化学方法测得小环、普通环的 热化学方法测得小环、 测得小环 稳定性顺序: 稳定性顺序:
H H 109 28' H
o
H
H
非键张力
12
e : 平伏键 a : 直立键
3、环烷烃的化学性质 、
15
注意:取代环丙烷
Br2 Br Br
X
▲断键规则 含H最少的C和 含H最多的C之 间的键断开
X2
CH2X
Br
+
Br2 Br
与卤素反应时,有光照或加热条件时写取代产 卤素反应时, 反应时 物。否则写加成产物。 否则写加成产物。
C
>
>
>
实际构型
11
2、环己烷的构象 、 有机分子结构的三个层次 分子式一定,分子中原子相互连接的次序与方式。 构造 : 分子式一定,分子中原子相互连接的次序与方式。 构造式一定,分子中原子在空间的排列。 构型 : 构造式一定,分子中原子在空间的排列。 构型一定,由于单键的转动改变立体形象。 单键的转动改变立体形象 构象 : 构型一定,由于单键的转动改变立体形象。 环己烷的构象 室温:椅式构象 船式构象0.1% 室温:椅式构象99.9% 船式构象
NO 2
反应困难, 反应困难,不能用于合成
Br
定位规律的理论解释:电子效应或共振论 定位规律的理论解释:
OH
O
Cl
N
O
p—π共轭 共轭 +C>- >-I >-
p—π共轭 共轭 +C<- <-I <-
π—π共轭 共轭 -I、- 、-C 、-
