氧化还原反应基础
氧化还原反应基础知识点

氧化还原反应1.常见的氧化剂与还原剂(1)常见的还原剂(能失电子的物质)①金属单质,如K、Na、Mg、Al、Zn、Fe、Cu等;②非金属阴离子,如S2-、I-、Br-、Cl-等;③含低价态元素的化合物,如NH3、CO、H2S、SO2、H2SO3、Na2SO3等;④低价态阳离子,如Fe2+等;⑤某些非金属单质,如H2、Si、C等。
(2)常见的氧化剂(能得电子的物质)①活泼的非金属单质,如F2、Cl2、Br2、I2、O2、O3等;②含高价态元素的化合物,如HNO3、KClO3、KMnO4、MnO2等;③高价态金属阳离子,如Fe3+、Cu2+、Ag+等;④能电离出H+的物质,如HCl、H2SO4、NaHSO4溶液等。
(3)某些既可作氧化剂又可作还原剂(既能失电子又能得电子)的物质①具有中间价态的物质:S、C、N2、Cl2、H2O2、SO2、H2SO3、Fe2+等;②阴、阳离子可分别被氧化还原的物质,如HCl、H2S、H2SO3、FeCl3等。
2.物质氧化性、还原性强弱的比较(1)根据化学方程式判断氧化剂+ 还原剂=还原产物+ 氧化产物氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物(2)根据元素周期表中元素性质的递变规律判断①同主族元素从上到下,非金属元素单质的氧化性逐渐减弱,对应阴离子的还原性逐渐增强;金属元素单质的还原性逐渐增强,对应阳离子的氧化性逐渐减弱。
②同周期元素从左到右,非金属元素单质的还原性逐渐减弱,氧化性逐渐增强。
对应阳离子的氧化性逐渐增强,阴离子的还原性逐渐减弱。
(3)根据金属活动顺序和非金属活动顺序判断①金属活动顺序表:K>Ca>Na>Mg>Al>Mn>Zn>Fe>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au在水溶液中,从前到后,金属单质的还原性逐渐减弱,对应金属阳离子的氧化性逐渐增强(如:Ag+ > Hg2+> Fe3+> Cu2+ > H+ > Fe2+ )。
超级详细氧化还原反应

目前对于氧化还原反应的研究主要集中在一些常见的反应类型上, 未来需要开发新的氧化还原反应,以适应不同的应用需求。
未来可能的应用领域
能源领域
利用氧化还原反应可以开发新的能源转换和储存技术,例 如燃料电池、太阳能电池等,用于替代传统的能源。
环境领域
利用氧化还原反应可以处理环境污染问题,例如水处理、 空气净化等,以保护环境。
3
氧化还原反应在生态系统中也扮演着重要角色, 如氮循环和硫循环等过程中都涉及到氧化还原反 应。
05
CATALOGUE
氧化还原反应的未来研究
需要进一步研究的问题
反应机理的深入研究
对于氧化还原反应的微观反应过程和机理,还需要进一步深入研究 ,以揭示反应过程中的细节和影响因素。
反应动力学和热力学研究
对于氧化还原反应的动力学和热力学性质,还需要深入研究,以了 解反应条件对反应速率和产物的影响。
04
CATALOGUE
氧化还原反应的应用
在工业上的应用
氧化还原反应在工业上被广泛应用,例如在化学 工业中合成有机物、制备无机盐等。
氧化还原反应在电化学工业中扮演着重要角色, 如电池和电解池中发生的氧化还原反应。
氧化还原反应还被用于纺织工业中,如漂白和染 色等。
在生物学上的应用
01
02
03
氧化还原反应在生物体 内发挥着重要作用,如 细胞呼吸和能量代谢等
发生变化。
氧化是电子转移的过程,其中原 子或分子失去电子并被氧化,而 获得电子的原子或分子则被还原
。
电子转移通常涉及化学键的形成 和断裂,从而改变原子或分子的
化学性质。
氧化还原反应的能量变化
能量变化可以是吸热或放热,这取决于反应的类型和环 境。
大学无机化学-第七章-氧化还原反应-电化学基础-课件

种元素的原子总数各自相等且电荷数相等 ④ 确定两半反应方程式得、失电子数目的最小公倍
数。将两个半反应方程式中各项分别乘以相应的 系数,使得、失电子数目相同。然后,将两者合 并,就得到了配平的氧化还原反应的离子方程式。 有时根据需要可将其改为分子方程式。
3Cl2 (g) + 6OH- = 5Cl- + ClO3- + 3H2O 3Cl2 (g) + 6NaOH = 5NaCl + NaClO3 + 3H2O
无机化学
§7.1 氧化还原反应的基本概念
例 4 配平方程式
Cr(OH)3 (s) + Br2 (l) + KOH
K2CrO4 + KBr
Cr(OH)3 (s) + Br2 (l)
电极组成:Pt , Cl2(p) | Cl- (a)
电极反应: Cl2 + 2e
2Cl-
无机化学
§7.2 电化学电池
3. 金属-金属难溶盐-阴离子电极
将金属表面涂有其金属难溶盐的固体,然后浸 入与该盐具有相同阴离子的溶液中构成的电极
电极组成:Ag ,AgCl(s)| Cl- (a) 电极反应:AgCl + e Ag + Cl电极组成:Hg ,Hg2Cl2(s)| Cl- (a) 电极反应:Hg2Cl2+2e 2Hg +2Cl-
无机化学
§7.1 氧化还原反应的基本概念
2-2 半反应法(离子—电子法) 配平原则 (1)反应过程中氧化剂得到的电子数等于还
原剂失去的电子数 (2)反应前后各元素的原子总数相等
氧化还原反应基础知识梳理

点燃氧化还原反应·基础知识1、氧化还原反应是指:反应前后,有元素化合价发生了变化的反应。
如,C + O 2 === CO 2 中,C 的化合价,反应前为0价,反应后为+4价;O 的化合价,反应前为0价,反应后为-2价。
所以,只需要观察是否有元素化合价发生了变化,就能判断氧化还原反应。
化合价变化的实质:电子的转移..... 两种情况:① 共价化合物(不含金属阳离子或NH + 4的化合物,如H 2O 、HCl 等)H 2+Cl 2→2HCl ,反应前H 和Cl 均为0价,化合生成HCl 后分别变成了+1和-1价。
是因为氢原子和氯原子共用了一对电子,并且由于氯原子核电荷数较大,吸引电子的能力强于氢原子,会将共用的一对电子拉向自己,使自己显负价,而氢就显正价。
如下左图所示。
② 离子化合物(包含金属阳离子或NH +4的化合物。
如NaCl 、FeSO 4等)2Na+Cl 2→2NaCl ,反应前Na 和Cl 均为0价,反应后分别变成了+1和-1价。
是因为钠失去了最外层的一个电子,而氯得到了钠失去的一个电子,二者通过这种方式都能形成最外层8电子的稳定结构。
如上右图所示。
两种情况中,电子的变化统称为“电子的转移”(后文则简称为“电子的得失”)。
综合来说,氧化还原反应的特征是化合价的变化,本质是电子的转移。
2、对于氧化和还原的定义一个反应中,得到电子必然伴随着失去电子,二者不可能独立存在(也就是说电子不可能凭空消失或出现,一定有来处和去处)。
于是我们有如下定义:氧化反应:物质所含元素化合价上升的反应(特征),物质失去电子的反应(本质); 还原反应:物质所含元素化合价下降的反应(特征),物质得到电子的反应(本质)。
例如,反应2FeCl 3 + Fe === 3FeCl 2,FeCl 3中Fe 的化合价由+3变为+2,化合价下降,说明FeCl 3发生了还原反应;Fe 的化合价由0变为+2,化合价上升,说明Fe 发生了氧化反应。
氧化还原反应的基础知识

氧化还原反应的基础知识氧化还原反应是化学中一个非常重要的基础概念。
它是指物质发生氧化或还原的过程,其中氧化是指物质失去电子,还原是指物质获得电子。
这种反应涉及到电子的转移,可以用于许多化学反应的研究和应用。
1. 氧化还原反应的基本概念氧化还原反应是伴随着电子的转移过程的化学反应。
化学物质中的原子或离子,在化学反应中会失去或获得一个或多个电子,或同时失去和获得电子,既发生氧化又发生还原的化学反应,称为氧化还原反应。
在反应中,被氧化的物质向反应体系输送电子,这个物质称为还原剂;被还原的物质从反应体系中接受电子,这个物质称为氧化剂。
因此,氧化还原反应又可以分为氧化剂和还原剂两个反应过程。
2. 氧化还原反应的电子转移氧化还原反应中电子转移是最具有特别性的一个概念,它是反应机理和反应规律的基础。
在化学反应中,发生氧化的物质中有个别原子失去了一个或多个电子,因而带正电荷,成为伴随着酸化或离子化而产生的阳离子。
同样的,失去正电荷或带负电荷的化学物质称为阴离子,带正电荷的称为阳离子。
电子转移是氧化还原反应的重要反应过程,是在反应体系中进行的物质内部电荷转移。
3. 氧化还原反应的电势氧化还原反应是在一定条件下进行的,即需要有一定的电位差或电势差。
电势是电学中的概念,指某一点测得电位的物理量,单位是伏特(V)。
反应体系的电势差是指观察氧化还原反应时,在反应物和生成物之间的电势差。
电势差的大小决定了氧化还原反应的进行方向,即方向性。
若产生电势差可使反应有利于原电位较高的化学物质被氧化,有利于原电位较低的化学物质被还原。
电势差是氧化还原反应进行的理论依据之一,可用于反应的计算和预测。
4. 氧化还原反应的应用氧化还原反应是在生物、环境、化学及其他领域中广泛应用的化学反应。
在生物过程中,酶催化氧化还原反应是生命活动的重要组成部分,可用于分解和利用食物、产生能量等方面。
在环境领域中,氧化还原反应可以用于清除污染物、处理废水、处理废气和净化土壤等方面。
氧化还原反应电化学基础N
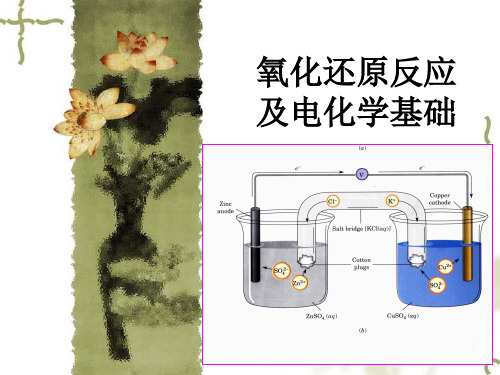
这一反应可在下列装置中分开进行
盐桥:在U型管中装 满用饱和KCl溶液和 琼胶作成的冻胶。 盐桥的作用:使Cl向锌盐方向移动, K+向铜盐方向移动, 使Zn盐和Cu盐溶液 一直保持电中性, 从而使电子不断从 Zn极流向Cu极。
这种装置能将化学能转变为电能,称为原电池。
正极(铜电极): Cu2+ + 2eCu 负极(锌电极): Zn Zn2+ + 2e正、负两极分别发生的 反应,称为电极反应。 电池反应:Zn + Cu2+ = Cu + Zn2+(总反应)
例:
H5I O6 S2 O S4 O
2 3 2 6
I的氧化值为 7 S的氧化值为 2 S的氧化值为 2.5 8 Fe的氧化值为 3
Fe3O 4
2、氧化还原半反应和氧化还原电对
氧化还原反应的方程式可分解成两个“半反应”。 反应中,氧化剂(氧化型)在反应过程中氧化数降 低生成氧化数较低的还原型; 还原剂(还原型)在反应 过程中氧化数升高转化为氧化数较高的氧化型。 由一对氧化型和还原型构成的共轭体系称为氧化还 原电对,可用“氧化型/还原型”表示。
Fe3+
溶液中,另一铂片插入到含有MnO4- 、Mn2+ 及H+ 的溶液
正极反应: MnO4- + 8H+ + 5e- = Mn2+ + 4H2O 电池反应: MnO4- + 8H+ + 5Fe2+ = Mn2+ + 5Fe3+ + 4H2O
电池符号:
(-)Pt|Fe2+(c1),Fe3+(c2)||MnO4-(c3),H+(c4),Mn2+(c5)|Pt (+)
工学氧化还原反应电化学基础

7-1 氧化还原反应的基本概念 7-2 电化学电池 7-3 电极电势 7-4 电极电势的应用
知识回顾: 四大平衡
酸碱 氧化还 沉淀溶 络合反 平衡 原平衡 解平衡 应平衡
思考:
对于氧化还原反应:
7-1 氧化还原反应的基本概念
7.1.1 氧化值 Def:
属1。的氢化物(如NaH、CaH2、LiAlH4)中,氢的氧化值为★ 通常,在化合物中氧的氧化值为-2;但在过氧化物(如
HO22OF22中,,Na氧2O的2,氧B化aO值2)分中别氧为的+氧2和化+值1为。-1;而在OF2和 ★ 在所有氟化物中,氟的氧化值为-1。 ★ 碱金属和碱土金属在化合物中的氧化值分别为+1和+2。 ★ 在中性分子中,各元素氧化值的代数和为零。在多原
氧化值法 离子—电子半反应法(适用于有介质参与的复
杂反应)
配平氧化还原反应方程式的基本原则:
电荷守恒 质量守恒
下面分别用酸性溶液和碱性溶液中的氧 化还原反应为例介绍离子-电子法的配平步骤。
配平酸性溶液中的反应:
KMnO4 K2SO3 H MnSO4 K2SO4
e-
7-2 电化学电池
伏特(Alessandro Volta 1745~ 1827)。意大利物理学家。 1800年3月20日宣布发明伏打 电堆,这是最早的直流电源。 从此,人类对电的研究从静 电发展到流动电(电流)。为纪 念他,人们将电动势单位取 名伏特。
7.2.1 原电池的构造
原电池: 将化学能转化为电能的装置
MnO4 8H Mn2 4H 2O SO32 H2O SO42 2H
口诀:少氧的一边加H2O,多氧的一边加H+。
氧化还原反应基础

氧化还原反应一、氧化还原反应基础1、氧化还原反应的实质:有电子的转移(得失)2、氧化还原反应的特征:有化合价的升降(判断是否氧化还原反应)3、氧化剂具有氧化性(得电子的能力),在氧化还原反应中得电子,发生还原反应,被还原,生成还原产物。
4、还原剂具有还原性(失电子的能力),在氧化还原反应中失电子,发生氧化反应,被氧化,生成氧化产物。
5、氧化剂的氧化性强弱与得电子的难易有关,与得电子的多少无关。
6、还原剂的还原性强弱与失电子的难易有关,与失电子的多少无关。
7、元素由化合态变游离态,可能被氧化(由阳离子变单质),也可能被还原(由阴离子变单质)。
8、元素最高价态有氧化性,但不一定有强氧化性;元素最低价态有还原性,但不一定有强还原性;阳离子不一定只有氧化性(不一定是最高价态,,如:Fe2+),阴离子不一定只有还原性(不一定是最低价态,如:SO32-)。
9、常见的氧化剂和还原剂:10、氧化还原反应与四大反应类型的关系:置换反应一定是氧化还原反应;复分解反应一定不是氧化还原反应;化合反应和分解反应中有一部分是氧化还原反应。
11、常见元素的化合价:H -1 +1 Li +1 Be +2 C -4 +2 +4 N -3 +1 +2 +3 +4 +5 O -2 -1 +2 F -1Na +1 Mg +2 Al +3 Si +4 P -3 +3 +5 S -2 -1 +4 +6 Cl -1 +1 +3 +5 +7 K +1 Ca +2 Br -1 +1 +3 +5 +7 I -1 +1 +3 +5 +7 Cr +3 +6 Mn +2 +4 +6 +7 Fe +2 +3 Co +2 +3 Cu +1 +2 Zn +2 Ag +1 Ba +2 Hg +1 +212、氧化还原反应的规律口决:还原剂:高失三氧化;氧化剂:低得三还原13、氧化还原反应应用模型:氧化性:氧化剂>氧化产物还原性:还原剂>还原产物14、氧化还原反应与原电池:一定有自发的氧化还原反应发生1、原电池:把化学能转化为电能的装置2、原电池及其本质①本质发生自发的氧化还原反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧化还原反应部分复习一、氧化还原反应基础1、氧化还原反应的实质:2、氧化还原反应的特征:3、氧化剂具有氧化性(得电子的能力),在氧化还原反应中得电子,发生还原反应,被还原,生成还原产物。
4、还原剂具有还原性(失电子的能力),在氧化还原反应中失电子,发生氧化反应,被氧化,生成氧化产物。
5、元素由化合态变游离态,可能被氧化,也可能被还原。
6、元素最高价态只有氧化性,;元素最低价态只有还原性。
7、氧化还原反应与四大反应类型的关系:8、氧化还原反应应用模型:氧化性:氧化剂>氧化产物还原性:还原剂>还原产物一、氧化还原反应概念1.下面有关氧化还原反应的叙述不正确的是 ( )A.在反应中不一定所有元素的化合价都发生变化B.肯定有一种元素被氧化,另一种元素被还原C.在氧化还原反应中,失去电子的物质,所含元素化合价降低D.氧化还原反应的本质是电子的转移2.氧化还原反应的实质是( ) A.得氧和失氧B.化合价的升降C.有无新物质生成D.电子的转移3.下列叙述正确的是()A.在氧化还原反应中,做氧化剂的物质不能做还原剂B.分解反应都是氧化还原反应C.反应中某元素的原子变为阳离子,则该元素的单质在反应中一定是还原剂D.凡是没有电子转移也就没有化合价升降的反应,就不属于氧化还原反应4.下列反应中,属于氧化还原反应的是( )A.CaCO3+2HCl CaCl2+CO2↑+H2O B.CaO+H2O Ca(OH)2C.Fe+CuSO4FeSO4+Cu D.5.下列反应属于非氧化还原反应的是( )A.Fe2O3+3CO====2Fe+3CO2B.NH4NO3====N2O↑+2H2OC.2NaHCO3==Na2CO3+CO2↑+H2OD.Cu2(OH)2CO3==2CuO+CO2↑+H2O 6.实验室利用氧化还原反应制取的气体是()A.O2 H2CO2B.O2CO2C.CO2D.H2O2二、氧化还原反应与四大基本反应类型的关系7.下列反应一定属于氧化还原反应的是()A.化合反应式B.分解反应 C.置换反应D.复分解反应8.下列说法中错误的是( )A.凡是氧化还原反应,都不可能是复分解反应B.化合反应不可能是氧化还原反应C.置换反应一定是氧化还原反应D.分解反应可能是氧化还原反应三、氧化剂、还原剂(一)氧化剂、还原剂;氧化性、还原性;氧化产物、还原产物判断题型一:氧化剂、还原剂;氧化产物、还原产物判断10.在下列反应中,水作还原剂的是( )A.SO3+H2O=H2SO4B.2Na+2H2O=2NaOH+H2↑C.2H2+O22H2O D.2F2+2H2O=4HF+O211.CaH2常做生氢剂,其中氢元素是-1价,化学方程式为:CaH2+2H2O=Ca(OH)2+2H2↑,其中水是()A.还原剂B.既是氧化剂,又是还原剂C.氧化剂D.既不是氧化剂,又不是还原剂12.在2KMnO4==2K2MnO4 + MnO2 + O2↑中,KMnO4所起的作用是:()A.氧化剂B.既不是氧化剂又不是还原剂C.还原剂D.既是氧化剂又是还原剂14.下列表示SO2被还原的反应是()A.SO2+2H2O+Cl2==H2SO4+2HClB.SO2+2H2S==3S↓+2H2OC.SO2+H2O==H2SO3D.2SO2 + O2 ===2SO315.(05江苏)在下列生成二氧化硫的反应中,反应物中的含硫物质被氧化的是A.硫在空气中燃烧B.铜片与浓硫酸共热C.红热的木炭与浓硫酸反应 D.亚硫酸钠与稀硫酸反应16.在下列反应中,氧化产物与还原产物是同一种物质的是()A.二氧化碳通过赤热的炭层B.氧化铜和木炭在高温下反应C.氢气通过灼热的氧化铜D.一氧化碳通过高温的赤铁矿17.某元素在化学反应中由化合态变为游离态,则该元素()A.可能被氧化B.一定被还原C.既可能被氧化又可能被还原D.以上都不是18.在K2Cr2O7+14HCl==2KCl+2CrCl3+3Cl2↑+7H2O反应中,______是氧化剂;______是还原剂;______元素被氧化;______元素被还原;______是氧化产物;______是还原产物题型二:氧化性、还原性判断20.下列微粒①Al3+②Cl-③N2④MnO4- ⑤CO2⑥H2O2⑦Fe2+⑧MnO42-既具有氧化性又具有还原性的是A.①④⑤⑦B.③⑥⑦⑧C.④⑤⑥⑧D.①②③⑥21.下列离子最容易给出电子的是()A.Cl— B.Cu2+C.Fe2+ D.F—22.人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转化为Fe3+离子,生成高铁血红蛋白而丧失与O2的结合的能力,服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有()A.酸性B.碱性C.氧化性D.还原性23.阅读下列材料后,回答相应问题一个体重50Kg的健康人,含铁2g。
这2g铁在人体中不是以单质金属的形式存在的,而是以Fe2+和Fe3+和—的形式存在。
二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。
服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利与铁的吸收。
(1)、人体中经常进行的转化,A中Fe2+做剂,B中Fe3+做剂。
(2)、“服用维生素C,可使食物中的三价铁离子还原成二价铁离子。
”这句话指出维生素C在这一反应中做剂,具有性。
24.在Fe、Fe2+、Fe3+、Cl2、Cl-、Na+几种粒子中,只有氧化性的是,只有还原性的是,既有氧化性又有还原性的是。
25.在下列反应中A.Na2O2+HCl—H2O2+NaClB.Ag2O+H2O2—Ag+O2↑+H2OC.H2O2—H2O+O2↑D.H2O2+Cr2(SO4)3+KOH—K2SO4+H2O+K2CrO4(1)H2O2仅体现氧化性的反应为(填代号)(2)H2O2既表现氧化性,又表现还原性的为(3)H2O2表现出酸性的是因为题型三:26、下列变化中,一定需加还原剂才能实现的是( )A.Cl2→Cl- B.FeCl3→FeCl2C.C→CO2D.KMnO4→MnO227.下列变化必须加入氧化剂才能实现的是A.CuO→CuSO4 B.CO2→C O C.Fe→Fe3O4D.KClO3→O2 28.下列变化需加入氧化剂才能实现的是()A.CuO→Cu B.CaCO3→CaOC.Fe→FeCl2 D.HCl→Cl2(二)氧化性、还原性强弱比较题型一:根据金属(非金属)活动顺序表判断得电子能力越强的元素,氧化性越强,失电子能力越强的元素,还原性越强30.下列对氧化还原反应的分析中合理的是( )A. Cu2+氧化性比Na+强B. Cl2得电子的能力比Br2强,所以氧化性:Cl2 >Br2C.凡是氧化还原反应都能造福于人类D.氧化还原反应中元素的原子电子失去的越多,还原性越强如:钠原子能失去1个电子,铝原子能失去3个电子,所以铝的还原性比钠强题型二:较强的氧化剂+较强的还原剂较弱的还原剂+较弱的氧化剂氧化性:氧化剂>氧化产物还原性:还原剂>还原产物31(05广东)从海水中可以提取溴,主要反应为:2Br—+Cl2=2Cl—+Br2,下列说法正确的是A.溴离子具有氧化性B.氯气是还原剂C.该反应属于复分解反应D.氯气的氧化性比溴单质强32.已知在某温度时发生如下三个反应:(1)C+CO2=2CO (2)C+H2O=CO+H2(3)CO+H2O=CO2+H2据此判断,该温度下C、CO、H2的还原性强弱顺序是:A.CO>C>H2B.C>CO>H2C.C>H2>CO D.CO>H2>C 33.根据以下四个反应:(1)H2S+I2=2H++2I-+S↓(2)H2SO3+2H2S=3S↓+3H2O(3)2I-+Br2=2Br-+I2(4)H2SO3+I2+H2O=H2SO4+2HI确定Br-、I-、H2S和H2SO3还原性由强到弱的顺序是A.H2S>H2SO3>I->Br-B.Br->I->H2SO3>H2SC.H2SO3>H2S>Br->I-D.I->Br->H2S>H2SO334.已知:①2FeCl3+2KI=2FeCl2+2KCl+I2②2FeCl2+Cl2=2FeCl3判断下列物质的氧化能力由大到小的顺序是(A)Fe3+>Cl2>I2(B)Cl2>Fe3+>I2 (C)I2>Cl2>Fe3+ (D)Cl2>I2>Fe3+35.根据下列反应,判断氧化性强弱正确的是()(1)2H2S+O2===2S↓+2H2O (2)4NaI+O2+2H2O===4NaOH+2I2(3)Na2S+I2===2NaI+S↓A.O2>I2>S (B) O2>S>I2C.I2>O2>S D.S>I2>O236.有下列反应(其中A、B、C、D各代表一种元素)2A-+B2===2B-+A22A-+C2===2C-+A22B-+C2===2C-+B22C-+D2===2D-+C2其中氧化性最强的物质是()A.A2 B.B2C.C2D.D2题型三:根据氧化性、或还原性强弱判断反应能否进行37.(05江苏)已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。
下列反应在水溶液中不可能...发生的是A.3 Cl2 + 6 FeI2= 2FeCl3+ 4 FeI3B.Cl2+ FeI2= FeCl2+ I2C.Co2O3+ 6 HCl = 2CoCl2+ Cl2↑+ 3H2O D.2Fe3+ + 2I— = 2Fe2+ + I2四、标出电子转移的方向和数目41.用双线桥表示下列氧化还原反应中电子转移方向和数目(1)Cl2+2NaOH===NaCl+NaClO+H2O(2)HgS + O2 === Hg + SO2(3)2KNO3+S+3C=== K2S+N2+3CO2(4)KClO3 + 6HCl ==== KCl + 3Cl2↑+ 3H2O42.3S+6KOH=2K2S+K2SO3+3H2O中,被氧化与被还原的S原子数之比为A.1 :1 B.2 :1 C.1 :2 D.3 :243.反应8NH3+3C12=6NH4Cl+N2中,被氧化的氨和未被氧化的氨的质量比是:()A.3 :1 B.1 :3C.1 :1 D.3 :8。
