2020年CSCO蒽环类药物心脏毒性防治指南发布会纪实
《蒽环类药物心脏毒性防治专家共识》解读(最全版)

《蒽环类药物心脏毒性防治专家共识》解读(最全版)蒽环类药物等被广泛应用于治疗血液系统恶性肿瘤和实体肿瘤,包括急性白血病、淋巴瘤、乳腺癌、软组织肉瘤等。
以蒽环类药物为基础的化疗方案是一线治疗的经典方案,其抗肿瘤疗效确切,但会引起心脏毒性。
蒽环类药物导致的心脏毒性呈进展与不可逆性,且第1次使用蒽环类药物就可能对心脏造成损伤,因此早期监测并早期预防蒽环类药物引起的心脏毒性显得尤为重要。
蒽环类药物导致的心脏毒性按出现的时间进行分类,分为急性、慢性和迟发性心脏毒性。
给予蒽环类药物后的前几年中超过50%的患者发生左心室结构和功能亚临床心超变化,说明大多数患者在蒽环类给药后很快发生心脏损害,而且随着时间的延长损害越来越明显。
蒽环类药物的慢性及迟发性心脏毒性与其累积剂量呈正相关。
但近来研究显示低剂量蒽环类药物也可能引起心脏毒性,接受低剂量阿霉素治疗的患者在长期随访时发现心脏功能异常,因此并没有绝对的安全剂量,其原因可能是存在个体差异,患者体内代谢蒽环类药物相关基因的差异性导致其对蒽环类药物的易感性不同。
越来越多的研究证实蒽环类药物对心脏的器质性损害第1次应用就可能出现,呈进行性加重且不可逆。
虽然蒽环类药物诱导心脏毒性的机制仍不清楚,但现有的证据揭示其心脏毒性与产生的自由基直接有关。
蒽环类药物螯合铁离子后触发氧自由基,尤其是羟自由基的生成,导致心肌细胞膜脂质过氧化和心肌线粒体DNA的损伤等。
铁的螯合物可以抑制由自由基触发的心脏毒性反应。
蒽环类药物心脏毒性的检测方法有:心电图、超声心动图、心内膜心肌活检、血清心肌肌钙蛋白(cTn)、脑钠肽(BNP)等。
心电图及心肌酶检测为目前临床治疗前后的常规检测项目,但缺乏特异性。
左室射血分数(LVEF)和缩短轴分数(FS)是最常用的监测方法,可区分危险人群,对预防心脏功能衰竭(心衰)有重要意义。
然而,根据LVEF数据常可能低估心脏的损伤程度,LVEF正常者可有亚临床的心脏功能损伤,因此,LVEF对早期亚临床心脏疾病的检测并不敏感。
蒽环类药物心脏毒性

蒽环类药物心脏毒性蒽环类药物以其严重的心脏毒性而著称。
这种心脏毒性可能由许多因素引起,包括对心肌细胞肌质网上兰尼碱受体的影响、心脏中自由基的产生及药物代谢产物的蓄积。
它们的心脏毒性通常表现为心电图变化尤其是QRS复合波的频率变化和心律不齐;心肌病及其引发的心力衰竭有时数年后才表现出来也时有发生。
毒性主要与患者终生累积剂量有关。
因此,在治疗的过程中,医生会根据药物种类及患者情况计算所适用的终生剂量,当剂量达到上限的时候,一般来说会停止继续使用蒽环类药物或者重新估算上限。
有研究显示蒽环类药物引起心力衰竭的几率不仅与剂量有关,还随着接受治疗之后的时间的推移而增加——由2年之后的2%到15年之后的5%。
除了保持在累积剂量上限以下之外,肿瘤科医生还会使用许多其他方法降低心脏毒性。
一般来说,在化疗结束的3、6、9个月之后医生会建议检查一次心脏。
此外,保护心脏的措施还包括了使用右雷佐生辅助化疗,使用脂质体药物,和改用持续静脉滴注:● 右雷佐生是一种心脏保护剂,能够通过竞争性螯合铁离子来减少蒽环类药物产生的自由基数目。
研究显示它能够将心脏毒性发生几率减少约三分之二,同时并不影响化疗的效果或者是总体生存率。
● 相对于普通蒽环类药物来说,较少的脂质体药物会被运输到心脏,因此毒性较小。
● 持续静脉滴注能够减小药物在心脏尤其是左心室中的的峰浓度。
为了有效预防蒽环类药物导致的心脏毒性,应在第1次使用蒽环类药物前联合应用右丙亚胺。
另外还有其他的心脏保护剂,包括辅酶Q10,左卡尼汀,N-乙酰半胱氨酸,抗氧化剂VC、VE以及其他的铁螯合剂如去铁敏等,或许具有一定的心脏保护效果,但是用于防治蒽环类药物所致心脏毒性尚需进一步研究,目前只有右丙亚胺可使经过蒽环药治疗的病人心衰的发生率明显降低。
蒽环类药物用法用量多柔比星--5%葡萄糖注射液溶解后静脉冲入或滴注,可进行腔内注射或膀胱灌注,但不能鞘内注射;表柔比星--0.9%氯化钠注射液250~500ml溶解后静脉冲入或滴注;如选用葡萄糖注射液稀释,其含量下降速度很快,1h后的含量平均下降率大于5%,放置12h后,剩余含量仅为原含量的50%,因此建议选用生理盐水配伍吡柔比星--建议选用5%葡萄糖注射液溶解稀释静脉冲入或滴注,也可以膀胱灌注及动脉给药吡柔比星难溶于氯化钠注射液,因此不宜选用生理盐水作溶剂蒽环类药物适应症均为广谱抗肿瘤药,适用于急性白血病、乳腺癌、肺癌、卵巢癌等。
蒽环类药物心脏毒性防治指南2020
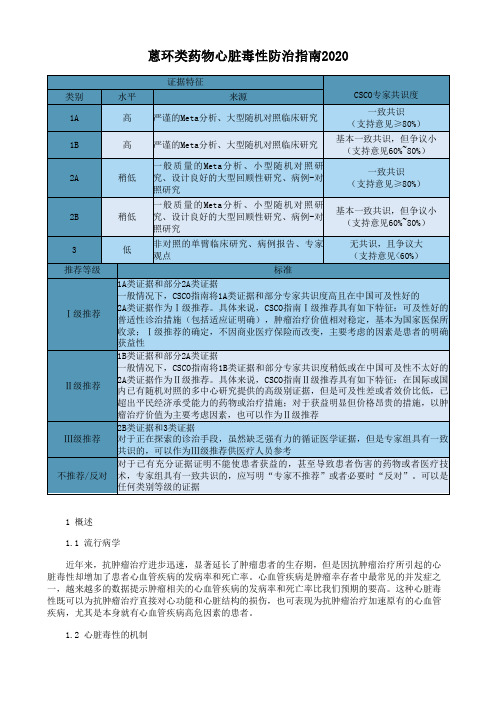
蒽环类药物心脏毒性防治指南20201 概述1.1 流行病学近年来,抗肿瘤治疗进步迅速,显著延长了肿瘤患者的生存期,但是因抗肿瘤治疗所引起的心脏毒性却增加了患者心血管疾病的发病率和死亡率。
心血管疾病是肿瘤幸存者中最常见的并发症之一,越来越多的数据提示肿瘤相关的心血管疾病的发病率和死亡率比我们预期的要高。
这种心脏毒性既可以为抗肿瘤治疗直接对心功能和心脏结构的损伤,也可表现为抗肿瘤治疗加速原有的心血管疾病,尤其是本身就有心血管疾病高危因素的患者。
1.2 心脏毒性的机制蒽环类药物所致心脏毒性的机制仍未明确,可能主要有以下两个方面。
(1)蒽环类药物通过酶和非酶介导的途径产生氧自由基,导致心脏损伤:1)蒽环类药物中的蒽醌基团在多种还原酶及NADH脱氢酶等酶系统的作用下,还原为半醌自由基,半醌自由基与氧分子和其他细胞电子供体之间的电子交换产生过量的活性氧(ROS),氧自由基蓄积量超过心脏线粒体和肌浆网的解毒能力而损害心脏。
2)蒽环类药物还可以通过非酶途径与铁形成螯合物,再经历氧化还原循环并产生氧自由基。
蒽环-铁螯合物对心脏磷脂的亲和力很高,当与心磷脂结合后,会导致细胞膜功能的损伤而产生心脏毒性。
右雷佐生是一种减弱蒽环类药物诱导的心脏毒性的药物,可以降低线粒体铁离子水平,预防蒽环诱导的心脏损伤。
还有研究认为右雷佐生的作用机制包括其提高了超氧化物歧化酶(SOD)活性,减少氧自由基的产生,降低脂质过氧化物含量以及调节心肌细胞凋亡机制,从而对心脏起到了保护作用。
(2)拓扑异构酶Ⅱ(Top Ⅱ)是蒽环类药物诱导心脏毒性的关键介质。
拓扑异构酶Ⅱ通过改变DNA在复制、染色体凝缩和姐妹染色体双链分离过程中的拓扑结构而发挥作用。
已经证明哺乳动物体内有两种拓扑异构酶亚型:Ⅱ和Ⅱ。
拓扑异构酶Ⅱ主要存在于增殖细胞中,是DNA复制所必需的,被认为是蒽环类药物抗肿瘤活性的分子基础。
相反,Top Ⅱ存在于所有静止细胞中,包括心肌细胞,蒽环类药物通过抑制Top Ⅱ导致DNA双键断裂,从而导致心肌细胞死亡。
防治蒽环类化疗药物的心脏毒性

防治蒽环类化疗药物的心脏毒性蒽环类药物治疗血液恶性肿瘤和实体瘤疗效确切,但其存在治疗相关心脏毒性,表现为进展性与不可逆性,且首次使用就可能对心脏造成损伤。
在使用蒽环类药物时,早期监测和提前预防心脏毒性显得尤为重要。
当前治疗血液肿瘤和实体肿瘤的蒽环类药物包括柔红霉素、去甲氧柔红霉素、盐酸多柔比星、表柔比星、阿柔比星、米托蒽醌、吡喃多柔比星、脂质体多柔比星、脂质体柔红霉素、脂质体去甲氧柔红霉素。
蒽环类药物是血液肿瘤和实体肿瘤(急性髓细胞白血病、急性淋巴细胞白血病、霍奇金淋巴瘤、非霍奇金淋巴瘤、乳腺癌、胃癌、骨肉瘤、软组织肉瘤、卵巢癌等)的基石类药物。
首先,在复发转移性乳腺癌化疗中,中国抗癌协会乳腺癌专业委员会及美国国立综合癌症网络(NCCN)指南均肯定了蒽环类药物的地位和作用,推荐的化疗药物如下。
①环类:如多柔比星、表柔比星、聚乙二醇化脂质体多柔比星。
②紫杉类:如紫杉醇、多西他赛、白蛋白结合型紫杉醇。
③抗代谢药:如卡培他滨、吉西他滨。
④非紫杉醇类微血管形成抑制剂:如长春瑞滨。
其次,蒽环类药物在血液恶性肿瘤治疗中也彰显了其基石地位。
①非霍奇金淋巴瘤:多柔比星、表柔比星、脂质体多柔比星、去甲氧柔红霉素、米托蒽醌。
②霍奇金淋巴瘤:多柔比星、表柔比星、脂质体多柔比星。
③急性髓细胞白血病:多柔比星、柔红霉素、去甲氧柔红霉素、米托蒽醌、阿柔比星。
④急性淋巴细胞白血病:多柔比星、柔红霉素。
早期监测并提前预防蒽环类药物心脏毒性需要清楚地了解其相关心脏毒性的分类、特点、作用机理及如何监测和预防,从而使患者有更好的获益。
蒽环类药物相关心脏毒性分类1、急性心脏毒性在给药后的几小时或几天内发生,常表现为心内传导紊乱和心律失常,极少数表现急性左心衰。
慢性心脏毒性在化疗的1年内发生,表现为左心室功能障碍,最终可导致心衰。
2、迟发性心脏毒性在化疗后数年发生,可表现心衰、心肌病及心律失常等。
蒽环类药物的慢性及迟发性心脏毒性与其累计剂量相关,因此限制其累计剂量可以降低心脏毒性的发生率。
2020年蒽环类药物心脏毒性防治指南(课件)

蒽环类药物心脏毒性诊疗概要
蒽环类药物心 脏毒性
2020-11-29
诊断 检查
预防或减 少 治疗
1、不良事件评定标准(CTCAE4.0)(1类) 2、心内膜心肌活检评分(EMB)
1、超声心动图或MUGA:LVEF、FS能预测心衰,但对早期 的蒽环亚临床心脏损伤的检测并不敏感(1类)
2、肌钙蛋白:特异性较高,能监测早期蒽环心脏毒性(1类) 3、脑钠肽:判定心衰及其严重程度的客观指标(2A类) 4、心电图:常规检测,特异性较低(2B类) 5、心肌酶谱:常规检测,特异性较低(2B类) 6、心内膜心肌活检:敏感性、特异性较高,但为有创性检测 1、(右3丙类亚)胺可以有效地预防蒽环类药物心脏毒性(1类) 、 2、限制蒽环类药物累积剂量、改变给药方法或使用脂质体蒽
14
❖ 蒽环类药物没有绝对的安全剂量,低剂量蒽环类药物也可能引起心脏毒性。 ❖ 原因:可能是个体差异,患者体内代谢蒽环类药物相关基因的差异性导致其对蒽环的易感性不同。
2020-11-29
Crit.Rev.Oncol/Hematol 2005;54:171-196
Drugs 2005; 65: 1005-1024.
Expert Opin. Pharmacother. 2007; 8:1039-1058.10
阿霉素累积剂量与心衰发生的关系
阿霉素累积剂量 400 mg/m2 550 mg/m2 700 mg/m2
2020-11-29
心衰发生率
Von Hoff DD
Swain SM
3% 7% 18 %
5% 26 % 48 %
左图:心肌纤维化,坏死; 右图:心肌细胞空泡化
2020-11-29
5
治疗血液肿瘤和实体肿瘤的蒽环类药物
蒽环类抗肿瘤药的心脏毒性及治疗措施

蒽环类抗肿瘤药的心脏毒性及治疗措施郭军;张华金【期刊名称】《中国医院用药评价与分析》【年(卷),期】2014(014)004【总页数】2页(P381-382)【作者】郭军;张华金【作者单位】济南第四人民医院药剂科,济南250031;济南第四人民医院药剂科,济南250031【正文语种】中文【中图分类】R969.3蒽环类药是一类对造血系统肿瘤和实体肿瘤有良好疗效的抗肿瘤药,但因其对心脏渐进性、不可逆的毒性作用,对患者造成了严重影响。
目前认为,蒽环类抗肿瘤药用药早期即可出现各种心律失常,晚期出现剂量依赖性充血性心力衰竭,表现为不可逆的慢性心肌改变。
1 病例某男性患儿,14岁,既往确诊“急性淋巴细胞白血病”2年余,初入院时心脏彩超提示无相关心肌损害的临床症状。
给予VDCLP(V:长春新碱,D:柔红霉素,C:环磷酰胺,L:左旋门冬酰胺酶,P:泼尼松)方案治疗后达缓解,随后依次给予VDCP、MA(M:米托蒽醌,A:阿糖胞苷)等方案巩固强化治疗。
患儿给予维持剂量治疗。
蒽环、蒽醌类药累积总剂量:柔红霉素总量913 mg,米托葸醌总量25 mg。
患儿2月前输液后(治疗白血病)出现乏力、恶心,行走无力,伴咳嗽、咳痰,为白色黏痰,活动后及夜间较重,心脏听诊为奔马律。
10 d前患儿症状加重,出现胸闷憋喘等不适,并出现双下肢水肿、尿少、不能平躺,有时夜间阵发性呼吸困难,咳嗽、咳痰。
诊断为急性淋巴细胞白血病(缓解期);药物性心肌病变:心功能不全(Ⅳ级);肺部感染。
治疗情况:考虑患儿系因蒽环类药导致的严重心肌损害,立即停药。
加用磷酸肌酸注射液营养心肌。
治疗采取吸氧、支持对症处理、加用血管紧张素转化酶抑制剂(ACEI)(培哚普利)和β受体阻断剂(美托洛尔缓释片)以及心脏保护剂。
10余天后,患儿心力衰竭症状缓解,心悸、胸闷、气短等症状消失,心电图及心肌酶恢复正常。
2 药物心脏毒性急性淋巴细胞白血病的化疗方案通常包括蒽环类化疗药,与非蒽环类化疗方案相比,其增加了心脏毒性风险。
蒽环类心脏毒性防治指南 最新版

蒽环类心脏毒性防治指南最新版引言蒽环类化合物是一类常见的环境污染物,也是一种重要的心脏毒性物质。
长期暴露于蒽环类化合物可能导致心脏疾病的发生和开展。
因此,制定一份针对蒽环类心脏毒性的防治指南对于减少相关疾病的发生具有重要意义。
本文档旨在提供蒽环类心脏毒性防治的最新指南。
通过了解蒽环类化合物的毒理学特性,评估暴露风险,采取适当的个人和环境保护措施,可以有效降低蒽环类化合物对心脏的毒性影响。
蒽环类化合物概述蒽环类化合物是一类具有蒽骨架结构的多环芳香烃,常见的蒽环类化合物包括苯蒽、鹅蒽等。
蒽环类化合物广泛存在于石油和煤矿等工业生产过程中,并存在于空气、水、土壤以及食物中。
人类主要通过吸入、食入和皮肤接触途径暴露于蒽环类化合物。
蒽环类化合物具有较高的毒性,其主要作用机制是通过氧化应激、炎症反响、细胞凋亡和细胞周期调控异常等途径对心脏细胞造成损伤。
长期暴露于蒽环类化合物可能导致心脏病变、心肌纤维化、心律失常等心脏疾病的发生和开展。
评估蒽环类化合物暴露风险在进行蒽环类心脏毒性的防治之前,需要对蒽环类化合物的暴露风险进行评估。
评估过程包括以下几个步骤:1. 确定暴露途径确定蒽环类化合物的暴露途径是评估风险的第一步。
蒽环类化合物主要通过吸入、食入和皮肤接触途径暴露于人体。
根据实际情况,确定主要的暴露途径。
2. 测量暴露水平利用适当的实验方法测量蒽环类化合物的暴露水平。
可以通过空气、水、食物或尿液中蒽环类化合物的含量来评估暴露水平。
3. 评估暴露频率和暴露时间评估蒽环类化合物的暴露频率和暴露时间。
了解蒽环类化合物的暴露频率和暴露时间有助于评估暴露风险。
4. 制定防护策略根据暴露风险评估的结果,制定适当的个人和环境保护措施,降低蒽环类化合物的暴露风险。
个人防护措施个人防护是防止蒽环类心脏毒性的关键措施。
以下是一些个人防护措施的建议:•使用防护手套和呼吸器等防护装备,在接触蒽环类化合物时保护皮肤和呼吸道。
•防止接触污染的空气、水和土壤等环境。
蒽环类化疗药物心脏毒性的监控

蒽环类化疗药物心脏毒性的监控
陈玲
【期刊名称】《国外医学:内科学分册》
【年(卷),期】2000(027)012
【摘要】蒽环类药物是对血液系统肿瘤和实体肿瘤具有高效作用的化疗药物,具有抗肿瘤谱广、疗效高的特点。
但因其具有心脏毒性而限制了用药量。
本文就蒽环类药物心脏毒性的临床表现、发病机制以及监测、预防作一综述。
【总页数】4页(P525-528)
【作者】陈玲
【作者单位】广东省人民医院血液科,广东广州
【正文语种】中文
【中图分类】R979.1
【相关文献】
1.左心室心肌做功在乳腺癌患者蒽环类化疗药物心脏毒性评价中的应用价值 [J], 曹司琪;陈勇;杨菲;陈银花;袁静;崔瑞雪
2.《伤寒论》理法方药治疗蒽环类化疗药物所致心脏毒性初探 [J], 林方圆;田菲;韩佳彤;林鹏展
3.益心补气方对乳腺癌患者蒽环类化疗药物引起心脏毒性的保护作用 [J], 吴雷娟;常冬华;章宇明;严务倩;马壬娇
4.超声心动图斑点追踪技术对蒽环类化疗药物心脏毒性的临床研究 [J], 隋东奎;苗重昌
5.蒽环类化疗药物所致心脏毒性的研究进展 [J], 孙海楠;杨欢;李艳芬;李美凤;黄宇虹;王瑞华
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020年CSCO蒽环类药物心脏毒性防治指南发布会纪实关键词:蒽环类药物心脏毒性
近年来,肿瘤治疗取得突飞猛进的发展,从化疗到靶向治疗再到免疫治疗,我们步入了个体化精准诊疗的新时代。
然而不可否认的是,化疗仍然是恶性肿瘤治疗的基石,其中蒽环类药物抗肿瘤疗效确切,被广泛地应用于治疗血液系统恶性肿瘤和实体肿瘤,其安全性也越来越受到重视,蒽环类药物治疗相关的心脏毒性引起更多临床医生的关注。
随着对蒽环类药物心脏毒性的机理、临床表现以及预防治疗的认识进一步加深,在马军教授、秦叔逵教授等国内几十位专家的共同努力下,《C SCO蒽环类药物心脏毒性防治指南(2020)》完成了更新,于7月1 6日以线上会议的形式正式发布。
马军教授和秦叔逵教授共同担任2020年CSCO蒽环类药物心脏毒性防治指南发布会的主席,邀请张宇辉教授、刘基巍教授参与指南的解读与讨论。
马军教授在开场致辞中表示,蒽环类药物心脏毒性的防治从《共识》到《指南》我们走过了9年的历程,积累了丰富的临床使用经验和循证医学证据,本次《CSCO蒽环类药物心脏毒性防治指南》发布,进一步规范了蒽环类药物在肿瘤治疗中的合理应用,给患者带来更多获益。
秦叔逵教授:《蒽环类药物心脏毒性防治指南》制定原则及临床指导意义
基于循证医学证据、兼顾诊疗产品的可及性、吸收精准医学新进展,制定中国常见癌症的诊断和治疗指南是CSCO的基本任务之一。
中国是一个幅员辽阔但地区经济和学术发展不平衡的发展中国家,指南需要兼顾地区发展差异、药物和诊疗手段的可及性以及肿瘤治疗的社会价值三个方面。
因此指南的制定,要求每一个临床问题的诊疗意见,需根据循证医学证据和专家共识度形成证据级别,同时结合产品的可及性和效价比形成推荐等级。
CSCO指南主要基于国内外临床研究成果和CSCO专家意见,确定推荐等级,便于大家在临床实践中参考使用。
《蒽环类药物心脏毒性防治指南》开启了国内肿瘤心脏病学的先河,以循证医学为基础,结合国内临床诊疗手段的可及性,给临床医生指导建议,同时推动了肿瘤学家和心血管专家的合作,规范临床实践。
本《指南》秉承科学、先进、实用、便捷的出发点,采用口袋书的设计,更便于临床医生在实际工作中推广应用。
此外,秦叔逵教授还介绍了国内外肿瘤心脏病学的进展,2000年,首个肿瘤心脏病学专科在美国成立,2016年,第一届中国肿瘤心脏病学大会在大连召开,标志着肿瘤心脏病学这门新兴学科在中国正式成立。
2019年,CSCO肿瘤心脏病学专家委员会正式成立,相信在大家的共同努力下,更多的患者会从中获益。
马军教授:《蒽环类药物心脏毒性防治指南(2020)》解读
近年来,抗肿瘤治疗进步迅速,显著延长了肿瘤患者的生存期,但是因抗肿瘤治疗所引起的心脏毒性却增加了患者心血管疾病的发病率和死亡率,心血管疾病是肿瘤患者非肿瘤原因的主要死因。
蒽环类药物在给药后,多数患者可以较快地发生心肌损伤,且随着时间的延长而愈加明显。
蒽环类药物对心脏的损害具有明显的剂量-效应线性关系,其所致心脏毒性也与累积剂量密切相关。
但不同肿瘤患者对于蒽环类药物所致心脏毒性的敏感性不同,因此蒽环类药物并没有绝对的“安全剂量”,预防是降低蒽环类药物心脏毒性的主要措施。
蒽环类药物心脏毒性的监测管理主要包括抗肿瘤治疗前筛查心功能不全的危险因素,抗肿瘤治疗过程中的心功能监测以及抗肿瘤治疗后的心功能随访。
蒽环类药物心脏毒性可以通过降低最大累积剂量、改变给药方式、应用心脏保护药物等策略实现预防,大量的前瞻性随机对照研究数据证明,右雷佐生可以有效预防蒽环类药物造成的心脏毒性和左心功能降低,同
时不影响抗肿瘤药物有效率、不影响肿瘤生存或促生第二肿瘤等。
因此国内、外多项指南均推荐在初次使用蒽环类药物时联合右雷佐生。
肿瘤患者出现心衰表现后,应该参照“中国心力衰竭诊断和治疗指南”的要求进行治疗。
如果在化疗过程中出现心衰,需请肿瘤和心脏病专科医师共同会诊,并形成肿瘤医师肿瘤心脏科医师协商机制,共同探讨停止抗肿瘤治疗的必要性及持续时间(一般至心衰病情稳定)。
病情稳定后,是否继续原方案治疗,需要综合考虑左室功能异常的严重程度、临床心衰状态、肿瘤预后以及抗肿瘤治疗的效果。
张宇辉教授:肿瘤治疗过程中心脏毒性的监测和管理
随着癌症患者生存时间延长,肿瘤患者心血管相关的不良反应越来越引起临床医师关注,肿瘤心脏病学已经发展成为一门新学科。
肿瘤心脏病学的范围很广,包括预防、监测、诊断和治疗癌症治疗相关的心血管毒性。
而在肿瘤治疗的过程中,任何影响心脏安全的抗癌治疗都需要监测。
蒽环类药物心脏毒性防治指南中心脏毒性的监测方法包括心电图、超声心动图,放射性核素显像,心脏磁共振成像(CMR),生化标志物以及心内膜心肌活检(EMB)等手段,每个监测方法都各有其优缺点,目前临床常用的监测方法主要是心电图,超声心动图,生化标志物等。
肿瘤心脏毒性的监测管理包括:肿瘤治疗前对潜在心血管疾病(CVD)风险的预测,针对肿瘤患者合并CVD,建议积极治疗CVD并密切密切监测,采取必要的防护措施。
肿瘤治疗期间监测:监测潜在的心血管并发症,并根据实际情况进行可能的早期干预。
肿瘤幸存者CVD的长期监测与随访:参考肿瘤治疗方案的心血管致病性,以个体化原则合理随访,蒽环类药物治疗后的大多数心脏毒性发生在第一年内,并且在治疗结束时与蒽环类药物剂量和LVEF有关。
早期发现和迅速治疗心脏毒性对心脏功能的实质恢复至关重要。
刘基巍教授:肿瘤患者心脏保护全程管理——2020年ESMO共识
肿瘤治疗的不断进步,患者长期生存率明显增加,抗肿瘤治疗带来的心脏毒性(短期和长期),引起临床广泛关注和重视,推动了肿瘤心脏病
学的发展,国内外相关指南共识也在不断更新,2020年,ESMO发布了癌症治疗全程管理心脏疾病的共识建议。
ESMO共识建议主要包括以下内容:抗肿瘤治疗的心血管疾病管理的一般原则,抗肿瘤治疗前的筛查,抗肿瘤治疗心血管疾病的一级预防,肿瘤治疗期间心血管毒性的监测,临床前心血管毒性,临床心功能不全,抗肿瘤治疗后幸存者的心血管毒性以及免疫检查点抑制剂相关的心血管毒性。
ESMO共识对肿瘤治疗相关的心血管疾病提供了预防、筛选、监测和治疗相关的指导建议,该共识建议适用于大多数患者,但临床为达到最佳的治疗方案,医生的判断仍然非常重要,需考虑患者的个人情况。
ESMO共识建议:接受已知与心脏毒性相关的抗肿瘤治疗的患者应被视为A期心衰患者(有心衰风险,但无结构性心脏病或心衰症状)。
ES MO一级预防推荐对于LVEF和心血管疾病危险因素正常的患者,如果计划使用已知的心脏毒性药物进行抗肿瘤治疗,特别是那些暴露于多种心脏毒性药物的患者,可以考虑预防性使用ACE-Is或ARBs(如果对A CE-Is不耐受)和/或选择BBs来减少心脏毒性。
对于需要以蒽环类药物为基础的ChT的既往心肌病患者,无论癌症类型如何,从蒽环类药物治疗开始,都可以考虑同时使用右雷佐生。
总之,肿瘤患者的心血管疾病是复杂的,肿瘤治疗的心脏毒性在上个世纪70年代就已被观察到,随着靶向治疗的引入,目前的临床状况已经
发生了很大的改变,肿瘤心脏病学的范围也更广泛了,个体化的患者管理和治疗是至关重要的。
肿瘤学家、心脏病学家之间的密切合作为肿瘤患者提供最佳诊疗同时不损害患者的心血管健康。
小结
恶性肿瘤和心血管疾病是威胁人类健康的两大主要疾病,常伴有共同的危险因素,也存在部分共同的生物学机制。
抗肿瘤治疗引起的心脏毒性需要引起我们的重视,《CSCO蒽环类药物心脏毒性防治指南》以循证医学为基础,结合临床诊疗及最新进展,指导临床医生科学决策。
秦叔逵教授最后总结道,蒽环类药物心脏毒性重在预防,实时监测,积极治疗,同时还需要全程管理。
通过多学科的交流可以减少认知差距,优化疾病的防治策略,使得更多的患者得到更专业、有效、优质的治疗。
