蒽环类药物心脏毒性防治指南
蒽环类药物心脏毒性及防治进展

者左心 室容量下 降 1 2 9 / 6 ( P<O . 0 1 ) , 左 心 室 内径 降低
3 . 6 ( P=0 . 0 3 ) 。( 4 ) 遗 传 因素 : 基 因改 变导 致 细胞
膜通透性 、 抗氧 自由基 的能力 、 代 谢等 发生改 变 , 易患 心脏疾病 _ 9 ] 。( 5 ) 生活 习 惯 及其 他 : 存 在心 血 管疾 病 及危 险因素 , 治 疗 过 程 中肌 钙蛋 白及 N末 端 B型利 钠肽原 ( NT - p r o B N P ) 水平升高, 吸烟 、 嗜酒 等 生 活不 良生活方 式均可l l l l 重心脏 毒性 ] 。
1 . 5 拓 扑 异 构 酶 的 相 关 研 究
的作用下 , 蒽环类药 物的蒽醌基 团被还原 成半 醌 自由
基, 完成 电子传递过程后 生成超氧 阴离子 ( 0 2 一 )和 羟
蒽环 类 药 物 可 与 拓 扑 异 构 酶 ( t o p o i s o me r a s e ,
T OP ) 的 2种 亚型 相结 合 , 其 中与 T OP 2  ̄结 合 更 为
2 蒽环 类药 物导 致心 脏毒 性的 危 险因素 ( 1 ) 累积 药物剂 量 : 这是 引起 心脏 损 害的独 立危
化 酶系如 超氧化 物歧 化 酶 和谷 胱甘 肽过 氧 化物 酶 的
含量, 使 自由基 、 超氧化物 不能被 及 时清除 , 加 重心 肌
细胞 的损 伤 ] 。 1 . 2 铁 离子 代谢 紊乱 学说
自由基 ( OH一 ) , 导致 线 粒体及 微 粒体脂 质 过 氧化 , 损
伤 心肌细 胞 。同时 , 蒽环类药物 降低心 肌细胞 中抗 氧
蒽环类药物心脏毒性

蒽环类药物心脏毒性蒽环类药物以其严重的心脏毒性而著称。
这种心脏毒性可能由许多因素引起,包括对心肌细胞肌质网上兰尼碱受体的影响、心脏中自由基的产生及药物代谢产物的蓄积。
它们的心脏毒性通常表现为心电图变化尤其是QRS复合波的频率变化和心律不齐;心肌病及其引发的心力衰竭有时数年后才表现出来也时有发生。
毒性主要与患者终生累积剂量有关。
因此,在治疗的过程中,医生会根据药物种类及患者情况计算所适用的终生剂量,当剂量达到上限的时候,一般来说会停止继续使用蒽环类药物或者重新估算上限。
有研究显示蒽环类药物引起心力衰竭的几率不仅与剂量有关,还随着接受治疗之后的时间的推移而增加——由2年之后的2%到15年之后的5%。
除了保持在累积剂量上限以下之外,肿瘤科医生还会使用许多其他方法降低心脏毒性。
一般来说,在化疗结束的3、6、9个月之后医生会建议检查一次心脏。
此外,保护心脏的措施还包括了使用右雷佐生辅助化疗,使用脂质体药物,和改用持续静脉滴注:● 右雷佐生是一种心脏保护剂,能够通过竞争性螯合铁离子来减少蒽环类药物产生的自由基数目。
研究显示它能够将心脏毒性发生几率减少约三分之二,同时并不影响化疗的效果或者是总体生存率。
● 相对于普通蒽环类药物来说,较少的脂质体药物会被运输到心脏,因此毒性较小。
● 持续静脉滴注能够减小药物在心脏尤其是左心室中的的峰浓度。
为了有效预防蒽环类药物导致的心脏毒性,应在第1次使用蒽环类药物前联合应用右丙亚胺。
另外还有其他的心脏保护剂,包括辅酶Q10,左卡尼汀,N-乙酰半胱氨酸,抗氧化剂VC、VE以及其他的铁螯合剂如去铁敏等,或许具有一定的心脏保护效果,但是用于防治蒽环类药物所致心脏毒性尚需进一步研究,目前只有右丙亚胺可使经过蒽环药治疗的病人心衰的发生率明显降低。
蒽环类药物用法用量多柔比星--5%葡萄糖注射液溶解后静脉冲入或滴注,可进行腔内注射或膀胱灌注,但不能鞘内注射;表柔比星--0.9%氯化钠注射液250~500ml溶解后静脉冲入或滴注;如选用葡萄糖注射液稀释,其含量下降速度很快,1h后的含量平均下降率大于5%,放置12h后,剩余含量仅为原含量的50%,因此建议选用生理盐水配伍吡柔比星--建议选用5%葡萄糖注射液溶解稀释静脉冲入或滴注,也可以膀胱灌注及动脉给药吡柔比星难溶于氯化钠注射液,因此不宜选用生理盐水作溶剂蒽环类药物适应症均为广谱抗肿瘤药,适用于急性白血病、乳腺癌、肺癌、卵巢癌等。
一例蒽环类药物心脏毒性的用药分析

3 分析讨论
3 . 1心脏 毒性 反 应分析 蒽环 类抗 肿瘤 药物 引起的 心 脏毒 性 主要 表现 为 三种 情 况 :急性 或 亚急 性心 脏 毒
蒽 环类 药 物激 活 肌 浆 网上 的C 道 ,使 肌浆 网释 能 出现 的临床表现 ,如心慌 、气短 、胸 闷、心律 失常 a通
等 ,且心肌酶检 测及心 电图、超 声心动 图检 查应为治
疗前后的 常规 检测项 目;③应用心肌保护 剂 ,右丙亚
②氧 化应 激产 物 的形 成 , 自由基和超 氧 化物 的形 成 胺为双 内酰 亚胺类化合物 ,是一种强 力的细胞 内交联 以及 脂 质过 氧化 反 应可导 致 细 胞膜 的完 整性 遭 到破 剂 ,能络 合与葸环 类药物结合 的铁 ,去除蒽环—铁 鳌 坏 ,引起 组织 损 伤 ;③铁 离 子代 谢 紊乱 ,有研 究 合物 中的三价铁离 子 ,减轻脂 质过 氧化物产生 的心脏 发 现 ,铁调 节 蛋 白一铁 效 应元 件结 合 的改 变 ,也 可 毒性【 5 J .促红细胞生成素也被多项研究证实对缺血性
s mma i e h c a i m,rs a t r ,mo i rn n r v n i n o n h a y l e i d c d c r i t x c t y u rz d t e me h n s ik f co s n t i g a d p e e to fa t r c c i n u e a d o o i i b o n y a aysso p t n t a i n n mp o a wh a a d o o i i f r h d c to . n l i f a i t a e wi m l a tl h g y h m o h d c r i t x c t a e e me ia i n y t t
【参考文档】蒽环类药物心脏毒副作用研究及防治的进展分析-易修

本文部分内容来自网络,本司不为其真实性负责,如有异议请及时联系,本司将予以删除== 本文为word格式,下载后可编辑修改,推荐下载使用!==蒽环类药物心脏毒副作用研究及防治的进展分析蒽环类抗肿瘤药物(anthracylinc, ATC)自上世纪60年代应用于临床以来,己成为血液病及实体肿瘤治疗中不可替代的基石药物,但其使用中可能出现的心脏毒副作用影响患者的远期生活质量并加重社会经济负担,因此早期有效的监测手段将对ATC所致心脏毒性有积极意义。
目前关于ATC所致心脏毒性的检测手段有了长足的进步,木文综述如下。
1发病机制蒽环类药物属于细胞毒性药物,主要以静脉注射形式给药,为细胞周期非特异性药物,对各期细胞均有作用,其中5期的早期细胞最为敏感,作用机制是嵌入DNA碱基对之间使DNA双链裂解,同时也干扰DNA和RNA多聚酶活性,阻碍DNA和RNA的合成。
蒽环类药物造成心脏病变的确切机制目前还不十分清楚。
可能与以下几种机制有关。
1. 1自由基损伤学说既往的大部分研究认为蒽环类药物对心肌的损伤与其在体内形成大量自由基有关。
蒽环类药物中的蒽酮基团在多种酶系的作用下,还原为半酮自由基,然后经一系列电子传递过程生成超氧阴离子轻自由基(OH-),从而对多种细胞产生强烈的损伤作用。
Simunck等认为活性氧在心肌内产生,蒽环类药物可促进苷元循环,经过氧化还原作用和活性氧形成蒽环铁螯合物,因其与心脏磷脂的亲和力较高,故结合后可导致细胞器膜功能损伤而产生心脏毒性。
1. 2钙超载及能量代谢障碍正常情况下,心肌细胞中的C a2+大部分储存在线粒体及肌浆网等处,它对维持心肌细胞兴奋收缩偶联有着重要作用。
蒽环类药物经激活肌浆网上的C a2+通道,使其释放到胞浆中的C a2+增加,从而影响心电活动导致各种心律失常,此为钙超载。
蒽环类药物还可抑制心肌细胞肌浆网膜上的C a2+ -APT酶基因表达,使其活性降低,使肌浆网摄取C a2+的能力下降,导致线粒体产生的ATP减少,影响心肌能量代谢,加重细胞损伤,甚至可导致心肌细胞死亡。
蒽环类药物心脏毒性防治指南(word版)

蒽环类药物心脏毒性防治指南(word版)蒽环类药物心脏毒性防治指南(2013年版) 中国临床肿瘤学会中华医学会血液学分会1 前言蒽环类药物,包括阿霉素、表阿霉素、柔红霉素和阿克拉霉素等广泛地用于治疗血液系统恶性肿瘤和实体肿瘤,如急性白血病、淋巴瘤、乳腺癌、胃癌、软组织肉瘤和卵巢癌等。
蒽环类药物可以与其他化疗药物及分子靶向药物联合应用,以蒽环类药物为基础的联合治疗通常是一线治疗的标准方案。
蒽环类药物的抗瘤谱广,抗瘤作用强,疗效确切,不可或缺,但是可以引起脱发、骨髓抑制和心脏毒性等毒副反应。
针对骨髓抑制可采用造血刺激因子(G-CSF、EPO和TPO 等)进行防治,而心脏毒性是蒽环类药物最严重的毒副作用。
临床研究和实践观察都显示蒽环类药物导致的心脏毒性往往呈进展性和不可逆性,特别是初次使用蒽环类药物就可能造成心脏损伤,因此早期监测和积极预防蒽环类药物引起的心脏毒性显得尤为重要,巳经引起临床上的高度重视。
为此,我们组织国内血液病科、肿瘤科和心脏内科等领域的专家,对蒽环类药物心脏毒性的特点、机理、诊断和防治等问题进行了认真研论,在原有的专家共识的基础上形成了本指南,提供临床医师参考。
2 蒽环类药物心脏毒性的临床表现和特征按照出现的时间进行分类,蒽环类药物导致的心脏毒性可以分成急性、慢性和迟发性心脏毒性(图1)。
多数患者在蒽环类药物给药后可较快地发生心肌损伤,且随着时间的延长愈加明显。
在给予蒽环类药物的数年后,超过50%的患者可发生左心室组织和功能亚临床心脏超声变化,例如后负荷的增加或收缩能力的下降。
蒽环类药物的慢性和迟发性心脏毒性与其累积剂量呈正相关(表1、表2)。
常用蒽环类药物导致心脏毒性的剂量可以进行换算(表3)。
蒽环类药物心脏毒急慢迟给药后的几小时或几天内发生,常表现为心内传导紊乱和心律失常,极少在化疗的1年内发生,表现为左心室功能障碍,最终可在化疗后数年发生,可表现心衰、心肌病及心律失常米托蒽醌(MIT) l60 mg/m2(用过ADM等药物,< 120 mg/m2)表2阿霉素累积剂量与心衰发生的关系阿霉素累积剂量心衰发生率(%)Von Hoff DD Swain SM400 mg/m2 3 5 550 mg/m27 26 700 mg/m218 48表3 蒽环类药物剂量换算表蒽环类药物转换系数5%发生心脏毒性的蒽环累积剂量阿霉素 1 450 mg/m2表阿霉素0.5 900 mg/m2柔红霉素0.5 935 mg/m2去甲氧柔红霉素 2 225 mg/m2米托蒽醌 2.2 200 mg/m23 蒽环类药物心脏毒性的机理蒽环类药物导致心脏毒性的机制仍未完全明了,现有的证据揭示与产生的自由基直接有关。
蒽环类药物心脏毒性防治指南2020
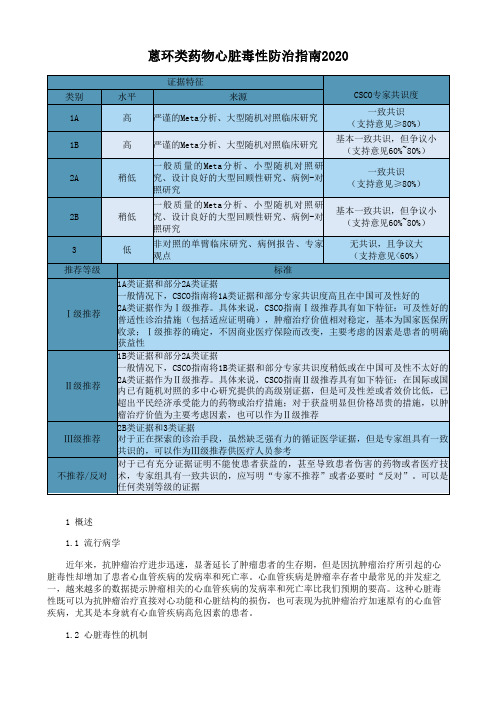
蒽环类药物心脏毒性防治指南20201 概述1.1 流行病学近年来,抗肿瘤治疗进步迅速,显著延长了肿瘤患者的生存期,但是因抗肿瘤治疗所引起的心脏毒性却增加了患者心血管疾病的发病率和死亡率。
心血管疾病是肿瘤幸存者中最常见的并发症之一,越来越多的数据提示肿瘤相关的心血管疾病的发病率和死亡率比我们预期的要高。
这种心脏毒性既可以为抗肿瘤治疗直接对心功能和心脏结构的损伤,也可表现为抗肿瘤治疗加速原有的心血管疾病,尤其是本身就有心血管疾病高危因素的患者。
1.2 心脏毒性的机制蒽环类药物所致心脏毒性的机制仍未明确,可能主要有以下两个方面。
(1)蒽环类药物通过酶和非酶介导的途径产生氧自由基,导致心脏损伤:1)蒽环类药物中的蒽醌基团在多种还原酶及NADH脱氢酶等酶系统的作用下,还原为半醌自由基,半醌自由基与氧分子和其他细胞电子供体之间的电子交换产生过量的活性氧(ROS),氧自由基蓄积量超过心脏线粒体和肌浆网的解毒能力而损害心脏。
2)蒽环类药物还可以通过非酶途径与铁形成螯合物,再经历氧化还原循环并产生氧自由基。
蒽环-铁螯合物对心脏磷脂的亲和力很高,当与心磷脂结合后,会导致细胞膜功能的损伤而产生心脏毒性。
右雷佐生是一种减弱蒽环类药物诱导的心脏毒性的药物,可以降低线粒体铁离子水平,预防蒽环诱导的心脏损伤。
还有研究认为右雷佐生的作用机制包括其提高了超氧化物歧化酶(SOD)活性,减少氧自由基的产生,降低脂质过氧化物含量以及调节心肌细胞凋亡机制,从而对心脏起到了保护作用。
(2)拓扑异构酶Ⅱ(Top Ⅱ)是蒽环类药物诱导心脏毒性的关键介质。
拓扑异构酶Ⅱ通过改变DNA在复制、染色体凝缩和姐妹染色体双链分离过程中的拓扑结构而发挥作用。
已经证明哺乳动物体内有两种拓扑异构酶亚型:Ⅱ和Ⅱ。
拓扑异构酶Ⅱ主要存在于增殖细胞中,是DNA复制所必需的,被认为是蒽环类药物抗肿瘤活性的分子基础。
相反,Top Ⅱ存在于所有静止细胞中,包括心肌细胞,蒽环类药物通过抑制Top Ⅱ导致DNA双键断裂,从而导致心肌细胞死亡。
参附注射液防治蒽环类药物心脏毒性临床观察
・
必 备 中成 药
・
参 附注射液 防治蒽环类药物心脏毒性 临床观察
沈 娜
中 图分 类 号 : 7 05 文献 标 识 码 : 文章 编号 :04~ 4 X(0 00 R 3.9 B 10 7 5 2 1 )7—13 0 12—床 资 料 比较
表 2 两组 治 疗 前后 心 肌 酶 C K—MB及 c n 水 平 比较 ( TI 面±5 )
1 1 临床 资料 .
选择 白血病 ( L 2 A )1 0例 、 非霍 奇金
1 2 治 疗方 法 .
对 照组 :对 N HL患者 实施 C O H P方
【 摘要】 目的 观察参附注射液对蒽环类药物致心脏毒性的防治效果 。 方法 白血病 ( L 10例 、 A )2 非霍奇金淋
巴瘤 ( H )0例 随机 分 为 观 察 组 和对 照 组 各 8 N L4 0例 , 照 组 N L患 者 实 施 C O 对 H H P方 案 化 疗 , 性 淋 巴 细胞 白 急 血 病 ( L ) 者 实施 V C A L患 D P方 案 化 疗 、 性 髓性 白血 病 ( ML 患 者 实 施 MA和 D 方案 交 替 化 疗 ; 察 组 在 急 A ) A 观 此 基 础 上予 以参 附 注射 液 静 滴 。结 果 治疗 组 心 电图 异 常发 生 率 低 于 对 照组 , 心肌 酶 谱 的 异 常 情 况好 于对 照 组 。 结论 参 附 注射 液可 以防 治 蒽 环类 药 物 所 致 的 心脏 毒 性 。
持续 1 d 5 。所有患 者均 完成 6个周期 化疗 。
蒽环类药物心脏毒性防治与药物研究进展
蒽环类药物心脏毒性防治与药物研究进展发表时间:2018-08-31T12:23:45.513Z 来源:《中国误诊学杂志》2018年7月20期作者:赵小翠韩燕霍朝辉杨包臣[导读] 蒽环类药物在肿瘤的防治方案中应用率较高,但由于其本身具有心脏毒性,故导致其临床应用范围受到严格限制赵小翠韩燕霍朝辉杨包臣天津医学高等专科学校,药学方向 300222摘要:蒽环类药物在肿瘤的防治方案中应用率较高,但由于其本身具有心脏毒性,故导致其临床应用范围受到严格限制;但若能清楚其临床特征,并加以药物干预,那么将有助于减轻心脏毒性,保证临床用药安全。
本文从蒽环类药物产生心脏毒性后所表现出的临床特征、药物干预手段方面入手,阐述蒽环类药物心脏毒性防治与药物研究进展。
关键词:蒽环类药物;心脏毒性;防治措施;药物干预;临床特征蒽环类药物主要是指去甲氧柔红霉素、阿霉素以及柔红霉素等药物,属于临床一线抗肿瘤药物,广泛应用于乳腺癌、白血病、骨肉瘤及胃癌等恶性肿瘤的治疗。
在临床使用过程中,蒽环类药物具有的心脏毒性日趋明显,轻则表现为无任何临床表现的偶发心电图异常,重则引发心力衰竭,甚至诱发心源性猝死。
但目前尚不明确蒽环类药物导致心脏损伤的病机,现阶段受到普遍支持的可能性原因包括自由基氧化、心肌细胞钙离子超负荷或线粒体释放色素C等[1-2]。
近年来,随着肿瘤发病率的提高,越来越多新类型抗肿瘤药物应用于临床,肿瘤患者死亡率趋于下降趋势。
这也成为蒽环类药物所导致的心脏毒性问题越来越突出的原因之一。
本文详见蒽环类药物产生心脏毒性后所表现出的临床特征、药物干预手段阐述如下。
1.蒽环类药物心脏毒性按照发病时间的不同可将心脏毒性分为三大类,其一为急性心脏毒性,多在蒽环类药物给药后几小时至几天内发生。
其二为慢性心脏毒性,是指在应用蒽环类药物化疗后1年后出现的类型。
其三为应用包含蒽环类药物在内的化疗药物数年后出现心脏毒性[3]。
使用蒽环类药物化疗的肿瘤会出现合并症之一的急性心脏毒性,多在给药后7天发生,听诊或心电图可见其心电图检查结果异常,心律不齐的情况。
蒽环类药物的心脏毒性管理
2 0 , 0 9 :4 — . 4 【 C o a i V C i c rc c . s a d s t i h p r ni 杂 志 , 0 8 1 ( )6 1 6 8 9 h b n A . l i p t e I l e y o c y e e s n i ] n a na ai l ot sl t o n
人 民卫 生 出版社 ,0 1 l — 9 20 :8 1.
【3 国高血压防治指 南修订委 员会. 0 l仲 2 4中国高血压防治指南 0
【4 ¥ 1f 林祥 , 梁伯进 , 谭文锋. 现代老年心血 管病学【 . M】 长沙 : 湖南
科 技 出版 社 ,0 6 20 . 20 ,3 1 :o 6. 04 2 ( )6一 2
5 4— 6 7 57 .
Me i a S in e a d T c n lg u l h n u e o h n ,1 9 . d c ce c e h o y P bi i g Ho s f C i a 9 3 l n o s
Chn s .ie e
【] 北 凡 . 压 升 高 和脑 率 中发 病 【 . 力 生. 5周 血 M】 刘 高血 压 【 . 京 : M] 北
中国公 共卫 生 。0 3 1(1: 1— 37 20 ,91 ) 3 5 1 1. 1 tee e y N E g JM d 2 0;5( :8- 9. h dr . nl e .0 7 7879 7 6 l l 3 )
L A.L z L J ,J n s DW ,Maes n B ,O ai S z o J r o e tro J p r , l g tJ r h T J,
【6王 薇 , 东. 1] 赵 中国老 年人 高血 压 的 流行 病 学【 . 老 年 医学 J 中华 ] 【 】 国老 年 高血压 治疗 共 识 专 家委 员会 . 老 年 心 脑血 管 病 1中 7 中华
阿霉素心脏毒性的防治与药物防护
阿霉素心脏毒性的防治与药物防护标签:阿霉素;心脏毒性;防治;防护阿霉素(adriamycin,ADM)属蒽环类抗肿瘤抗生素,是目前临床上的最常用抗肿瘤药物之一。
长期应用可诱发微粒体巯基氧化、脂质过氧化,使Ca2+-ATP 酶抑制,Ca2+转运受阻,从而引起心脏毒性。
本文就对ADM本身用法、用量的进一步研究,以及心脏毒性的药物防护两方面作一简要回顾。
1阿霉素的给药方式通过改变阿霉素的用药方法,以达到在对临床效果无明显影响基础上使其毒性反应降到最小,其已成为目前国内外临床研究焦点。
主要有以下两种方法:(1)将短时间静脉注射改为较长时间静脉滴注;(2)每周期总剂量保持不变的前提下,将每3周1次的阿霉素用量等分为3份,每周用药一次。
近年来,多项临床研究表明持续静脉输注阿霉素较静脉推注的心脏毒性显著降低,96 h持续输注效果最佳。
Hortobagyi对274例晚期乳腺癌患者采用CTX+阿霉素+5-氟尿嘧啶+TAM进行治疗,A组133例患者采用静脉1次注射阿霉素;B组144例患者采用中心静脉导管法持续滴注阿霉素48或96 h,两组缓解期、生存期及有效率比较差异均无统计学意义,但B组患者恶心呕吐、心脏毒性发生率显著下降。
Legha等采用30 min、24 h、48 h、96 h应用阿霉素,进行心肌活检。
30 min用药组(阿霉素累积量465 mg/m2)30例患者中,14例出现重度心脏毒性,而持续静脉滴注组(阿霉素累积量600 mg/m2)21例中仅发生2例(P=0.002)。
Shapira等对阿霉素20 min 静脉滴注和6 h静脉滴注的比较性研究发现,累积量达400 mg/m2时,心脏毒性的发生率分别为21%和6%。
阿霉素的分割应用,即将每3周1次阿霉素的给药量,等分3份,一周应用一次。
Torti等采用3周1次给药方式治疗98例,每周一次用法治疗27例,疗程结束行心内膜活检。
进行多变量分析,发现除肿瘤类型、合并其他抗肿瘤药物、性别、年龄等因素外,用药方式与累积量与心脏毒性的发生密切相关,每周应用阿霉素组的心脏毒性发生率下降明显。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
需要介入治疗 -
根据厂商的定义, 心肌肌钙蛋白I升 水平高于正常上限 高 低于心肌梗死时的 水平
心肌肌钙蛋白T 升高 射血分数下降 心电图QT间期校 正间隔时间延长 根据厂商的定义, 水平高于正常上限 低于心肌梗死时的 水平 -
-
-
-
静止时射血分数 39-20%; 50-40%;比基线 静止时射血分数 比基线下降> 20% 下降10-19% QTc481-500ms
Am J Clin Pathol 2008;130:688-695
生化标记物
cTn(心肌肌钙蛋白) T/I:
应用蒽环类药物化疗的患者cTn的水平显著增高,且
与心脏舒张功能不全相关。
在出现明显的LVEF变化前,cTnT/TnI即可监测到阿霉 素等蒽环类药物导致的早期心脏毒性。
Circulation 1997; 96:2641-2648.
蒽环类药物心脏毒性诊疗概要
诊断
1、不良事件评定标准(CTCAE4.0)(1类) 2、心内膜心肌活检评分(EMB) 1、超声心动图或MUGA:LVEF、FS能预测心衰,但对早期 的蒽环亚临床心脏损伤的检测并不敏感(1类) 2、肌钙蛋白:特异性较高,能监测早期蒽环心脏毒性(1类) 3、脑钠肽:判定心衰及其严重程度的客观指标(2A类) 4、心电图:常规检测,特异性较低(2B类) 5、心肌酶谱:常规检测,特异性较低(2B类) 6、心内膜心肌活检:敏感性、特异性较高,但为有创性检测 (3类) 、 1、右丙亚胺可以有效地预防蒽环类药物心脏毒性(1类) 2、限制蒽环类药物累积剂量、改变给药方法或使用脂质体蒽 环类药物可减少蒽环类药物心脏毒性(1类) 1、对症处理 2、心衰应常规联用3种药物:血管紧张素转化酶抑制剂 (ACEI)、血管紧张素受体拮抗剂(ARB)和β-受体阻滞 剂(1类) 3、心脏类药物治疗后前几年中,超过50%患者发生
后负荷增加或收缩能力下降。
大多数患者在蒽环类给药后很快发生了心脏损害,
而且随着时间的延长损害越明显,呈进展性与不
可逆性。
J Clin Oncol 2005;23(12):2629-2636. N Engl J Med 1991;324(12):808-815.
静止时射血分数<20%
-
QTc450-480ms
QTc≥501ms或较基线改变> 至少两个单独的心电图 60ms,尖端扭转性或多态性 中QTc≥501ms 室性心动过速或严重心律失 常征兆/症状
-
心内膜心肌活检(EMB)是公认的评估蒽环类 药物心脏毒性最敏感、最特异的方法。
• 蒽环心脏毒性病理学改变:
生化标记物
BNP ( 脑钠肽 ):
浓度与心衰程度相关,是判定心衰及其严重 程度的客观指标,可依此评价心脏功能。 研究显示癌症患者接受蒽环类药物治疗期间 BNP的升高与左室功能的损害相关。
蒽环类药物没有绝对的安全剂量,低剂量蒽环类药 物也可能引起心脏毒性。
原因:可能是个体差异,患者体内代谢蒽环类药物
相关基因的差异性导致其对蒽环的易感性不同。
Crit.Rev.Oncol/Hematol 2005;54:171-196
Drugs 2005; 65: 1005-1024.
(三)蒽环类药物心脏毒性的机理
蒽环类药物心脏毒性防治指南
目 录
(一)前言 (二)蒽环类药物心脏毒性的特征 (三)蒽环类药物心脏毒性的机理 (四)蒽环类药物心脏毒性的诊断 (五)蒽环类药物心脏毒性的监测 (六)蒽环类药物心脏毒性的预防和处理 (七)小结
(一)前 言
• 蒽环类药物治疗血液恶性肿瘤和实体肿瘤疗效确 切。
• 蒽环类药物存在心脏毒性——心脏毒性呈进展性 与不可逆性,且第1次使用就可能对心脏造成损伤。 • 早期监测和提前预防蒽环心脏毒性显得尤为重要。
心脏是人体最大的耗能器官,线粒体是能量的主
要来源,因此心脏的线粒体非常丰富,是产生活
性氧簇(ROS)的根源。
心脏比其他组织缺乏清除自由基的酶(超氧化物 岐化酶、过氧化氢酶、谷胱甘肽过氧化物酶), 其抗氧化作用较弱。
心脏更易受蒽环类药物的损伤。
Pharmacological Reports 2009;61:154–171.
• 脂质体阿霉素 • 脂质体柔红霉素 • 脂质体去甲氧柔红霉素
蒽环类药物是血液肿瘤和实体肿瘤 的基石类药物!
• • • • • • • • • 急性髓细胞白血病 急性淋巴细胞白血病 霍奇金淋巴瘤 非霍奇金淋巴瘤 乳腺癌 胃癌 骨肉瘤 软组织肉瘤 卵巢癌
• ……
(二)蒽环类药物心脏毒性的特征
蒽环类药物心脏毒性分类
J Clin Oncol . 2002 ; 20: 1215 – 1221.
诊 断
可通过临床症状结合心电图、超声心动图等检查进
行诊断。 现在国外多数临床诊疗和评价都是根据纽约心脏协 会(NYHA)关于心脏状态的分类评估或不良事件评 定标准(CTCAE 4.0)进行心脏毒性分级的评定。
J Clin Oncol 1996;14:3112-3 120.
述症状,亦称Ⅱ度或中度心衰。
Ⅳ级:不能从事任何体力活动,休息时亦有充血性心衰或心绞痛症状, 任何体力活动后加重,亦称Ⅲ度或重度心衰。
心脏不良事件评定标准(CTCAE 4.0)
不良事件
心力衰竭
1 4 5 无症状,实验室 静止或最低程度活动或 危及生命的后果;需要紧急 (如B型钠尿肽)或 轻度至中度活动 或劳累时产生症 劳累时严重症状;需要 介入治疗(如持续静脉治疗 死亡 心脏影像学检查异 状 介入治疗 或机械血液动力学支持治疗) 常
评分标准
Pediatr. Blood Cancer. 2005; 44:630-637.
(五)蒽环类药物心脏毒性的监测
蒽环类药物心脏毒性监测方法
方法 优点 缺点
显示心脏形态和功能;病人不需接触 LVEF检测费时,操作重复性差;LVEF 超声心动图 电离辐射;组织多普勒对监测心脏收 对监测早期的临床前心脏病变不敏感; 缩舒张功能更敏感 FS和LVEF受前后负荷影响 侵入性的——病人接触辐射,影响其 放射性核素心室 很好地评估射血分数;可评估局部室 重复性;低空间分辨率;不能显示瓣 显像术(MUGA) 壁的运动和舒张功能 膜功能;LVEF对监测早期的临床前心 脏病变不敏感 负荷超声心动图 可检测出静息状态下掩藏的心脏异常 非常规应用 肌钙蛋白是监测心肌损伤的高特异性 生化标记 关于临床价值的数据比较有限 和敏感性的标记物;是潜在的有效的 筛查工具 磁共振成像 评估心肌功能与损伤的有价值的工具 价格因素限制其应用 (MRI) CT 图像质量与MRI相似 高辐射剂量,应用受限 有创伤;需专家操作并解释结果;只 心内膜心肌活检 提供心脏毒性的组织学证据 能检测小样本的心肌组织 ;在中国不 适合进行
典型病例
急性淋巴细胞白血病患者使用蒽环治疗5年后心肌变化(尸检)
左图:心肌纤维化,坏死; 右图:心肌细胞空泡化
治疗血液肿瘤和实体肿瘤的蒽环类药物
• 柔红霉素(DNR)
• 去甲氧柔红霉素(IDA)
• 盐酸阿霉素(ADM) • 表阿霉素(EPI) • 阿克拉霉素(ACM) • 米托蒽醌(MIT)
• 吡喃阿霉素(THP)
在给药后的几小时或几天内发生, 常表现为心内传导紊乱和心律失常, 极少数表现心包炎和急性左心衰
急性
蒽环类药物 心脏毒性
慢性
在化疗的1年内发生, 表现为左心室功能障碍,最终可导致心衰
迟发性
在化疗后数年发生, 可表现心衰、心肌病及心律失常等
Drugs 2005; 65: 1005-1024.
蒽环类药物的最大累积剂量
蒽环类药物心脏毒性
蒽环类药物的慢性及迟发性心脏毒性与其累积剂 量呈正相关 低剂量蒽环类药物也可能引起心脏毒性 蒽环类药物对心脏的器质性损害从第1次应用时就 有可能出现
J Am Soc Echocardiogr 2007; 20:1351-1358. Circulation 1997; 96:2641-2648.
Annals of Oncology2006; 17: 614–622.
NYHA 心功能分级
美国纽约心脏病协会(NYHA)心功能分级 :
Ⅰ级:体力活动不受限,日常活动不引起过度的乏力、呼吸困难或心 悸,即心功能代偿期。
Ⅱ级:体力活动轻度受限。休息时无症状,日常活动即可引起乏力、心
悸、呼吸困难或心绞痛,亦称Ⅰ度或轻度心衰。 Ⅲ级:体力活动明显受限,休息时无症状,轻于日常的活动即可引起上
Expert Opin. Pharmacother. 2007; 8:1039-1058.
阿霉素累积剂量与心衰发生的关系
心衰发生率 阿霉素累积剂量
400 mg/m2 550 mg/m2 700 mg/m2
Von Hoff DD
3 % 7 % 18 %
Swain SM
5 % 26 % 48 %
Ann. Intern. Med. 1979; 91:710-717. Cancer 2003; 97:2869-2879.
蒽环类药物
阿霉素(ADM) 550 mg/m2 (放射治疗或合并用药, < 350-400 mg/m2 ) 表阿霉素(EPI) 吡喃阿霉素(THP) 900-1000 mg/m2(用过ADM,< 800 mg/m2) 950 mg/m2
推荐最大累积剂量
柔红霉素(DNR)
550 mg/m2
去甲氧柔红霉素(IDA) 290 mg/m2 阿克拉霉素(ACM) 米托蒽醌(MIT) 2000 mg( 用过ADM < 800 mg ) 160 mg/m2 (用过ADM等药物,< 120 mg/m2 )
机理复杂,尚未完全阐明:
