髓过氧化物酶测定试剂盒(酶法)产品技术要求lepu
髓过氧化物酶(MPO)测定试剂盒(胶乳免疫比浊法)产品技术要求百奥泰康

髓过氧化物酶(MPO)测定试剂盒(胶乳免疫比浊法)适用范围:该产品用于体外定量测定人血清或血浆中髓过氧化物酶浓度。
1.1 产品规格1.2 组成成分1.2.1试剂组成:液体双试剂。
1.2.2校准品的组成五个水平的冻干校准品,在磷酸盐缓冲液(50mM)中添加髓过氧化物酶纯品。
定值范围:(50-100)ng/mL;(100-180) ng/mL;(200-500)ng/mL;(550-800)ng/mL;(800-1400)ng/mL。
1.2.3质控品的组成两个水平的冻干质控品,在牛血清(20g/L)中添加髓过氧化物酶纯品。
定值范围:(30-150)ng/mL;(500-1000)ng/mL。
2.1 外观液体双试剂:试剂1:无色至淡黄色澄清液体,试剂2:乳白色液体。
校准品:冻干品,复溶后为无色至淡黄色澄清液体。
质控品:冻干品,复溶后为无色至淡黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度试剂空白吸光度应在0.3-2.0之间。
2.4 分析灵敏度浓度为120ng/mL时,吸光度变化范围应大于0.01。
2.5 线性测试血清或血浆样本,试剂线性在(0,1000]ng/mL范围内,线性相关系数(r)应不小于0.990;在(0,200]ng/mL范围内绝对偏差不超过20ng/mL,在(200,1000]ng/mL范围内的相对偏差不超过±10%。
2.6 批内重复性试剂盒测试项目重复性CV≤10%。
2.7 批间差不同批号之间测定结果的相对极差应≤15%。
2.8 准确度:回收试验:回收率应在90%-110%之间。
2.9 质控品赋值有效性测定值在质控靶值范围内。
2.10 批内瓶间差校准品批内瓶间差瓶间重复性CV≤5%质控品批内瓶间差CV≤5%。
2.11校准品溯源性根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品控制物质赋值的计量学溯源性》及有关规定提供髓过氧化物酶校准品的来源、赋值过程以及测量不确定度等内容。
超氧化物歧化酶测定试剂盒(SOD底物法)产品技术要求lepu

超氧化物歧化酶测定试剂盒(SOD底物法)适用范围:用于体外定量测定全血中的超氧化物歧化酶的活性。
1.1规格试剂1a:5×20mL,试剂1b:1×105mL,试剂2: 3×10mL,稀释液:1×100mL。
1.2主要组成成分试剂1a主要组分:试剂1b主要组分:试剂2主要组分:稀释液主要组分:2.1 净含量应不低于试剂瓶标示装量。
2.2 外观试剂1a:白色或淡黄色晶块,试剂1b:无色或淡黄色透明溶液,试剂2:白色或淡黄色晶块,稀释液:无色或淡黄色透明溶液。
外包装完好、无破损,标签完好、字迹清晰。
2.3 试剂空白2.3.1 试剂空白吸光度在505nm处测定试剂空白吸光度,应≤1.9;2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率△A/min≤0.8。
2.4 分析灵敏度测试2.0U/L的被测物时,吸光度变化率(ΔA/min)应不低于0.0012。
2.5 准确度在样品中加入一定体积的纯品,计算回收率,应介于90%-110%之间。
2.6 重复性批内变异系数(CV)应不超过10%。
2.7 线性2.7.1在[0.1,5.5]U/L区间内,线性相关系数r应不低于0.990;2.7.2 [0.1,0.66)U/L区间内绝对偏差不超过±0.08U/L;[0.66,5.5]U/L区间内相对偏差不超过±12%。
2.8 批间差对同一份样品进行重复测定,相对极差≤12%。
2.9 稳定性取在2℃~8℃条件下贮存达到12个月后的试剂进行检测,应符合本标准2.2、2.3、2.4、2.5、2.6、2.7之规定。
髓过氧化物酶(MPO)测定试剂盒(胶乳免疫比浊法)产品技术要求云想

1.性能指标1.1外观外观应符合如下要求:a)试剂盒应组分齐全,内外包装均应完整,标签清晰;液体试剂无渗漏。
b)R1:无色澄清透明液体、无沉淀、悬浮物和絮状物。
c)R2:为乳白色液体。
d)校准品/质控品:无色澄清透明液体、无沉淀、悬浮物和絮状物。
1.2装量液体试剂装量应不低于标示量。
1.3空白限不高于25ng/mL。
1.4分析灵敏度测试浓度为90ng/mL的MPO样本所引起的吸光度差值(ΔA)≥0.03。
1.5线性范围1.5.1试剂盒在[54,621]ng/mL 范围内,线性相关系数r≥0.990。
1.5.2在[54,200] ng/mL 范围内,线性绝对偏差应不大于±20.0ng/mL;在(200,621]ng/mL范围内,线性相对偏差应不大于±10.0%。
1.6精密度1.6.1重复性变异系数(CV)应不大于10%。
1.6.2批间差批间相对极差R 应不大于15%。
1.7准确度回收率应在90%-110%之间。
1.8分析特异性样本中胆红素≤400μmol/L、脂肪乳≤0.3%、抗坏血酸≤0.25g/L 时,对试剂检测结果的偏差影响应在±10% 以内。
1.9校准品正确度≤1。
量值传递的正确度应符合En1.10质控品赋值准确度在用校准品校准后的生化分析仪上测试定值质控品,结果应在制造商指定的赋值范围内。
1.11校准品/质控品均匀性1.11.1瓶内均匀性:CV应不大于10%。
瓶内1.11.2瓶间均匀性:CV应不大于10%。
瓶间1.12校准品赋值结果及其不确定度的表示方式应使用规范的表示方式,主要表示方式可选择:a)赋值结果±扩展不确定度;b)赋值结果,扩展不确定度。
髓过氧化物酶测定试剂盒产品技术要求万孚

髓过氧化物酶测定试剂盒产品技术要求万孚髓过氧化物酶测定试剂盒(化学发光免疫分析法)是一种用于测定体液
中髓过氧化物酶(MPO)浓度的试剂盒。
这种测定试剂盒在医疗诊断中具有
重要的应用价值,可以帮助医生及时发现和监测一些炎症性疾病和心血管
疾病的病情。
为了保证髓过氧化物酶测定试剂盒在实际使用中的准确性和灵敏度,
产品需要满足以下一些技术要求:
1. 灵敏度:可以测定微量水平下的髓过氧化物酶浓度,灵敏度应小
于20 ng/mL。
2. 线性范围:试剂盒需要具有较广的线性范围,可以测定不同浓度
范围内的髓过氧化物酶。
通常可以测定的线性范围应从10 ng/mL至500
ng/mL。
3.反应时间:试剂盒应具有快速的反应时间,可以在较短的时间内完
成髓过氧化物酶浓度的测定。
一般反应时间应控制在30分钟以内。
4.特异性:试剂盒应具有良好的特异性,可以区分髓过氧化物酶与其
他可能存在的干扰物质。
特异性可以通过进行交叉反应实验等方法来验证。
5.稳定性:试剂盒需要具有较好的稳定性,可以在存储和运输过程中
不降低其灵敏度和准确性。
通常应具有两年以上的长期稳定性。
6.操作简便性:试剂盒需要操作简便、易于使用,并且可以适用于各
种常见的化学发光免疫分析仪器。
7.技术支持:供应商需要提供详细的产品说明书,包括操作步骤、试剂的配制方法以及结果的解读方法。
同时还需要提供技术支持和问题解答服务。
以上是髓过氧化物酶测定试剂盒(化学发光免疫分析法)的一些基本技术要求,供参考使用。
实际产品的技术要求可能会根据具体厂家和产品而有所不同。
髓过氧化物酶测定试剂盒(胶乳免疫比浊法)产品技术要求zhongshengbeikong

髓过氧化物酶测定试剂盒(胶乳免疫比浊法)适用范围:本试剂用于体外定量测定人血清或血浆中髓过氧化物酶的含量。
1.1规格液体双剂型试剂1(R1):60mL×2,试剂2(R2):20mL×2;试剂1(R1):45mL×1,试剂2(R2):15mL×1;试剂1(R1):30mL×1,试剂2(R2):10mL×1;选配校准品(5个浓度):1mL×5;选配质控品(2个水平):1mL×2。
1.2规格划分说明根据净含量划分规格。
1.3主要组成成分试剂盒由试剂1(R1)液体、试剂2(R2)液体、选配校准品液体和选配质控品液体组成。
1.3.1 试剂1(R1)液体:Tris缓冲液 100mmol/L1.3.2 试剂2(R2)液体:包被胶乳颗粒的单克隆鼠抗人MPO抗体0.1%1.3.3 校准品液体:人血清基质髓过氧化物酶浓度1(20µg/L~110µg/L);浓度2(110µg/L~200µg/L);浓度3(200µg/L~450µg/L);浓度4(450µg/L~900µg/L);浓度5(900µg/L~1600µg/L)(每批定值)。
1.3.4 质控品液体:人血清基质髓过氧化物酶水平1(20µg/L~400µg/L);水平2:(400µg/L~1300µg/L)(每批定值)。
2.1 外观试剂盒中各组件的外观应满足:a) 试剂1(R1)应为无色或淡黄色透明溶液,无杂质、无絮状物,外包装完整无破损;b) 试剂2(R2)应为白色乳浊液,无杂质、无絮状物,外包装完整无破损;c) 校准品应为无色或淡黄色澄清液体,无混浊,无未溶解物,外包装完整无破损;d) 质控品应为无色或淡黄色澄清液体,无混浊,无未溶解物,外包装完整无破损。
髓过氧化物酶测定试剂盒(胶乳免疫比浊法)产品技术要求北京森美希克玛
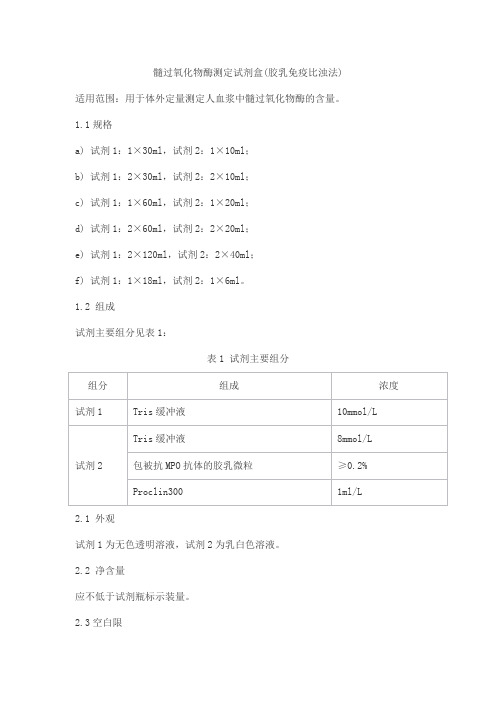
髓过氧化物酶测定试剂盒(胶乳免疫比浊法) 适用范围:用于体外定量测定人血浆中髓过氧化物酶的含量。
1.1规格a) 试剂1:1×30ml,试剂2:1×10ml;b) 试剂1:2×30ml,试剂2:2×10ml;c) 试剂1:1×60ml,试剂2:1×20ml;d) 试剂1:2×60ml,试剂2:2×20ml;e) 试剂1:2×120ml,试剂2:2×40ml;f) 试剂1:1×18ml,试剂2:1×6ml。
1.2 组成试剂主要组分见表1:表1 试剂主要组分2.1 外观试剂1为无色透明溶液,试剂2为乳白色溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3空白限试剂空白限为25ng/ml。
2.4 试剂空白测定试剂空白吸光度,应≤1.8。
2.5 分析灵敏度测定浓度为800ng/ml样品时,吸光度变化(ΔA)应不低于0.01。
2.6 线性2.6.1在[25,1300]ng/ml范围内,线性回归的相关系数应不低于0.990;2.6.2测试浓度[60,1300]ng/ml的样品,相对偏差应不超过±10%;测试浓度[25,60)ng/ml的样品,绝对偏差应不超过±6ng/ml。
2.7 重复性2.7.1 批内重复性变异系数(CV)应不超过8%。
2.7.2 批间差对同一份样品进行重复测定,相对极差(R)应不超过10%。
2.8 准确度回收率应在85%~115%范围内。
2.9 稳定性取在2℃~8℃条件下贮存达到18个月但未超过24个月的试剂检测,应符合本技术要求2.1、2.3、2.4、2.5、2.6、2.7.1、2.8之规定。
髓过氧化物酶(MPO)测定试剂盒(荧光免疫层析法)产品技术要求huaketai

髓过氧化物酶(MPO)测定试剂盒(荧光免疫层析法)适用范围:本试剂盒用于体外定量测定人血清、血浆、全血中髓过氧化物酶(MPO)的含量。
1.1规格10人份/盒、20人份/盒、50人份/盒。
1.2主要组成成分注:1.质控品质控范围批特异,具体浓度详见标签。
2.1物理性能2.1.1外观检测卡应整洁完整、无毛刺、无破损、无污染;材料附着牢固。
2.1.2膜条宽度膜条的宽度应不小于3mm。
2.1.3移行速度液体移行速度应不低于10mm/min。
2.2溯源性根据GB/T21415-2008的有关规定,提供所用校准品的来源、赋值过程及测量不确定度等内容,溯源至企业工作校准品,并与已上市产品比对赋值。
2.3空白限空白限应不高于5ng/mL。
2.4准确度回收率应在85%~115%之间。
2.5线性在线性范围[10,1000]ng/mL内,相关系数(r)应不低于0.99。
2.6重复性分别检测高值和低值两个样本,重复性(CV%)应不高于15.0%。
2.7批间差在三个批次产品之间,样本测定结果的变异系数(CV%)应不高于20.0%。
2.8特异性2.9质控品赋值有效性测定高值、低值浓度质控品,其结果均应在质控范围内。
2.10稳定性2.10.1效期稳定性10℃~30℃储存(质控品2℃~8℃),有效期12个月,效期后2个月内分别检测2.3~2.6,2.8,2.9项,其结果应符合各项要求。
2.10.2质控品复溶稳定性冻干粉试剂复溶后,-20℃以下储存,有效期1个月,分别检测2.6,2.9项,其结果应符合各项要求。
5‘-核苷酸酶(5’-NT)测定试剂盒(过氧化物酶法)产品技术要求lepu
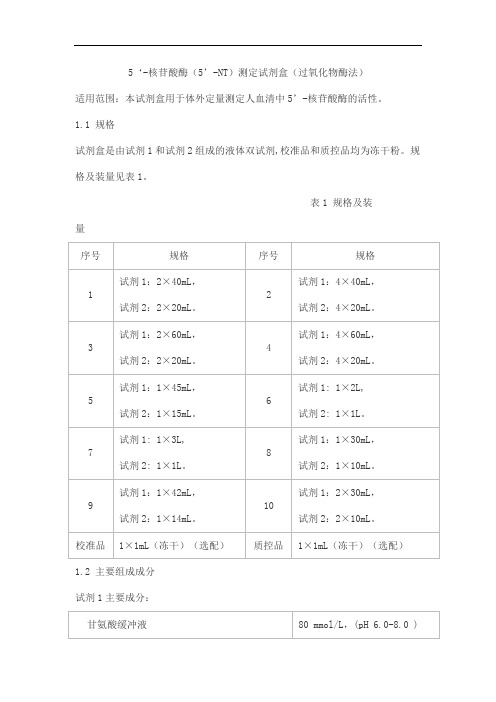
5‘-核苷酸酶(5’-NT)测定试剂盒(过氧化物酶法)适用范围:本试剂盒用于体外定量测定人血清中5’-核苷酸酶的活性。
1.1 规格试剂盒是由试剂1和试剂2组成的液体双试剂,校准品和质控品均为冻干粉。
规格及装量见表1。
表1 规格及装量1.2 主要组成成分试剂1主要成分:试剂2主要成分:校准品主要组分:质控品主要组分:2.1 净含量应不低于试剂瓶标示装量。
2.2 外观试剂1:无色或淡黄色透明溶液,试剂2:无色或淡黄色透明溶液 ,校准品:白色至浅黄色冻干粉,复溶后为无色至浅黄色透明液体,质控品:白色至浅黄色冻干粉,复溶后为无色至浅黄色透明液体。
外包装完好、无破损,标签完好、字迹清晰。
2.3 试剂空白2.3.1 试剂空白吸光度在546nm(546nm-550nm)处测定试剂空白吸光度,应<0.6。
2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率△A/min≤0.15。
2.4 分析灵敏度测试80U/L的被测物时,吸光度变化率(ΔA/min)应不低于0.004。
2.5 准确度参照EP9-A2的方法,用比对试剂盒同时测试40例线性区间内的不同浓度的血清样本。
其相关系数(r)不小于0.990。
每个浓度点在(1,15)U/L区间内绝对偏差不超过±2.25U/L;[15,95]U/L区间内相对偏差不超过±15%。
2.6 重复性变异系数(CV)应不超过10%。
2.7 线性2.7.1在(1,95]U/L区间内,线性回归的相关系数r应不低于0.990;2.7.2(1,15)U/L区间内绝对偏差不超过±2.25U/L;[15,95]U/L区间内相对偏差不超过±15%。
2.8 批间差对同一份样品进行重复测定,相对极差<15%。
2.9校准品批内瓶间差变异系数(CV)应≤10%。
2.10 质控品批内瓶间差变异系数(CV)应≤10%。
2.11溯源性根据GB/T 21415-2008的规定,本试剂盒内校准品溯源至企业工作校准品,与已上市公司试剂盒进行比对赋值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
髓过氧化物酶测定试剂盒(酶法)
适用范围:用于体外定量测定人血清中髓过氧化物酶的活性。
1.1规格
试剂1: 1×24mL,试剂2: 1×12mL,试剂3: 1×9mL;
试剂1: 2×24mL,试剂2: 2×12mL,试剂3: 2×9mL。
1.2主要组成成分
试剂1主要组分:
试剂2主要组分:
试剂3主要组分:
2.1 净含量
应不低于试剂瓶标示装量。
2.2 外观
试剂1:无色或淡黄色透明溶液;试剂2:无色或淡黄色透明溶液;试剂3:无色或淡黄色透明溶液。
外包装完好、无破损,标签完好、字迹清晰。
2.3 试剂空白
2.3.1 试剂空白吸光度
在505nm处测定试剂空白吸光度,应≤1.2;
2.3.2 试剂空白吸光度变化率
试剂空白吸光度变化率△A/min≤0.3。
2.4 分析灵敏度
测试150 ng/mL的被测物时,吸光度变化率(ΔA/min)应不低于0.0055。
2.5 准确度
在样品中加入一定体积的纯品,计算回收率,应介于90%-110%之间。
2.6 重复性
批内变异系数(CV)应不超过10%。
2.7 线性
2.7.1在[50,1300] ng/mL区间内,线性相关系数r应不低于0.990;
2.7.2 [50,156 )ng/mL L区间内绝对偏差不超过±18.7 ng/mL;[156,1300] ng/mL 区间内相对偏差不超过±12%。
2.8 批间差
对同一份样品进行重复测定,相对极差≤12%。
2.9 稳定性
取在2℃~8℃条件下贮存达到12个月后的试剂进行检测,应符合本标准2.2、2.3、2.4、2.5、2.6、2.7之规定。
