化学中的有色物质
初中化学中常见的有色物质在初中的化学中有哪些常见的物质是有颜色的,比如 白色:碳酸钙……蓝色:硫酸铜

初中化学中常见的有色物质在初中的化学中有哪些常见的物质是有颜色的,比如白色:碳酸钙……蓝色:硫酸铜1.有色气体:Cl2(黄绿色).NO2.Br2(气)红棕色2.液体:Br2(红棕色)3.有色固体:红色Cu.Cu2O.Fe2O3红褐色:Fe(OH)3绿色:Cu2(OH)2CO3.FeSO4*7H2O蓝色:Cu(OH)2.CuSO4*5H2O黑色:CuO.FeO.FeS.CuS.MnO2.C.Fe3O4.FeO.Ag2S浅黄色:S.Na2O2.AgBr黄色:AgI.Ag3PO44.有色溶液:Cu2+(蓝色).Fe2+(浅绿色).Fe3+(黄色).MnO4-(紫红色).溴水(橙色).5.焰色反应:Na+(黄色).k+(紫色)6.使品红褪色的气体:SO2(加热后又恢复到红色).Cl2(加热后不恢复红色)颜色变化的反应:1.蛋白质遇硝酸变黄(如做实验时.被某液体溅到皮肤上.皮肤变黄)2.酚类遇Fe3+显紫色3.Fe3+遇SCN-呈现血红色4.Fe2+(浅绿色或灰绿色)遇比较强的氧化剂变成Fe3+(黄色)5.Fe(OH)2(白色).在空气或溶液中会迅速变为灰绿色沉淀.最后变为Fe(OH)3红褐色沉淀.6.白色无水硫酸铜溶于水会变蓝7.淀粉遇碘变蓝8.氧化漂白:次氯酸HClO(氯气通到湿润的有色布条.使有色布条褪色.其实是氯气与水生成次氯酸HClO.而次氯酸HClO具有强氧化性使布条褪色).臭氧O3.双氧水H2O2等都可使高锰酸钾溶液褪色9.二氧化硫通入品红溶液.品红溶液褪色.但非氧化漂白.再加热品红溶液.颜色恢复.10.不饱和烃(如烯烃.炔烃等)会使溴水或高锰酸钾溶液褪色(与溴发生加成反应.还原高锰酸钾)11.苯酚(固体)在空气中露置被氧气氧化变为粉红色12.2NO(无色)+O2=2NO2(红棕色)13.NO2(红棕色)=N2O4(无色) (由于技术有限.这里的等号应为可逆号)(正反应条件好像是加压.逆反应条件反之)14.黑色氧化铜CuO会与还原性物质(如氢气H2.一氧化碳CO.碳C等)反应生成红色的铜Cu.15.醛基与银氨溶液反应生成光亮的银镜(反应要在水浴中进行)16.醛基与新制氢氧化铜悬浊液反应.反应现象是蓝色絮状沉淀(Cu(OH)2)到砖红色沉淀(Cu2O)17.无机反应(沉淀或有色离子)CH3COO-与Pb2+Ba2+与SO42-Ba2+与SO32-Sn2+与SO42-Ag+与Cl-Hg+(Hg2Cl2) 与Cl-等等都是生成白色沉淀18.Cu2+与碱生成Cu(OH)2蓝色沉淀.19.Fe2+与碱生成Fe(OH)2.但它易被氧化.所以实验现象中没有我们期望的白色沉淀.而是灰绿色沉淀.过一段时间最终形成Fe(OH)3红褐色沉淀.20.Fe3+与碱生成Fe(OH)3红褐色絮状沉淀去转的,但是他归纳的很好、很完整后面的颜色变化反应大多是高中内容,看着觉得陌生就丢开不用管。
高中化学有色物质大全

物质的颜色一、红色1、Li 的焰色:紫红色(用于元素锂元素存在的检验)2、Ca 的焰色:砖红色(用于元素钙元素存在的检验)3、Sr 的焰色:洋红色(用于元素锶元素存在的检验)4、固体铜:红色(有金属光泽)5、红磷:暗红色6、液溴:深红棕色(水溶液为橙色,蒸汽为红棕色)7、氧化铁粉末:红棕色(通常用作颜料,俗称铁红)8、氢氧化铁胶体或沉淀:红褐色(通常用来检验Fe2、Fe3的存在)9、氧化亚铜沉淀:砖红色(用于检验有机物中醛基的存在)10、二氧化氮气体:红棕色11、Fe3+溶液中加入SCN-:棕色溶液变成血红色(用来检验Fe3的存在)12、碱性溶液中滴入酚酞溶液:溶液变红色13、酸性溶液中滴入石蕊试液:溶液变红色二、黄色1、Au:金黄色(有金属光泽)2、Na 的焰色:黄色(用于检验Na 元素的存在)3、白磷:黄色或白色4、硫固体:淡黄色晶体5、AgBr:淡黄色(不溶于稀硝酸,用于检验溴离子的存在)6、AgI:黄色(不溶于稀硝酸,用于检验碘离子的存在)7、Ag3PO4:黄色(溶于稀硝酸)8、Na2O2:淡黄色固体(用于潜水艇中的制氧气)9、Fe3的溶液:棕黄色10、工业盐酸:因含有Fe3而显黄色11、浓硝酸:因长久放置分解出NO2 而显黄色12、鸡蛋白溶液:遇浓硝酸而变黄色三、绿色1、Cu 的焰色:绿色(用于检验铜元素的存在)2、Ba 的焰色:黄绿色(用于检验钡元素的存在)3、白磷自燃:绿色(俗称鬼火)4、FeSO47H2O:绿色(俗称绿矾)5、CuOH2CO3:绿色(铜锈)6、氯气:黄绿色气体7、氯水:黄绿色8、氟气:淡黄绿色气体9、Fe 溶液:浅绿色四、蓝色:淡蓝色1、O2(液态或固态)2、CuSO45H2O 晶体:蓝色(俗称蓝矾,又叫胆矾)3、Cu(OH)2 沉淀:蓝色4、CuSO4 溶液:蓝色5、CuCl2 溶液:蓝绿色(与溶液浓度有关)6、CO 在空气中燃烧:蓝色火焰7、H2、H2S、CH4、C2H5OH、S 在空气中燃烧:淡蓝色火焰8、淀粉遇上I2:变蓝色9、葡萄糖溶液中加入氢氧化铜悬浊液:变成绛蓝色溶液(若加热煮沸则生成砖红色沉淀Cu2O)10、碱性溶液中加入石蕊试液:变蓝色11、湿润的红色石蕊试纸遇氨气变蓝色12、白色的碘化钾淀粉试纸:遇氧化性物质变蓝色(如H2O2、Cl2、NO2 等)五、紫色1、I2 固体:紫黑色(有金属光泽)2、I2 蒸汽:紫色3、I2 的CCl4 溶液或苯溶液:紫红色(I2 水呈褐色)4、KMnO4 溶液:紫色或紫红色5、石蕊试液:紫色6、苯酚溶液中滴加FeCl3 溶液:变紫色7、K 的焰色:紫色(透过蓝色钴玻璃,用于检验钾元素的存在)8、Rb(铷)的焰色:紫色(用于检验铷元素的存在)六、白色1、大多数金属固体都是银白色(铯略带金色光泽)2、AgCl:白色沉淀(不溶于稀硝酸,用于检验氯离子的存在)3、BaSO4:白色沉淀(不溶于稀硝酸,用于检验钡离子或硫酸根离子的存在)4、Fe(OH)2:白色絮状沉淀(接触空气后迅速变为灰绿色,最后变为红褐色氢氧化铁,可用于检验Fe2的存在)5、澄清石灰水中通入过量的CO2 或SO2:先出现白色浑浊,后又澄清。
化学物质的性质

一、物理性质1、有色气体:F2(淡黄绿色)、Cl2(黄绿色)、Br2(g)(红棕色)、I2(g)(紫红色)、NO2(红棕色)、O3(淡蓝色),其余均为无色气体。
其它物质的颜色见会考手册的颜色表。
2、有刺激性气味的气体:HF、HCl、HBr、HI、NH3、SO2、NO2、F2、Cl2、Br2(g);有臭鸡蛋气味的气体:H2S。
3、熔沸点、状态:① 同族金属从上到下熔沸点减小,同族非金属从上到下熔沸点增大。
② 同族非金属元素的氢化物熔沸点从上到下增大,含氢键的NH3、H2O、HF反常。
③ 常温下呈气态的有机物:碳原子数小于等于4的烃、一氯甲烷、甲醛。
④ 熔沸点比较规律:原子晶体>离子晶体>分子晶体,金属晶体不一定。
⑤ 原子晶体熔化只破坏共价键,离子晶体熔化只破坏离子键,分子晶体熔化只破坏分子间作用力。
⑥ 常温下呈液态的单质有Br2、Hg;呈气态的单质有H2、O2、O3、N2、F2、Cl2;常温呈液态的无机化合物主要有H2O、H2O2、硫酸、硝酸。
⑦ 同类有机物一般碳原子数越大,熔沸点越高,支链越多,熔沸点越低。
同分异构体之间:正>异>新,邻>间>对。
⑧ 比较熔沸点注意常温下状态,固态>液态>气态。
如:白磷>二硫化碳>干冰。
⑨ 易升华的物质:碘的单质、干冰,还有红磷也能升华(隔绝空气情况下),但冷却后变成白磷,氯化铝也可;三氯化铁在100度左右即可升华。
⑩ 易液化的气体:NH3、Cl2 ,NH3可用作致冷剂。
4、溶解性① 常见气体溶解性由大到小:NH3、HCl、SO2、H2S、Cl2、CO2。
极易溶于水在空气中易形成白雾的气体,能做喷泉实验的气体:NH3、HF、HCl、HBr、HI;能溶于水的气体:CO2、SO2、Cl2、Br2(g)、H2S、NO2。
极易溶于水的气体尾气吸收时要用防倒吸装置。
② 溶于水的有机物:低级醇、醛、酸、葡萄糖、果糖、蔗糖、淀粉、氨基酸。
高中化学有色物质大全

高中化学有色物质大全高中化学中,有色物质是一个重要的研究对象。
有色物质广泛存在于我们的生活和实验室中,对于理解物质的性质和应用具有重要意义。
本文将为大家介绍一些常见的有色物质及其相关知识。
1. 金属离子溶液金属离子溶液是实验中常见的有色物质。
当某些金属离子溶解在水中时,其溶液会呈现出特定的颜色。
例如,铁离子溶液呈现出淡黄色,铜离子溶液呈现出蓝色,铬离子溶液呈现出绿色等。
这些颜色是由金属离子的电子跃迁引起的,不同金属离子的电子跃迁能级不同,因而呈现出不同的颜色。
2. 过渡金属络合物过渡金属络合物是一类常见的有色物质。
过渡金属离子在与配体形成络合物后,其电子转移发生变化,从而导致溶液呈现出不同的颜色。
例如,铜离子与氨水(NH3)形成四氨合铜离子(Cu(NH3)4²⁺)的络合物,呈现出深蓝色。
这是由于络合物的形成改变了铜离子的电子跃迁过程。
3. 配位化合物配位化合物是一类由中心金属原子或离子与多个配体形成配位键的化合物。
这类化合物通常呈现出明亮的颜色。
例如,紫色的[Co(H2O)6]²⁺,粉红色的[KMnO4]等。
这些有色配位化合物的颜色主要是由于配位原子或离子的变化以及电子的吸收和发射引起的。
4. 有机化合物在有机化学中,一些有机物分子结构上的共轭体系也能引起物质呈现出有色。
共轭体系中的π电子有较低的跃迁能级,可以吸收较长波长的可见光,因而呈现出有色。
例如,苯(C6H6)呈现无色,而具有共轭结构的苯类化合物(如芳香族化合物)多呈现出黄色至红色。
5. 部分过渡金属氧化物部分过渡金属氧化物在不同的氧化态下呈现出不同的颜色。
这是由于氧化物的电子结构发生改变,从而引起能带结构的变化。
例如,二氧化钛(TiO2)在纯净状态下是白色的,但掺杂不同的氧化态(如二价钛或三价钛)后,颜色会发生变化。
总结:高中化学中,有色物质的研究对于了解物质的性质和应用具有重要意义。
金属离子溶液、过渡金属络合物、配位化合物、有机化合物以及部分过渡金属氧化物都是常见的有色物质。
有色金属元素共64种

因此,若在较低温度(1150℃)下熔炼冰铜,只要冰 铜中含硫量较CuS-FeS线低些,熔体冰铜便会进入液 相分层区,从而发生液相分层,或进入S-L两平衡区, 析出金属铁的固熔体,显然在1150℃下熔炼冰铜不合 适。
随着温度增高,如1250℃以上,冰铜熔体可在较大的 组成范围内以单一均匀液相存在,既不分层,也没有 金属存在,所以炼冰铜及冰铜吹炼一般都在15231623k条件下进行。
因此若在较低温度1150下熔炼冰铜只要冰铜中含硫量较cusfes线低些熔体冰铜便会进入液相分层区从而发生液相分层或进入sl两平衡区析出金属铁的固熔体显然在1150下熔炼冰铜不合随着温度增高如1250以上冰铜熔体可在较大的组成范围内以单一均匀液相存在既不分层也没有金属存在所以炼冰铜及冰铜吹炼一般都在15231623k条件下进行
如果铜的硫化物原料如(CuFeS2)进行造锍熔 炼,必须满足下列条件:
①氧化气氛控制得当;
②有足够的FeS存在; 铜就会以Cu2S的形式全部进入冰铜,这是氧化富集的 理论基础。
§3 锍的形成:
造锍过程可以说是几种金属硫化物之间的互溶过程。 一种金属的不同价态的硫化物,如Cu2S、CuS、FeS2、 FeS,高价硫化物在熔化之前会发生如下的热离解:
Cu2S+FeS= Cu2S·FeS(熔体)
2FeO+SiO2 = 2FeO.SiO2(熔渣)
这就是造锍熔炼,它使原料中的Cu(以硫化物或氧 化物形式)全部以Cu2S形态富集在冰铜中,再利用渣 的比重小于锍的比重,实行有效分离。
Co、Ni与此类似,这个过程的产物为锍。
Cu-Fe-S的元素状态图
锍是复杂的硫化物共熔体,其中富集了所提炼的金属 和贵金属,例如冰铜中主要是Cu2S和FeS,总量占8090%。
高中化学有色物质大全
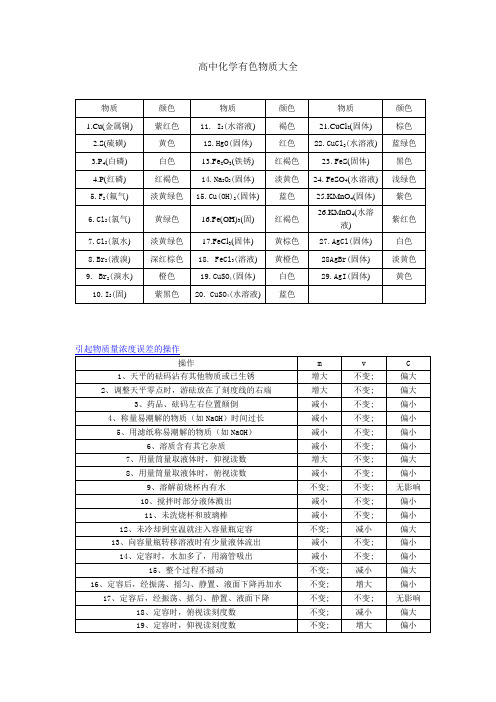
高中化学有色物质大全硝酸固碘硝酸银,低温避光棕色瓶。
液溴氨水易挥发,阴凉保存要密封。
白磷存放需冷水,钾钠钙钡煤油中,碱瓶需用橡皮塞,塑铅存放氟化氢。
易变质药放时短,易燃易爆避火源。
实验室中干燥剂,蜡封保存心坦然。
1、硝酸固碘硝酸银,低温避光棕色瓶:意思是说硝酸、固体碘和硝酸银都属于受热见光易分解的物质,所以必须存放在棕色瓶里,并放在阴凉处。
2、碱瓶需用橡皮塞:意思是说盛放碱液的试剂瓶要用橡皮塞或木塞。
3、塑铅存放氟化氢:意思是说氟化氢(氢氟酸)易腐蚀玻璃,因而必须存放在塑料或铅制器皿中。
4、易变质药放时短:意思是说易变质的药品存放时间较短,即不能长久贮存,最好现用现配制常见易变质的药品有:①氢硫酸放久了,则大部分将挥发,部分被空气氧化;②氯水长期存放将因慢慢分解而失效;③亚铁盐长期存放,则易被氧化为铁盐;④酸化的高锰酸钾溶液长期存放则慢慢退色]。
5、易燃易爆避火源:意思是说易燃物质(如:二硫化碳、酒精、丙酮、苯、硫、磷、镁粉等)和易爆炸的物质(如:氯酸钾、硝酸铵等)存放时要远离火源。
6、实验室中干燥剂,蜡封保存心坦然:意思是说实验室中用的干燥剂极易吸水,因而要用蜡封保存。
燃烧及火焰的颜色(一)燃烧的一般条件1.温度达到该可燃物的着火点2.有强氧化剂如氧气、氯气、高锰酸钾等存在3.(爆炸物一般自身具备氧化性条件,如硝化甘油、三硝基甲苯、火药等,只要达到温度条件,可以在封闭状态下急速燃烧而爆炸)(二)镁在哪些气体中可以燃烧?1镁在空气或氧气中燃烧2.镁在氯气中燃烧3.镁在氮气中燃烧4.镁在二氧化碳中燃烧(三)火焰的颜色及生成物表现的现象氢气在空气中燃烧—-淡蓝色火焰氢气在氯气中燃烧---苍白色火焰,瓶口有白雾。
甲烷在空气中燃烧---淡蓝色火焰酒精在空气中燃烧---淡蓝色火焰硫在空气中燃烧---微弱的淡蓝色火焰,生成强烈剌激性气味的气体。
硫在纯氧中燃烧---明亮的蓝紫色火焰,生成强烈剌激性气味的气体硫化氢在空气中燃烧---淡蓝色火焰,生成强烈剌激性气味的气体。
高中化学中的有色物质

色离子(Colored ion)在水溶液中,有些离子是有色的。
常见的有色离子有:有色离子的颜色Cu2+铜离子-----------蓝色Fe2+亚铁离子-----------浅绿色Fe3+铁离子-----------几近无色的淡紫色(黄色是在一般溶液中的颜色。
)Mn2+锰离子-----------浅粉色Co2+钴离子-----------粉色Ni2+镍离子---------绿色Cr2+亚铬离子-----------蓝绿色Cr3+铬离子-----------绿色Cd2+镉离子-----------蓝绿色Au3+金离子--------金黄色MnO4-高锰酸根离子----------紫红色MnO42-锰酸根离子---------墨绿色CrO42-铬酸根离子---------黄色Cr2O72-重铬酸根离子--------橙色[Fe(SCN)]2+硫氰合铁络离子------血红色[CuCl4]2-四氯合铜络离子--------黄色血红色:Fe3+遇到SCN-时的颜色有色物质编辑1. 有色气体:Cl2(黄绿色)、NO2、Br2(气)红棕色2. 液体:Br2(红棕色)3. 有色固体:红色Cu、Cu2O、Fe2O3红褐色:Fe(OH)3,Fe3O4绿色:Cu2(OH)2CO3,FeSO4*7H2O蓝色:Cu(OH)2,CuSO4*5H2O黑色:CuO,FeS,CuS,MnO2,C,FeO,Ag2S浅黄色:S,AgBr 黄色:AgI,Ag3PO44. 有色溶液:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色)、MnO4-(紫红色)、溴水(橙色)。
二苯甲酮显色原理

二苯甲酮显色原理引言:二苯甲酮(Benzoin)是一种有机化合物,具有强烈的香草味。
它在化学实验室中广泛应用于有机合成和分析化学中。
二苯甲酮的显色原理是指在特定条件下,二苯甲酮会发生化学反应,产生有色物质从而产生显色现象。
本文将介绍二苯甲酮显色原理以及其在实验室中的应用。
一、二苯甲酮的结构与性质二苯甲酮的分子式为C14H12O,它由苯甲醇经过酸催化氧化反应得到。
二苯甲酮是一种白色结晶固体,在常温下稳定。
它是一种非常有用的化合物,可以用作酮类化合物的合成试剂,也可以用作荧光染料和光敏化合物。
二、二苯甲酮显色原理二苯甲酮显色原理是指在还原剂的作用下,二苯甲酮会发生还原反应,生成有色的产物。
这种显色反应被广泛应用于分析化学中,可以用于测定还原剂的含量以及其他化合物的定量分析。
三、二苯甲酮显色的实验操作在实验室中,可以通过以下步骤进行二苯甲酮显色实验:1. 准备试剂:将适量的二苯甲酮溶解在有机溶剂中,并配制出一定浓度的溶液。
2. 加入还原剂:将所需测定的样品溶液与还原剂混合,在适当的温度下反应一段时间。
3. 观察显色现象:反应完成后,观察产物的颜色变化并记录下来。
4. 分析测定:根据显色的程度可以确定还原剂的含量或其他化合物的浓度。
四、二苯甲酮显色的应用二苯甲酮显色原理在实验室中有着广泛的应用。
以下是几个典型的应用案例:1. 还原剂的测定:二苯甲酮可以作为指示剂,用于测定还原剂的含量。
通过比较产物的颜色与标准曲线,可以确定还原剂的浓度。
2. 金属离子的测定:某些金属离子(如铜离子)可以还原二苯甲酮,产生有色产物。
通过测定产物的颜色可以确定金属离子的浓度。
3. 分子结构的研究:二苯甲酮显色原理可以用于研究有机分子的结构和反应机理。
通过观察显色现象可以推断出分子内部的电子转移过程和还原机制。
结论:二苯甲酮显色原理是一种重要的化学反应原理,在实验室中有着广泛的应用。
通过二苯甲酮的显色反应,可以确定还原剂的含量、金属离子的浓度以及研究分子结构和反应机理。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学有色物质有哪些?
| [<<] [>>]
色离子:Cu2+蓝色Fe3+黄色Fe2+浅绿色MnO4-紫色
碱:蓝色氢氧化铜红褐色氢氧化铁
盐:同有色离子溴化银淡黄色碘化银黄色(多为白色)
氧化物:红棕色NO2
红色Fe2O3(基本上能溶与水的氧化物是白色,不溶的是黑色)
Na2O2淡黄色
单质:少数金属:金铜
非金属:黄绿色的氯气、棕红色的溴、紫黑色的碘、淡黄色的硫
一、红色物质和红色反应
(一)物质
1.pH<3.1时的甲基橙溶液呈红色
2.pH<5时的石蕊溶液呈红色
3.pH在8--10时的酚酞溶液呈浅红色
4.pH在10--14时的酚酞溶液呈红色
5.pH<3的溶液能使pH试纸变红色
6.氖气灯光呈红色
7.液溴呈深棕红色
8.氦气灯光、含有部分被氧化的苯酚均呈粉红色
9.NO2、浓溴水成红棕色。
10.Fe2 O3、Fe(OH)3及Fe(OH)3胶体呈红褐色
11.Cu2O、钙的焰色反应呈砖红色
12.红磷暗红色
13.Fe3+与CNS-反应生成的一系列产物呈血红色
14、品红试液呈深红色。
(二)反应
1、 FeCl3溶液和硫氰化钾溶液反应生成血红色的硫氰化铁溶液。
2、醛基化合物与新制的Cu(OH)2碱性悬浊液反应,生成Cu2O红色沉淀。
二.黑色物质和黑色反应
(一)物质
1.Fe3O4、FeS、CuS、Cu2S、CuO、Ag2S、PbS、FeO、MnO2 Ag2O、活性炭、从盐溶液中析出的银均呈黑色。
2.I2、KMnO4晶体呈紫黑色。
3.木炭、焦炭、硅呈灰黑色。
4.黑色金属:Fe、Cr、Mn粉末状态时成黑色或灰黑色。
(二)反应
1、浓硫酸使蔗糖脱水炭化
2、 H2S或S2-与大多数重金属离子反应生成黑色金属硫化物
三.绿色物质与绿色反应
(一)物质
1.CuCl2浓溶液、碱式碳酸铜、pH在8--10时的pH试纸变绿色
2.FeSO4·7H2O及亚铁盐溶液呈浅绿色
3.氯气、溶液pH在7--8时pH试纸呈黄绿色
4.氯水、氟气呈浅黄绿色
5.Fe(OH)2氧化后的混合溶液呈灰绿色
(二)反应
1、FeCl3溶液被还原为亚铁盐,溶液由棕黄色变为浅绿色。
2、FeCl3溶液Cu反应,溶液由棕黄色变为蓝绿色
三.绿色物质与绿色反应
(一)物质
1.CuCl2浓溶液、碱式碳酸铜、pH在8--10时的pH试纸变绿色
2.FeSO4·7H2O及亚铁盐溶液呈浅绿色
3.氯气、溶液pH在7--8时pH试纸呈黄绿色
4.氯水、氟气呈浅黄绿色
5.Fe(OH)2氧化后的混合溶液呈灰绿色
(二)反应
1、FeCl3溶液被还原为亚铁盐,溶液由棕黄色变为浅绿色。
2、FeCl3溶液Cu反应,溶液由棕黄色变为蓝绿色
四.紫色物质和紫色反应
(一)物质
1.pH在5--8时石蕊试液、KMnO4溶液、I2的汽油或CCl4溶液、苯酚与FeCl3溶液反应的产物呈紫色
2.钾的焰色反应呈浅紫色
3.氩气的灯光呈紫蓝色
4、碘蒸气呈紫色
(二)反应
1、苯酚与FeCl3溶液反应的产物呈紫色。
2、I-与强氧化剂反应生成紫黑色的碘
五.黄色物质和黄色反应
(一)物质
1.钠的焰色反应、AgI,Ag
3PO
4
,蛋白质与浓硝酸反应的产物、pH>4.4时的甲
基橙溶液、pH在5-6时的pH试纸呈黄色。
2.Mg
3N
2
、AgBr、单质硫、Na
2
O
2
固体呈淡黄色。
3.FeCl
3·6H
2
O及水溶液呈淡黄色;三硝基甲苯是淡黄色针状晶体。
4.稀溴水呈棕黄色。
5.工业盐酸、浓硝酸常呈黄色。
(二)反应
1、硝酸银与I-反应生成黄色沉淀
2、硝酸银与PO43+反应生成黄色沉淀
3、钠燃烧生成淡黄色的过氧化钠
4、镁在氮气中燃烧生成淡黄色的
5、H2S受热分解生成淡黄色的硫
6、黄蛋白反应:蛋白质与浓硝酸反应产生黄色沉淀。
7、苯酚与浓硝酸反应生成黄色针状沉淀。
三.绿色物质与绿色反应
(一)物质
1.CuCl2浓溶液、碱式碳酸铜、pH在8--10时的pH试纸变绿色
2.FeSO4·7H2O及亚铁盐溶液呈浅绿色
3.氯气、溶液pH在7--8时pH试纸呈黄绿色
4.氯水、氟气呈浅黄绿色
5.Fe(OH)2氧化后的混合溶液呈灰绿色
(二)反应
1、FeCl3溶液被还原为亚铁盐,溶液由棕黄色变为浅绿色。
2、FeCl3溶液Cu反应,溶液由棕黄色变为蓝绿色
四.紫色物质和紫色反应
(一)物质
1.pH在5--8时石蕊试液、KMnO4溶液、I2的汽油或CCl4溶液、苯酚与FeCl3溶液反应的产物呈紫色
2.钾的焰色反应呈浅紫色
3.氩气的灯光呈紫蓝色
4、碘蒸气呈紫色
(二)反应
1、苯酚与FeCl3溶液反应的产物呈紫色。
2、I-与强氧化剂反应生成紫黑色的碘
五.黄色物质和黄色反应
(一)物质
1.钠的焰色反应、AgI,Ag
3PO
4
,蛋白质与浓硝酸反应的产物、pH>4.4时的甲
基橙溶液、pH在5-6时的pH试纸呈黄色。
2.Mg
3N
2
、AgBr、单质硫、Na
2
O
2
固体呈淡黄色。
3.FeCl
3·6H
2
O及水溶液呈淡黄色;三硝基甲苯是淡黄色针状晶体。
4.稀溴水呈棕黄色。
5.工业盐酸、浓硝酸常呈黄色。
(二)反应
1、硝酸银与I-反应生成黄色沉淀
2、硝酸银与PO43+反应生成黄色沉淀
3、钠燃烧生成淡黄色的过氧化钠
4、镁在氮气中燃烧生成淡黄色的
5、H2S受热分解生成淡黄色的硫
6、黄蛋白反应:蛋白质与浓硝酸反应产生黄色沉淀。
7、苯酚与浓硝酸反应生成黄色针状沉淀。
2、硝酸银与PO43+反应生成黄色沉淀
3、钠燃烧生成淡黄色的过氧化钠
4、镁在氮气中燃烧生成淡黄色的
5、H2S受热分解生成淡黄色的硫
6、黄蛋白反应:蛋白质与浓硝酸反应产生黄色沉淀。
7、苯酚与浓硝酸反应生成黄色针状沉淀。
六.蓝色物质与蓝色反应
(一)物质
1.Cu(OH)2沉淀,水合Cu2+、CuSO4·5H2O晶体、碘遇淀粉溶液、pH在8-14的石蕊试液、碱性溶液中的pH试纸均呈蓝色。
2.CO、H2S、H2、CH4、S、乙醇在空气中燃烧火焰的颜色均为淡蓝色。
(硫在氧气中燃烧呈蓝紫色火焰)。
(二)反应
1、碘与淀粉作用呈蓝色。
2、 Cu与强氧化性酸反应生成铜盐。
七.褐色物质
1.碘酒、溴苯中溶有溴均呈褐色或浅褐色。
2.煤焦油呈黑褐色。
3.Fe(OH)3胶体、Fe(OH)3沉淀呈红褐色。
