高三化学中的有色物质和颜色反应
高中化学常见物质颜色和状态

高中化学常见物质的颜色和状态1、黑色固体:石墨、炭粉、铁粉、FeS、CuS、CuO、MnO2、Fe3O42、红色固体:Cu、Cu2O、Fe2O3、HgO、红磷3、淡黄色固体:S、 Na2O2、 AgBr4.紫黑色固体:KMnO4、5、黄色固体: AgI 、Ag3PO46、绿色固体: Cu2(OH)2CO37、蓝色晶体:CuSO4·5H2O8 、蓝色沉淀 Cu(OH)29、红褐色沉淀: Fe(OH)310、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)11、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,MnO4-溶液为紫红色,其余溶液一般无色。
12、不溶于酸的白色沉淀: BaSO4 、AgCl13、不溶于水的白色沉淀 CaCO3 (溶于酸)、BaCO3(溶于酸)、Al(OH)3、 Mg(OH)2 等14、(1)具有刺激性气体的气体:NH3、SO2、HCl(皆为无色(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)(3) 红棕色气体: Br2(气体) NO2(4)黄绿色气体:Cl2(5)臭鸡蛋气味气体:H2S15、具有刺激性气味的液体:盐酸、硝酸、醋酸、酒精16、有毒的: 气体:CO SO2 H2S 液体:CH3OH 固体:NaNO2 CuSO4(可作杀菌剂 ,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液)中学常见物质颜色归纳2、单质化学式颜色化学式颜色化学式颜色Cu 紫红 Au 黄 S 黄B 黄或黑 F2 淡黄绿 C(石墨)黑Cl2 黄 Br2 红棕 C(金刚石)无Si 灰黑 I2紫黑 P 白、黄、红棕3、氧化物化学式颜色化学式颜色化学式颜色NO2 棕红 ClO2 黄 Na2O2 浅黄K2O 黄 Pb3O4 红 MnO 绿化学式颜色化学式颜色化学式颜色CuO 黑 MnO2 黑 Ag2O 棕黑FeO 黑 ZnO 白 Fe3O4 黑Hg2O 黑 Fe2O3 红棕 HgO 红或黄Cu2O 红4、氧化物的水化物化学式颜色化学式颜色化学式颜色Fe(OH)3 红褐 HNO2 亮蓝 Cu(OH)2 蓝5、盐化学式颜色化学式颜色化学式颜色CuFeS2 黄 ZnS 白 Ag2S 黑FeS 黑棕 FeS2 黄 Sb2S3 黑或橙红HgS 红 PbS 黑 CuS 黑Cu2S 黑 FeCl3·6H2O 棕黄 FeSO4 9H20 蓝绿Fe2(SO4)3.9H2O 棕黄 Fe3C 灰 FeCO3 灰Ag2CO3 黄 Ag3PO4 黄 CuCl2 棕黄AgF 黄 CuCl2 7H2O 蓝绿 AgCl 白CuSO4 白 AgBr 浅黄 CuSO4 5H2O 蓝AgI 黄 Cu2(OH2)CO3 暗绿6、盐溶液中离子特色:化学式颜色化学式颜色化学式颜色Cu2+ 蓝 MnO4-紫红 [CuCl4]2- 黄Cr2O72- 橙红 Fe2+ 浅绿 Fe3+ 棕黄7、非金属互化物物质颜色物质颜色物质颜色氯水黄绿溴水黄-橙碘水黄褐溴的有机溶液橙红-红棕 I2的有机溶液紫红8、其它:蛋白质遇浓变黄、遇淀粉变蓝、 TNT 淡黄、遇酚酞溶液变紫黄色:AgI、Ag3PO4、P4(黄磷)、溴水(黄--橙)、FeS2、Al2S3、甲基橙在弱酸性、中性或碱性环境中、某些蛋白质加硝酸。
高中化学有色物质大全

高中化学有色物质大全高中化学中,有色物质是一个重要的研究对象。
有色物质广泛存在于我们的生活和实验室中,对于理解物质的性质和应用具有重要意义。
本文将为大家介绍一些常见的有色物质及其相关知识。
1. 金属离子溶液金属离子溶液是实验中常见的有色物质。
当某些金属离子溶解在水中时,其溶液会呈现出特定的颜色。
例如,铁离子溶液呈现出淡黄色,铜离子溶液呈现出蓝色,铬离子溶液呈现出绿色等。
这些颜色是由金属离子的电子跃迁引起的,不同金属离子的电子跃迁能级不同,因而呈现出不同的颜色。
2. 过渡金属络合物过渡金属络合物是一类常见的有色物质。
过渡金属离子在与配体形成络合物后,其电子转移发生变化,从而导致溶液呈现出不同的颜色。
例如,铜离子与氨水(NH3)形成四氨合铜离子(Cu(NH3)4²⁺)的络合物,呈现出深蓝色。
这是由于络合物的形成改变了铜离子的电子跃迁过程。
3. 配位化合物配位化合物是一类由中心金属原子或离子与多个配体形成配位键的化合物。
这类化合物通常呈现出明亮的颜色。
例如,紫色的[Co(H2O)6]²⁺,粉红色的[KMnO4]等。
这些有色配位化合物的颜色主要是由于配位原子或离子的变化以及电子的吸收和发射引起的。
4. 有机化合物在有机化学中,一些有机物分子结构上的共轭体系也能引起物质呈现出有色。
共轭体系中的π电子有较低的跃迁能级,可以吸收较长波长的可见光,因而呈现出有色。
例如,苯(C6H6)呈现无色,而具有共轭结构的苯类化合物(如芳香族化合物)多呈现出黄色至红色。
5. 部分过渡金属氧化物部分过渡金属氧化物在不同的氧化态下呈现出不同的颜色。
这是由于氧化物的电子结构发生改变,从而引起能带结构的变化。
例如,二氧化钛(TiO2)在纯净状态下是白色的,但掺杂不同的氧化态(如二价钛或三价钛)后,颜色会发生变化。
总结:高中化学中,有色物质的研究对于了解物质的性质和应用具有重要意义。
金属离子溶液、过渡金属络合物、配位化合物、有机化合物以及部分过渡金属氧化物都是常见的有色物质。
浅谈生物实验中的颜色反应

浅谈生物实验中的颜色反应在生物实验中,某些化学试剂能够使生物组织中的有关有机化合物产生特定的颜色反应。
因此,可以根据某些化学试剂所产生的颜色反应,来鉴定生物组织中某种成分的存在,或借助颜色反应的效果,来观察生物组织中某种结构的形态特征和变化情况。
生物实验中常见的颜色反应包括红色反应、砖红色反应、蓝色反应、紫色反应、蓝紫色反应和橘黄色反应等。
本文就生物实验中常见颜色反应的原理、试剂、颜色变化和适用范围等几个方面加以归纳阐述,以抛砖引玉。
一、红色反应红色反应包括苏丹IV染液与脂肪的红色反应和醋酸洋红染液与染色体的红色反应。
1.苏丹IV染液与脂肪的红色反应(1)反应原理苏丹IV在脂肪中的溶解度比在酒精中的溶解度大,当用苏丹IV染料的酒精溶液处理含有脂肪的生物组织时,酒精中的苏丹IV进入脂肪中,在脂肪中溶解、积累,并且吸附在脂肪颗粒上,将脂肪染成红色。
(2)反应试剂—苏丹IV称取1g苏丹IV干粉,溶于500mL丙酮中,再加人体积分数为70%的酒精500mL,充分混合均匀后待用。
(3)颜色变化:白色→红色(4)用途:适用于鉴定脂肪2.醋酸洋红染液与染色体的红色反应(1)反应原理醋酸洋红染液是一种碱性染料,能够电离出无色的阴离子和有色的阳离子,有色的阳离子可与细胞中带负电荷的部分牢固地结合。
如细胞核中的染色体(质)内含脱氧核糖核酸,属于酸性物质,可电离出氢离子,而使自身带负电荷,所以它能和醋酸洋红染液电离出的有色阳离子通过电荷间的引力作用而牢固地结合,从而被染上红色。
(2)反应试剂—醋酸洋红称取10g洋红,溶解在1000mL的质量浓度为45%醋酸溶液中煮沸(沸腾时间不超过30秒),冷却后过滤使用,此溶液浓度为0.01g/mL,也可以在此溶液中再加入1%~2%铁明矾水溶液5mL~10mL,颜色会变得更红。
(3)颜色变化:无色→红色(4)用途:适用于染色体的着色二、砖红色反应1.反应原理生物组织中普遍存在的还原糖种类较多,常见的有葡萄糖、果糖、麦芽糖。
高中化学有颜色变化的反应有哪些

高中化学有颜色变化的反应有哪些颜色反应是利用某些物质经过特定的化学反应的生成物产生特别的颜色,有新物质产生,所以是化学反应。
焰色反应是利用某些元素的原子的电子在激发态跃迁到基态发射出的光谱进行鉴别,没有新物质产生,所以不是化学反应。
颜色反应和焰色反应都会发生颜色变化,掌握这些知识对解化学各类题型都有帮助。
1化学物质燃烧火焰颜色的变化1、氢气在空气中燃烧—-淡蓝色火焰2、氢气在氯气中燃烧---苍白色火焰,瓶口有白雾。
3、甲烷在空气中燃烧---淡蓝色火焰4、酒精在空气中燃烧---淡蓝色火焰5、硫在空气中燃烧---微弱的淡蓝色火焰,生成强烈剌激性气味的气体。
6、硫在纯氧中燃烧---明亮的蓝紫色火焰,生成强烈剌激性气味的气体7、硫化氢在空气中燃烧---淡蓝色火焰,生成强烈剌激性气味的气体。
8、一氧化碳在空气中燃烧---蓝色火焰9、磷在空气中燃烧,白色火焰,有浓厚的白烟10、乙烯在空气中燃烧,火焰明亮,有黑烟11、乙炔在空气中燃烧,火焰很亮,有浓厚黑烟12、镁在空气中燃烧,发出耀眼白光13、钠在空气中燃烧,火焰黄色14、铁在氧气中燃烧,火星四射,(没有火焰)生成的四氧化三铁熔融而滴下。
15.在空气中点燃乙炔:火焰明亮,有浓烟产生,放出热量。
16.苯在空气中燃烧:火焰明亮,并带有黑烟。
17.乙醇在空气中燃烧:火焰呈现淡蓝色。
18.H2和O2的燃烧:发出淡蓝色的火焰.19.CO和O2的燃烧:发出蓝色的火焰.20.CH4和O2的燃烧:发出明亮的蓝色火焰.21.在空气中点燃乙烯:火焰明亮,有黑烟产生,放出热量。
22.木炭在氧气中燃烧:发出白光,放出热量。
23.硫在氧气中燃烧:发出明亮的蓝紫色火焰,放出热量,生成一种有刺激性气味的气体。
24.铁丝在氧气中燃烧:剧烈燃烧,火星四射,放出热量,生成黑色固体物质。
25.镁条在空气中燃烧:。
生物颜色反应总结

生物颜色反应总结
1. 亲水实验
(1) 葡萄糖溶液:加入少量碘液后,会呈现深蓝紫色,表示葡萄糖是亲水性物质。
(2) 橄榄油:没什么颜色变化,表示橄榄油是疏水性物质。
2. 醋酸反应
(1) 葡萄糖溶液:加入醋酸后无色变化,表示葡萄糖不含醇基。
(2) 乙醇溶液:加入醋酸后会出现橘黄色,表示乙醇含醇基。
3. 碘钾碘化物试验
(1) 葡萄糖溶液:加入碘钾碘化物后呈蓝色,表示葡萄糖含醛糖素。
(2) 浓盐酸:加入碘钾碘化物后无色变化,表示浓盐酸不含醛糖素。
4. 铜硫酸盐反应
(1) 葡萄糖溶液:加入铜硫酸盐显现墨绿色,表示葡萄糖含醛糖素。
(2) 甲醇溶液:加入铜硫酸盐无色变化,表示甲醇不含醛糖素。
以上总结了几种常见的生物颜色反应实验及结果,初步了解了生物分子的亲水性及基团的存在与否。
2011届高三化学第一轮复习资料:无机框图中的题眼 新人教版

无机框图中的题眼1.中学化学中的颜色(1)焰色反应:Na+(黄色)、K+(紫色,透过蓝色钴玻璃)(2)有色溶液:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4–(紫红色)、Fe(SCN)3(血红色)(3)有色固体:红色:Cu、Cu2O、Fe2O3;红褐色固体:Fe(OH)3;蓝色固体:Cu(OH)2;黑色固体:CuO、FeO、FeS、浅黄色固体:S、Na2O2、AgBr;黄色固体:AgI、白色固体:Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3等。
(4)反应中的颜色变化① Fe2+与OH–反应:产生白色絮状沉淀,迅速转变成灰绿色,最后变成红褐色。
② I2遇淀粉溶液:溶液呈蓝色。
③苯酚中加过量..浓溴水:产生白色沉淀(三溴苯酚能溶于苯酚、苯等有机物)。
④苯酚中加FeCl3溶液:溶液呈紫色。
⑤ Fe3+与SCN–:溶液..呈血红色。
⑥蛋白质溶液与浓硝酸:出现黄色浑浊(蛋白质的变性)。
2.中学化学中的气体(1)常见气体单质:H2、N2、O2、Cl2(2)有颜色的气体:Cl2(黄绿色)、溴蒸气(红棕色)、NO2(红棕色)。
(3)易液化的气体:NH3、Cl2、SO2。
(4)有毒的气体:F2、O3、HF、Cl2、H2S、SO2、CO、NO(NO、CO均能与血红蛋白失去携氧能力)、NO2(制备时需在通风橱内进行)。
(5)极易溶于水的气体:NH3、HCl、HBr;易溶于水的气体:NO2、SO2;能溶于水的气体:CO2、Cl2。
(6)具有漂白性的气体:Cl2(潮湿)、O3、SO2。
注意:Cl2(潮湿)、O3因强氧化性而漂白(潮湿Cl2中存在HClO);SO2因与有色物质化合生成不稳定...无色物质而漂白;焦碳因多孔结构,吸附有色物质而漂白。
(7)能使石蕊试液先变红后褪色的气体为:Cl2(SO2使石蕊试液显红色)。
(8)能使品红溶液褪色的气体:SO2(加热时又恢复红色)、Cl2(加入AgNO3溶液出现白色沉淀)。
高中的化学中有颜色变化的反应

高中的化学中哪些反应有颜色变化1.镁条在空气中燃烧:发出耀眼强光,放出大量的热,生成白烟同时生成一种白色物质。
2.木炭在氧气中燃烧:发出白光,放出热量。
3.硫在氧气中燃烧:发出明亮的蓝紫色火焰,放出热量,生成一种有刺激性气味的气体。
4.铁丝在氧气中燃烧:剧烈燃烧,火星四射,放出热量,生成黑色固体物质。
5.加热试管中碳酸氢铵:有刺激性气味气体生成,试管上有液滴生成。
6.氢气在空气中燃烧:火焰呈现淡蓝色。
7.氢气在氯气中燃烧:发出苍白色火焰,产生大量的热。
8.在试管中用氢气还原氧化铜:黑色氧化铜变为红色物质,试管口有液滴生成。
9.用木炭粉还原氧化铜粉末,使生成气体通入澄清石灰水,黑色氧化铜变为有光泽的金属颗粒,石灰水变浑浊。
10.一氧化碳在空气中燃烧:发出蓝色的火焰,放出热量。
11. 向盛有少量碳酸钾固体的试管中滴加盐酸:有气体生成。
12.加热试管中的硫酸铜晶体:蓝色晶体逐渐变为白色粉末,且试管口有液滴生成。
13.钠在氯气中燃烧:剧烈燃烧,生成白色固体。
14.点燃纯净的氯气,用干冷烧杯罩在火焰上:发出淡蓝色火焰,烧杯内壁有液滴生成。
15.向含有C1-的溶液中滴加用硝酸酸化的硝酸银溶液,有白色沉淀生成。
16.向含有SO42-的溶液中滴加用硝酸酸化的氯化钡溶液,有白色沉淀生成。
17.一带锈铁钉投入盛稀硫酸的试管中并加热:铁锈逐渐溶解,溶液呈浅黄色,并有气体生成。
18.在硫酸铜溶液中滴加氢氧化钠溶液:有蓝色絮状沉淀生成。
19.将Cl2通入无色KI溶液中,溶液中有褐色的物质产生。
20.在三氯化铁溶液中滴加氢氧化钠溶液:有红褐色沉淀生成。
21.盛有生石灰的试管里加少量水:反应剧烈,发出大量热。
22.将一洁净铁钉浸入硫酸铜溶液中:铁钉表面有红色物质附着,溶液颜色逐渐变浅。
23.将铜片插入硝酸汞溶液中:铜片表面有银白色物质附着。
24.向盛有石灰水的试管里,注入浓的碳酸钠溶液:有白色沉淀生成。
25.细铜丝在氯气中燃烧后加入水:有棕色的烟生成,加水后生成绿色的溶液。
常见的化学反应及其现象
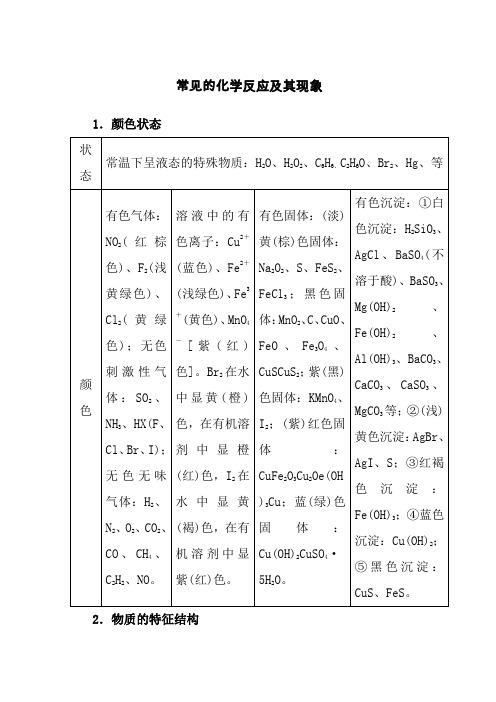
常见的化学反应及其现象1.颜色状态状态常温下呈液态的特殊物质:H2O、H2O2、C6H6、C2H6O、Br2、Hg、等颜色有色气体:NO2(红棕色)、F2(浅黄绿色)、Cl2(黄绿色);无色刺激性气体:SO2、NH3、HX(F、Cl、Br、I);无色无味气体:H2、N2、O2、CO2、CO、CH4、C2H2、NO。
溶液中的有色离子:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色)、MnO4-[紫(红)色]。
Br2在水中显黄(橙)色,在有机溶剂中显橙(红)色,I2在水中显黄(褐)色,在有机溶剂中显紫(红)色。
有色固体:(淡)黄(棕)色固体:Na2O2、S、FeS2、FeCl3;黑色固体:MnO2、C、CuO、FeO、Fe3O4、CuSCuS2;紫(黑)色固体:KMnO4、I2;(紫)红色固体:CuFe2O3Cu2Oe(OH)3Cu;蓝(绿)色固体:Cu(OH)2CuSO4·5H2O。
有色沉淀:①白色沉淀:H2SiO3、AgCl、BaSO4(不溶于酸)、BaSO3、Mg(OH)2、Fe(OH)2、Al(OH)3、BaCO3、CaCO3、CaSO3、MgCO3等;②(浅)黄色沉淀:AgBr、AgI、S;③红褐色沉淀:Fe(OH)3;④蓝色沉淀:Cu(OH)2;⑤黑色沉淀:CuS、FeS。
2.物质的特征结构10电子微粒可能为N3-、O2-、F-、OH-、NH2-、Ne、CH4、NH3、H2O、HF、Na+、Mg2+、Al3+、NH4+、H3O+等。
18电子微粒可能为K+、Ca2+、Ar、F2、SiH4、PH3、H2S、HCl、H2O2、N 2H4CH3CH3CH3FCH3OHHS-、S2-、Cl-、O22-等。
14电子微粒可能为CO、N2、C22-常见的正四面体结构有甲烷、CCl4、白磷、NH4+;三角锥形有NH3;直线型的多原子分子可能为CO2。
H的原子核内没有中子。
常见元素中半径最小的是H。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中学化学中的有色物质和颜色反应
“赤橙黄绿青蓝紫,谁持彩练当空舞”,中学化学教材中有形形色色的物质,各自显示不同的颜色,也有许多反应,往往伴随着颜色的变化。
掌握各类物质的颜色及有关显色反应,对于学习物质的性质,正确描述实验现象,分析判断实验结果是不可缺少的.希望你能在认真阅读之后,强化记忆。
一、红色物质和红色反应
(一)物质
1.pH<3.1时的甲基橙溶液呈红色
2.pH<5时的石蕊溶液呈红色
3.pH在8--10时的酚酞溶液呈浅红色
4.pH在10--14时的酚酞溶液呈红色
5.pH<3的溶液能使pH试纸变红色
6.氖气灯光呈红色
7.液溴呈深棕红色
8.氦气灯光、含有部分被氧化的苯酚均呈粉红色
9.NO2、浓溴水成红棕色。
10.Fe2O3、Fe(OH)3 及Fe(OH)3胶体呈红褐色
11.Cu2O、钙的焰色反应呈砖红色
12.红磷暗红色
13.Fe3+与CNS- 反应生成的一系列产物呈血红色
14、品红试液呈深红色。
(二)反应
1、FeCl3溶液和硫氰化钾溶液反应生成血红色的硫氰化铁溶液。
Fe3++3SCN-== Fe(SCN)3
2、醛基化合物与新制的Cu(OH)2碱性悬浊液反应,生成Cu2O红色沉淀。
如:CH3CHO + 2Cu(OH)2 CH3COOH+Cu2O↓ +2H2O
二.黑色物质和黑色反应
(一)物质
1.Fe3O4、FeS、CuS、Cu2S、CuO、Ag2S、PbS、FeO、MnO2Ag2O、活性炭、从盐溶液中析出的银均呈黑色。
2.I2、KMnO4晶体呈紫黑色。
3.木炭、焦炭、硅呈灰黑色。
3、黑色金属:Fe、Cr、Mn粉末状态时成黑色或灰黑色。
(二)反应
1、浓硫酸使蔗糖脱水炭化
C12H22O11 浓H2SO4 12C+11H2O
2、H2S或S2-与大多数重金属离子反应生成黑色金属硫化物
如:(CH3COO)2Pb+H2S==PbS↓+2CH3COOH
三.绿色物质与绿色反应
(一)物质
1.CuCl2浓溶液、碱式碳酸铜、pH在8--10时的pH试纸变绿色
2.FeSO4·7H2O及亚铁盐溶液呈浅绿色
3.氯气、溶液pH在7--8时pH试纸呈黄绿色
4.氯水、氟气呈浅黄绿色
5.Fe(OH)2氧化后的混合溶液呈灰绿色
(二)反应
1、FeCl3溶液被还原为亚铁盐,溶液由棕黄色变为浅绿色。
如:2Fe3++Fe=3Fe2+
2、FeCl3溶液Cu反应,溶液由棕黄色变为蓝绿色
2FeCl3+Cu=2FeCl2+CuCl2
四.紫色物质和紫色反应
(一)物质
1.pH在5--8时石蕊试液、KMnO4溶液、I2的汽油或CCl4溶液、苯酚与FeCl3溶液反应的产物呈紫色
2.钾的焰色反应呈浅紫色
3.氩气的灯光呈紫蓝色
4、碘蒸气呈紫色
(二)反应
1、苯酚与FeCl3溶液反应的产物呈紫色。
2、I-与强氧化剂反应生成紫黑色的碘
2I- +2e-==I2
五.黄色物质和黄色反应
(一)物质
1.钠的焰色反应、AgI,Ag3PO4,蛋白质与浓硝酸反应的产物、pH>4.4时的甲基橙溶液、pH在5-6时的pH试纸呈黄色。
2.Mg3N2、AgBr、单质硫、Na2O2固体呈淡黄色。
3.FeCl3·6H2O及水溶液呈淡黄色;三硝基甲苯是淡黄色针状晶体。
4.稀溴水呈棕黄色。
5.工业盐酸、浓硝酸常呈黄色。
(二)反应
1、硝酸银与I-反应生成黄色沉淀:Ag++I-=AgI↓
2、硝酸银与PO43+反应生成黄色沉淀:3Ag++ PO43= Ag3PO4↓
3、钠燃烧生成淡黄色的过氧化钠:2Na+O2=Na2O2
4、镁在氮气中燃烧生成淡黄色的Mg3N2: 3Mg+ N2= Mg3N2
5、H2S受热分解生成淡黄色的硫:H2S △ H2+S
6、黄蛋白反应:蛋白质与浓硝酸反应产生黄色沉淀。
7、苯酚与浓硝酸反应生成黄色针状沉淀。
六.蓝色物质与蓝色反应
(一)物质
1.Cu(OH)2沉淀,水合Cu2+、CuSO4·5H2O晶体、碘遇淀粉溶液、pH在8-14的石蕊试液、碱性溶液中的pH试纸均呈蓝色。
2.CO、H2S、H2、CH4、S、乙醇在空气中燃烧火焰的颜色均为淡蓝色。
(硫在氧气中燃烧呈蓝紫色火焰)。
(二)反应
1、碘与淀粉作用呈蓝色。
2、Cu与强氧化性酸反应生成铜盐。
如:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O
七.褐色物质
1.碘酒、溴苯中溶有溴均呈褐色或浅褐色。
2.煤焦油呈黑褐色。
3.Fe(OH)3胶体、Fe(OH)3沉淀呈红褐色。
八.铜,铁在氯气中燃烧产生棕色烟。
九.pH在3.1-4.4时甲基橙溶液呈橙色。
十.氢气在氯气中燃烧呈苍白色火焰。
十一.灰色物质
1.As、Sn、Fe3C为灰色。
2.Fe、Cr、Mn等的单质粉末状态一般为灰黑。
