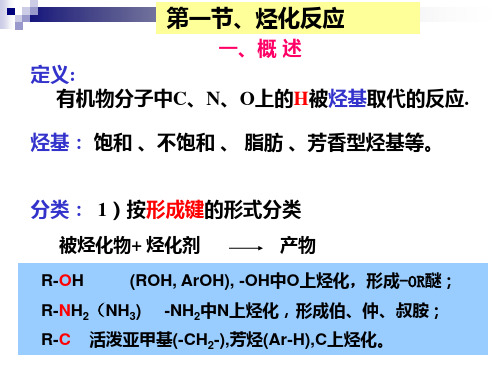
烃化
合集下载
《烃化反应》课件

碳正离子的形成是烃化反应的关键步骤,其稳定性直接影响反应速率和 产物构型。在形成碳正离子的过程中,取代基的影响较大,取代基的电
子效应和空间效应均可影响碳正离子的稳定性。
亲核取代过程是放热反应,其速率主要受亲核试剂的活性影响。在亲核 取代过程中,溶剂效应、温度、压力等因素也会影响反应速率和产物构 型。
烃化反应的影响因素
底物的影响
底物的结构和取代基的性质对烃化反应的影响较 大。在底物分子中,未取代的碳-氢键的数目和取 代基的性质均可影响碳正离子的形成和稳定性。
溶剂的影响
溶剂的极性和酸碱性对烃化反应的影响较大。在 极性溶剂中,反应物的溶解度和反应速率均会增 加。此外,酸碱性溶剂可影响碳正离子的稳定性 ,进而影响反应速率和产物构型。
烃化反应的挑战与机遇
挑战
如何实现绿色低碳发展、提高反 应效率和选择性、降低能耗和资 源消耗等是烃化反应面临的挑战 。
机遇
随着科技的不断进步和社会需求 的增加,烃化反应在化工、医药 、新能源等领域的应用前景广阔 ,具有很大的发展机遇。
烃化反应的前沿研究动态
新催化剂研究
针对烃化反应的催化剂进行创新研究, 开发高效、环保、低成本的催化剂体系
氨基烃化
在氨氮上添加烃基,生成胺类 化合物。
烃化反应的重要性
01 02
在有机合成中的重要性
烃化反应是有机合成中的重要反应之一,可以用于合成高分子材料、药 物、香料等。通过烃化反应,可以改变有机物的官能团和结构,生成新 的化合物。
在工业生产中的重要性
烃化反应在工业生产中具有广泛的应用,如生产塑料、合成橡胶、农药 、染料等。通过烃化反应,可以生产出具有特定性能和用途的化学品。
烃化反应的未来发展方向
绿色低碳
子效应和空间效应均可影响碳正离子的稳定性。
亲核取代过程是放热反应,其速率主要受亲核试剂的活性影响。在亲核 取代过程中,溶剂效应、温度、压力等因素也会影响反应速率和产物构 型。
烃化反应的影响因素
底物的影响
底物的结构和取代基的性质对烃化反应的影响较 大。在底物分子中,未取代的碳-氢键的数目和取 代基的性质均可影响碳正离子的形成和稳定性。
溶剂的影响
溶剂的极性和酸碱性对烃化反应的影响较大。在 极性溶剂中,反应物的溶解度和反应速率均会增 加。此外,酸碱性溶剂可影响碳正离子的稳定性 ,进而影响反应速率和产物构型。
烃化反应的挑战与机遇
挑战
如何实现绿色低碳发展、提高反 应效率和选择性、降低能耗和资 源消耗等是烃化反应面临的挑战 。
机遇
随着科技的不断进步和社会需求 的增加,烃化反应在化工、医药 、新能源等领域的应用前景广阔 ,具有很大的发展机遇。
烃化反应的前沿研究动态
新催化剂研究
针对烃化反应的催化剂进行创新研究, 开发高效、环保、低成本的催化剂体系
氨基烃化
在氨氮上添加烃基,生成胺类 化合物。
烃化反应的重要性
01 02
在有机合成中的重要性
烃化反应是有机合成中的重要反应之一,可以用于合成高分子材料、药 物、香料等。通过烃化反应,可以改变有机物的官能团和结构,生成新 的化合物。
在工业生产中的重要性
烃化反应在工业生产中具有广泛的应用,如生产塑料、合成橡胶、农药 、染料等。通过烃化反应,可以生产出具有特定性能和用途的化学品。
烃化反应的未来发展方向
绿色低碳
总结:烃化与酰化的异同

二、相异之处
1.影响因素: A :烃化反应
亲核取代反应 Ư 被烃化物的结构:加碱!
>
B: 酰化反应
亲核取代反应 +亲电
酰化剂的结构:离去基团Z的共轭酸 即:吸电子效应 被酰化物的结构:-YH的碱性 即:推电子效应
催化剂:质子酸或Lewis酸
二、相异之处
2. 烃化反应:被烃化剂的反应活性, 2.1 酚》醇 2.2 氨基》-OH 3. 酰化反应:被酰化的活性 3.1醇》酚 3.2 氨基》-OH
总结:烃化与酰化的异同
一:共同点
1. 反应机理相同:亲核取代反应+亲电取代 反应(苯环上的F-C反应); 2.被烃化/酰化剂相同:醇/酚、含氮物、含碳 物(苯环、羰基αC-碳负离子、烯烃);其 中烃化反应还有环氧化物为烃化剂! 3. 烃化反应的烃化剂:RX; 酰化反应的酰化剂:羧酸、酯、酸酐、酰 卤
烃化反应和酰化反应的共性!!
1. F-C 烃化反应: 2. F-C酰化反应:
共性1:Lewis酸催化剂-AlCl3; 共性2:亲电取代反应机理; 共性3:邻对位定位基-推电子有利反应;
第五章烃化反应
丙二酸酯、丙二腈、氰乙酸酯、乙酰乙酸乙酯、苄腈等
Eg. CH2(COOEt)2
Cl
(EtOOC)2HC
EtONa
(61%)
主要影响因素 a.催化剂 常用RONa b.溶剂 以RONa为催化剂时,多选用醇类作溶剂。 c.被烃化物的结构 当活泼亚甲基上有两个活性H时,若有足够量的碱 和烃化剂存在,可发生双烃化反应。
O
C OEt H2C
C OEt O
(CH3)2CHCH2CH2Br EtONa, EtOH
O
C OEt
CH (H3C)2HCH2CH2C C OEt
O
O
CH3CH2Br EtONa, EtOH
C2H5
C OEt
C (H3C)2HCH2CH2C C OEt
O
三、硫酸酯和芳磺酸酯类烃化剂
(CH3)2SO4 , (C2H5)2SO4 ,
⑵ 活泼亚甲基化合物的C-烃化
活性亚甲基:亚甲基上连有吸电子基团时,其上氢原子的
活性增大。 X
B:-
H2C
+R
Y
X
X R HC Y
吸e基使亚甲基活性增大的能力按大小次序排列:
X H2C Y
X, Y为吸电子基
O
-NO2 > -CR> RSO2-> -CN> -COOR> Ph
常见的活性亚甲基的化合物:β-二酮、β-羰基酸酯、
OHO N H
(CH3)2SO4,NaOH
△
O
O OCH3
(酚羟基形成氢链
N
O 用RX难烃化)
CH3
抗肿瘤药阿克罗宁(Acronine)
⑵ 氮原子上的烃化反应
亲核活性 氨基氮 > 羟基氧 , 用(CH3)2SO4更易烃化. Eg.
烃化

第一节 氧原子上的烃化反应
二、酚的O-烃化
由于酚的酸性比醇强,所以反应更容易进行 1. 卤代烃为烃化剂
第一节 氧原子上的烃化反应
位阻及螯合对酚O-烃化的影响
第一节 氧原子上的烃化反应
2. 硫酸二甲酯为烃化剂
第一节 氧原子上的烃化反应
3 重氮甲烷为烃化剂
第一节 氧原子上的烃化反应
第二节 氧原子上的烃化反应
一、醇的O-烃化
1.卤化烃为烃化剂 Williamson醚合成:
ROH + B
RO + R'X
ROHROR' NhomakorabeaRO
+ HB
ROR' + X
增加底物浓度提高反应速度;
第二节 氧原子上的烃化反应
(1)影响因素 醇的活性较低,加入强碱利于反应;
不能用叔卤代烷作为烷化试剂;如反应的卤代 烷活性不够可加碘化钾催化。 使用极性非质子溶剂(DMSO,DMF等)有利于 反应。
应,是制备环氧乙烷、环氧丙烷及高环醚类化合物的方法。
第一节 氧原子上的烃化反应
2、芳基磺酸酯作为烃化剂 OTs是很好的离去基,常用于引入分子量较大的 烃基。
ROH + TsCl ROTs
第一节 氧原子上的烃化反应
3、环氧乙烷为烃化剂 环氧乙烷由于环张力很大,很活泼,开环可以与 醇反应引入羟乙基。 在碱催化条件下,环氧乙烷取代少的一端与醇相 连。
第二节 氧原子上的烃化反应
(2)应用
①药物苯海拉明的合成:醇(RO-)活性不同,反应条件的选择
也不同
第二节 氧原子上的烃化反应
② 改进的Willamson反应用于醚的制备
烃化20110221

(CH 3)2SO4+2H 2O SO3 CH 3
NaOH
2 CH3
+ CH3OH CH 3
+ NaCl + H2O
磺酸酯类为烃化剂:主要指芳磺酸酯,引入较大的烃基 磺酸酯类为烃化剂:主要指芳磺酸酯,
芳基磺酸脂作为烃化剂在药物合成中的应用范围比较 是很好的离去基, 广, OTs 是很好的离去基,常用于引入分子量较大的 烃基。例如鳖肝醇的合成,以甘油为原料, 烃基。例如鳖肝醇的合成,以甘油为原料,异亚丙基 保护两个羟基后, 保护两个羟基后,再用对甲苯磺酸十八烷酯对未保护 烃化反应, 的伯醇羟基进行 O 烃化反应,所得烃化产物经脱异亚 丙基保护, 丙基保护,便可得到鳖肝醇
X
从X的背面进攻
伯卤代烷RCH2X按SN2历程 伯卤代烷 按 ][R’CH v=k[RO-][R CH2X] 随着与X相连的 的取代基数目 随着与 相连的C的取代基数目 相连的 的增加越趋向SN1 的增加越趋向
1 卤代烷为烃化剂:醇在碱的条件下与卤代烷生成醚 卤代烷为烃化剂:
影响因素 ① 醇的影响
卤代反应中也学习过
应用实例
依次将对羟基苯丙酮、苄氯、碳酸钾、碘化钠、 依次将对羟基苯丙酮、苄氯、碳酸钾、碘化钠、 乙醇加入反应器中,加热回流 ,除去溶剂, 乙醇加入反应器中,加热回流6h,除去溶剂, 残留物溶于氯仿, 残留物溶于氯仿,用1mol/L氢氧化钠水溶液和 氢氧化钠水溶液和 水洗净,无水硫酸钠干燥,除去溶剂,残留物 水洗净,无水硫酸钠干燥,除去溶剂, 用乙醇重结晶,得针状结晶。 用乙醇重结晶,得针状结晶。
卤代烃与酚在碱存在下, 卤代烃与酚在碱存在下,很易得到较高收率的酚 醚,一般加氢氧化钠即可形成芳氧负离子,或用 一般加氢氧化钠即可形成芳氧负离子, 碳酸钠碳酸钾作为除酸剂
烃化

3)用酯类的N-烷化 硫酸酯、芳磺酸酯和磷酸酯等强酸的烷基酯都是活 泼的N-烷化剂,反应可在常压和不太高的温度下 进行。但酯的价格贵主要用于制备价格贵的N-烷 化产物。 (1)用硫酸酯的N-烷化 (P221) 主要是硫酸二甲酯,通常只利用其中的一个甲基, 反应一般在缚酸剂存在下在水介质中或在无水有 机溶剂中,在温热条件下进行。 (2)用芳磺酸酯的N-烷化 主要是苯磺酸的高碳烷基酯,可在较高温度下进 行。
3)催化剂 (1)酸性卤化物 (2)质子酸 (3)酸性氧化物 (4)烷基铝 4)烯烃、卤烷、醇类、醛类、酮类对芳烃的C-烷化 (P243-248)
1、硝基苯制苯胺的反应既有氢化,也有氢解,分三步进 行(P176): C6H5–NO2 –—— C6H5–N=O –—— C6H5–NHOH 氢解 氢化 –—— C6H5–NH2 氢解 2、简述以对硝基苯胺为原料制取3,5-二氯苯胺的反应 方程式,并进行讨论或说明。(P393) 先卤化得2,6-二氯-4-硝基苯胺,然后用亚硝酰硫 酸重氮化,再还原脱氨基得3,5-二氯硝基苯,再将 硝基还原得产品。
8)N-芳基化(芳氨基化)(通式)P225
(1) 卤素化合物的芳氨基化
Ar-NH2是亲电试剂,Ar-X是亲核试剂。最常 用的卤素化合物主要有:硝基氯苯衍生物、四氯 苯醌、苯醌系或稠环系的氯衍生物或溴衍生物。 为了消除反应生成的HCl或HBr的不利影响,通常 要加缚酸剂。当Ar-NH2或Ar-X不够活泼时还要 加入铜催化剂。为了简化产品的精制操作, Ar-X 或Ar-NH2的物质的量比接近1:1。如果芳伯胺 易回收,也可用过量的芳伯胺作溶剂。例如2-氯5-硝基苯磺与苯胺经芳氨基化、磺基水解和硝基 还原制4-氨基-4`-甲氧基二苯胺(p226)。
4)用环氧乙烷N—烷化(P222) 活泼烷化剂,容易与氨基氮原子发生加成N—烷化引入 羟乙基。是连串反应,K1和K2相差不大,在氮原子上 引入一个或两个羟乙基时均应严格控制反应条件。芳 胺碱性较弱,较难羟乙基化,要用酸性催化剂先生成 +CH CH OH(P232)。注意环氧乙烷易燃、易爆。 2 2 5)用烯烃的N—烷化 当烯双键的AN—烷化位有吸电基时,容易与胺类发生 亲电加成N—烷化。最常用的烯烃是丙烯腈和丙烯酸 甲酯。是较弱的烷化剂,通常要加入酸性或碱性催化 剂,反应一般在水介质中进行。常需加入对苯二酚等 阻聚剂,以避免烯烃自聚。
第二章 烃化反应

6
苄基卤化物,烯丙基卤化物活性较大,只要在 较弱的碱碳酸钾催化下与酚反应即得苄醚或烯 丙醚:
OH
K CO , KI 2 3 K K CO CO ,, KI KI K CO , KI 2 2 3 3 2 3 + ClCH CH=CH + 2CH=CH 2 2CH=CH + ClCH ClCH 2 Me CO 2 2 2 Me2CO Me Me CO CO 2 2 2 OH OH OH OH
NO 22 NO NO 2
OH OH OH OH
NO2
NO2
OCH3 OCH3OH OCH 3 OH NaOH OH NaOH NaOH
OCH3 OCH3ONa OCH 3 ONa ClCH2CHOHCH2OH ONa ClCH2CHOHCH CHOHCH2OH OH ClCH
2 2
OCH3 OCH OCH3 OCH2CHCH2OH 3 OCH 2OH OCH22CHCH CHCH OH 2OH OH OH 6 6
伯卤代烃:SN2机理 苄卤和烯丙卤:SN1或SN2的反应活性都很高; 不同卤素对反应活性有影响: R-I > R-Br > R-Cl。 亲核试剂对反应活性有影响,强亲核试剂对SN2反 应有利,但强碱对于易按SN1机理反应的叔卤烷影 响不大,却可引起它发生消除反应生成烯烃。
叔卤代烃作烷基化试剂:会发生消除反应,得不 到相应的醚; 要合成叔烷基混合醚时,需用叔醇与相应的卤代 烷进行反应;
OH + + R'X R-OH R'X
OH OH
R-O-R' R-O-R'
该反应为亲核取代反应(SN) 根据烃基的结构,可按SN1或SN2机理进行。
烃化_精品文档

O +
CH2Br
DMF OCH2Ph
CF3CH2OH CH2Ph OH
2.1.3醇、酚羟基的保护
在有醇、酚羟基的化合物中,同时存在其他的官 能团,这些官能团发生转换、氧化或还原反应 时,为了不使羟基发生变化,可先将羟基与某些 试剂反应,生成稳定的衍生物,待其他的官能团 转化完成后,再脱除保护基,恢复羟基。
叔卤代烃在强碱中优先发生消除反应,而不 是O-烃化反应。
CH3
CH3O C CH3 的合成
CH3
(1)CH3ONa
+ Cl
CH3 C CH3 CH3
消除 -HCl
CH3
碱
(2)CH3Cl + HO C CH3
CH3
CH3 CH3 C CH2
稳定
CH3O
CH3 C CH3 CH3
在中性或弱碱性条件下,叔卤代烃也可以进 行单分子的亲核取代反应(SN1),也可得 到O-烃化产物。
ROH RCl / R2SO4
• 混合醚:
ROR
ROH + R'Cl
ROR'
• 醇进行O-烃化反应的烃化剂有:
卤代烃RX
硫酸酯(芳磺酸酯)R2SO4、R 环氧烷,如:环氧乙烷
SO3R'
其他的烃化剂
卤代烃RX为烃化剂:
醇在碱(钠、氢氧化钠、氢氧化钾)存在下与 卤代烃RX反应制备混醚,称为威廉森法 (Williamson)。
NO2 非那西丁的中间体
叔卤代烃在强碱中优先发生消除反应,而不是 O-烃化反应。
在中性或弱碱性条件下,叔卤代烃也可以进行 单分子的亲核取代反应(SN1),也可得到O-烃 化产物。
• (2) 醇的影响
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
烷化试剂:醇(R-OH)、卤化烷(R-X)、 环氧烷、酯、醛酮类等。
产物:醚
1.用卤烷的O-烷化
δ+
R-OHNa++ R' X
R-O-R' + HNXaX
R-OH + NaOH
RO- Na+
一般加碱作为缚酸剂
• 当醇和卤烷都很不活泼时,要将醇先制成无水醇钠,然后与卤烷作用, 以避免水解等副反应。
• 当卤烷不够活泼时,也可加入适量碘化钠。 • 使用相转移催化剂时,酚与卤烷反应非常顺利。
二、烃基化试剂(烃化剂)
用于烷基化的反应试剂称为烷基化剂。常用的有:
(1)卤烷 (2)酯类 (3)醇类和醚类
O HO S OH
O
O RO S OR
O
O Ar S OR
O
硫酸酯、磺酸酯
(4)环氧化合物
(5)烯烃和炔烃
(6)羰基化合物
说明: 上述N-烷化剂中,前三类反应活性最强的是硫酸的中
性酯,如硫酸二甲酯;其次是卤烷;醇醚类烷化剂的活性 较弱,需用强酸催化或在高温下才可发生反应。
CH3 C18H37 N CH2C6H5 Cl
CH3
三.用酯类的N-烷化
• 酯类活泼,但价格贵,仅用于不太活泼的氨基或羟
基化合物。
• 常用的酯:硫酸二酯、芳磺酸酯、磷酸三酯
• 甲基化—Me2SO4 • 乙基化—Et2SO4
反应式:
ArNH2 + CH3-O-SO2-OCH3 NaOH ArNHCH3 + NaO-SO2-OCH3 + H2O
(2)特点:连串反应 RO(CH2CH2O)nH
合成聚醚:非离子表面活性剂
将壬基苯酚与环氧乙烷反应,得到聚醚产品,其商品名为OP型乳化剂。
C9H19
OH + n O
NaOH C9H19
O-(CH2CH2O)n-H
此类表面活性剂广泛用作W/O型乳化剂或O/W乳化剂、分散剂, 在工业清洗、纺织印染、造纸、皮革化工、农药等工业领域有着 广泛的应用。
质子酸: HF>H2SO4>H3PO4
三、C-烷基化反应历程 亲电取代反应
1、用卤烷烷基化的反应历程
R-Cl + AlCl3
R Cl:AlCl3
分子络合物
R+....AlCl4离子对或离子络合物
+ CCH3 CH3
CH(CH3)2
H
H+
CH(CH3)2
催化剂的作用是使烷基化试剂极化成活泼的亲电质点,这种 亲电质点进攻芳环生成σ-络合物,再脱去质子而变成最终产物。
N-烷基化反应的类型
(1)取代型 所用N-烷基化剂是醇、醚、卤烷和酯类
CH3CH2Br + 2 NH3
CH3CH2NH2 + NH4Br
(2)加成型 所用N-烷基化剂是环氧化合物和烯烃衍生物;
CH2 CH2
CH2 CH2
RNH2 O
RNHCH2CH2OH O
RN(CH2CH2OH)2
RNH2 CH2 CH CN RNHCH2CH2CNCH2 CH CN RN(CH2CH2CN)2
NH2 + 2C2H5Cl NaOH
N(C2H5)2 + 2HCl
缚酸剂
例:N,N-二乙基间氨基苯磺酸钠的制备
NNEHt2
用量
SSOO33HH
NH2
+ 2C2H5Cl NaOH
SO3H
1
3
NEt2
+ 2NaCl + 2H2O
SO3H
卤烷过量,过量百分比=
r100%=50%
• 苯胺与氯乙酸在水介质中反应,得羧酸甲基苯胺,它 是合成靛蓝染料的中间体:
HCl + AlCl3 R-CH=CH2 +
ClAlCl3
ClAlCl3
RCH+-CH3 AlCl4-
+
+ RCHCH3
R
H
CHCH3 +
-H+
R CHCH3
3、用醇、醛酮进行烷基化的反应历程
ROH + H+ ROH + AlCl3
ROH2+ ROAlCl2
R+ + H2O R+ + AlOCl2-
1)N-甲基苯胺与环氧乙烷反应 2)氯苯硝化,氯可被甲氧基取代,部分还原,与环氧乙烷反应
Cl
Cl
NO2
OCH3 NO2
OCH3 NH2
OCH3 N(C2H5OH)2
NO2
NO2
NO2
NO2
10.3 O-烃化
啥叫O-烃化?有机中有氧的分子?产物?用途?
醇羟基(R-OH)或酚羟基(Ar-OH)上的氢 原子被烃基取代,生成二烷基醚、烷基芳基醚或 二芳基醚的反应叫做O-烃化反应。
NH S
水-乙醇介质200C,10h
OO
OH COOCH3
S NCH3 OO
但硫酸二甲酯是剧毒物!
四.用环氧化合物的N-烷化
环氧乙烷是活泼的烷基化剂,三环张力大,易开 环,因而活泼。
与氨基氮原子上的氢发生加成反应,在氮原子上 引入羟乙基,故又称羟乙基化。例如:
R NH2
H2C
CH2
H2C
CH2
O
R C H + H+
OH
R C+
H
O
R C R, + H+
OH
R C+
R,
四、芳环上C-烷基化反应的特点
1.C-烷基化是连串反应
+ CH3CH2Cl
AlCl3
CH2CH3
Ò±Ò Òü Ò×Ò×ÒÒÒú
C2H5Cl AlCl3
2.C-烷基化是可逆反应
CH3
AlCl3 2
CH3 CH3 +
CH2CH3 CH2CH3 +
OCH3
OC2H5
OCH2COOH
OCH3
OC2H5
Cl
OH
Cl
+ ClCH2COOH NaOH
OCH2COOH Cl
O-烷基化
2.用醇类的O-烷化
ROH + R'OH 大量浓H2SO4 R-O-R' + H2O
• 对于某些活泼的酚类,也可以用醇类作烷基化剂:
ROH H+ R-O-H R'OH 质子化 H
+ 2CH3OH
高压液相烷化法 H2SO4
3.2
0.11
温度:205-215oC
压力:3.0-3.2MPa
时间:5h
N(CH3)2 含量0.5%)
2)N-甲基苯胺
NHCH3
甲醇:苯胺=2:3,温度:2300C
二.用卤烷的N-烷化
卤烷是N-烷基化常用的烷基化剂,其反应活性较醇为强, 但其价格比相应的醇为高,常用于不太活泼的氨基的烷基化 或季铵化。
CH2CH3 CH2CH3
3、烷基可能发生重排
+ CH3CH2CH2Cl
AlCl 3
CH 3
CH CH 3
+
CH 2CH 2CH 3
异丙苯(65~69%) 正丙苯(35~31%)
五、实例
1.抗氧化剂BHA
OH
+(CH3)3COH
H3PO4,H2SO4 800C
OH C(CH3)3
抗氧化剂BHA
OCH3
用醇作烷基化剂常用强酸(如浓硫酸)作催化剂。酸的作用是助醇 生成烷基碳正离子,R+与氨的氮原子上的未共用电子对能形成配合物, 然后脱去质子成为伯胺:
ROH + H+
H
H N + R+
H
ROH2+
R++ H2O
H
+ HN R
H
H
R N + H+
H
亲电取代反应
胺的碱性越强,越利于反应。对于芳香族胺类,若环上有其它给电子基团, 则芳胺容易发生烷基化;而环上带有吸电子基团时,则烷基化较难进行。
OCH3
叔丁基对羟基茴香醚
醇的C-烷基化反应。
食品抗氧剂,能阻碍油脂食品的氧化作用,延缓食 品开始败坏的时间。
-H2O
R+
R'OH
R-O-R' + H2O -H+ H
-H+
R-O-R'
R-O-R' H
C2H5OC2H5 , n-C3H7-O-C3H7-n ,
OCH3(C2H5)
3.用环氧烷类的O-烷化
ROH + CH2CH-R' 催化剂 O
ROCH2CH-R' OH
(1)催化剂
酸:BF3,Al2O3 (SN1) 碱:NaOH,KOH (SN2)
由于碳正离子的稳定性:R3C+﹥R2CH+﹥RCH2+,因此伯烷不 易生成R+,一般以分子络合物参加反应。
2、用烯烃烷基化的反应历程
R-CH=CH2 + HF
RCH+-CH3 + F-
用三氯化铝作催化剂时,还必须有少量氯化氢催化。三氯化铝能与HCl作用 生成络合物,该络合物又能与烯烃反应而形成活泼的亲电质点碳正离子:
H OH
H OH
CH2OH
O CH2 HO O H CH HO H OH
CH2OH
C6H5
1,3,2,4-双-O-(苯亚甲基)山梨醇
新型的增稠剂和凝胶剂
产物:醚
1.用卤烷的O-烷化
δ+
R-OHNa++ R' X
R-O-R' + HNXaX
R-OH + NaOH
RO- Na+
一般加碱作为缚酸剂
• 当醇和卤烷都很不活泼时,要将醇先制成无水醇钠,然后与卤烷作用, 以避免水解等副反应。
• 当卤烷不够活泼时,也可加入适量碘化钠。 • 使用相转移催化剂时,酚与卤烷反应非常顺利。
二、烃基化试剂(烃化剂)
用于烷基化的反应试剂称为烷基化剂。常用的有:
(1)卤烷 (2)酯类 (3)醇类和醚类
O HO S OH
O
O RO S OR
O
O Ar S OR
O
硫酸酯、磺酸酯
(4)环氧化合物
(5)烯烃和炔烃
(6)羰基化合物
说明: 上述N-烷化剂中,前三类反应活性最强的是硫酸的中
性酯,如硫酸二甲酯;其次是卤烷;醇醚类烷化剂的活性 较弱,需用强酸催化或在高温下才可发生反应。
CH3 C18H37 N CH2C6H5 Cl
CH3
三.用酯类的N-烷化
• 酯类活泼,但价格贵,仅用于不太活泼的氨基或羟
基化合物。
• 常用的酯:硫酸二酯、芳磺酸酯、磷酸三酯
• 甲基化—Me2SO4 • 乙基化—Et2SO4
反应式:
ArNH2 + CH3-O-SO2-OCH3 NaOH ArNHCH3 + NaO-SO2-OCH3 + H2O
(2)特点:连串反应 RO(CH2CH2O)nH
合成聚醚:非离子表面活性剂
将壬基苯酚与环氧乙烷反应,得到聚醚产品,其商品名为OP型乳化剂。
C9H19
OH + n O
NaOH C9H19
O-(CH2CH2O)n-H
此类表面活性剂广泛用作W/O型乳化剂或O/W乳化剂、分散剂, 在工业清洗、纺织印染、造纸、皮革化工、农药等工业领域有着 广泛的应用。
质子酸: HF>H2SO4>H3PO4
三、C-烷基化反应历程 亲电取代反应
1、用卤烷烷基化的反应历程
R-Cl + AlCl3
R Cl:AlCl3
分子络合物
R+....AlCl4离子对或离子络合物
+ CCH3 CH3
CH(CH3)2
H
H+
CH(CH3)2
催化剂的作用是使烷基化试剂极化成活泼的亲电质点,这种 亲电质点进攻芳环生成σ-络合物,再脱去质子而变成最终产物。
N-烷基化反应的类型
(1)取代型 所用N-烷基化剂是醇、醚、卤烷和酯类
CH3CH2Br + 2 NH3
CH3CH2NH2 + NH4Br
(2)加成型 所用N-烷基化剂是环氧化合物和烯烃衍生物;
CH2 CH2
CH2 CH2
RNH2 O
RNHCH2CH2OH O
RN(CH2CH2OH)2
RNH2 CH2 CH CN RNHCH2CH2CNCH2 CH CN RN(CH2CH2CN)2
NH2 + 2C2H5Cl NaOH
N(C2H5)2 + 2HCl
缚酸剂
例:N,N-二乙基间氨基苯磺酸钠的制备
NNEHt2
用量
SSOO33HH
NH2
+ 2C2H5Cl NaOH
SO3H
1
3
NEt2
+ 2NaCl + 2H2O
SO3H
卤烷过量,过量百分比=
r100%=50%
• 苯胺与氯乙酸在水介质中反应,得羧酸甲基苯胺,它 是合成靛蓝染料的中间体:
HCl + AlCl3 R-CH=CH2 +
ClAlCl3
ClAlCl3
RCH+-CH3 AlCl4-
+
+ RCHCH3
R
H
CHCH3 +
-H+
R CHCH3
3、用醇、醛酮进行烷基化的反应历程
ROH + H+ ROH + AlCl3
ROH2+ ROAlCl2
R+ + H2O R+ + AlOCl2-
1)N-甲基苯胺与环氧乙烷反应 2)氯苯硝化,氯可被甲氧基取代,部分还原,与环氧乙烷反应
Cl
Cl
NO2
OCH3 NO2
OCH3 NH2
OCH3 N(C2H5OH)2
NO2
NO2
NO2
NO2
10.3 O-烃化
啥叫O-烃化?有机中有氧的分子?产物?用途?
醇羟基(R-OH)或酚羟基(Ar-OH)上的氢 原子被烃基取代,生成二烷基醚、烷基芳基醚或 二芳基醚的反应叫做O-烃化反应。
NH S
水-乙醇介质200C,10h
OO
OH COOCH3
S NCH3 OO
但硫酸二甲酯是剧毒物!
四.用环氧化合物的N-烷化
环氧乙烷是活泼的烷基化剂,三环张力大,易开 环,因而活泼。
与氨基氮原子上的氢发生加成反应,在氮原子上 引入羟乙基,故又称羟乙基化。例如:
R NH2
H2C
CH2
H2C
CH2
O
R C H + H+
OH
R C+
H
O
R C R, + H+
OH
R C+
R,
四、芳环上C-烷基化反应的特点
1.C-烷基化是连串反应
+ CH3CH2Cl
AlCl3
CH2CH3
Ò±Ò Òü Ò×Ò×ÒÒÒú
C2H5Cl AlCl3
2.C-烷基化是可逆反应
CH3
AlCl3 2
CH3 CH3 +
CH2CH3 CH2CH3 +
OCH3
OC2H5
OCH2COOH
OCH3
OC2H5
Cl
OH
Cl
+ ClCH2COOH NaOH
OCH2COOH Cl
O-烷基化
2.用醇类的O-烷化
ROH + R'OH 大量浓H2SO4 R-O-R' + H2O
• 对于某些活泼的酚类,也可以用醇类作烷基化剂:
ROH H+ R-O-H R'OH 质子化 H
+ 2CH3OH
高压液相烷化法 H2SO4
3.2
0.11
温度:205-215oC
压力:3.0-3.2MPa
时间:5h
N(CH3)2 含量0.5%)
2)N-甲基苯胺
NHCH3
甲醇:苯胺=2:3,温度:2300C
二.用卤烷的N-烷化
卤烷是N-烷基化常用的烷基化剂,其反应活性较醇为强, 但其价格比相应的醇为高,常用于不太活泼的氨基的烷基化 或季铵化。
CH2CH3 CH2CH3
3、烷基可能发生重排
+ CH3CH2CH2Cl
AlCl 3
CH 3
CH CH 3
+
CH 2CH 2CH 3
异丙苯(65~69%) 正丙苯(35~31%)
五、实例
1.抗氧化剂BHA
OH
+(CH3)3COH
H3PO4,H2SO4 800C
OH C(CH3)3
抗氧化剂BHA
OCH3
用醇作烷基化剂常用强酸(如浓硫酸)作催化剂。酸的作用是助醇 生成烷基碳正离子,R+与氨的氮原子上的未共用电子对能形成配合物, 然后脱去质子成为伯胺:
ROH + H+
H
H N + R+
H
ROH2+
R++ H2O
H
+ HN R
H
H
R N + H+
H
亲电取代反应
胺的碱性越强,越利于反应。对于芳香族胺类,若环上有其它给电子基团, 则芳胺容易发生烷基化;而环上带有吸电子基团时,则烷基化较难进行。
OCH3
叔丁基对羟基茴香醚
醇的C-烷基化反应。
食品抗氧剂,能阻碍油脂食品的氧化作用,延缓食 品开始败坏的时间。
-H2O
R+
R'OH
R-O-R' + H2O -H+ H
-H+
R-O-R'
R-O-R' H
C2H5OC2H5 , n-C3H7-O-C3H7-n ,
OCH3(C2H5)
3.用环氧烷类的O-烷化
ROH + CH2CH-R' 催化剂 O
ROCH2CH-R' OH
(1)催化剂
酸:BF3,Al2O3 (SN1) 碱:NaOH,KOH (SN2)
由于碳正离子的稳定性:R3C+﹥R2CH+﹥RCH2+,因此伯烷不 易生成R+,一般以分子络合物参加反应。
2、用烯烃烷基化的反应历程
R-CH=CH2 + HF
RCH+-CH3 + F-
用三氯化铝作催化剂时,还必须有少量氯化氢催化。三氯化铝能与HCl作用 生成络合物,该络合物又能与烯烃反应而形成活泼的亲电质点碳正离子:
H OH
H OH
CH2OH
O CH2 HO O H CH HO H OH
CH2OH
C6H5
1,3,2,4-双-O-(苯亚甲基)山梨醇
新型的增稠剂和凝胶剂
