第十九章 配合物习题
配合物习题
有一些五边形碳环和七边形碳环,试问 (1)这些五、七边形碳环在碳纳米管的什么位置比较 多? (2)你认为碳纳米管可能具有超导特性吗?为什么?
[答案:]
(1)碳纳米管管身弯曲开叉部位,以及两端封闭部 分。 (2)可能。由于这种碳纳米管可以看成石墨结构卷 曲而成,所以在它的径向存在自由电子导电,所以可能 具有超导性(其它答案只要合理均可给分)
部结合O2,然后随血液输送到体内需氧部位,在那里,O2便
被H2O取代出来。通常在铁的配合物中结合有各种小分子,如 O2、H2O和CO等,它们结合力的强弱顺序为CO》O2≈H2O。 据此,请简要分析使用家用燃气热水器,为什么有时会出现伤 亡事故。 (1)若热水器的燃气主要成分为丙烷(C3H8),燃烧时的
• (1)写出形成A的化学反应方程式。 • (2)画出B和C的结构示意图。 • (3)在形成化合物A、B、C间涉及哪些化学平衡常数, 请用反应式表示它们间的关系。
解答
(13)
• 铂的配合物{Pt(CH3NH2)(NH3)[CH2(COO)2]}是一种抗癌新 药,药效高而毒副作用小,其合成路线如下:
+Cl-=AgCl↓+2NH4+ CO32-+2H+=CO2↑+H2O
[例题] [2001年江苏省高中学生化学奥林匹克竞赛(预赛)试题 ] 碳纳米管(CNTs—Carbon Nanotubes)的发现是材料科 学研究领域的一个新的突破,它又称巴基管(Buckytube) ,属富勒(F ullerene)碳系,是伴随着C60的研究不断深入 而出现的。碳纳米管是处于纳米级范围内,具有完整分 子结构的新型材料。典型的碳纳米管直径小于100nm, 长度为几μm。(注:lnm=10-9m,1μm=10-6m)CNTs 的基 本结构主要由六边形碳环组成,此外还
配位化合物习题答案

第十九章配位化合物1、[Pt(NH3)2Cl4]1、配合物:K2PtCl6, Co(NH3)6Cl3, CuSO4·5H2O螯合物:Ni(en)2Cl2, Cu(NH2CH2COO)2复盐:(NH4)2SO4·FeSO4·6H2O KCl·MgCl2·6H2O简单盐:Cu(OOCH3)23、(1)六氯合锑(III)酸铵(2)四氢合铝(III)酸锂(3)三氯化三(乙二胺)合钴(III)(4)氯化二氯·四水合钴(III)(5)二水合溴化二溴·四水合钴(III)(6)羟·水·草酸根·乙二胺合铬(III)(7)六硝基合钴(III)配阴离子(8)氯·硝基·四氨合钴(III)配阳离子(9)三氯·水·二吡啶合铬(III)(10)二氨·草酸根合镍(II)4、(1)[Pt(NH3)2(NO2)Cl] 平面正方形2种异构体H3N NO2H3N NO2Pt PtH3N Cl H3N Cl (2)[Pt(Py)(NH3)ClBr] 平面正方形3种异构体Cl Py Cl NH3Pt PtBr NH3 Br PyCl 3PtPy Br(3)[Pt(NH3)2(OH)2Cl2] 八面体5种异构体3NH3NH3 NH333OH Cl(4)[Co(NH3)2(NO2)4]-八面体2种异构体23O22O2NH3NO2(5)[Co(NH3)3(OH)3] 八面体2种异构体H3H3NH3 OH(6)[Ni(NH3)2Cl2] 四面体无异构体(7)[Cr(en)2(SCN)2]SCN[Cr(en)2(SCN)2]-八面体2种异构体enSCN en(8)[Co(en)3]Cl3[Co(en)3]3+八面体2种异构体(9)[Co(NH3)(en)Cl3] 八面体2种异构体(10)[Co(en)2(NO2)2]Cl2[Co(en)2(NO2)2]2+八面体2种异构体5、该中心金属离子可能是Fe2+)2nn= 4.90 n = 4(即在八面体场中有四个成单电子八面体强场中磁矩为零,即无成单电子故Fe2+符合题意6、高自旋的有:(1),(2),(5),(7)低自旋的有:(3),(4),(6),(8)内轨型的有:(3),(4),(6),(8)外轨型的有:(1),(2),(5),(7)7、dsp28、由软硬酸碱规则:“硬亲硬,软亲软,软硬交界就不管”9、(1)Al3+与F-的配合物更加稳定,Al3+为硬酸;而碱F-的硬度比Cl-大(2)Pd2+与RSH配合后更加稳定,Pd2+为软酸,而RSH为软碱,ROH为硬碱。
配合物习题答案

配合物思考题与答案1.设计一些实验,证明粗盐酸的黄色是Fe3+与Cl-的络离子而不是铁的水合离子或者羟合离子的颜色。
(略)2.配位化学创始人维尔纳发现,将等物质的量的黄色CoCl3.6NH3﹑紫红色CoCl3.5NH3﹑绿色CoCl3.4NH3和紫色CoCl3.4NH3四种配合物溶于水,加入硝酸银,立即沉淀的氯化银分别为3 ﹑2 ﹑1 ﹑1mol,请根据实验事实推断它们所含的配离子的组成。
答:配离子分别是[Co(NH3)6]3+, [Co(NH3)5Cl]2+ , [Co(NH3)4Cl2] +, [Co(NH3)4Cl2] +,颜色不同的原因是有同分异构体。
3.实验测得Fe(CN)64-和Co(NH3) 63+均为反磁性物质(磁矩等于零),问它们的杂化轨道类型。
答:中心二价Fe2+亚铁离子外层价电子排布是3d6,有4个未成对电子,测得Fe(CN)64-为抗磁性物质,说明中心的铁离子的外层价电子排布发生变化,进行了重排,使得内层3d轨道上没有未成对电子,所以应采取的是d2sp3杂化方式。
三价Co离子外层价电子排布也是3d6,也有4个未成对电子,测得Co(NH3) 63+为反磁性物质,原理同上,也是d2sp3杂化方式。
4.实验证实,Fe(H2O)63+和Fe(CN) 63-的磁矩差别极大,如何用价键理论来理解?答:Fe(H2O)63+的中心离子铁是采用sp3d2杂化方式,外轨型配合物,高自旋,有5个成单电子,磁矩高;而Fe(CN) 63-采用的是d2sp3杂化方式,内轨型配合物,低自旋,只有1个成单电子,所以磁矩低。
5.上题的事实用晶体场理论又作如何理解?略6.用晶体场理论定性地说明二价和三价铁的水合离子的颜色不同的原因。
略7.FeF63-为 6 配位,而FeCl4-为四配位,应如何解释?答:三价Fe的外层价电子层电子排布是3d3,d轨道上有2个空轨道。
同样作为中心离子,作为负电荷的配体之间的排斥力是需要重点考虑的。
配合物 习题及答案

配合物习题及答案一、判断题:1.含有配离子的配合物,其带异号电荷离子的内界和外界之间以离子键结合,在水中几乎完全解离成内界和外界。
.... ()2.在1.0 L 6.0 mol·L-1氨水溶液中溶解0.10 mol CuSO4固体,假定Cu2+ 全部生成[ Cu (NH3 )4 ]2+,则平衡时NH3的浓度至少为 5.6 mol·L-1 。
.........................()3.在M2+溶液中,加入含有X-和Y-的溶液,可生成MX2沉淀和[MY4]2-配离子。
如果K( MX2 )和K([ MY4]2- ) 越大,越有利于生成[MY4]2-。
()4.金属离子A3+、B2+可分别形成[ A(NH3 )6 ]3+和[ B(NH3 )6 ]2+,它们的稳定常数依次为 4 ⨯105 和 2 ⨯1010,则相同浓度的[ A(NH3 )6 ]3+和[ B(NH3 )6 ]2+溶液中,A3+和B2+ 的浓度关系是c ( A3+ ) > c ( B2+ ) 。
()5.在多数配位化合物中,内界的中心原子与配体之间的结合力总是比内界与外界之间的结合力强。
因此配合物溶于水时较容易解离为内界和外界,而较难解离为中心离子(或原子)和配体。
.........................................................................................................................()6. 已知K2 [ Ni (CN)4 ] 与Ni (CO)4均呈反磁性,所以这两种配合物的空间构型均为平面正方形。
.....................................................................................()7.某配离子的逐级稳定常数分别为K、K、K、K,则该配离子的不稳定常数K= K·K·K·K。
张祖德《无机化学习题》及答案第十九章

第十九章 答案1. (1) 2FeCl 3 + H 2S 2 + S↓ + 2HCl (2) 2FeSO 4 + Br 2 + H 2SO 42(SO 4)3 +2HBr(3) FeCl 3+6NaF3FeF 6 + 3NaCl (4) 2FeCl 3 + 2KI2 + 2FeCl 2(5) Fe 3+ + K + + [Fe(CN)6]4—6↓ (6) Fe 2+ + K + + [Fe(CN)6]3—6↓ 2. (1) Co 2O 3 + 6HCl 2 + Cl 2 + 3H 2O (2) 2K 4[Co(CN)6O 3[Co(CN)6] + 2KOH (3)2Co(OH)2 + H 2O 3(4) Co(NO 3)22[Co(SCN)4] + 2KNO 3 (5) Ni + 4CO Ni(CO)4 (6) 2Ni(OH)2 + Br 2 + 2H 2O 3 + 2HBr3. 三角双锥型,dsp 3杂化,3d 8:4. 铁有+2、+3、+6氧化态,+3氧化态最稳定,因为Fe 3+ 3d 5半满,稳定;钴有+2、+3氧化态,+2氧化态最稳定,因为Co 一般失去4s 2电子,所以+2氧化态稳定; 镍有+2、+3、+4氧化态,Ni 一般也失去4s 2电子,所以+2氧化态稳定。
5.(1) 3Pt + 4HNO 3 + 18HCl 2PtCl 6 + 4NO + 8H 2O由于NOCl 的产生增加了氧化性,PtCl 62-的形成而增加了Pt 的还原性。
(2) H 2PtCl 6 (3) Pt(OH)4 + 2KOH 2[Pt(OH)6] (4) K 2PtCl 6 + SO 2 + 2H 2O 2PtCl 4 + H 2SO 4 + 2HCl(5) 铂溶于王水、盐酸—H 2O 2、盐酸—高氯酸的混合液中,热的浓硫酸也能缓慢地溶解铂生成Pt(OH)2·(HSO 4)2,熔化的苛性碱或过氧化钠对铂的腐蚀性很严重;硫或金属硫化物在加热时能与铂作用;硒和碲也容易与铂作用;磷或还原气氛中的磷化物和磷酸盐都容易与铂反应。
配合物课后习题答案解析

配合物课后习题答案解析课后习题答案8.1 区分下列概念:(1)接受体原⼦和给予体原⼦;(2)配位体和配位原⼦;(3)配合物和复盐;(4)外轨配合物和内轨配合物;(5)⾼⾃旋配合物和低⾃旋配合物;(6)强场配位体和弱场配位体;(7)⼏何异构体和旋光异构体;(8)左旋异构体、右旋异构体和外消旋混合物。
解答(1)配位个体由中⼼部位的中⼼原⼦(可以是⾦属原⼦,也可是⾼价⾮⾦属原⼦)或离⼦与配体组成,前者提供空轨道,称接受体,即接受体原⼦,后者提供孤电⼦对,称给予体,给予体中直接提供孤电⼦对的原⼦即为给予体原⼦。
(2)配位个体中与中⼼原⼦或离⼦结合的分⼦叫配位体,简称配体;配位体中直接键合于中⼼原⼦的原⼦叫配位原⼦,亦即上述之给予体原⼦。
(3)给予体和接受体相结合的化学物种(配位个体)即为配合物。
更为⼴义的是路易斯酸与路易斯碱的加合物。
复盐是过去⽆机化学上对明矾、冰晶⽯、光卤⽯等的俗称。
实际上并不存在单盐与复盐之分:①单盐(如有些有机酸的盐)也有⽐所谓复盐还复杂的;②从结构看,⽆论单盐还是复盐,都可认为是配合物;③复盐,⽆“复盐”⼀词完全是形式化。
论在晶体中,在溶液中都不存在所谓的“化学式单位”的。
从配位个体稳定性的观点,可将复盐看作是⼀类稳定性极⼩的配合物;由于存在着许多中间状态,显然⽆法在复盐和配合物之间确定出⼀条绝对的界线。
(4)从配合物的价键理论出发,凡配位原⼦的孤对电⼦填在中⼼原⼦或离⼦由外层轨道杂化⽽成的杂化轨道上,形成配位键的配合物即为外轨配合物。
相反,填在由内层轨道参与的杂化轨道上,即为内轨配合物。
(5)从配合物的晶体场理论出发,由于P 和Δ的相对⼤⼩,使得配合物中的电⼦可能有两种不同的排列组态,其中含有单电⼦数较多的配合物叫⾼⾃旋配合物,不存在单电⼦或含有单电⼦数少的配合物叫低⾃旋配合物。
(6)参见节7.2.2。
(7)均为配合物的异构体。
配体在中⼼原⼦周围因排列⽅式不同⽽产⽣的异构现象,称为⼏何异构现象,常发⽣在配位数为4 的平⾯正⽅形和配位数为 6 的⼋⾯体构型的配合物中。
(完整版)配合物习题及答案
配合物习题及答案一、判断题:1.含有配离子的配合物,其带异号电荷离子的内界和外界之间以离子键结合,在水中几乎完全解离成内界和外界。
.... ()2.在 1.0 L 6.0 mol·L-1氨水溶液中溶解0.10 mol CuSO4固体,假定Cu2+ 全部生成[ Cu (NH 3 )4 ]2+,则平衡时NH3的浓度至少为 5.6 mol·L-1 。
.........................()3.在M2+溶液中,加入含有X-和Y-的溶液,可生成MX2沉淀和[MY4]2-配离子。
如果K( MX 2 )和K([ MY4]2- ) 越大,越有利于生成[MY4]2-。
()4.金属离子A3+、B2+可分别形成[ A(NH 3 )6 ]3+和[ B(NH 3 )6 ]2+,它们的稳定常数依次为 4 105 和 2 1010,则相同浓度的[ A(NH 3 )6 ]3+和[ B(NH 3 )6 ]2+溶液中,A3+和B2+ 的浓度关系是c ( A3+ ) > c ( B2+ ) 。
()5.在多数配位化合物中,内界的中心原子与配体之间的结合力总是比内界与外界之间的结合力强。
因此配合物溶于水时较容易解离为内界和外界,而较难解离为中心离子(或原子)和配体。
.........................................................................................................................()6. 已知K2 [ Ni (CN)4 ] 与Ni (CO)4均呈反磁性,所以这两种配合物的空间构型均为平面正方形。
.....................................................................................()7.某配离子的逐级稳定常数分别为K、K、K、K,则该配离子的不稳定常数K= K·K·K·K。
无机化学下册:第十九章 配位化合物
特殊的稳定性
螯合物 Kf 一般配合物 Kf [Cu(en)2]2+ 1.0×1020 [Cu(NH3)4]2+ 2.09×1013 [Zn(en)2]2+ 6.8×1010 [Zn(NH3)4]2+ 2.88×109
[Co(en)2]2+ 6.6×1013 [Co(NH3)4]2+ 1.29×105 [Ni(en)2]2+ 2.1×1018 [Ni(NH3)4]2+ 5.50×108
几何构型 由于中心(原子或离子)的杂化轨道具有一定的伸展方 向性,使形成的配合物具有一定的几何构型。
形成配离子的轨道示意图 3d Fe3+ ↑ ↑ ↑↓ ↑ ↑ ↑ ↑↓ ↑ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ 4s 4p
螯合物比非螯形配合物稳定
多核配合物
两个或两个以上中心原子结合所形成的配合物。
5+
OH
(H3N)5Cr Cr(NH3)5
O C C O
O
2-
O
羰合物(羰基化合物)
以CO为配体的配合物
M←C间的σ键—C原子提供孤对电子,中心金属原子提 供空杂化轨道
M→C的反馈π键—CO分子提供空的π*(2p)反键轨道,金 属原子提供d轨道上的孤电子对。
(sp-sp反键)
(二重简并)
(sp(C))
(二重简并)
(sp-sp成键)
(sp(O))
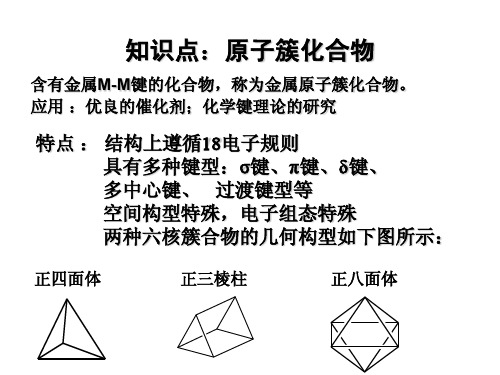
原子簇状化合物(簇合物)
具有金属-金属(M-M键)直接结合而形成的化合物。
同多酸、杂多酸型配合物
同多酸型配合物-有多核配离子形成的同多酸及 其盐。 K2Cr2O7,其中Cr2O72-为多核离子
杂多酸型配合物——由不同酸根组成的配合物
11配合物exc19
第十九章配合物补充习题8、一.选择题1.对中心形成体的正确说法是( )A. 一般是金属阳离子B. 一般是金属阳离子,中性原子,也可以是非金属阳离子或阴离子C. 只能是金属阳离子D. 以上几种说法都对2.对配位体的正确说法是( )A. 应该是带负电荷的阴离子B. 应该是中性分子C. 可以是中性分子,也可以是阴离子D. 应该是多电子原子(或离子)常见的是ⅤA,ⅥA,ⅦA等族原子3.下列不能做为配位体的物质是( )A. CH3 NH3B. C2H4 NH3C. NHD. NH34.当0.01mol氯化铬(Ⅲ)(CrCl3·6H2O)在水溶液中用过量的硝酸银处理时,有0.02mol氯化银沉淀析出,此样品的配离子的表示式为( )A. 〔Cr(H2O)6〕CI3B. 〔CrCl(H2O)5〕CI2. H2OC. 〔CrCl2(H2O)4〕CI.2H2OD. 〔CrCl3 (H2O)3〕.3H2O5.对中心原子的配位数,下列说法不正确的是( )A. 能直接与中心原子配位的原子数目称为配位数B. 中心原子电荷越高,配位数就越大C. 中性配体比阴离子配体的配位数大D. 配位体的半径越大,配位数越大6.在配位化合物中,一般作为中心形成体的元素是( )A. 非金属元素B. 过渡金属元素C. 金属元素D. ⅢB ⅧB族元素7.配合物,一氯·硝基·四氨合钴(Ⅲ)的化学式为( )A. 〔Co(NH3)4(NO2)Cl〕B. 〔Co(NH3)4(NO2)〕CIC. 〔Co(NH3)4(ONO)Cl〕D. 〔Co(NH3)4(ONO)〕Cl8.Na[B(NO3)4〕的正确命名是( )A. 硝酸合四硼酸(Ⅰ)钠B. 四硝酸合硼酸(Ⅲ)钠C. 四硝基硼酸钠D. 四硝酸根合硼(Ⅲ)酸钠9.在配位化合物的内界,若有多种无机配体和有机配体,其命名顺序为( )A. 阴离子 阳离子 中性分子 有机配体B. 阳离子 中性分子 阴离子 有机配体C. 中性分子 阳离子 阴离子 有机配体D. 阴离子 中性分子 阳离子 有机配体10.[Co(NH3)5(H2O)]Cl3 的正确命名是( )A. 一水·五氨基氯化钴B. 三氯化一水·五氨合钴(Ⅱ)C. 三氯化五氨·水合钴(Ⅲ)D. 三氯化水·五氨合钴(Ⅲ)11.K4[Fe(CN)6〕的错误名称是( )A. 铁氰化钾B. 六氰合铁酸钾C. 六氰合铁酸(4-)钾D. 六氰合铁(Ⅱ)酸钾E. 黄血盐12.(NH4)3[CrCl2(SCN)4〕的命名是( )A. 四硫氰酸根·二氯合铬(Ⅲ)酸铵B. 二氯四(硫氰酸根)合铬(Ⅲ)酸铵C. 二氯四硫氰酸根合铬(Ⅲ)酸铵D. 四异硫氰酸根·二氯合铬(Ⅲ)酸铵13.〔Cr(H2O)(en)(C2O4)(OH)〕的正确命名是( )A. 一羟基·一草酸根·一水·一乙二胺合铬(Ⅲ)B. 一羟基·水·草酸根·乙二胺合铬(Ⅲ)C. 一水·一羟基·草酸根·乙二胺合铬(Ⅲ)D. 乙二胺·一水·一羟基·一草酸根合铬(Ⅲ)14.配合物氯化二(异硫氰酸根)·四氨合铬(Ⅲ)的化学式为( )A. 〔Cr(NH3)4(SCN)2〕ClB. 〔Cr(NH3)4(NCS)2〕ClC. 〔Cr(NH3)4(SCN)2Cl〕D. 〔Cr(NH3)(NCS)2Cl〕15.关于螯合物的叙述,不正确的是( )A. 螯合物的配位体是多齿配体,与中心原子形成环状结构B. 螯合物中环愈多愈稳定C. 螯合剂中有空间位阻时,螯合物稳定性越小D. 螯合剂中配位原子相隔越远形成的环越大,螯合物稳定性越大17 . HgS能溶于王水,是因为( )A.酸解B. 氧化还原C. 配合作用D. 氧化还原和配合作用18.有一溶液含有0.1mol的NH3,0.01mol的NH4Cl和0.15mol的[Cu(NH3)4〕SO4混和,此溶液中相互作用的结果是(体积变化略)( )A.有Cu(OH)2沉淀生成B. 无Cu(OH)2沉淀生成C. 溶液形成缓冲体系D. [Cu(NH3)4〕2+ 浓度增大19.配位酸或配位碱比相应的普通酸或普通碱的酸性或碱性强,其原因是( )A. 配位酸,碱较稳定B. 配位酸,碱较不稳定C. H+或OH-为配位酸或碱的外界D. 配位后极性增强20.下列说法错误的是( )A. 金属离子形成配离子后,它的标准电极电势值一般要低B. 配离子越稳定,它的标准电极电势越负C. 配离子越稳定,相应的金属离子越难得电子D. 配离子越稳定,它的标准电极电势越正21.已知〔Ni(NH3)6〕2+的逐级稳定常数的对数值为:2.63,2.10,1.59,1.04,0.60,0.08,其K稳应为( )A. 1.10×108B. 8.04C. 4.3×104D. 2.74×10622.已知AgI的K SP=K ,〔Ag(CN)2〕-的K稳=K1,则下列反应的平衡常数为( )AgI(s) +2CN - = [Ag(CN)2〕- +I -A. K1·KB. K1/KC. K2/KD.K1+K23.下列配离子中,属于高自旋的是( )A. 〔Co(NH3)6〕3+B. 〔FeF6〕3-C. 〔Fe(CN)6〕3+D. 〔Zn(NH3)4〕2+24.下列各组配离子中,几何构型相同的是( )A. 〔Cd(CN)4〕2- 〔PtCl6〕2-B. 〔Ni(CN)4〕2- 〔Cu(NH3)4〕2+C. 〔Zn(CN)4〕2- 〔PtCl6〕2-D. 〔PtCl6〕2- 〔FeCl4〕-25.已知配离子〔CuCl4〕2- 的磁矩等于零,其空间构型和中心离子使用的杂化轨道分别是( )A. 四面体型和sp3杂化B. 平面正方形和dsp2杂化C. 八面体型和d2sp3杂化D. 八面体型和sp3d2杂化26.已知Cu为29号元素,试推测Cu(Ⅱ)在与氨形成配合物时其配位数,杂化类型和空间构型为( )A. 4 sp3杂化正四面体 B 4 dsp2杂化平面正方形C 6 sp3d2杂化八面体型D 4 sp2d杂化平面正方形27.配合离子〔CuCl4〕2-的中心离子Cu的杂化形式为( )A. spB. spC. dspD. dsp228.配合物的空间构型和配位数之间有着密切的关系,配位数为4的配合物空间立体构型是( )A. 正四面体B. 正八面体C. 直线型D. 三角形E. 平面正方形29.在〔AlCl4〕- 中, Al3+ 的杂化轨道是( )A. sp杂化B. sp2杂化C. sp3杂化D. dsp2杂化30.配离子〔Ni(CN)4〕2- 的磁矩等于0.0B.M,判断其空间构型和中心原子的杂化轨道为( )A. 四面体sp3杂化B. 平面正方形dsp2杂化C. 八面体sp3d2杂化D. 八面体d2sp3杂化31.已知螯合物〔Fe(C2O4)3〕3- 的磁矩等于5.75B.M, 其空间构型及杂化轨道类型是( )A. 八面体型B. 三角形C. 三角双锥型D. sp3d2杂化E. d2sp3杂化32.下列说法正确的是( )A. 配离子的稳定性依赖于螯环的大小,环越大越稳定。
配合物课后习题答案解析
课后习题答案8.1 区分下列概念:(1)接受体原子和给予体原子;(2)配位体和配位原子;(3)配合物和复盐;(4)外轨配合物和内轨配合物;(5)高自旋配合物和低自旋配合物;(6)强场配位体和弱场配位体;(7)几何异构体和旋光异构体;(8)左旋异构体、右旋异构体和外消旋混合物。
解答(1)配位个体由中心部位的中心原子(可以是金属原子,也可是高价非金属原子)或离子与配体组成,前者提供空轨道,称接受体,即接受体原子,后者提供孤电子对,称给予体,给予体中直接提供孤电子对的原子即为给予体原子。
(2)配位个体中与中心原子或离子结合的分子叫配位体,简称配体;配位体中直接键合于中心原子的原子叫配位原子,亦即上述之给予体原子。
(3)给予体和接受体相结合的化学物种(配位个体)即为配合物。
更为广义的是路易斯酸与路易斯碱的加合物。
复盐是过去无机化学上对明矾、冰晶石、光卤石等的俗称。
实际上并不存在单盐与复盐之分:①单盐(如有些有机酸的盐)也有比所谓复盐还复杂的;②从结构看,无论单盐还是复盐,都可认为是配合物;③复盐,无“复盐”一词完全是形式化。
论在晶体中,在溶液中都不存在所谓的“化学式单位”的。
从配位个体稳定性的观点,可将复盐看作是一类稳定性极小的配合物;由于存在着许多中间状态,显然无法在复盐和配合物之间确定出一条绝对的界线。
(4)从配合物的价键理论出发,凡配位原子的孤对电子填在中心原子或离子由外层轨道杂化而成的杂化轨道上,形成配位键的配合物即为外轨配合物。
相反,填在由内层轨道参与的杂化轨道上,即为内轨配合物。
(5)从配合物的晶体场理论出发,由于P 和Δ的相对大小,使得配合物中的电子可能有两种不同的排列组态,其中含有单电子数较多的配合物叫高自旋配合物,不存在单电子或含有单电子数少的配合物叫低自旋配合物。
(6)参见节7.2.2。
(7)均为配合物的异构体。
配体在中心原子周围因排列方式不同而产生的异构现象,称为几何异构现象,常发生在配位数为 4 的平面正方形和配位数为 6 的八面体构型的配合物中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
D. 2.74× 10 )
26. 已知 AgI 的 K=K,〔Ag(CN)〕的 K 稳=K,则下列反应的平衡常数为( AgI(S)+2CN〔Ag(CN)〕+I A. K1· K B. K1/K C. K2/K ) B. 〔FeF〕 D. 〔Zn(NH)〕 ) B. 〔Mn(NCS)〕 D. 〔CuCl〕 D.K1+K
配合物,一氯· 硝基· 四氨合钴(Ⅲ)的化学式为(
A. 〔Co(NH)(NO)Cl〕 B. 〔Co(NH)(NO)〕Cl C. 〔Co(NH)(ONO)Cl〕 10. Na〔B(NO)〕的正确命名是( A. 硝酸合四硼酸(Ⅰ)钠 C. 四硝基硼酸钠 11. cis〔PtCl(phP)〕的正确命名是( ) B. 四硝酸合硼酸(Ⅲ)钠 D. 四硝酸根合硼(Ⅲ)酸钠 ) D. 〔Co(NH)(ONO)〕Cl
A. 配离子的稳定性依赖于螯环的大小,环越大越稳定 B. 配离子的稳定性依赖于螯环的大小,环越小越稳定 C. 一般情况下,五圆环最稳定 D. 由于配位原子间键张力的存在,四圆环的形成较容易 42. CoCl3· 4NH用硫酸溶液处理再结晶,SO42-可取代化合物中的 Cl-,但氨的摩尔质量不变. 用过量的 AgNO溶液处理该溶液,每摩尔钴可得 1molAgCl 沉淀,这种化合物应是 ( ) A. 〔Co(NH)〕Cl C. 〔Co(NH)Cl〕Cl B. Co(NH)· Cl D. 〔Co(NH)Cl〕Cl
A. 〔HgCl〕,HgI,〔HgI〕 C. HgCl,HgCl,〔HgI〕
45. 在 0.1mol· LK〔Ag(CN)〕溶液中,加入固体 KCl,使 Cl的浓度为 0.1mol· L,可发 生下列何种现象( )
(KAgCl=1.56× 10,K〔Ag(CN)〕=1× 10) A. 有沉淀生成 C. 有气体生成 二.填空题 1. 选择配位 (A) 中心原子 (B) 配位体 (C) 配位原子 (D) 配阴离子 (E) 外界 B. 无沉淀生成 D. 先有沉淀然后消失
B. 三氯化一水· 五氨合钴(Ⅱ)
C. 三氯化五氨· 水合钴(Ⅲ) D. 三氯化水· 五氨合钴(Ⅲ)
2
第十七章
配合物补充习题
14. K〔Fe(CN)〕的错误名称是( A. 铁氰化钾 C. 六氰合铁酸(4-)钾 E. 黄血盐 15.
) B. 六氰合铁酸钾 D. 六氰合铁(Ⅱ)酸钾
(NH)〔CrCl(SCN)〕的命名是( A. 四硫氰酸根· 二氯合铬(Ⅲ)酸铵 B. 二氯四(硫氰酸根)合铬(Ⅲ)酸铵 C. 二氯四硫氰酸根合铬(Ⅲ)酸铵 D. 四异硫氰酸根· 二氯合铬(Ⅲ)酸铵
34. 配合离子〔CuCl〕的中心离子 Cu的杂化形式为( A. sp B. sp C. dsp D. dsp
35. 配合物的空间构型和配位数之间有着密切的关系,配位数为 4 的配合物空间立体构型是 ( ) A. 正四面体 D. 三角形 B. 正八面体 E. 平面正方形 ) C. 直线型
40. 比较配合物〔Cu(NH))与 Cu(CN)〕配离子的稳定性, 并说明理由( A. 稳定性 〔Cu(NH)〕>〔Cu(CN)〕 B. 稳定性 〔Cu(NH)〕<〔Cu(CN)〕 C. 稳定性无法比较 D. CN的碱性强于 NH
E. N 原子的原子量大于 C 41. 下列说法正确的是( )
) B. 〔Fe(CN)〕 D. 〔FeF〕 )
〔PtCl〕 〔Cu(NH)〕 〔PtCl〕 〔FeCl〕
5
第十七章
配合物补充习题
31. 已知配离子〔CuCl〕的磁矩等于零,其空间构型和中心离 子使用的杂化轨道分别是( A. 面体型和 sp杂化 C. 八面体型和 dsp杂化 ) B. 平面正方形和 dsp杂化 D. 八面体型和 spd杂化
B. sp杂化 D. dsp杂化
38. 配离子〔Ni(CN)〕的磁矩等于 0.0B.M,判断其空间构型和中心原子的杂化轨道为 ( ) A. 四面体和 sp杂化 C. 八面体和 spd杂化 B. 平面正方形和 dsp杂化 D. 八面体和 dsp杂化
39. 已知螯合物〔Fe(CO)〕的磁矩等于 5.75B.M, 其空间构型及杂化轨道类型是 ( ) A. 八面体型 D. spd杂化 B. 三角形 E. dsp杂化 ) C. 三角双锥型
A. 应该是带负电荷的阴离子
C. 可以是中性分子,也可以是阴离子 D. 应该是多电子原子(或离子)常见的是ⅤA,ⅥA,ⅦA 等族原子 3. 下列不能做为配位体的物质是( A. CHNH C. NH 4. ) B. CHNH D. NH )
下列可以做为酸配体的物质是(
A.CH B. CO C. CH D. CH 5. 某配合物中心形成体半径大小适中,其氧化数为+3,若配体为中性分子,问其配位数应该 为( ) A. 2 B. 3 C. 4 D. 6
)
16. 〔Cr(HO)(en)(CO)OH〕的正确命名是(
)
A. 一羟基· 一草酸根· 一水· 一乙二胺合铬(Ⅲ) B. 一羟基· 水· 草酸根· 乙二胺合铬(Ⅲ) C. 一水· 一羟基· 草酸根· 乙二胺合铬(Ⅲ) D. 乙二胺· 一水· 一羟基· 一草酸根合铬(Ⅲ) 17. 配合物氯化二(异硫氰酸根)· 四氨合铬(Ⅲ)的化学式为( A. 〔Cr(NH)(SCN)〕Cl B. 〔Cr(NH)(NCS)〕Cl C. 〔Cr(NH)(SCN)Cl〕 D. 〔Cr(NH)(NCS)Cl〕 18. 关于螯合物的叙述,不正确的是( ) )
当001mol氯化铬crcl6ho在水溶液中用过量的硝酸银处理时有002mol氯化银沉淀析出此样品的配离子的表示式为a
第十七章
配合物补充习题
第十七章 配合物习题
一.选择题 1. 对中心形成体的正确说法是( A. 一般是金属阳离子 B. 一般是金属阳离子,中性原子,也可以是非金属阳离子或阴离子 C. 只能是金属阳离子 2. 对配位体的正确说法是( ) B. 应该是中性分子 D. 以上几种说法都对 )
请选择适当的答案填入下列各题: 1). 〔Co(ONO)(NH)〕SO中 ONO是_______. 2). 〔Cr(HO)Cl〕Cl· 2HO 中 Cr是____. 2. 配位选择: (A) 0 (B) +2 (C) +3 (D) +4 (E) -1 请选择适当的答案填入下列各题: 1). 〔Co(NH)(NO)〕中 Co 的氧化数________. 2). 〔Fe(CN)(CO)〕中 Fe 的氧化数________. 3. [Fe(CN)]的中心离子采用的杂化轨道为___________, 离子的空间构型为_______________. 三.计算题
A. 螯合物的配位体是多齿配体,与中心原子形成环状结构 B. 螯合物中环愈多愈稳定 C. 螯合剂中有空间位阻时,螯合物稳定性越小 D. 螯合剂中配位原子相隔越远形成的环越大,螯合物稳定性越大 19. 在下列正方形和八面体的几何构型中,以 CO为螯合剂的是( )
3
第十七章
配合物补充习题
A. 〔Co(NH)CO〕 B. 〔Pt(en)CO〕 C. 〔Pt(en)(NH)CO〕 D. 〔Pt(NH)(NO)Cl〕CO 20. 关于螯合物的正确叙述是( )
22. 有一溶液含有 0.1mol 的 NH,0.01mol 的 NHCl 和 0.15mol 的 [Cu(NH)〕混和,此溶液中相互作用的结果是(体积变化略)( A. 有 Cu(OH)沉淀生成 B. 无 Cu(OH)沉淀生成 C. 溶液形成缓冲体系 D. 〔Cu(NH)〕浓度增大 23. 配位酸或配位碱比相应的普通酸或普通碱的酸性或碱性强,其原因是( ) A. 配位酸,碱较稳定 B. 配位酸,碱较不稳定 )
C. H或 OH为配位酸或碱的外界 D. 配位后极性增强 24. 下列说法错误的是( )
4
第十七章
配合物补充习题
A. 金属离子形成配离子后,它的标准电极电势值一般要低 B. 配离子越稳定,它的标准电极电势越负 C. 配离子越稳定,相应的金属离子越难得电子 D. 配离子越稳定,它的标准电极电势越正 25. 已知〔Ni(NH)〕的逐级稳定常数的对数 值为:2.63,2.10, 1.59,1.04,0.60,0.08,其 K 稳应为( A. 1.10× 10 B. 8.04 C. 4.3× 10 )
A. 螯合物是一类很稳定的配合物,很少出现分级配合的现象 B. 螯合剂均为有机物 C. 螯合剂的配位原子三面必须相隔 23 个非配位原子以形成较稳定的 五圆环或六圆环螯合物. D. 形成螯合物时,在配位原子附近必须有足够的空间使金属离子进入螯 合剂结构的一定位置 21. HgS 能溶于王水,是因为( A. 酸解 C. 配合作用 ) B. 氧化还原 D. 氧化还原和配合作用
27. 下列配离子中,属于高自旋的是( A. 〔Co(NH)〕 C. 〔Fe(CN)〕 28. 下列配离子中,属于低自旋的是( A. 〔Co(CN)〕 C. 〔Fe(SCN)〕 E. 〔Ni(HO)〕
29. 下列各配合物中,没有反馈键的是( A. 〔Pt(CH)Cl〕 C. 〔Ni(CO)〕 30. 下列各组配离子中,几何构型相同的是( A. 〔Cd(CN)〕 B. 〔Ni(CN)〕 C. 〔Zn(CN)〕 D. 〔PtCl〕
A. 能直接与中心原子配位的原子数目称为配位数
1
第十七章
配合物补充习题
B. 中心原子电荷越高,配位数就越大 C. 中性配体比阴离子配体的配位数大 D. 配位体的半径越大,配位数越大 8. 在配位化合物中,一般作为中心形成体的元素是( A. 非金属元素 C. 金属元素 9. )
B. 过渡金属元素 D. ⅢBⅧB 族元素 )
6. 当 0.01mol 氯化铬(Ⅲ)(CrCl· 6HO)在水溶液中用过量的硝酸银处理时,有 0.02mol 氯 化银沉淀析出,此样品的配离子的表示式为( A. 〔Cr(HO)〕 )
B. 〔CrCl(HO)〕
