磷酸化蛋白质组学常用定量方法介绍
tau蛋白磷酸化定量 质谱

tau蛋白磷酸化定量质谱
Tau蛋白是与神经退行性疾病,特别是阿尔茨海默病相关的一种蛋白质。
Tau蛋白的磷酸化状态与神经元退行性疾病的发展密切相关。
为了进行Tau蛋白磷酸化的定量分析,质谱技术是一种常用的方法之一。
以下是进行Tau蛋白磷酸化定量的一般步骤:
1.样品制备:提取和制备样品,通常使用离心分离蛋白质,并使
用蛋白质提取缓冲液。
对Tau蛋白进行磷酸化分析时,需要使
用含有磷酸酪氨酸酶抑制剂的提取缓冲液。
2.蛋白质消化:使用适当的酶(例如胰蛋白酶)对Tau蛋白进行
消化,将其分解成肽段。
3.液相色谱(LC):对产生的肽段进行液相色谱分离。
这通常涉
及将样品注入到高效液相色谱仪中,以分离肽段。
4.质谱分析(MS):将分离的肽段引入质谱仪,通过质谱分析技
术(例如液相色谱串联质谱,LC-MS/MS)来鉴定和定量Tau蛋
白的磷酸化状态。
这可能涉及到使用离子阱或四极杆飞行时间
质谱。
5.数据分析:通过质谱数据分析软件对得到的质谱数据进行处理,
以鉴定和量化Tau蛋白的磷酸化肽段。
6.定量分析:利用内部标准或外部标准进行定量,以确定Tau蛋
白磷酸化水平。
需要注意的是,Tau蛋白磷酸化的定量分析是一项复杂的工作,需
要使用高灵敏度和高分辨率的质谱仪器,并且需要专业的实验技术和数据分析。
通常,研究人员会依赖于质谱技术的进展和专业实验室的支持来进行这类研究。
蛋白质组学研究中的磷酸化分析技术与策略:揭示修饰调控的多样性与复杂性

蛋白质组学研究中的磷酸化分析技术与策略:揭示修饰调控的多样性与复杂性蛋白质组学通过全面分析和解析蛋白质组中的成分和功能,帮助我们理解细胞内的生物过程和调控机制。
磷酸化是一种常见的蛋白质修饰类型,通过在蛋白质分子中引入磷酸基团来调控其功能和相互作用。
蛋白质组学研究中的磷酸化分析技术与策略对于揭示修饰调控的多样性和复杂性具有重要意义。
图1。
一、蛋白质组学研究中的磷酸化分析技术:1.质谱分析技术:包括质谱仪和液相色谱技术等,用于鉴定和定量磷酸化蛋白质,并确定磷酸化位点的位置。
2.磷酸化酶和磷酸酶的应用:通过激酶和磷酸酶的作用,实现对磷酸化修饰的调控和定量分析。
图2。
二、磷酸化分析策略与方法:1.定性磷酸化分析:通过质谱技术鉴定和定位蛋白质中的磷酸化修饰位点,帮助理解蛋白质磷酸化修饰的多样性和动态变化。
2.定量磷酸化分析:结合标记和非标记的定量方法,实现对磷酸化修饰的定量分析,揭示磷酸化的丰度变化与细胞信号通路和生物过程的相关性。
三、磷酸化修饰的调控多样性与复杂性:1.磷酸化修饰的多样性:磷酸化修饰可发生在不同氨基酸残基上,如丝氨酸、苏氨酸和酪氨酸等,形成不同类型的磷酸化修饰。
2.磷酸化修饰的复杂性:磷酸化修饰可以发生在单个蛋白质上的多个位点,形成复杂的磷酸化修饰网络,参与多个生物过程的调控。
四、磷酸化分析的研究价值与应用:1.研究细胞信号通路:磷酸化分析可帮助揭示细胞信号通路中磷酸化修饰的动态调控过程,从而深入了解细胞的功能和调控机制。
2.发现新的药物靶点:通过分析磷酸化修饰的变化,可以发现新的疾病标志物和药物靶点,为疾病治疗提供新的策略和目标。
蛋白质组学研究中的磷酸化分析技术与策略对于揭示修饰调控的多样性与复杂性具有重要意义。
通过研究磷酸化修饰在蛋白质组中的定位和功能调控,我们可以更深入地理解细胞信号通路和生物过程的调控机制。
磷酸化分析在细胞生物学、疾病研究和药物开发等方面具有广阔的应用前景。
景杰生物:磷酸化修饰蛋白质组学

16
磷酸化蛋白质组学分析
降低样品复杂度
规模化分析
特异性富集方法 有效预分级方法 IMAC/MOAC C18/SCX/HILIC
Nat. Protocol, 2013, 8, 461-480.
17
磷酸化蛋白质组学分析策略
常用 定量 方法
绝对定量 MRM
Spectral counts
无标记定量
色谱峰面积
calcium calmodulin kinase IV (CaMKIV)
Annu. Rev. Biochem. 2011, 80:825–858.
钙调蛋白激酶4
12
Cross-talk with Ubiquitination
Mol. Cell, 2007, 28(5), 730-738.
13
Cross-talk with Ubiquitination and Acetylation p53 stabilization
Tauopathy (Tau蛋白病) Alzheimer’s disease
Trends Mol. Med., 2009, 15(3), 112-119.
10
mTOR磷酸化和细胞自噬
mTORC1复合体
Nat. Cell. Biol., 2011, 13(2), 132-141.
11
Cross-talk with O-GlcNAc
20
肝脏组织的磷酸化蛋白质组
J. Proteomics, 2014, 96, 253–262.
21
PTM-Biolabs
谢谢!
18
三、磷酸化蛋白质组学的应用
样品类型
某细胞 某细胞
项目类型
SILAC SILAC
蛋白质磷酸化定量稳定同位素_概述及解释说明

蛋白质磷酸化定量稳定同位素概述及解释说明1. 引言1.1 概述蛋白质磷酸化定量稳定同位素是一种现代生物学研究中常用的技术手段,其通过测量蛋白质中磷酸基团的数目和位置来探究细胞信号转导途径、调控网络以及相关疾病的发生机制。
随着分析技术和设备的不断进步,该技术在生物学领域取得了重要突破,并被广泛应用于临床诊断、药物研发以及信号传导途径等方面。
1.2 文章结构本文将首先介绍蛋白质磷酸化定量稳定同位素技术的基本概念和原理。
其次,我们将详细描述该技术在实验方法上的步骤以及标记蛋白质样品后的分析与检测方法。
然后,我们会探讨蛋白质磷酸化定量稳定同位素在生物学研究中应用所取得的成果与意义,包括对于疾病诊断与治疗方面的应用、信号传导途径和调控网络的解析与揭示,以及在药物研发中的应用。
最后,我们会对蛋白质磷酸化定量稳定同位素技术进行总结与评价,并探讨未来可能的发展方向和挑战。
1.3 目的本文旨在全面介绍蛋白质磷酸化定量稳定同位素技术及其应用,帮助读者更好地理解该技术的基本概念和原理,了解实验步骤与方法,并认识到其在生物学研究中的重要性和应用前景。
同时,我们也将提出该技术目前存在的局限性和未解之谜,为相关领域的进一步研究提供参考。
2. 蛋白质磷酸化定量稳定同位素的基本概念和原理2.1 蛋白质磷酸化的重要性蛋白质磷酸化是一种在细胞内广泛存在的后转录修饰方式,它参与了许多生物学过程,如细胞增殖、分化、凋亡、信号传导等。
蛋白质磷酸化能够改变蛋白质的结构和功能,从而调控细胞内各种生物过程的正常进行。
了解蛋白质磷酸化的状态和水平对于揭示细胞信号传递网络、发现潜在药物靶点以及诊断和治疗疾病具有重要意义。
2.2 定量稳定同位素技术的概述定量稳定同位素技术是一种精确测量样品中同位素丰度比例的方法。
该技术使用特定同位素标记样品中的目标分子,并利用高灵敏度仪器进行检测和分析。
通过测量样品中同位素标记与非标记分子之间的丰度差异,可以实现对目标分子的定量分析。
检测蛋白磷酸化的六种方法及其优缺点实验

检测蛋白磷酸化的六种方法及其优缺点实验生物在线蛋白激酶将磷酸基团从ATP转移到蛋白多肽底物上的丝氨酸、苏氨酸或酪氨酸残基,直接影响目标的活性和功能。
放射性研究表明,真核细胞中大约30%的蛋白经过磷酸化修饰。
这一关键的翻译后修饰调控了广泛的细胞活性,包括细胞周期、分化、代谢和神经元通讯。
此外,异常的磷酸化事件与许多疾病状态相关。
在评估磷酸化时,选择的方法可能会有所不同,这取决于多个因素,包括提出的具体问题以及特殊仪器或试剂的可用性。
如何检测蛋白磷酸化,本文简要介绍了几种常用方法,并提出了每种方法的优点和缺点。
激酶活性分析蛋白激酶通常是多个信号转导网络的常见组分,它们影响了众多负责生物反应的下游效应物,因此,评估某个特定激酶的活性可能为平行通路提供宝贵信息。
生物学样品中的激酶活性通常是在体外测定的,在ATP的存在下将免疫沉淀的激酶与外源底物共同孵育。
之后通过一些报告系统来评估特定激酶对底物的磷酸化,包括显色、放射性或荧光检测。
此外,R&D Systems还提供非放射性的Universal Kinase Activity Kit,能够定量任何可产生ADP的激酶的活性。
尽管我们能够获得有关特定激酶行为的信息,但评估细胞提取物中的酶活性仅仅揭开了信号通路的冰山一角。
我们对蛋白如何被修饰还知之甚少,且体外活性分析也不能说明内源磷酸酶活性的潜在作用。
磷酸化蛋白的直接检测可能为细胞如何应对外界刺激提供更详细的分析,因为磷酸化肽段的鉴定为蛋白的表达和功能状态提供信息。
磷酸化特异抗体的开发直接测定蛋白磷酸化的一种经典方法是将整个细胞与放射性标记的32P-磷酸盐共同孵育,获得细胞提取物,通过SDS-PAGE分离,并曝光在胶片上。
这种繁琐的方法需要多次几小时的孵育,且使用放射性同位素。
其他传统方法包括2D凝胶电泳,这种技术假定磷酸化会改变蛋白的迁移率和等电点。
鉴于这些方法很费力,磷酸化依赖抗体的开发受到研究人员的极大欢迎。
磷酸化TMT蛋白组学的具体步骤及方法
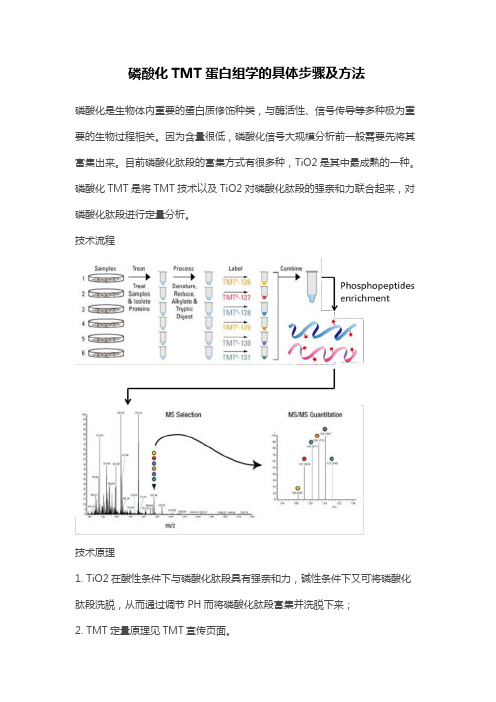
磷酸化TMT蛋白组学的具体步骤及方法
磷酸化是生物体内重要的蛋白质修饰种类,与酶活性、信号传导等多种极为重要的生物过程相关。
因为含量很低,磷酸化信号大规模分析前一般需要先将其富集出来。
目前磷酸化肽段的富集方式有很多种,TiO2是其中最成熟的一种。
磷酸化TMT是将TMT技术以及TiO2对磷酸化肽段的强亲和力联合起来,对磷酸化肽段进行定量分析。
技术流程
技术原理
1. TiO2在酸性条件下与磷酸化肽段具有强亲和力,碱性条件下又可将磷酸化肽段洗脱,从而通过调节PH而将磷酸化肽段富集并洗脱下来;
2. TMT定量原理见TMT宣传页面。
粒成生物技术流程。
酪氨酸磷酸化定量检测方法

酪氨酸磷酸化定量检测方法1.引言1.1 概述酪氨酸磷酸化作为一种常见的蛋白质修饰形式,在细胞信号传导、基因表达调控以及细胞周期调控等多个生命过程中起着重要的作用。
通过磷酸化酪氨酸残基,蛋白质的功能、稳定性以及相互作用能力得到明显的改变。
因此,研究和了解酪氨酸磷酸化的定量程度对于揭示细胞信号通路的调控机制以及疾病发生发展具有重要意义。
鉴于酪氨酸磷酸化的关键作用,科学家们不断努力开发各种定量检测方法,以便更准确地评估酪氨酸磷酸化水平。
这些方法可以分为定性和定量两种。
在定性检测方法中,常用的包括免疫印迹、免疫组织化学染色等技术,通过观察目标蛋白在特定条件下的表达情况来推断其磷酸化状态。
然而,这些方法对于不同样本之间的比较以及绝对定量上存在一定的局限性。
因此,研究人员提出了一系列的定量检测方法,如放射免疫沉淀(RIA)、酶联免疫吸附测定(ELISA)、质谱法(MS)等,这些方法能够量化酪氨酸磷酸化的水平,并且具有高灵敏度、高特异性、高通量等优点。
本文旨在综述当前酪氨酸磷酸化定量检测方法的原理、优缺点以及应用情况,以便读者更全面地了解这一重要的蛋白质修饰形式的检测技术。
通过深入的研究,我们可以为相关科研和临床应用提供参考,为进一步揭示磷酸化信号通路的调控机制以及促进相关疾病的诊断与治疗提供有力支持。
1.2 文章结构文章结构部分:本文主要包括引言、正文和结论三个部分。
引言部分(Chapter 1)将概述酪氨酸磷酸化定量检测的背景和意义,介绍文章的主要内容和结构,并明确研究的目的。
正文部分(Chapter 2)将详细讨论酪氨酸磷酸化的重要性和各种定量检测方法。
在2.1部分,将对酪氨酸磷酸化的重要性进行阐述,探讨其在细胞信号传导、蛋白质调控和疾病发生发展中的作用。
在2.2部分,将系统地介绍目前常用的酪氨酸磷酸化定量检测方法,包括质谱法、免疫印迹、荧光标记和定量PCR等。
每一种方法的原理、优缺点以及适用范围将得到详细的论述,为读者提供全面的了解和选择。
中科新生命 定量磷酸化蛋白质组学

中科新生命定量磷酸化蛋白质组学下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!探索中科新生命:定量磷酸化蛋白质组学导言在当今生命科学领域,蛋白质组学已经成为研究的热点之一。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
磷酸化蛋白质组学常用定量方法介绍蛋白质的磷酸化修饰是生物体内重要的共价修饰方式之一。
蛋白质的磷酸化和去磷酸化这一可逆过程几乎调节着包括细胞的增殖、发育、分化、信号转导、细胞凋亡、神经活动、肌肉收缩及肿瘤发生等过程在内的所有生命活动。
目前已知有许多人类疾病是由于某些异常的磷酸化修饰所引起,而有些磷酸化修饰却是某种疾病所导致的后果。
在哺乳动物细胞生命周期中,大约有1/3的蛋白质发生过磷酸化修饰;在脊椎动物基因组中,有5%的基因编码的蛋白质是参与磷酸化和去磷酸化过程的蛋白激酶和磷酸(酯)酶。
磷酸化修饰本身所具有的简单、灵活、可逆的特性以及磷酸基团的供体ATP的易得性,使得磷酸化修饰被真核细胞所选择接受而成为一种最普遍的调控手段。
鉴于磷酸化修饰在生命活动中所具有的重要意义,探索磷酸化修饰过程的奥秘及其对细胞功能的影响已成为众多生物化学家及蛋白组学家所关心的内容。
用蛋白质组学的理念和分析方法研究蛋白质磷酸化修饰,可以从整体上观察细胞或组织中磷酸化修饰的状态及其变化,这对以某一种或几种激酶及其产物为研究对象的经典分析方法是一个重要的补充,同时提供了一个全新的研究视角,并由此派生出磷酸化蛋白质组学(phosphoproteomics)这一新概念。
在蛋白质组学水平进行磷酸化蛋白质的分析定量研究已引起人们广泛关注,各种技术也相应地发展起来。
1. 磷酸化蛋白质和磷酸肽的富集1.1 免疫亲和色谱富集磷酸化蛋白质最简单的方法就是用识别磷酸化氨基酸残基的特异抗体进行免疫共沉淀,从复杂混合物中免疫沉淀出目标蛋白质。
目前,仅有酪氨酸磷酸化蛋白质的单克隆抗体可以用来进行有效的免疫共沉淀。
这是因为该抗体具有较强的亲和力和特异性,可以有效地免疫沉淀酪氨酸磷酸化的蛋白质。
Imam-Sghiouar等人从B-淋巴细胞中通过免疫沉淀获得酪氨酸磷酸化的蛋白质,然后再用二维电泳分离技术并结合质谱分析方法,鉴定出多个与斯科特综合症相关的酪氨酸磷酸化的蛋白质。
由于抗磷酸化丝氨酸和苏氨酸抗体的抗原决定簇较小,所以令抗原抗体的结合位点存在空间障碍,特异性较差。
因此,目前采用磷酸化丝氨酸/苏氨酸的抗体来富集磷酸化蛋白质的研究相对较少。
1.2 固相金属亲和色谱(IMAC)固相金属亲和色谱(immobilized metal affinity chromatography, IMAC)是一项较为成熟的磷酸化多肽分离富集技术。
它是利用磷酸基团与固相化的Fe3+、Ga2+和Cu2+等金属离子的高亲和力来富集磷酸肽。
目前发展的高通量磷酸化蛋白质组分析途径主要采用IMAC亲和色谱-反相液相色谱-串联质谱-数据库检索联用的方法。
Ficarro等人最先将IMAC 富集技术应用到细胞系大规模磷酸化蛋白质组学的分析中,并从啤酒酵母中鉴定出了216个磷酸化肽段和383个磷酸化位点。
该方法的优点在于对每个可溶磷酸肽,不管其长度如何,都有富集作用,而且IMAC柱洗脱下的样品可直接用于RP-HPLC分析,但有可能丢失一些与IMAC柱结合能力较弱的磷酸肽或某些因有多个磷酸化位点而难以洗脱的磷酸肽。
另外,那些富含酸性氨基酸的非磷酸化肽段与固相金属离子也有结合能力,也可能被富集。
为了解决IMAC柱的非特异性吸附的问题,可以采用对羧基进行酯化反应以及改变洗脱液的体系等方法来提高IMAC柱的特异性。
此外,自动化IMAC- capillary RP HPLC-ESI MS/MS技术平台的研究开发,使磷酸肽的富集、反相分离和质谱检测都能自动在线进行,为IMAC在蛋白质组学中的高通量应用开辟了道路。
1.3 TiO2色谱近期金属氧化物亲和富集技术得到了人们极大的关注。
2004年,Pinkse等人将二氧化钛(TiO2)技术引进磷酸化蛋白质组学领域,利用TiO2与磷酸肽上磷酸基团的亲和能力实现对磷酸肽的相对富集,并建立了通过TiO2作为预分离的2D-NanoLCESI-MS/MS 技术平台。
虽然该技术在对磷酸化肽段富集时的选择性和灵敏度方面都优于IMAC技术,但仍然存在非特异性吸附等问题。
后来,人们又利用纳米材料比表面积大的特点,对TiO2纳米级材料进行了开发研究,从而进一步增强了该技术对磷酸化肽段富集的巨大潜力。
但是,目前纳米级的TiO2富集磷酸化肽段技术还只能适于MALDI源的质谱仪,在ESI源质谱仪中的应用还有待进一步研究。
1.4 离子交换色谱离子交换色谱是利用物质的带电部分与具有相反电荷的离子交换剂的相互作用不同来达到分离纯化的目的。
Beausoleil等人发现大部分磷酸化肽在pH 2.7的溶液中所带净电荷是1+,而非磷酸化肽所带净电荷大部分为2+,因此,利用强阳离子交换(strong cattion exchange, SCE)技术就可以将磷酸化肽与非磷酸化肽分离开来。
磷酸化肽最先被洗脱下来,实现相对富集。
有人曾利用这一方法分离出了人HeLa细胞核蛋白的磷酸化肽。
但该法也有不足之处,因为有一些磷酸化肽所带电荷也是2+,甚至带有更多的电荷,这种情况下就会造成部分磷酸化肽的丢失。
1.5 亲/疏水作用色谱磷酸肽按照其疏水性不同而采用RP-HPLC进行分离。
RP-HPLC分离是减少混合肽中的复杂成分的一个十分重要的方法。
该方法重现性好、简单且不需要特别的设备。
极少量的磷酸化肽也可以在低流速下用毛细管柱分离。
需要注意的是,高亲水性的磷酸肽可能并未被吸附在柱上而直接流过色谱柱,而高疏水性的肽则会到最高梯度时才会被洗脱甚至可能不被洗脱,因此在样本中有些磷酸多肽无法被检测到。
再者,磷酸多肽吸附于金属表面上,如果使用金属注射器则可能发生显著的样品丢失。
尽管如此,RP-HPLC仍在磷酸多肽分析中得到广泛的应用,这是因为它容易与质谱联用,并且即使分析物没有同位素标记,也可以在样本混合物中发现和描述磷酸化肽。
1.6 磷酸基团的化学修饰近来,有人将肽或蛋白混合物置于碱性硫代二乙醇溶液中,通过β消除从磷酸化丝氨酸或苏氨酸中去掉磷酸基团H3PO4,形成的双键受到硫代二乙醇的作用,巯基取代磷酸基团,生物素与巯基相连,被标记的肽或蛋白质上样于固定有亲和素的层析柱,通过生物素与亲和素的高亲和力作用而达到磷酸化肽或蛋白质富集的目的。
这一方法的主要缺点在于它不能富集酪氨酸磷酸化的蛋白质和肽。
Zhou等人用另外一种方法修饰磷酸化肽,用碳二亚胺浓缩反应将半胱氨酸加在磷酸基团部分,修饰过的肽段以共价键与碘乙酰胺树脂结合,酸洗涤释放。
此方法既可用于富集磷酸化酪氨酸,可用于富集磷酸化丝氨酸和磷酸化苏氨酸,但需要多步化学反应和柱纯化过程。
化学修饰方法最大的缺点在于整个过程需要大量蛋白,不利于低丰度蛋白的检测。
2. 生物质谱分析磷酸化位点用于蛋白质鉴定的质谱依电离源的不同分为两种:基质辅助激光解吸/电离飞行时间质谱(matrix-assisted laser-desorption ionization time of flight mass spectrometry,MALDI-TOF-MS)和电喷雾电离质谱(electrosp ray ionization mass spectrometry, ESI-MS)。
前者利用基质吸收激光的能量使固相的多肽样品离子化,后者则在喷射过程中利用电场使液相的多肽样品离子化。
离子化的肽段进入质量分析器,因质量电荷比(m/z)差异发生分离,通过测量肽段离子的相关参数,可获得肽质量指纹图(peptide mass fingerprint, PMF)、肽序列标签(peptide sequence tag, PST)或部分氨基酸序列。
最后,应用适当的软件搜寻基因组和蛋白质组数据库,从而实现对蛋白质的定性鉴定及功能分析。
2.1 基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)MALDI-TOF-MS由于操作简单、敏感性强、价格低廉而广泛应用于蛋白质鉴定工作。
不过,将其应用于蛋白质磷酸化研究就遇到了问题。
磷酸化肽段带负电荷,而生物质谱常用正离子模式,导致离子化程度低;大量非磷酸化肽段的信号抑制了磷酸化肽段的信号并且在肽质量指纹图中缺少标志性离子。
因而,MALDI-TOF-MS通过与碱性磷酸酶的去磷酸化作用或与氢氟酸相结合来鉴定磷酸化肽段。
丝氨酸和苏氨酸磷酸化肽段会丢失磷酸基团(-98 u),而酪氨酸磷酸化肽段会去磷酸化(-80 u)。
MALDI-TOF的另一特征可以进行亚稳态裂解分析,即源后衰变(post source decay, PSD)。
前离子从离子源内解析电离过程中获得的内能在无场漂移区内飞行过程中通过发生断裂而释放其能量,这个过程称为源后衰变。
由此得到的碎片离子与前离子有相同的飞行速度但能量不同,在反射器内穿越的深度不一,可被反射器按其质量大小(即能量大小)从小到大依次反射,并到达检测器检测。
2.2 串联质谱(MS/MS)生物质谱的质量分析器有不同的选择,如三级四级杆、离子阱、飞行时间、傅立叶回旋共振等质量分析器。
将两个质谱仪的质量分析器串联,第一个质量分析器将预测组分与其它组分分离,第二个质量分析器对其进行扫描,产生该组分的质谱图即为串连质谱。
利用三级四级杆、四级杆-飞行时间、四级杆-离子阱进行前体离子扫描或中性丢失扫描,可鉴定磷酸化位点。
前体离子扫描是利用丝氨酸、苏氨酸和酪氨酸磷酸化肽段在碰撞诱导解离(CID)时会发生磷酸基团丢失的原理来实施检测的。
这些丢失的磷酸基团可以作为磷酸肽的“报告离子”:在阴离子模式下,第一个四级杆用来进行全谱扫描,CID在第二个四级杆中进行,第三个四级杆只选择通过质荷比为79的离子(即PO3-,m/z 79),用来鉴定磷酸化肽段。
一旦磷酸化肽段被鉴定出来后,质谱便转为阳离子扫描模式,进行肽段的测序。
前体离子扫描的另一种方式是直接进行阳离子扫描,immonium离子(m/z 216.04)是酪氨酸磷酸化肽段的特征性碎片离子。
而丝氨酸、苏氨酸磷酸化肽段涉及到对残基上的磷酸基团进行化学修饰。
在脱磷酸基团和发生β消除反应后,加入合成的巯基季铵进行加成反应,然后在低能量的CID下,产生特异的小分子碎片(m/z 122.06)。
中性丢失扫描在质谱检测磷酸化位点中也有重要地位。
在阳离子扫描模式下,丝氨酸、苏氨酸磷酸化肽段会失去H3PO4或HPO3,从而质量数会减少98u或80 u。
中性丢失扫描的优点是完全可以在阳离子模式下操作,而不像前体离子扫描那样要变换离子扫描方式,并且此方法在离子阱分析器中也有很好的利用。
因为质谱检测到的是质量电荷比而不是质量本身,所以中性丢失扫描时检测到的信号可能有几个数值。
例如,在失去H3PO4的情况下,若离子带单电荷,则检测到98 u,若带双电荷或三电荷,则会相应检测到49.0 u和32.7 u;在CID时发生β消除反应时,失去的有可能是H3PO4(98 u)也有可能是HPO3(80 u),从而使分析复杂化。
