第2章传质分离过程的热力学基础
化工分离工程第2章 单级平衡过程

FLGC
• 活度系数法通式
fˆi L
i
xi
fiL
i
xi
is
Pi s
expVi L
(P RT
Pi s
)
yiˆiv
P
i
xiis Pi s
expVi L
(P RT
Pi s
)
i 1,2,, N
低压至中压
expVi
L
(P RT
Pi
s
)
1
yiˆiv P
xi
s
ii
Pi
s
i 1,2,, N
(2-7)
11
FLGC
两种常用的汽液相平衡关系表达式:
(2-5)式和(2-6)式代入(2-4),得 ˆiV yi p ˆiL xi p (2-5)式和(2-7)式代入(2-4),得 ˆiV yi p i xi fiOL
12
FLGC
二、相平衡关系的表示方法:
1. 相图 yi
主要用来表示二元组分体系的相 平衡关系,包括恒压下的t-x图和 y-x图,以及恒温下的p-x图。
i
④判定 | 1 S y | 是否接近0,是,得到Tb=T和Ki;否,按以下方式调整
T。
⑤ S y 1,T偏大,调小; S y 1,T偏小,调大;调整后返回②。
FLGC
一、泡点温度的计算
1. Ki与组成无关: Ki f (T, P)
泡点方程:
f
T
C
Ki xi
1
0
i 1
假定T
已知P 得到Ki 调整T
3
FLGC
• 相平衡,是研究多相平衡体系的状态如何随温度、 压力、组成的变化的科学。
第二章 2.3 闪蒸

(0) T TB
TD TB
(2-61)
可采用Newton-Raphson法迭代 :
(k1) (k ) f (k) f (k)
(2-62)
f
(
(k)
)
C i1
(Ki 1)2
[1 (k) (Ki
zi 1)]2
Iteration equation
Specified variables: F, TF, PF, z1, z2,……, zC, TV,PV Steps:
(1) Solve
C
f ( )
(Ki 1)zi 0
i1 1 (Ki 1)
(2) V F
(3)
xi
zi
1 (Ki
1)
(4)
yi
Ki xi
Ki zi
部分冷凝 露点气体
过热气体
例1
• 进料流率为1000kmol/h的轻烃混合物,其 摩尔组成为:丙烯(1)30%,丙烷(2)35%, 异丁烷(3)35%。在900kPa和40℃下闪蒸问 题是否成立?
过热蒸气, 闪蒸不成立!
练习1
• 进料流率为1000kmol/h的轻烃混合物,其 摩尔组成为:丙烯(1)30%,丙烷(2)35%, 异丁烷(3)35%。在1000kPa和40℃下闪蒸 问题是否成立?
下次上课时交上节内容总结露点温度计算已知p结束输出ty调整t结束输出tx调整t本节内容闪蒸及部分冷凝概念闪蒸设计变量及分类等温闪蒸和部分冷凝绝热闪蒸和部分冷凝一闪蒸及部分冷凝概念闪蒸是连续单级蒸馏过程该过程使进料混合物部分气化或冷凝得到含易挥发组分角度的蒸汽和含难挥发组分较多的液体
泡点和露点计算
正丁烷 (1)
2.1
0.315
正戊烷 (2) 0.71
0.284
正己烷 (3) 0.25
0.1125
∑ 0.7115
传质分离过程
设温度为60℃,查P-T-K 图得K,将K值列于下表
组分 正丁烷 正戊烷 正己烷
∑
Ki
2.8
0.93
0.36
Kixi
0.42
0.372 0.162 0.954
yi
0.42
Ki f T, P, xi , yi
计算步骤:
L i
Pi S
iS
ˆ Vi P
exp ViL
P PiS RT
已知p,假设T 求出(或查出)各组分的相应参数
由已知的 x按i 理想状态求出Ki,初步算出 yi
求出 Ki,由已知的xi yi Ki xi
Ki xi 1 (通常取为0.005) 泡点T
如果 Ki xi 1 ; 升高T,重新计算。 Ki xi 1 ; 降低T,重新计算。
传质分离过程
开始 Y
输入P、y及有关参数
设T并令 1 作第一次迭代
计算PiS ,ViL ,iS ,ˆiV
调整T
计算 K i和xi 计算 xi
是否第一次迭代
圆整 xi
计算 i
Y
N
xi有无变化
N
xi 1 N
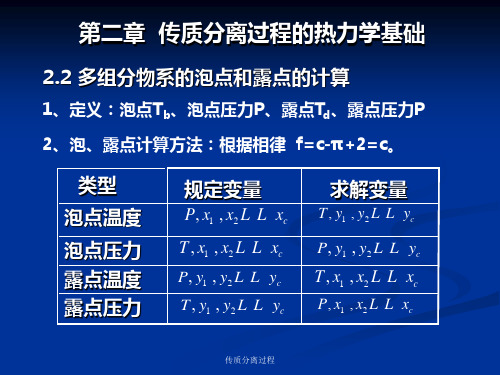
第二章 传质分离过程的热力学基础
2.2 多组分物系的泡点和露点的计算
1、定义:泡点Tb、泡点压力P、露点Td、露点压力P 2、泡、露点计算方法:根据相律 f=c-π+2=c。
类型 泡点温度
泡点压力 露点温度 露点压力
规定变量
P, x1 , x2 L L xc
分离模拟考题

模拟考试试题 (1)卷一、填空(每空2分,共20分)1、气液传质分离过程的热力学基础是( )。
如果所有相中的温度压力相等、每一组分的逸度也相等,则此时达到了 。
2、精馏塔计算中每块板温度变化是由于 改变,每块板上的温度利用 确定。
3、多组分精馏根据指定设计变量不同可分为 型计算和 型计算。
4、只在塔顶或塔釜出现的组分为 。
5、 超滤是以 为推动力,按( )选择分离溶液中所含的微粒和大分子的膜分离操作。
6、吸收操作在传质过程上的主要特征是 二、推导分析(20分)1. 由物料衡算,相平衡关系式推导图1单级分离基本关系式。
1(1)0(1)1ci i i i z K K ψ=-=-+∑ 式中: K i ——相平衡常数;ψ——气相分率(气体量/进料量)。
2. 一烃类混合物送入精馏装置进行分离,进料组成和相对挥发度a 值如下,现有A 、B 两种方案可供选择(见下图),你认为哪种方案合理?为什么?异丁烷 正丁烷 戊烷 异丁烷 正丁烷 戊烷摩尔% 25 30 45 相对挥发度:1.24 1.00 0.34三、简答(每题5分,共25分)1. 在萃取精馏中,萃取剂在何处加入?为何?2. 从热力学角度和工艺角度简述萃取精馏中萃取剂选择原则?3. 在吸收过程中,塔中每级汽、液流量为什么不能视为恒摩尔流?4. 试分析吸附质被吸附剂吸附一脱附的机理?5. 精馏过程全回流操作的特点?四、计算(1、2题10分,3题15分,共35分)1. 将含苯0.6(mol 分数)的苯(1)—甲苯(2)混合物在101.3kPa 下绝热闪蒸,若闪蒸温度为94℃,用计算结果说明该温度能否满足闪蒸要求? 已知:94℃时 P 10=152.56kPa P 20=61.59kPa2. 已知某乙烷塔,塔操作压力为28.8标准大气压,塔顶采用全凝器,并经分析得塔顶产品组成为:组 分 甲烷. 乙烷. 丙烷. 异丁烷. 总合组成x iD 1.48 88 10.16 0.36 100%(摩尔) 相平衡常数: 5.4 1.2 0.37 0.18 (20℃) 5.6 1.24 0.38 0.19 (22℃) 试计算塔顶温度。
传质分离过程_绪论

●采用生产装置的闭路循环技术;
●处理生产中的副产物和废物,使之减少和消除 对环境的危害; ●研究、开发和采用低物耗、低能耗、高效率的 “三废”治理技术。
闭路循环系统: 将过程所产生的废物最大限度地回收和循环 使用。
原 料 产品 1 废 物 1 废 物 1
2
2
2
排除
1—单元过程;2—处理
实现分离与再循环系统使废物最小化的方 法: ●废物直接再循环
超滤(UF):
目的:溶液脱大分子,大分子溶液脱小分子,大 分子分级。
进料
胶体大分子
溶剂、水
推动力:压力差(100~1000kPa)
传递机理:筛分
反渗透(RO):
目的:溶剂脱溶质,含小分子溶质溶液浓缩。
进料
溶质、盐 溶剂、水
推动力:压力差(1000~10000kPa) 传递机理:扩散模型
渗析(D):
先修课程:
物理化学、化工热力学、化工原理
同时进行的课程:
化工工艺学、化工过程分析与模拟
教材:
刘家祺 主编.传质分离过程.高等教育出版社,2005.
参考书:
邓修,吴俊生.化工分离工程. 科学出版社,2000.
陈洪纺 刘家祺.化工分离过程。化学工业出版社, 1995.
刘家祺 主编. 分离过程。化学工业出版社, 2002.
第7章 分离过程的节能优化与集成
第1章 绪论
1.1 概述 1.2 分离因子 1.3 分离过程的集成化 1.4 过程开发及方法 1.5 分离方法的选择
第1章 绪论
基本要求: 1)了解分离操作在化工生产中的重要性; 2)熟悉分离过程的分类; 3)掌握分离因子的概念及意义; 4)了解分离方法的选择;
大学化工分离工程教案

课程名称:化工分离工程授课班级:化学工程与工艺专业授课教师:[教师姓名]授课时间:[具体日期]课时安排:2课时教学目标:1. 让学生了解化工分离工程的基本概念、分类和重要性。
2. 掌握常见分离方法的原理、操作特点和设备。
3. 理解分离过程的热力学平衡、传质与扩散的基本理论。
4. 培养学生分析和解决实际化工分离工程问题的能力。
教学内容:一、绪论1. 化工分离工程的基本概念、分类和重要性2. 常见分离方法简介二、传质与分离过程的热力学基础1. 热力学平衡2. 传质与扩散的基本理论三、常见分离方法1. 吸收法- 原理、操作特点、设备- 气液吸收、气固吸收2. 蒸馏法- 原理、操作特点、设备- 简单蒸馏、精馏3. 萃取法- 原理、操作特点、设备- 液-液萃取、液-固萃取4. 膜分离法- 原理、操作特点、设备- 微滤、超滤、纳滤、反渗透教学过程:一、导入1. 提问:什么是化工分离工程?它在化学工业中的重要性是什么?2. 回答并总结化工分离工程的基本概念、分类和重要性。
二、讲授新课1. 传质与分离过程的热力学基础- 讲解热力学平衡、传质与扩散的基本理论,结合实例进行分析。
2. 常见分离方法- 吸收法、蒸馏法、萃取法、膜分离法- 分别介绍每种方法的原理、操作特点、设备,并举例说明。
三、课堂讨论1. 学生分组讨论:针对一个实际化工分离工程问题,分析并选择合适的分离方法。
2. 各组汇报讨论结果,教师点评并总结。
四、课堂小结1. 回顾本节课所学内容,强调重点知识。
2. 布置课后作业,巩固所学知识。
教学评价:1. 学生对化工分离工程的基本概念、分类和重要性的掌握程度。
2. 学生对常见分离方法的原理、操作特点和设备的理解程度。
3. 学生分析和解决实际化工分离工程问题的能力。
教学资源:1. 教材:《化工分离工程》2. 课件:化工分离工程相关课件3. 网络资源:化工分离工程相关网站、文献资料教学反思:本节课通过理论讲解、实例分析和课堂讨论,使学生掌握了化工分离工程的基本概念、分类和重要性,了解了常见分离方法的原理、操作特点和设备。
第二章 2.1相平衡基础20120925

课内作业
1. 相平衡准则有哪几条? 2. 相平衡常数定义。 3. 什么是分离因子?在精馏过程中,分离因子 有什么特点?
4.说明逸度、活度及逸度系数、活度系数的定 义及物理意义。
目录
• • • • 2.1 一些基本概念 2.2 状态方程法 2.3 活度系数法 2.4 相平衡常数计算方法选择
2.1 相平衡基本概念
ˆ bi lnZ 1 b ln Φi m vt b vt 2 aai RTvt
计算得到气相和液相逸度系数:
ˆ ΦV 0.8405
ˆ Φ L 1.68587
ˆ yi Φ L K V 2.0 ˆ xi Φ
2.2 状态方程法
yi---Concentration of any component in vapor xi---Concentration of any component in liquid
For the liquid-liquid case(eg. Extraction), the constant is referred to as the distribution coefficient (分配系数)or liquid-liquid equilibrium ratio(液液平衡常数).
相对挥发度对温度和压力变化不敏感,常视为常数,以简化计算。
For the liquid-liquid case, relative selectivity is
K Di ij K Dj
分离因子与1的偏离程度表示组分间分离的难易程度。
2.2 状态方程法(PVT equation-of-state model)
(2)不凝性组分(non- condensed component) p14
泡点和露点计算课件

1. Ki与组成无关:if Ki f(T,P)
泡点方程:
C
fTKixi 10
i1
计算过程:
已知p 设T
计算或查图 得Ki
计算
C
f (T ) Ki xi 1 i 1
调整T
f (T )
是
结束 输出T,y
否
例题2-3
• 例2-3
• 三种组分含量 相差不大,取 分子量居中的 正戊烷在该压 力下的沸点为 初值
?定义哪些变量
称为设计变量
一、气液平衡系统设计 变量
多组分泡点、露点 计算的类型
二、泡露点计算重点、难点
相平衡常数Ki
• 与系统T、p有关
• 对非理想体系,还与气液相组成x,y
有关
• 计算的重点、难点:Ki的计算
(1)列线图 法求K值
p12
部分轻烃 忽略组成变化 对K值的影响
T升高,K如何变化? P增加,K如何变化?
计算中,如何适当的调整试差的温度(或压力)?
本节内容
• 气液平衡系统的设计变量 • 泡露点计算的重点、难点 • 泡点温度计算 • 露点温度计算
2.2 多组分物系的泡点和露点计算 Bubble-point and Dew-point Calculation for Multicomponent Systems
Kx yii iˆpV iis pisexV piL(R pT pis)
(2)活度系数、逸度系数法计算K值
Liquid
Gas
Ideal solution Real solution
Ideal gas
Ki
Pi s P
Ki
i Pi s
P
Ideal solution Real gas
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
纯组分i在一定温度的饱 和蒸汽压下的逸度系数。
纯液体组分 i 在系统温度下的 摩尔体积,与压力无关。
L s f i L pis is exp V ( p p i ) / RT i
校正饱和蒸汽压下的蒸 汽对理想气体的偏离。
Poynting因子,校正压力 对饱和蒸汽压的偏离。
Henry’s law
不凝组分的逸度:
ˆ L * Hx f i i i
不对称型标准化方法 对于由一个溶质(不凝性组分)和一个溶剂(可凝性组分) 构成的两组分溶液,通常,
0L L f f x 1 , 1 i i i 溶剂的活度系数基准态定义为: i
ˆ iL yi Ki V ˆ xi i
以V和T为独立变量:
ˆ f ˆ ln i 1 ln i pyi RT
V
[(
p RT )T ,V ,n j ]dVt ln Z m ni Vt
以p和T为独立变量:
ˆ f 1 i ˆ ln i ln pyi RT
equilibrium ratio(气液平衡常数).
yi Ki xi
yi---Concentration of any component in vapor xi---Concentration of any component in liquid
For the liquid-liquid case(eg. Extraction), the constant is referred
.
Dalton’s law
pi yi p
Case 3---真实混合物
用逸度系数或活度系数计算逸度
For a real mixture, partial fugacity coefficients are defined by
ˆV ˆVy p f i i i
and
ˆL ˆ Lx p f i i i
ˆL f i i 0L ˆ x f
i i
Fugacity under standard state 通常取纯组分 i的液体在系统温 度和压力下的逸度。
ˆL x f ˆ 0L f i i i i
ˆV ˆVy p f i i i
0L
yi i f i Ki V ˆ p xi i
V L ˆ ˆ fi fi
Therefore,
ˆVy p ˆ Lx p i i i i
ˆ iL yi Ki V ˆ xi i
应用状态方程分别计算汽、液两相的逸度系数。
At vapor-liquid equilibrium,
V L ˆ ˆ fi fi
Activity coefficient of i species in a liquid phase is defined by:
(1)可凝性组分 For condensed component, the standard state is selected as the pure species at the same pressure and phase condition as the mixture. xi 1, i 1 ˆL 0L L f i f f i i i xi f i 0 L Lewis-Randall
混合物所形成的若干相保持物理平衡而共存的状态。 热力学:整个物系的自由能最小
动力学:相间表观传递速率为零 相平衡条件(准则): 各相的温度相等、压力相等,每个组分的化学位、逸度等。
T T T ......
P P P ......
i ˆ f i C exp RT
For the liquid-liquid case, relative selectivity is
K Di ij K Dj
selectivity coefficient (选择性系数) for Extraction
选择性系数与1的偏离程度表示组分间分离的难易程度。
2.1.1 汽液平衡 Vapor-liquid equilibrium
基准态逸度
活度系数等于1的状态
基准态逸度是与系统具有相同T、p和同一相态的纯i组分的逸度。
以p和T为独立变量:
ˆ f 1 i ˆ ln i ln pyi RT
用于计算纯组分的逸度:
Vt RT p0 [( ni )T , p,n j p ]dp
p
fi 1 ln p RT
p
xi(2)---Concentration of any component in raffinate
Ki 的计算:
Case 1---理想体系的吸收过程
亨利定律(Henry’s Law)
Case 2---理想体系的精馏过程
拉乌尔定律(Raoult’s Law)
Case 3---非理想体系
用气相逸度和液相活度系数来计算
At vapor-liquid equilibrium,
V L ˆ ˆ fi fi
Case 1—纯组分
fugacity,
逸度等于纯组分的逸度
For a pure component, the partial fugacity,
ˆ f i
, becomes the pure-component
fi .
to as the distribution coefficient ( 分 配 系 数 ) or liquid-liquid equilibrium ratio(液液平衡常数).
K xi(1)---Concentration of any component in extract
分离因子
Separation Factor
yi /y j
平衡分离过程,常采用分离因子表示平衡关系。
For the vapor-liquid case, separation facor is
Ki ij xi /x j K j
relative volatility(相对挥发度) for Distillation 相对挥发度对温度和压力变化不敏感,常视为常数,简化计算。
3. 分离因子:
Separation Factor
平衡常数
Equilibrium Ratio
For the vapor-liquid case ( eg Distillation and Absorption ) , the constant is referred to as the K-value ( K 值 ) or vapor-liquid
第二章 传质分离过程的热力学基础
?
极限程度 ---- 热力学 分离速率 ---- 动力学
本章主要知识点
1. 相平衡常数计算:状态方程法,活度系数法 2. 泡点、露点计算 (1)泡点计算:在一定p(或T)下,已知xi,确 定Tb(或pb)和yi。 (2)露点计算 3. 等温闪蒸和绝热闪蒸计算:给定物料的量与组成, 计算在一定p和T下闪蒸得到的汽相量与组成,以 及剩余的液相量与组成。
2.1 相平衡基础
常见的化工单元操作,如精馏、吸收、萃取、结晶等 都是有相变化的过程,其研究和设计基础是相平衡、物料 平衡和传递速率。相平衡在传质分离过程中占有重要地位, 实际系统与平衡状态的差距是相间传质过程的推动力。相 平衡是阐述混合物分离原理和计算传质推动力的基础数据。
相平衡关系
什么是相平衡?
Vt RT p0 [( ni )T , p,n j p ]dp
p
状态方程法的关键 适合于气相、液相和固相溶液
选择一个既适用于气相,又适用于液相的状态方程
Useful Equations of State
Name Ideal gas law Equation
p RT V
Equation constants and function
与实际体系相差较大
(2)用范德华方程计算
2 aai b b i ˆ ln Φ ln Z m 1 i Vt b Vt RTVt
RT 2 a ab Vt b Vt Vt 0 p p p
3
ˆ V 0.8405 Φ
R 2 Tc a 0.4278 pc
5
2
b 0.0867
RTc pc
p
RT a V b V (V b)
0.5 1 (1 Tr0.5 )(0.480 1.574 0.176 2 )
R 2 Tc a 0.4278 pc
5 2
b 0.0867
RTc pc
逸度等于组分的分压
Case 2---理想气体混合物
For a pure ideal gas, fugacity is equal to the pressure, and for a component in an ideal gas mixture, the partial fugacity is equal to its partial pressure,
(2)不凝性组分 (non- condensed component)
ˆL f i
xi 0, i 1
*
i
xi f i
0L
fi
0L
ˆL f H lim i xi 0 x i
基准态下组分i的逸度是在系统T和p下估计的亨利系数。 当T、p 一定,xi → 0时:
ˆ L Hx f i i
0
RT Vi p dp
对气、液、固组分均适用
p fi L 1 pis RT RT ln dp s Vi dp 0 Vi pi p RT p p L s V (p p p s i i ) ln i ln s RT pi
