浙大材料电化学-电子转移步骤动力学
电化学第3章电化学极化讲解

电化学第3章电化学极化讲解第3章电化学极化(电荷转移步骤动⼒学)绪论中曾提到:⼀个电极反应是由若⼲个基本步骤形成的,⼀个反应⾄少有三个基本步骤:00R R ze O O s s →→+→-1) 反应粒⼦⾃溶液深处向电极表⾯的扩散——液相传质步骤。
2) 反应粒⼦在界⾯得失电⼦的过程——电化学步骤。
3) 产物⽣成新相,或向溶液深处扩散。
当有外电流通过电极时,?将偏离平衡值,我们就说此时发⽣了极化。
如果传质过程是最慢步骤,则?的偏离是由浓度极化引起的(此时0i s i C C ≠,e ?的计算严格说是⽤s i C 。
⽆浓度极化时0i s i C C =,?的改变是由s i C 的变化引起)。
这时电化学步骤是快步骤,平衡状态基本没有破坏。
因此反映这⼀步骤平衡特征的Nernst ⽅程仍能使⽤,但须⽤?代e ?,s i C 代0i C ,这属于下⼀章的研究内容。
如果传质等步骤是快步骤,⽽电化学步骤成为控制步骤,则这时?偏离e ?是由电化学极化引起的,也就是本章研究的内容。
实际上该过程常常是⽐较慢的,反应中电荷在界⾯有积累(数量渐增),?随之变化。
由此引起的?偏离就是电化学极化,这时Nernst ⽅程显然不适⽤了,这时?的改变将直接以所谓“动⼒学⽅式”来影响反应速度。
3.1 电极电位与电化学反应速度的关系电化学反应是⼀种特殊的氧化—还原反应(⼀个电极上既有氧化过程,⼜有还原过程)。
若⼀个电极上有净的氧化反应发⽣,⽽另⼀个电极上有净的还原反应发⽣,则在这两个电极所构成的电化学装置中将有电流通过,⽽这个电流刚好表征了反应速度的⼤⼩,)(nFv i v i =∝[故电化学中总是⽤i 表⽰v ,⼜i 为电信号,易测量,稳态下串联各步速度同,故浓差控制也⽤i 表⽰v 。
i 的单位为A/cm 2,zF 的单位为C/mol ,V 的单位为mol/(cm 2.s )]。
既然电极上有净的反应发⽣(反应不可逆了),说明电极发⽣了极化,?偏离了平衡值,偏离的程度⽤η表⽰,极化的⼤⼩与反应速度的⼤⼩有关,这⾥就来研究i ~?⼆者间的关系。
电化学理论与方法 第七章 电子转移动力学

j 0 越大,净反应速度也越大,电极反应越 当极化值相等时,
容易进行。
以同一净反应速度进行,则 j 0 越大,其可逆性越大 。
0 越大,所需要的极化值越小。 j
通过交换电流密度的大小,有助于判断电极反应的可逆性。
电极反应的可逆性:电极反应这种力图恢复平衡态的能力,或 者说去极化作用的能力称之为~。
交换电流密度值与电极体系动力学性质之间的关系
§6.2.3电极反应速度常数K
1、定义 电极电位为标准电极电位和反应粒子浓度为单位浓度时电 极反应的绝对速度,单位为cm/s,它本身排除了浓度变化的 影响。 K的表达式: F 0 F 0 F Kc R exp F KcO exp RT RT 已知
第6章 电子转移步骤动力学
内容
电极电位对电子转移步骤反应速度的影响 电子转移步骤的基本动力学参数 稳态电化学极化规律 多电子的电极反应 双电层结构对电化学反应速度的影响 电子转移步骤量子理论简介
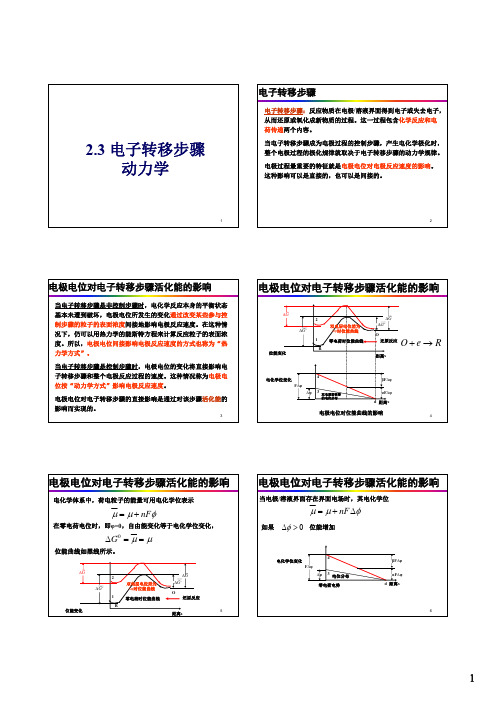
§6.1.1电极电位对电子转移步骤活化能的影响
电极电位对电子转移步骤的直接影响是通过对该 步骤活化能的影响实现的。 反应活化能:反应物越过反应能垒而活化所需的 能量。
(6.8)
式中 即
K 和 K 分别表示电位 0 处的反应速度常数,
用 j 和 j 分别表示电位 0 处的还原反应速度和氧 化反应速度,则
0
0
j F Kc O j F KcR
代入式(6.8)、式(6.9)得
0
0
(6.12)
(6.13)
F j j exp RT
F 平 F 平 F Kc R exp j F KcO exp RT RT
电子转移步骤动力学
F 平 i F KcO exp( ) RT F平 i F KcR exp( ) RT
16
15
交换电流密度
在平衡电位下,还原反应速度与氧化反应速度相等,用 i 0 表示
交换电流密度
F 平 F 平 交换电流密度的影响因素: i 0 F KcO exp( ) F KcR exp( ) RT RT
ic i 0 exp(
F
RT
c )
26
高过电位下的电化学极化规律
取对数:
高过电位下的电化学极化规律
电极反应以一定的速度进行时,电化学过电位的大小取决于电极 反应性质(i0、α、β体现)和反应温度T。
c
2.3RT 2.3RT log i 0 log ic F F
对于阳极极化公式:
还原反应
氧化反应
8
电极电位对电子转移步骤反应速度的影响
根据化学动力学,反应速度与反应活化能之间的关系为:
v kc exp(
对于电极反应
G ) RT
v为反应速度,c为反应粒子的浓度,∆G为反应活化能,k为指前因子。
电极电位对电子转移步骤反应速度的影响 * G 还原反应 i F kcO exp( ) RT * G 氧化反应 i F kcR exp( ) RT
交换电流密度
电极反应
Oe R
传递系数 交换电流密度 电极反应速度常数
当电极电位等于平衡电位时,电极上没有净反应发生,即没有 宏观的物质变化和外电流通过,但微观上仍有物质交换。电极 上的氧化反应和还原反应处于动态平衡
ii
在平衡电位下
传递系数:表示电极电位对还原反应活化能和氧化反应活化能 影响的程度,其数值决定于电极反应的性质
电子转移步骤动力学完整版

三种前提假设: (1) 溶液中参与反应的Ag+离子位于外亥姆荷茨平面 ,电极上参与反应的Ag+离子位于电极表面的晶格中,活 化态位于这二者之间的某个位置。 (2) 电极/溶液界面上不存在任何特性吸附,也不存在 除了离子双电层以外的其他相间电位。也就是说,我们只 考虑离子双电层及其电位差的影响。 (3)溶液总浓度足够大,以致于双电层几乎完全是紧 密层结构,即可认为双电层电位差完全分布在紧密层中, ψ1=0
第六章 电子转移步骤动力学
电子转移步骤(电化学反应步骤)系指反应物质在电极/溶液界 面得到电子或失去电子,从而还原或氧化成新物质的过程。 这一单元步骤包含了化学反应和电荷传递两个内容,是整个 电极过程的核心步骤。因此,研究电子转移步骤的动力学规 律有重要的意义。尤其当该步骤成为电极过程的控制步骤, 产生所谓电化学极化时,整个电极过程的极化规律就取决于 电子转移步骤的动力学规律。对该步骤的深入了解,有助于 人们控制这一类电极过程的反应速度和反应进行的方向。
对式取对数,整理,得电子转移步骤的基本动 力学公式:
对图6.3的解释
Βιβλιοθήκη 曲线1:纯化学反应活化能变化 曲线3:界面电场电压降 曲线4:有界面电场后的电功(nFE) 曲线2:曲线1与曲线4的加和(电化学位)。
另外:对曲线4,分成了α、β两部分,对于还 原反应,为αnFE ,对于氧化反应,为βnFE 。 α+β=1,传递系数。
问题: 有界面电场后,还原反应与氧化反应的活化能(自 由能)有什么变化?
电化学动力学的第一组方程 根据化学动力学,反应速度与反应活化能之 间的关系为:
阿累尼乌斯方程
斯万特·奥古斯特·阿累尼乌斯(Svante August Arrhenius) 瑞典物理化学家,1859年2月19日生于瑞乌普萨拉附近的维克城 堡。电离理论创立者。学术成果:解释溶液中的元素是如何被 电解分离的现象,研究过温度对化学反应速度的影响,得出著 名的阿累尼乌斯公式。还提出了等氢离子现象理论、分子活化 理论和盐的水解理论。对宇宙化学、天体物理学等也有研究。 获得1903年诺贝尔化学奖。
电子转移步骤的动力学

G G0 nF, G G0 nF
jc
nF zc
exp
G 0
nF
RT
c0O
jc0
exp
nF
RT
ja
nF za
exp
G0 nF
RT
c0R
ja0
exp
nF
RT
上式即为电极电位对电极反应绝对速度影响 的公式,也即电子交换步骤的基本方程式。
注:1.上述公式中电位零点的选取是任意的,无 具体物理含义;
2.绝对电流密度是无法直接测量到的,又称 内电流密度,所能测量的是内电流密度的差值, 净电流密度。
将绝对电流密度表达式写成对数形式有:
2.3RT
nF
lg
ja0
2.3RT
nF
lg
ja
2.3RT
nF
lg
jc0
2.3RT
G 0
nF (
平)(还原)
G
G 0
nF
(
平)(氧化)
G0,G0分别为 平时的还原与氧化
过程的活化能
其内电流表达式为 :
J
nFzc
exp
G0
nF ( RT
平)
c0O
J0
exp
nF( RT
平)
J
nFza
二.电极电位对电子转移步骤绝对反应速
度的影响
O+ne⇋R
根据绝对反应速度理论,上述反应在φ=0
第六章++++电子转移步骤动力学

en
t
为了使动力学参数具有更广泛的适用 性,必须寻找一个作用与J0相当,但与反应 物浓度无关的动力学参数,这样更有利于对 不同的电极反应进行比较,这个作用与J0相 当,又与反应物浓度无关的动力学参数就是 电极反应速度常数K。
PDF created with pdfFactory Pro trial version
从上表可以看出: J 0从J 0 =0,到J 0 →∞ 电极由完全不可逆到完全可逆;
J 0从J 0 =0,到J 0 →∞ 电位由可以任意改变到电极电位 几乎不变。 J 0 →∞,电极完全可逆、电极电位几乎不变,为理想非 极化电极。如参比电极。 J 0 =0,电极完全不可逆、电极电位可以任意改变,为理 想极化电极。
t
电极反应易进行 电极反应难进行
在一定的过电位 ∆ϕ 下:
i小
0
定义:电极过程恢复平衡态的能力或去极 化作用的能力为电极反应过程的可逆性。
PDF created with pdfFactory Pro trial version
U rg
i净小
i大
0
i净 大
根据J 0的大小可以判断电极的性质
U rg
当电极电位发生变化时,会引起自由能的变化,自由能 由两部分组成,一部分是化学因素引起的,另一部分是由电 场因素引起的,而电场作用引起的自由能变化中,只有一部 分用于改变某一反应方向的活化吉布斯自由能。 即电位对向某一方向进行的反应的(如还原反应或氧化 反应)活化能影响的分数就是α或β。
en
t
二.交换电流密度 物理意义:平衡电位下氧化反应和还原反 应的绝对速度。
β nFϕ 平 i = nF K c R exp RT
U rg
电化学过程

表6.4
31
表6.5
32
四、(标准)电极反应速度常数 K
i
0 0 nFKa cR
nF平 nF平 0 exp RT nFKc cO exp RT
i 0与反应物质浓度有关
ic
ia
0 nFKc cO
ln
0 Kc
ln cO
nF平
RT
ln
0 Ka
ln cR
nF平
RT
25
( )nF平 0 0 ln K c ln K a ln cO ln cR RT
1
nF平 K c0 cO ln 0 ln RT cR Ka
RT 平 = ln nF
稳态电化学极化与浓差极化共存时的动力学规律 非稳态电化学极化与浓差极化共存时的动力学规律
第7节 复杂电极过程
第8节 电子转移步骤量子理论简介
3
第1节 电极电位对电子转移步骤反应速度的影响
一、电极电位对电子转移步骤活化能的影响
阴极过程
Ox + ne
阳极过程
Red
当EC为 (电化学)
为非控制步骤,改变Cis, 间接影响, 热力学方式 为控制步骤,改变活化能, 直接影响, 4 动力学方式
极化值 平
F ic i exp RT
0
28
O R
F ic i exp RT F 0 ia i exp RT
0
F F i净 ic ia i0 exp = exp RT RT
W20 0 因K c k c exp RT
电化学反应中的电荷转移

电化学反应中的电荷转移电化学反应是指在电解质溶液中,由于电子的流动引起的物质转变过程。
在电化学反应中,电子的流动是由正极向负极方向的,而离子的流动则恰恰相反。
电化学反应中的电荷转移过程至关重要,是电化学反应中不可或缺的一部分。
在本文中,我们将对电化学反应中的电荷转移过程进行深入的分析和探讨。
1. 电化学反应的基本概念在电化学反应中,电流是电子流动的量度指标,而溶液中离子的流动则与电流和电压直接相关。
电化学反应的基本过程可以分为氧化反应和还原反应。
氧化反应是指物质失去电子,而还原反应则是指物质得到电子。
在电化学反应中,氧化反应和还原反应同时进行,因此也称作氧化还原反应(简称为“电化学反应”)。
这里我们要说到一个重要的概念“标准氧化还原电位”,简称“标准电位”。
标准电位是指在25℃、1.0M离子浓度下,将某一物质与氢气或氧气接触,使之既可以发生氧化反应也可以发生还原反应时,化合物参与氧化还原反应的两个半反应式所必需的电势差。
标准电位是电化学反应本质性质的体现,因此也常常用作表征反应性质的重要参考指标。
2. 电化学反应中的电荷转移在电化学反应中,电子和离子的流动是相互关联的。
电子是负电荷的带电粒子,带负电荷的物质失去电子而氧化,而带正电荷的物质得到电子而还原。
电子在电化学反应中向正极流动,正极受到电子的加持而减少,从而形成氧化反应。
在反应生成的还原物质中,少了一个电子,自然会从负极中寻找它所需要的电子,从而形成还原反应。
在电化学反应中,电流的通量为离子流动的通量的反向。
离子在电化学反应中向负极流动,因为他们具有正电荷。
正极吸引负电荷,当晶格中发生离子化时,所剩余的离子受到电场作用而向带电电极移动。
在电解质溶液中,正离子朝向阴极移动,即向带负电荷的阴极移动。
这一过程也就形成了还原反应中电子和离子的结合,从而形成新的还原物质。
在电化学反应中,电荷的转移可以是直接发生(如由铜片直接溶解成离子铜),也可以是有机会发生的(如银离子与铜片接触发生置换反应)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电极电位对电子转移步骤活化能的影响电极电位对电子转移步骤活化能的影响电极电位对电子转移步骤活化能的影响
电极电位对电子转移步骤活化能的影响
电极电位对电子转移步骤活化能的影响
G
∆
0G F αϕ∆+
同一个电极上发生的还原反应和氧化反应的绝对速度与电极电位交换电流密度交换电流密度
交换电流密度交换电流密度
交换电流密度交换电流密度
交换电流密度稳态电化学极化规律稳态电化学极化规律稳态电化学极化规律
稳态电化学极化规律
η
高过电位下的电化学极化规律
2.3 2.3
高过电位下的电化学极化规律
电极反应以一定的速度进行时,电化学过电位的大小取决于电极
混合控制时的动力学规律已知混合控制时的动力学规律
i i
RT RT
i i
RT RT i i
RT RT
i i RT RT。
