江苏溧阳市高一化学上学期 02物质的转化学案 苏教版
苏教版必修一物质的分类与转化教学案(教师版1.1.1)

专题一化学家眼中的物质世界第一单元丰富多彩的化学物质第1课时物质的分类与转化要记忆的内容1.物质的分类:人们往往按照物质的组成、状态、性能对物质进行分类,常见的分类依据有物质的组成、物质的状态、物质的导电性、物质的水溶性等。
2.酸性氧化物:能与碱反应生成盐和水的氧化物。
如CO2+2NaOH=Na2CO3+H2O3.碱性氧化物:能与酸反应生成盐和水的氧化物。
如Na2O+2HCl=2NaCl+H2O4.四种基本反应类型:化合反应、分解反应、置换反应、复分解反应。
要理解的规律1.依据物质的组成和性质特点,可以对物质进如2.单质、氧化物、酸、碱、盐之间有一定的反应关系,可以相互转化课前预习题1.将下列物质分类,说明你的分类依据:空气、乙醇、水、硫酸铵、铜、碘酒、碘、氧气、石墨、食盐水①依据______________,分为_________________;②依据______________,分为_________________;③依据______________,分为_________________。
答案①通常情况下物质的状态硫酸铵、铜、碘、石墨是固体,乙醇、水、碘酒、食盐水是液体,空气、氧气是气体②物质的组成和特点空气、碘酒、食盐水是混合物,铜、碘、氧气、石墨是单质,乙醇、水、硫酸铵是化合物③是否导电水、铜、石墨,食盐水能导电,其余不导电2.下列关于化学反应类型的叙述中,正确的是()A.凡是生成盐和水的反应都是酸与碱的中和反应B.复分解反应一定没有单质参加C.生成一种单质和一种化合物的反应一定是置换反应D.分解反应的生成物一定有单质【例6】下列转化不能一步实现的是() A.CuO―→Cu(OH)2B.CuSO4―→CuC.CaCO3―→CaOD.MgSO4―→MgCl2解析CuO难溶于水,所以不会一步转化为Cu(OH) Fe能从CuSO4溶液中置换出Cu,高温分解CaCO3得到CaO,MgSO4和BaCl2反应可以生成BaSO4 MgCl2,所以答案为B。
苏教高中化学必修一物质的分类与转化 PPT学习教案

实验室中 有下列 物质, 请根据 物质的 组成对 它们进行 分类。 钙(Ca) 、氯气 (Cl2)、 氯化钙( CaCl2 )溶液 、硫酸 (H2SO4)、 碳酸钙( CaCO3)、氧 化钙( CaO) 、
第11页/共29页
氯化钙( CaCl2)溶液: 钙(Ca) :
2氯气(Cl
单质 碱
化合物 单 质☆
氧化物 ☆
氧化物
碱
第19页/共29页
盐
碱 盐☆
二、物质 的转化 1、转化类型
单质→化合物 化合物→单质
酸→盐 碱→盐
酸性氧化物→酸 碱性氧化物→碱 氧化物→盐 盐→氧化物
第20页/共29页
无机化学反应的一般规律
第21页/共29页
整理与归纳 1.根据化学反应特征,填写表格:
):
氧化钙( CaO) :
2 4 硫酸(H
SO
):
3 碳酸钙(CaCO
):
金属单质
均匀混合物
非金属单质 氧化物 酸 盐
第12页/共29页
由于一 种分类 方法所 依据的 标准有 一定的 局限, 所能提 供的信 息较少 ,人们 在认识 事物时 需要采 用不同 的分类 方法, 如:交 叉分类 法等。
Na2CO3
2 4 2 4 Na
SO
+ B aCl
= BaSO
↓ + 2NaCl
2 3 2 2 Na
CO
+ 2 HCl = 2NaCl + H
O + CO
↑
2 4 2 4 2 H
SO
+ 2 NaOH = Na
SO
+ 2H
O
第24页/共29页
第二课时 物质的转化 高一化学苏教版(2019)必修第一册学案
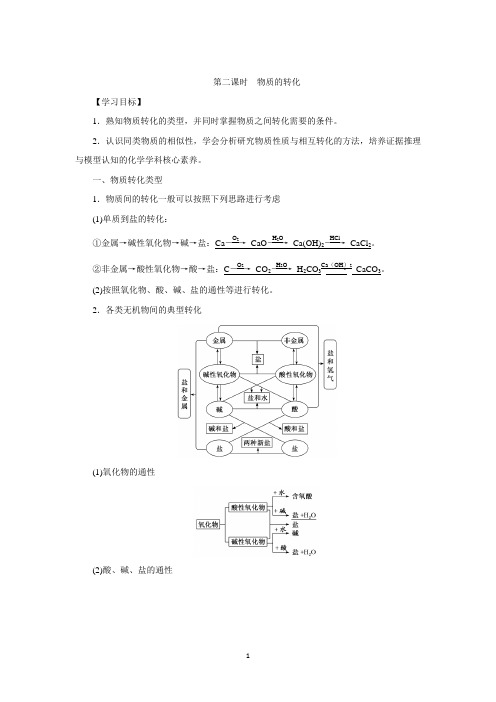
第二课时 物质的转化【学习目标】1.熟知物质转化的类型,并同时掌握物质之间转化需要的条件。
2.认识同类物质的相似性,学会分析研究物质性质与相互转化的方法,培养证据推理与模型认知的化学学科核心素养。
一、物质转化类型1.物质间的转化一般可以按照下列思路进行考虑(1)单质到盐的转化: ①金属→碱性氧化物→碱→盐:Ca ――→O 2 CaO ――→H 2O Ca(OH)2――→HClCaCl 2。
②非金属→酸性氧化物→酸→盐:C ――→O 2 CO 2――→H 2O H 2CO 3――→Ca (OH )2 CaCO 3。
(2)按照氧化物、酸、碱、盐的通性等进行转化。
2.各类无机物间的典型转化(1)氧化物的通性(2)酸、碱、盐的通性3.无机化合物转化为有机化合物1828年,德国化学家维勒用氰酸铵(NH 4CNO)合成了尿素,打破了无机化合物与有机化合物之间不可转化的观念,揭开了人工合成有机化合物的序幕。
【问题探讨】1.硫酸属于常见酸,可与哪些类别的物质反应?写出相应的化学方程式。
提示:(1)硫酸可与活泼金属反应,如Fe +H 2SO 4===FeSO 4+H 2↑;(2)硫酸与碱性氧化物反应,如CuO +H 2SO 4===CuSO 4+H 2O ;(3)硫酸与碱反应,如H 2SO 4+2NaOH===Na 2SO 4+2H 2O ;(4)硫酸与某些盐反应,如H 2SO 4+BaCl 2===2HCl +BaSO 4↓。
2.同类物质具有相似的性质,思考并讨论:酸、碱、盐的化学性质中涉及哪些反应类型?提示:(1)置换反应:酸与金属、盐与金属。
(2)复分解反应:碱性氧化物与酸、酸与碱、盐与酸、盐与碱、盐与盐等。
【对点练习】1.盐是一类常见的物质,下列物质通过一步反应可直接形成盐的是( )①金属单质 ②碱性氧化物 ③碱 ④非金属单质⑤酸性氧化物 ⑥酸A .①②③B .①④⑥C .②⑤⑥D .全部解析:选D 题中所列物质均可通过一步反应直接形成盐。
物质的分类与转化学案-苏教版(实用教案)

第课时物质的分类及转化一、学习目标、学会从不同角度对常见物质进行分类。
掌握化学物质的分类方法,认识比较和分类等科学方法对化学研究的作用、理解单质、氧化物、酸、碱、盐等物质之间的相互转化关系。
初步了解通过化学反应实现物质相互转化的重要意义。
、从化合价升降的角度,初步认识氧化还原反应。
二、重点、难点:氧化物、酸性氧化物、碱性氧化物的概念理解和应用,物质的转化途径、物质的转化关系、氧化还原反应的认识。
三、课堂互动教材:交流及讨论:空气、乙醇()、水、硫酸铵、铜、碘酒、碘()、氧气、石墨、食盐水你会按照什么样的标准进行分类。
【学法指导】一物质的分类、物质的分类依据物质的分类具有多样化的特点,例如,根据,将物质分为气态物质、液态物质和固态物质;根据物质的导电性,将物质分为、和;据物质,将物质分为可溶性物质、微溶性物质和难溶性物质。
同一类物质往往在组成、状态、性能等方面具有一定的性。
、物质的分类方法()按组成结构分类(完成空格部分)()按物质的性质分类①氧化物:由两种元素组成,其中一种是元素的化合物。
②碱性氧化物:.概念:能及酸反应生成的氧化物。
.举例:写出及硫酸反应的化学方程式:③酸性氧化物:.概念:能及碱反应生成的氧化物。
.举例:写出及足量溶液反应的化学方程式:()其它分类方法二物质的转化1、 常见物质之间的转化类型2、 钙及其化合物之间的相互转化写出上述反应的化学方程式,并指出有元素化合价发生改变的反应。
三 化学反应的几种类型、以反应物和生成物的类别、反应前后物质的种类为分类依据可以把化学反应分为 、、、四种基本反应类型。
2、 根据化学反应中元素的化合价是否发生变化 ()氧化还原反应:元素化合价的反应 ()非氧化还原反应:元素化合价的反应 、氧化还原反应和四大反应类型的关系:四 物质间相互转化的条件、置换反应的条件:、复分解反应发生需要的条件: 举例: 【课堂训练】、今有下列三组物质,每组中都有一种物质跟其他三种属于不同的种类。
苏教版高中化学必修第一册专题1第1单元基础课时2物质的转化化学反应的分类学案

基础课时2 物质的转化 化学反应的分类1.能通过观察和分析,辨识物质形态、物质性质及其变化的宏观现象,培养宏观辨识与微观探析的化学核心素养。
2.能从不同视角对物质及其变化进行分类,培养证据推理与模型认知的化学核心素养。
一、物质的转化1.以碳、钙两种元素的单质和化合物为例,按要求完成物质间的转化。
物质的转化反应 实例(化学方程式) 单质→化合物C +O 2=====点燃CO 2或2Ca +O 2===2CaO 碱性氧化物→碱CaO +H 2O===Ca(OH)2 酸性氧化物→酸CO 2+H 2O===H 2CO 3 酸→盐 Ca(OH)2+2HCl===CaCl 2+2H 2O2.物质转化中的常见反应类型(1)酸、碱、盐在溶液中发生复分解反应,通常有沉淀析出、气体放出或有水等物质生成。
例如:MgCl 2+2NaOH===Mg(OH)2↓+2NaCl 。
(2)酸性氧化物与碱性氧化物可以发生化合反应,生成盐类物质。
例如:CaO +CO 2===CaCO 3。
(3)排在金属活动性顺序表中氢前面的金属与稀盐酸(或稀硫酸)发生置换反应,生成氢气和盐。
例如:Mg +2HCl===MgCl 2+H 2↑。
3.无机化合物转化为有机化合物1828年,德国化学家维勒通过蒸发无机化合物氰酸铵(NH 4CNO)水溶液得到了尿素[CO(NH 2)2]。
尿素的合成揭开了人工合成有机化合物的序幕。
(正确的打“√”,错误的打“×”)(1)同类别物质之间的转化有相似性。
( )(2)通常条件下,碱性氧化物都可以与H 2O 反应生成相应的碱。
( )(3)化学反应中一定有物质的转化,物质的转化过程中一定发生化学反应。
( ) (4)有机物只能在自然界中合成,无法通过人工合成。
( )[答案] (1)√ (2)× (3)√ (4)×二、化学反应的分类1.基本反应类型 根据反应物、生成物的类别和数量,将化学反应分为化合反应、分解反应、置换反应和复分解反应等基本类型。
高中化学1.2.1《物质的分类及转化》导学案苏教版必修1

1物质的分类及转化【知识梳理】: 一、物质的分类世界上的物质极其繁多,为了简明有序地掌握其性质及变化规律,常采用的方法之一是进行 ①分类研究。
人们常根据物质的②组成、③状态、④性能等对物质进行分类。
1.根据物质的状态:物质分为⑤气态(g)、⑥液态(l)、⑦固态(s)。
2.根据物质的导电性:物质分为⑧导体、⑨半导体、⑩绝缘体。
3.可溶物 微溶物 难溶物 4.物质可以分为混合物和纯净物,纯净物可以分为单质和化合物,化合物可以分为无机化合物和有机化合物,无机化合物可分为 酸、 碱、 盐和氧化物。
二、物质间的转化1.化学反应的分类A+B AB 化合反应 AB A+B 分解反应 AB+C 置换反应 AB+CD 复分解反应 另外根据在反应前后物质所含元素的化合价是否发生改变,将化学反应分为氧化还原反应和非氧化还原反应。
2.酸性氧化物:能与 碱反应只生成盐和水的氧化物。
碱性氧化物:能与 酸反应只生成盐和水的氧化物。
【基础知识交流】1.中学所学习的化学知识中,常见的易溶物、微溶物、难溶物有哪些?2.纯净物具有相同的组成元素,具有相同组成元素的物质都是纯净物吗?3.氧化物是否只能分为酸性氧化物和碱性氧化物两种?4.有同学认为“氧化还原反应就是有氧元素参与的反应”,你认为这句话对吗? 【问题探究】 探究1:物质的分类B CH3COOH KHSO4SO2C NaHSO4NaHCO3SiO2D H3PO4K2CO3CO2已知Na2O2与盐酸反应生成氯化钠、水和氧气,则Na2O2是否为碱性氧化物?探究2:基本反应类型与氧化还原反应的关系已知有下列反应: ①SO3+H2O H2SO4②Cu(OH)2CuO+H2O③Fe2O3+3CO2Fe+3CO2④NaCl+AgNO3AgCl↓+NaNO3⑤Fe+2HCl FeCl2+H2↑(1)上述反应中属于氧化还原反应的是。
(2)指出上述反应各属于哪种基本反应类型?1.四大基本反应类型中哪些一定属于氧化还原反应?哪些一定不属于氧化还原反应?2.写出一个既属于氧化还原反应又属于化合反应的化学方程式。
[原创]苏教版必修1专题1第一单元第一节物质的转化学案
物质的转化班级_______姓名_________学号_______[学习目标]1、理解单质、氧化物、酸、碱、盐等物质之间的相互转化关系。
2、从化合价升降的角度初步认识氧化还原反应。
[课前检测]1、请根据物质的组成、性质对下列物质进行分类。
NH4Cl、CO(NH2)2、NaH2PO4、SiO2、BaO、H3PO4、液态氧、NH4CNO、液氨、盐酸、CuSO4·5H2O2、⑴SO3属于酸性氧化物,请写出SO3与足量KOH溶液反应的化学方程式⑵Na2O属于碱性氧化物,请写出Na2O与硫酸反应的化学方程式;一、物质的转化[情景设计]在初中阶段我们已经学习了一些物质转化的知识。
如下表:这些物质间如何转化?并[能生成氯化钙。
请你尽可能多地写出图中物质之间转化的方程式,并将你的结果与同学交流讨论。
CaCO3CaO Ca(OH)2Ca CaCl2[知识归纳]化学反应的四种基本类型反应类型实例A +B == ABAB == A + BAB + C == A + CBAB + CD == AD + CB[概念形成]分类并没有唯一性,它会根据分类的标准不同而不同。
根据反应前后元素化合价是否发生改变可分为氧化还原反应和非氧化还原反应。
氧化还原反应:凡是的反应都是氧化还原反应。
[典型例题]①H2SO4 + CuO = H2O + CuSO4②H2 + CuO H2O + Cu③CO + CuO Cu + CO2④Fe + CuSO4 == Cu + FeSO4⑤Na2O + H2O = 2NaOH ⑥Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑⑦2KClO32KCl + 3O2⑧SiO2 + 2NaOH = Na2SiO3 + H2O在上述反应中,属于化合反应的有(填编号,下同),属于分解反应的有,属于复分解反应的有,属于置换反应的有,属于氧化还原反应的有。
[知识归纳]四类基本反应与氧化还原反应的关系[知识拓展]1、氧化剂:2、还原剂:3、氧化产物:4、还原产物:[情景设计]判断下面溶液中的化学反应能否发生①Cu + 2AgNO3 = 2Ag + Cu(NO3)2②Fe + 2HCl = H2↑ + FeCl2③K2SO4 + BaCl2 = BaSO4↓ + 2KCl ④Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑⑤Cl2 + Na2S = 2NaCl + S ⑥CO2通入 BaCl2溶液中[知识归纳]复分解反应和置换反应的条件[当堂训练]1、下面物质混合能否反应?若能请写出化学反应方程式A.硝酸银溶液和氯化钠溶液混合B.氯化钡溶液和稀硫酸混合C.二氧化硫通入氯化钙溶液中D.氯化银与碳酸钾溶液混合2、下列物质间的转化能一步实现的是()A.Na2CO3→ NaOHB.CaCO3→ Ca(OH)2C.NaNO3→ NaClD.FeSO4→ CuSO43、用化学方程式表示制取MgCl2的可能方法。
高中化学2.1《物质的分类与转化2》教案(苏教版必修1)
[讨论]基本反应类型与氧化还原反应的关系。
(四)课堂总结
这一课我们学习了物质的分类和物质之间的相互转化,根据不同的分类标准,物质可以分成很多种类别,物质之间的转化可以分成四种基本反应类型,也可以根据化合价是否变化将化学反应分为氧化还原反应和非氧化还原反应。
[整理与归纳]根据化学反应的特征(如参加反应的物质种类或种数),完成表1-4的填充。
反应类型
实例
A+B=AB
AB=A+B
AB+C=A+CB
AB+CD=AD+CB
[过渡]写出一氧化碳还原氧化铁的方程式,它属于那种基本反应类型呢?用现有的分类方法我们无法划分,即四种基本反应类型不能包括所有反应。就像不同种物质间有多种分类方法一样,化学反应也还有其他的分类依据与分类方法。
重点
分析
具体细化内容和确定依据
学会从组成和性质的角度对常见物质进行分类
能说出氧化还原反应的概念。
难点
分析
科学分类既是化学家研究物质的方法,同时也是学生学习化学的方法,为以后学习化学提供方法指导。
氧化还原反应是高中化学的核心概念。
主要教学方法
讲授法;谈话法
教
学
过
程
(一)新课导入
(二)新课教学
[导入复习引入然后再做相应的题目
5、掌握四种基本反应类型,能根据化合价的变化判断是否氧化还原反应。认识基本反应类型与氧化还原反应之间的关系。
过程与方法
1、通过阅读教材目录,说出教材的知识体系。
苏教版高中化学必修一《物质的分类与转化》【创新学案】2
第一单元丰富多彩的化学物质第一课时物质的分类与转化[学习目标]1、掌握化学物质的分类方法,认识比较和分类等科学方法对化学研究的作用;2、学会从不同角度对常见物质进行分类。
3、理解单质、氧化物、酸、碱、盐等物质之间的相互转化关系。
4、从化合价升降的角度初步认识氧化还原反应。
[重难点]1、学会从不同角度对常见物质进行分类。
2、理解单质、氧化物、酸、碱、盐等物质之间的相互转化关系。
3、从化合价升降的角度初步认识氧化还原反应[课前检测]在我们的日常生活中,常会接触到下列物质:空气乙醇硫酸铵铜碘酒碘氢气石墨食盐水请你将上述物质进行分类,并说明分类的依据。
将你的分类结果与同学交流讨论。
1、根据通常的存在状态分类2、根据导电性能分类3、根据所含物质的种类分类4、根据组成纯净物是否为同种元素5、将物质分为无机物和有机物在上图中氧化物、酸、碱、盐等各类无机化合物我们能否进行更细致的划分?[学习过程]一、物质的分类[情景设计1]试写出下列化学反应方程式:CuO+H2SO4------ MgO+HCl------SO2+Ca(OH)2------- CO2+NaOH------[概念形成]1、碱性氧化物:能与________反应生成_______和_______的____________。
2、酸性氧化物: 能与_______反应生成_________和_____的____________。
[友情提示]金属氧化物、非金属氧化物与碱性氧化物、酸性氧化物有什么关系?[知识拓展]1、两性氧化物:。
2、不成盐氧化物:如。
3、酸酐:含氧酸失水后的生成物,如H2CO3的酸酐是CO2[情景设计2] HCl、H2SO4、H3PO4、H2S、HF、HNO3能否进一步分类呢?[归纳][情景设计3] NaOH、Ca(OH)2、Fe(OH)3、Ba(OH)2能否进一步分类呢?[归纳][情景设计4]NaCl、NaHCO3、Cu2(OH)2CO3、KAl(SO4)2能否进一步分类呢?[归纳][典型例题]下列每组物质中都有一种物质与其它物质在分类方法上不同,试分析每组中物质的组成规律,将这种不同于其它物质的物质找出来,用横线划出。
苏教版高中化学物质的转化教案
苏教版高中化学物质的转化教案【教学目标】1.回顾并加强初中四大基本反应类型。
2.掌握四大基本反应类型与氧化还原反应间的关系。
【教学重点】四大基本反应类型与氧化还原反应间的关系。
【教学方法】讨论、讲授【教学过程设计】【回顾复习】(物质的分类……)上节课我们学习了物质的分类,知道,从物质的组成及分类,我们可以把纯净物分为单质和化合物,化合物还可以继续再分……那么,这些物质间是如何来的呢?他们之间能不能进行转化呢?如果能,又是如何进行转化?今天,我们就一起来学习有关物质的转化。
【板书】物质的转化【回顾】在我们初中三,我们学习了,H2和O2点燃可以反应生成H2O,也就是说,单质可以转化成化合物。
当然其他的也可以,比如,我们一起看一下下面物质间的转化……按照物质的类型研究物质的转化(教师解释说明并举例)【老师引导】而这些反应,很多都是我们初中学习过的。
在我们初中学习过四大基本反应类型,请问是哪四大基本反应类型呢?【学生回答】化合反应、分解反应、置换反应、复分解反应。
反应类型A+B=AB化合反应AB=A+B分解反应AB+C=A+C B置换反应AB+CD=A D+CB复分解反应注:概念:化合反应:由两种或两种以上的物质反应生成一种物质的反应。
如:分解反应:由一种物质反应生成两种或两种以上的物质的反应。
如:置换反应:单质与化合物反应生成另外的单质和化合物的化学反应。
如:复分解反应:由两种化合物互相交换成分,生成另外两种化合物的反如:(还有常见的中和反应?)(2)复分解反应和置换反应发生的条件①在水溶液中,发生复分解反应,至少要具备下列条件之一:生成沉淀(包括微溶物);生成气体;生成水(严格地说是生成难电离的物质)。
②在水溶液中,一种金属与另一种可溶性金属的盐溶液发生置换反应具备的条件是:金属活动性强的金属置换金属活动性弱的金属。
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au【老师】下面我们完成下面些练习。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课题2 物质的转化
〔学习目标〕
1、了解通过化学反应实现物质间相互转化的意义;
2、掌握和判断氧化还原反应和非氧化还原反应;
3、了解氧化还原反应、非氧化还原反应与四种基本反应类型之间的联系。
〔思考讨论〕
1、电解熔融氯化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙。
请完成下列化学方程式。
①
②
③
④
⑤
⑥
⑦
思考:(1)按基本反应类型对上述化学反应进行分类。
(2)观察上述化学反应,指出有元素化合价发生改变的反应。
2、完成书P 6 “交流与讨论”2、3
3、完成书P 6 “整理与与归纳”1、2
归纳小结:
〔例题分析〕下列反应既是化合反应,又是氧化还原反应的是 ( )
A 、CaO + H 2O == Ca (OH )2
B 、CO 2 + Ca (OH )2 == CaCO 3↓+ H 2O
C 、C + H 2O CO + H 2
D 、2CO + O 2 2CO 2
高温 === 点燃 ===。
