氮在自然界中的存在方式及绪论..共86页
氮的循环

2NO + O2 =2NO 2
NO作还原剂,表现还原性 作还原剂, 作还原剂
该性质可用于检验NO气体。 气体。 该性质可用于检验 气体
⑶根据视频2,你认为二氧化氮溶于水是否发生了化学反应? 根据视频 ,你认为二氧化氮溶于水是否发生了化学反应? 若是,请推测其可能的产物。 若是,请推测其可能的产物。
高温
ห้องสมุดไป่ตู้
+2 -2
-2
白色晶体, 4.铵盐 铵盐(NH4+) 白色晶体,易溶于水 铵盐 化学性质: 化学性质:
①某些铵盐受热易分解: 某些铵盐受热易分解: NH4Cl = NH3 + HCl NH4HCO3 = NH3 + H2O + CO2 铵盐与碱反应: ②铵盐与碱反应: NH4 +
+
OH-
= NH3·H2O = NH3 + H2O
NH3 + HCl = NH4Cl (白烟) 白烟) NH3 + HNO3 = NH4NO3 (白烟) 白烟) 2NH3 + H2SO4 = (NH4)2SO4
③NH3具有还原性
-3 0
4NH3 + 5O2催化剂 4NO + 6H2O = 2NH3+3CuO=3Cu+N2+3H2O 2NH3+3Cl2=N2+6HCl
化学性质: 化学性质:
无色液体, 5.硝酸(HNO3)无色液体,易挥发 硝酸( 硝酸
①不稳定性: 不稳定性: 4HNO3 = 4NO2+2H2O+O2
受热 见光
浓硝酸显黄色,硝酸在棕色瓶中保存。 浓硝酸显黄色,硝酸在棕色瓶中保存。 酸性:可与指示剂、碱性氧化物、 ②酸性:可与指示剂、碱性氧化物、碱、盐反应 强氧化性: ③强氧化性: Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2 + 2H2O 浓 3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO + 4H2O 稀 C + 4HNO3(浓) = CO2 + 4NO2 + 2H2O 浓 钝化: 钝化:铁、铝在冷的浓硫酸或浓硝酸中迅速形成致密的 氧化膜,难以发生其它反应。 氧化膜,难以发生其它反应。
自然界的氮循环(PPT课件)

发黄,严重时叶脉呈淡棕色,你认为应该施加下列哪
D 一种化肥(
)
A.氯化钾 B. 硫酸钾 C. 过磷酸钙 D. 尿素
9. 国外施行用汽水(碳酸饮料)浇灌农田,它的动机
是( C )
①对植物呼吸作用有利;②改良碱性土壤,调节PH值; ③有利于土壤的Ca2+、Mg2+被植物吸收;④加速光合 作用进行
A.只有②正确 B.只有③正确
熟后逐步转化为可溶于水、能 被作物吸收的物质,肥效较慢 但较长
便于工业生产,成本较高 便于就地取材,成本低廉
有些品种化肥如长期大量施 用能使土壤板结
能改良土壤结构
棉花你的叶子为什么变黄了? 因为我缺氮!
氮肥能促使作物的茎、叶生长茂盛,叶色浓绿。
缺磷肥,作物矮小瘦弱,分枝少,叶片暗绿色,叶缘、 叶柄出现紫色。
壤中较少,而植物摄取量又较多的是哪些元素?
N、P、K
氮肥
磷肥
Байду номын сангаас肥料
化学肥料
钾肥 复合肥料 微量元素肥料
农家肥料:如厩肥、人粪尿、绿肥等。
对比化学肥料和农家肥料的一些特点
化学肥料
农家肥料
所含营养元素种类少,
常含多种营养元素,营
但营养元素的含量大
养元素含量较少
一般易溶于水,易于被 作物吸收,肥效较快
一般较难溶于水,经腐
5、铵盐不能跟( K2CO3 ) 等碱性物质混合施用,
否则会 降低肥效。
CD 6. 下列化肥属于复合肥料的是: (
)
A. NH4Cl
B. NH4NO3
C. KH2PO4
D. KNO3
D 7. 下列化肥与熟石灰混合研磨,能闻到氨气的是( )
第1课时_自然界中氮的循环_氮气及

19
(2)若 NO2 过量,设过量的 NO2 体积为 y 3NO2+H2O===2HNO3+NO 3 y=6 mL 1 2 mL
则参加反应的 NO2 和 O2 总体积:12 mL-6 mL=6 mL V(O2)=6×(1/5)=1.2 mL, V(NO2)=12-1.2=10.8 mL。
答案 1.2 mL
解析
( C )
根据反应 3NO2+H2O===2HNO3+NO 中元素化
合价的变化可判断。 NO2 中氮元素化合价既有升高也有 降低。
11
5.下列关于氮气的性质的说法中,错误的是 A.通常情况下,氮气性质很不活泼 B.可在氧气中燃烧,生成一氧化氮 C.通常情况下,氮气在水中的溶解度很小
( B )
D.跟氢气在一定条件下发生反应时,氮气是氧化剂
20
NO2:8 mL,O2:4 mL 或 NO2:10.8 mL,O2:
11. 在元旦联欢会上, 某同学给同学们表演了一段魔术: 首先收集一集气瓶红棕色的气体,用玻璃片盖好, 然后向其中加入少量水,振荡后变为无色,然后轻 轻移动玻璃片使少量空气进入集气瓶,气体又变为 红棕色,振荡,又变为无色„„ (1)集气瓶中红棕色的气体是________。 (2)气体颜色变化的原因是___________________; 有关反应的化学方程式为___________________。 (3) 做 魔 术 时 操 作 者 要 注 意 什 么 问 题 ? 为 什 么 ? _______________________________________。
6Байду номын сангаас
思维拓展 2.“雷雨发庄稼”有什么科学道理?试用化学方程式 表示。
答案 放电 N2+O2=====2NO, 2NO+O2===2NO2, 3NO2+H2O===2HNO3+NO。
4.氮及其化合物

答案:B
练习
2. 将已充满NO2和NO混合气体的试管倒立于水槽 中,充分反应后,若水上升至试管1/4处,则原 混合气体中NO2和NO的体积比为
答案:3:5
四、有关NOx与O2、H2O反应的计算技巧
(2)NO、O2混合气体通入水中,发生反应 4NO+3O2+2H2O==4HNO3
正常雨水的PH值在5.6左右,酸雨的PH值小于5.6 由于溶解了二氧化碳的缘故,正常雨水的PH值在 5.6左右,然而,当空气中大量N和S的氧化物随雨水降 落下来就会使得雨水的PH值小于5.6而形成酸雨。
酸雨有哪些危害?
酸 雨 的 危 害
被 污 染 的 树 叶
乐 山 大 佛 遭 受 酸 雨 腐 蚀
答案:BC
四、有关NOx与O2、H2O反应的计算技巧
(4)NO、NO2、O2三种混合气体通入水中, 可先求NO2和水反应生成的NO的体积,然 后按照NO和O2的混合来进行计算
练习
1. 往盛有40mLNO、NO2混合气体的试管中 加入20mLO2,倒立于水槽中,完全反应剩 余气体5 mL,求NO和NO2的体积
=4:3
无气体剩余,水充满容器
3 V O 2 V 7
V(NO):V(O2) >4:3 有NO剩余 <4:3 有O2剩余
4 VNO V 7
练习
1. 向盛有15 mLNO气体倒立于水槽的试管中 通入O2,充分反应后,试管中还剩余气体 3mL。请问通入的O2的体积可能是多少? 答案:9 mL或14.25 mL
由雷电作用是地球上氮盐天然合 成的主要途径, 氮盐是植物生长所 必须的大量营养盐,在工业时代之 前,农业不使用化肥,雷雨天降水 中的氮盐相当给农作物施了一次肥, 能促进其生长,所以说“雷雨发庄 稼”。
氮的知识点总结
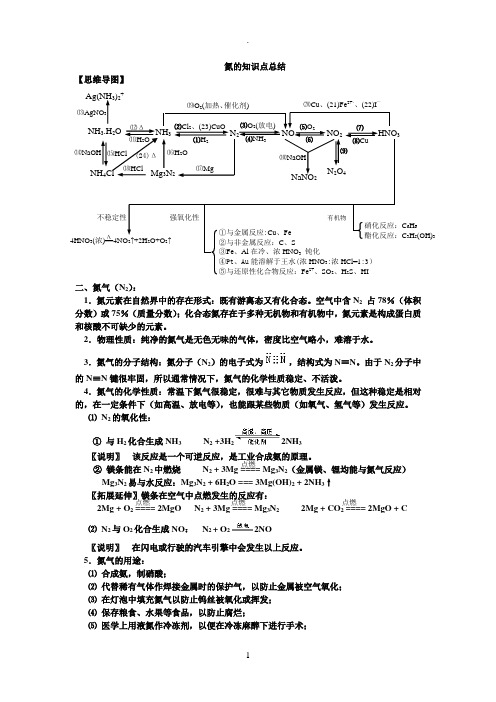
氮的知识点总结【思维导图】二、氮气(N 2):1.氮元素在自然界中的存在形式:既有游离态又有化合态。
空气中含N 2 占78%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素。
2.物理性质:纯净的氮气是无色无味的气体,密度比空气略小,难溶于水。
3.氮气的分子结构:氮分子(N 2)的电子式为,结构式为N ≡N 。
由于N 2分子中的N ≡N 键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼。
4.氮气的化学性质:常温下氮气很稳定,很难与其它物质发生反应,但这种稳定是相对的,在一定条件下(如高温、放电等),也能跟某些物质(如氧气、氢气等)发生反应。
⑴ N 2的氧化性:① 与H 2化合生成NH 3 N 2 +3H 22NH 3〖说明〗 该反应是一个可逆反应,是工业合成氨的原理。
② 镁条能在N 2中燃烧 N 2 + 3Mg ==== Mg 3N 2(金属镁、锂均能与氮气反应)Mg 3N 2易与水反应:Mg 3N 2 + 6H 2O === 3Mg(OH)2 + 2NH 3↑〖拓展延伸〗镁条在空气中点燃发生的反应有: 2Mg + O 2 ==== 2MgO N 2 + 3Mg ==== Mg 3N 2 2Mg + CO 2 ==== 2MgO + C ⑵ N 2与O 2化合生成NO : N 2 + O 22NO〖说明〗 在闪电或行驶的汽车引擎中会发生以上反应。
5.氮气的用途:⑴ 合成氨,制硝酸;⑵ 代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;⑶ 在灯泡中填充氮气以防止钨丝被氧化或挥发;⑷ 保存粮食、水果等食品,以防止腐烂;⑸ 医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;⒆O 2(加热、催化剂) 4HNO 3(浓)==4NO 2↑+2H 2O+O 2↑ 强氧化性 不稳定性 HNO 3 NaNO 2 ⑽NaOH ⒄Mg N 2O 4 ⒃H 2O NH 3.H 2O NH 3 N 2 NO NO 2 Ag(NH 3)2+ NH 4Cl ⒀AgNO 3 ⒁NaOH ⒂HCl ⑿Δ ⑾H 2O Mg 3N 2 ⑵Cl 2、(23)CuO ⑴H 2 ⑶O 2(放电) ⑷NH 3 ⑸O 2 ⑹ ⑺ ⑻Cu ⒅HCl ⒇Cu 、(21)Fe 2+、、(22)I — ①与金属反应:Cu 、Fe ②与非金属反应:C 、S ③Fe 、Al 在冷、浓HNO 3 钝化④Pt 、Au 能溶解于王水(浓HNO 3:浓HCl=1:3) ⑤与还原性化合物反应:Fe 2+、SO 2、H 2S 、HI 有机物 硝化反应:C 6H 6 酯化反应:C 3H 5(OH)3 ⑼ Δ (24)Δ 点燃 点燃 点燃 点燃⑹ 利用液氮制造低温环境,使某些超导材料获得超导性能。
高中化学 氮元素在自然界中的存在形式

氮气的性质和用途①合成氨,制硝酸;②代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;⑧在灯泡中填充氮气以防止钨丝被氧化或挥发;④保存粮食、水果等食品,以防止腐烂;⑤医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;⑥利用液氮制造低温环境,使某些超导材料获得超导性能。
氮元素在自然界中的存在形式既有游离态又有化合态。
空气中含N278%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素•氮气的物理性质和化学性质:(1)物理性质:纯净的氮气是无色气体,密度比空气略小,氮气在水中的溶解度很小,在常压下101kPa,-195.8℃氮气变成无色液体,-209.9℃变成雪花状固体。
氮气的分子结构:氮分子(N2)的电子式为,结构式为N≡N,由于N2分子中的N≡N 键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼。
(2)化学性质:氮分子化合价为0价,既可以升高也可以降低,说明氮气既有氧化性又有还原性。
①N2与H2化合生成NH3:说明:该反应是一个可逆反应,是工业合成氨的原理。
②N2与金属反应(Mg Ca Sr Ba)反应:③N2与O2化合生成NO:说明:在闪电或行驶的汽车引擎中会发生以上反应。
1.氮气(1)氮的固定使空气中游离态的氮转化为化合态氮的过程。
(2)氮气的性质①物理性质纯净的N2是一种无色无味的气体,难溶于水,在空气中约占总体积的4/5。
②化学性质通常情况下,N2化学性质很稳定,只在高温、放电、催化剂等条件下才能发生一些化学反应。
a.与H2反应:N2+3H2高温、高压催化剂2NH3。
b.与O2反应:N2+O2放电或高温2NO。
2.氮的氧化物氮有多种价态的氧化物:N2O、NO、N2O3、NO2、N2O4、N2O5等。
完成NO和NO2的比较表:特别提醒(1)氮的氧化物都是大气污染物。
(2)空气中NO2是造成光化学烟雾的主要因素。
(4)NO2:既有氧化性又有还原性,以氧化性为主。
氮在自然界中的存在形式
氮在自然界中的存在形式氮是一种重要的化学元素,在自然界中以多种形式存在。
以下是氮在自然界中的一些主要存在形式:1. **大气中的氮气**:氮气是大气中最主要的成分之一,约占大气的 78%。
氮气是一种无色、无味、无臭的气体,通常不活泼,不易与其他物质发生反应。
2. **硝酸盐和亚硝酸盐**:硝酸盐和亚硝酸盐是氮的化合物,常见于土壤、水体和生物体中。
它们可以通过氮的硝化和反硝化过程形成,对植物的生长和生态系统的氮循环起着重要作用。
3. **蛋白质和氨基酸**:氮是组成蛋白质和氨基酸的重要元素。
蛋白质是生物体的重要组成部分,存在于动物、植物和微生物体内。
氨基酸则是构成蛋白质的基本单位。
4. **氨**:氨是一种具有刺激性气味的气体,在自然界中可以通过生物过程或化学反应产生。
氨在一些生态系统中起着重要的作用,但高浓度的氨可能对环境和生物造成危害。
5. **氮化物**:氮可以与其他元素形成各种氮化物,如氯化铵、硝酸铵等。
这些氮化物在农业、化工和工业领域有广泛的应用。
6. **生物体中的核酸**:核酸,如 DNA 和 RNA,也含有氮。
氮在核酸中的存在对于遗传信息的传递和生物体的正常功能具有关键意义。
7. **土壤中的有机氮**:土壤中含有各种有机氮化合物,这些化合物是土壤肥力的重要指标之一。
它们可以来自动植物残体、排泄物和分解过程。
氮在自然界中的存在形式多样,并且在生态系统的氮循环中起着关键作用。
氮的转化和流动受到生物、化学和环境因素的影响,对维持生态平衡和生物的生存至关重要。
此外,人类活动,如农业施肥、工业生产和化石燃料燃烧等,也对氮在自然界中的分布和循环产生重要影响。
了解氮的存在形式有助于我们更好地理解生态系统和环境问题,并采取相应的措施来保护和管理氮资源。
高一化学 知识点总结 必修一 3.2 氮的循环
3.2 氮的循环一、自然界中氮的循环:1.氮的存在形态氮是地球上含量丰富的一种元素,以游离态的形式存在于大气中,以化合态的形式存在于动植物体、土壤和水体中。
2.氮在自然界中的循环➢在自然界中豆科植物根部的根瘤菌把空气中的氮气转变为硝酸盐等含氮的化合物。
➢在放电条件下,空气中少量的N2与O2化合生成NO,NO和O2迅速生成NO2并随水进入土壤和水体。
➢人们通过化学方法把空气中的N2转化为NH3,再根据需要进一步转化成各种含氮化合物(如HNO3、氮肥等)。
二、氮气:1.物理性质➢色味态:无色无味气体➢溶解性:难溶于水➢密度:比空气略小2.化学性质放电2NO➢与氧气:N2+O2=====➢与氢气:N2+3H22NH3➢与镁:N2+3Mg点燃Mg3N23.用途➢氮气是合成氨,制硝酸的重要原料➢氮气因为性质稳定,经常用作保护气,比如用于焊接金属➢液氮可用作冷冻剂,应用于医学领域4、氮的固定(1) 概念:使空气中游离态的氮转化为含氮化合物的过程(2) 分类:➢自然固氮:主要包括生物固氮和高能固氮➢人工固氮:主要包括合成氨固氮和仿生固氮三、氮的氧化物:12. 注意事项:➢酸酐的问题:N2O3是亚硝酸的酸酐,N2O5是硝酸的酸酐➢颜色的问题:只有NO2是红棕色气体,其余均为无色气体➢污染的问题:氮的氧化物都具有毒性,而且都是大气污染物,3. NO和NO2(1)物理性质➢色味态:NO是无色无味气体,NO2是红棕色有刺激性气味的气体➢溶解性:NO难溶于水,NO2易溶于水➢密度:NO比空气略小,NO2比空气大(2) 相互转换➢NO→NO2:2NO+O2====2NO2➢NO2→NO:3NO2+ H2O====2HNO3 + NO(3)影响➢NO:是传递神经信息的“信使分子”,但容易与血红蛋白结合而使人体缺氧。
➢NO2:能损坏多种织物和尼龙制品,对金属和非金属材料有腐蚀作用。
四、氨气:1.物理性质(1)NH3是无色、有刺激性气味、极易溶于水的气体,常温时,1体积水大约溶解700体积的氨气。
氮元素由海洋到林木的过程
氮元素由海洋到林木的过程
氮元素在自然界中通过氮循环的过程在海洋和陆地上发生着。
首先,氮气通过大气中的氮气固定作用,被一些细菌转化为氨或硝
酸盐,然后被降雨带入海洋。
在海洋中,氮元素被吸收和利用,成
为海洋生物体内蛋白质和核酸等生物大分子的重要组成部分。
海洋
中的氮元素还可以通过生物固氮作用,由一些特定的微生物将氮气
转化为有机氮化合物,进一步丰富了海洋生态系统中的氮资源。
当海洋生物死亡或排泄时,其中的有机氮化合物会进入海水中,一部分被微生物分解成氨或硝酸盐,然后被植物吸收利用。
此外,
海洋中的氮元素也可以通过潮汐和海浪的作用,被带到海岸,进入
陆地生态系统。
在陆地上,植物通过根系吸收土壤中的氮元素,将
其转化为蛋白质等有机物质,并成为食物链的起点。
动物通过食用
植物摄入氮元素,然后将其积累在自己的体内。
当动植物死亡时,其中的有机氮化合物会被分解为无机氮化合物,然后返回到土壤中。
在土壤中,一部分氮元素被微生物分解释
放为氮气,重新进入大气,完成了氮气的固氮作用。
另一部分则被
植物吸收利用,继续循环在陆地生态系统中。
此外,一部分氮元素
也可能被冲刷到河流,最终流入海洋,参与海洋中的氮循环。
总的来说,氮元素在自然界中通过海洋和陆地上的氮循环过程不断地在不同的生态系统中转化和循环,为生物体提供了必要的营养物质,维持了生态系统的平衡和稳定。
氮气的存在形式和分布
氮气的存在形式和分布氮气(N2)是地球大气中最主要的成分之一,占据了大气的约78%。
它在大气中以不同的形式存在,并参与了许多重要的地球化学过程,对地球生态系统的平衡起着重要作用。
首先,我们可以看到氮气以分子态(N2)的形式存在于大气中。
氮气是由两个氮原子(N)通过三键结合形成的稳定分子。
这些氮气分子以高度稀薄的形式存在于大气中,可以被吸入我们的肺部。
虽然氮气在人类活动中并没有直接的用途,但它对维持地球生态系统的平衡至关重要。
此外,氮气还以其他形式存在,比如在大气中的颗粒物中。
这些颗粒物包含固态或液态的氮化物化合物,如氨(NH3)和氮氧化物(NOx)。
这些颗粒物不仅来自自然过程,比如火山爆发和海洋生物排泄物的分解,也来自人类活动,比如化石燃料燃烧和工业排放。
这些氮化物颗粒物往往是对人类健康和环境有害的,因为它们可以造成酸雨和大气污染。
另外,氮气还以大气中的亚硝酸盐(NO3-)和铵盐(NH4+)的形式存在。
这些化合物通常来自于大气中的氮气分子的氧化和还原反应。
大气中的闪电和太阳辐射可以将氮气转化为亚硝酸盐和铵盐。
这些化合物进一步以形成了植物生长必需的氮素形式。
在土壤中,氮素被植物吸收,并成为植物生长和发育的关键营养元素。
随着植物的生长和死亡,氮素也会重新输入到土壤中。
此外,氮气还以氨或亚甲基胺的形式存在于全球大气中。
这些氨化合物主要来自于农业活动,比如肥料的施用和动物排泄物的分解。
氮气的这种存在形式对农作物生产至关重要,但是它也可能导致水体的富营养化现象,对水体生态系统产生负面影响。
总之,氮气以分子态(N2)的形式是地球大气中最常见的组分之一,同时它还以亚硝酸盐、铵盐、氨等形式存在于大气中。
这些不同的形式和分布使得氮气参与了大量的地球化学过程,包括植物生长和发育、大气污染和水体富营养化等。
对于地球生态系统的平衡和人类的生存,深入了解氮气的存在形式和分布是十分重要的。
