无机物工艺教案-第二节硫铁矿制取二氧化硫炉气
典型化工工艺-硫酸工艺课件

4.以硫磺为原料 当原料为液态硫磺时,可直接用液硫泵将其输入焚
硫炉;若原料为固态硫磺,则需在熔硫槽中以蒸汽间 接加热熔融,滤除杂质后,用泵送入焚硫炉。
硫磺燃烧时的反应为: S + O2─→ SO2 + 297 kJ
典型化工工艺学
. 第一部分:合成氨工艺 . 第二部分:硫酸工艺 . 第三部分:纯碱与烧碱工艺
第二部分 硫酸工艺
• Chp1: 概述 • Chp2: 硫铁矿焙烧制二氧化硫炉气 • Chp3:炉气的净化与干燥 • Chp4:二氧化硫氧化制三氧化硫 • Chp5: 三氧化硫吸收 • Chp6: 三废治理与综合利用
硫酸工业“十二五”发展规划要点*
• 指导思想
“十二五”期间将进一步促进行业可持续健康发展,满 足国民经济对硫酸及相关硫产品需要;加快企业结构、原料 结构调整,努力转变产业增长方式;继续发展循环经济,对各 种硫资源进行综合与循环利用;坚持硫资源多样化供应,充 分利用国际国内两种资源;加快技术进步,促进节能减排;提 高硫酸生产中余热回收利用率,将硫酸生产企业变成副产或 回收能源的工厂。
1.3 硫酸生产方法
• 硫酸的工业生产主要有接触法和亚硝基法。 • 亚硝基法分为铅室法和塔式法。 • 接触法是目前硫酸生产主流生产工艺。基本原理
是在催化剂存在下,以空气中的氧氧化二氧化硫 变为三氧化硫,再与水结合得到硫酸。
• 生产过程主要分三部进行 • 1)从含硫原料制造二氧化硫气体; • 2)将二氧化硫氧化为三氧化硫; • 3)三氧化硫与水结合生产硫酸。
3. 以石膏(磷石膏)为原料
• 用油、煤或天然气作燃料,在回转窑中使石膏与焦 炭于约1400℃下进行还原热解产生氧化钙,继而再 与添加剂起矿化作用生成水泥熟料。同时窑内产生 的二氧化硫气体则送去制酸,其工艺流程同硫铁矿 制酸系统。
第二节 二氧化硫 教案

第二节二氧化硫教案主题:二氧化硫教学目标:1. 了解二氧化硫的性质和应用;2. 掌握二氧化硫的制备方法;3. 理解二氧化硫与水反应的化学方程式;4. 了解二氧化硫的环境和健康影响。
教学重点:1. 二氧化硫的制备方法;2. 二氧化硫与水反应的化学方程式。
教学难点:二氧化硫的环境和健康影响。
教学准备:1. 讲义和PPT;2. 实验室设备和试剂。
教学过程:1. 引入(5分钟)教师简单介绍二氧化硫的概念和性质,引发学生对该物质的兴趣,激发学生思考二氧化硫在生活中的应用和影响。
2. 讲解二氧化硫的制备方法(10分钟)教师介绍二氧化硫的常见制备方法,包括燃烧硫、二氧化硫矿石的加热分解等。
并通过示意图和示例,使学生对制备方法有清晰的理解。
3. 展示实验:二氧化硫与水的反应(15分钟)教师进行实验演示,将二氧化硫气体通入水中,观察并记录反应现象。
让学生通过实验观察,了解二氧化硫与水反应的化学方程式。
4. 讲解二氧化硫的环境和健康影响(10分钟)通过PPT展示,教师向学生介绍二氧化硫的环境和健康影响,包括空气污染、酸雨等。
引导学生思考如何减少二氧化硫的排放和应对相关问题。
5. 小结与检测(10分钟)教师对本节课所学内容进行小结,并进行简单的课堂检测,巩固学生的学习成果。
检测形式可以选择填空题、选择题或简答题等。
6. 课堂练习与反馈(10分钟)学生自主或小组合作完成一道与本节课内容相关的练习题,并进行答题和讨论,教师对答案进行解析和评价。
7. 课堂延伸(5分钟)教师引导学生进行课堂延伸,探讨二氧化硫的其他应用领域,并让学生自主或小组合作完成一道与延伸内容相关的问题。
8. 作业布置(5分钟)教师布置相关作业,要求学生扩展了解二氧化硫的其他方面知识,如二氧化硫的制备工艺、二氧化硫的氧化物等,并在下节课前完成。
教学反思:本节课通过实验演示和讲解的结合方式,让学生对二氧化硫的制备方法和与水的反应有深入的了解。
通过对环境和健康影响的介绍,引发学生的思考,激发学习兴趣。
第七章 硫酸

接触会发生剧烈反应,甚至引起燃烧。能与一
些活性金属粉末发生反应,放出氢气。遇水大
量放热,可发生沸溅。具有强腐蚀性。
应急处理处臵方法:
泄漏应急处理
疏散泄漏污染区人员至安全区,禁止无关人员进入污染区,
建议应急处理人员戴好面罩,穿化学防护服。合理通风, 不要直接接触泄漏物,勿使泄漏物与可燃物质(木材、纸、 油等)接触,在确保安全情况下堵漏。喷水雾减慢挥发(或 扩散),但不要对泄漏物或泄漏点直接喷水。用沙土、干燥
●建国后我国的硫酸工业
1949年后,我国的硫酸工业发展较快。硫酸厂由建国前的几 家发展成数百家,硫酸产量也随之大幅度增长。
年
产量/ 万吨
1949 4.0
1952 19.0
1957 63.3
1966 225.0
1970 291.4
1975 484.7
1980 764.3
1987 983.0
2004 4000
灭火方法: 砂土,禁止用水。
三、硫酸的用途
基本化学工业中产量最大,用途最广泛的化工产品之 一。(曾被Байду номын сангаас为“工业之母”)
1、化肥工业中,占总用量的40~50%。用硫酸制取硫 酸铵和过磷酸钙。 2、作为化工原料使用。生产相关的酸、盐类物质应用于 各行各业。 3、作为试剂使用。 4、其它方面。制造炸药
SO3 (mol ) 80 / 80 0.9 1 H 2O(mol ) 20 /18
20%的发烟硫酸100㎏其各项组成: 总质量:100㎏ 分为其一: 游离的SO3质量:20㎏
其二: H2SO4的质量:80 ㎏ SO3的总质量=生成H2SO4的SO3质量 + 游离的SO3质量
3化工工艺学-第三章硫酸与硝酸.ppt
除去,需要采取增大雾滴直径的措施来保证除雾效果。雾滴
直径越大,表面效应越少,与平既降低温度又通过增湿来增大雾滴直径。
《化工工艺学》第3章 硫酸与硝酸
3.1.3.3 炉气的干燥
炉气经洗涤后被水 汽饱和。含有水的SO2湿 气,对设备和管道腐蚀 很强;而且后续工序也 要求转化气体干燥。
沸腾焙烧炉的特点有:生产强度大(25~30t/m3.d)、硫的 烧出率高、传热系数高、产生的炉气二氧化硫浓度高、适用 的原料范围广、结构简单、维修方便。
不足之处:炉尘量大,炉尘占总烧渣的60~70%。除尘 净化系统负荷大。需将硫铁矿粉碎至较小粒度,需高压鼓风 机,动力消耗大。
《化工工艺学》第3章 硫酸与硝酸
但硫酸浓度大于80%后,SO2的溶解度增大很快,气相中的SO3 也容易与水蒸气形成酸雾。两方面都使S的损失增多。所以也不宜 追求过高的硫酸浓度。通常以93~95%的浓硫酸为干燥剂。同时, 这种硫酸由于冰点低,还可避免冬季低温时硫酸的结晶现象。
《化工工艺学》第3章 硫酸与硝酸
几种焙烧方法——(4) 脱砷焙烧
脱砷焙烧主要用于含砷量大的硫铁矿,使As气化,并在 洗涤塔中除去。除了FeS2的反应外,还发生下列反应:
4 Fe A 4 Fs e S A S 4 (g )s 4 F e 4 F A 2 e 8 s F S S e A 4 S 4 S ( g )s A 4 s3 O 22 A 2 O 3 s (g )
性质
数据
密度(20℃),g/cm3 (t℃), g/cm3
1.8305
1 .85 1 .1 1 1 7 3 0 t 2 1 6 0 t2
熔点,℃
10.37±0.05
沸点,℃
275±5(有文献:270、 279.6)
化工工艺学3章
再经硫化除去铜和砷,最后再中和清液达标排放。
3.2 硝 酸 (Nitric acid)
3.2.1 概 述
纯硝酸(100%HNO3)为无色液体,可使动物窒 息,有刺激性气味,常温下能分解:
2HNO3+NO = 3NO2+H2O
(12)
当气体中NO的氧化度达到70%80%时,即可进行吸收制酸
操作。
3.2.2.3 氮氧化物气体的吸收
• SO2催化氧化成SO3后,送入吸收工序用发烟硫酸或浓硫酸吸收,吸 收过程可写为:
• nSO3(g) + H2O(l) = H2SO4(aq) + (n-1)SO3(aq) • n>1时生成发烟硫酸, n=1时生成无水硫酸, n<1时生成含水硫酸。
• 3.1.5.1 发烟硫酸吸收过程的原理和影响因素
• 吸收过程中,(NH4)2SO3浓度下降,吸收能力下降,因此要不断补充氨, 保持操作稳定。
•
NH3(g) + NH4HSO3 = (NH4)2SO3
• 为了保持亚硫酸铵和亚硫酸氢铵的比例稳定,要移出部分母液去分解。
3.1.6.3 污酸污水污液的处理
• 前面已谈到,生产过程中必定有废酸、废水和废液,并且其中可 能含有少量砷、硒、氟等。绝不能随便排放,必须处理达标后才 能排放。若污水量大,治理成本较高,所以目前都推广环保型两 转两吸工艺。
3.1.4 二氧化硫的催化氧化 Catalyze-oxidation of SO2
3.1.4.1 化学平衡和平衡转化率
化学反应: SO2(g) + 0.5O2(g) = SO3(g) 3.1.4.2 二氧化硫催化氧化动力学 催化剂 目前主要用钒催化剂作二氧化硫催化氧化反应的催 化剂。其主要成份为V2O5(6~12%) ,另外还有氧化 钾、氧化钠作助催化剂,以二氧化硅作载体。
第一篇硫酸第二章nmggydx

(2)炉气体积及所需空气量的计算
炉气体积和所需空气量,可根据炉气中SO2含量及硫铁矿释 出的硫量计算。 焙烧1t含硫干原料,可制得SO2浓度为C SO2的干炉气的体积 为(设不生成SO3); 1000 C S(烧) 22.4 100 700C S(烧) (1-2-23) V
则在100kg硫铁矿中含FeS2量为 CS(矿)=120/64=1.875 CS(矿) % 在100kg烧渣中含FeS量为 CS(渣)=88/32=2.75 CS(渣) % 又设X为烧渣产率,则100kg硫铁矿所得的烧渣中含FeS为2.75 CS(渣)X(kg),相当于FeS2的量为 120/88*2.75 CS(渣)X=3.75 CS(渣)X(kg) 其余部分的FeS2为:1.875 CS(矿)-3.75 CS(渣)X(kg),该 FeS2部分以Fe2O3型式转入烧渣中,相当于Fe2O3的量为: (1.875 CS(矿)-3.75 CS(渣)X)*160/(2*120)=1.25 CS(矿)2.5 CS(渣)X(kg)
2.2.1 硫铁矿焙烧原理
反应热力学 主要反应:
2.2.1.1
硫铁矿焙烧的主反应式(1-2-6)和 式(1-2-7)均为强放热、体积减小 的不可逆反应。 提高反应温度及压力有利于反应 的进行和提高余热品位。
当较温度较高,空气过剩量小时,有部分Fe3O4(棕 黑色) 3FeS+5O2=Fe3O4+4SO2 △H298O=-1723.79kJ 总反应式为:4FeS2+11O2==8SO2+2Fe2O3 (1-2-6) 3FeS2+8O2==6SO2+Fe3O4 (1-2-7)
高三化学第二节二氧化硫等教案(精选3篇)

高三化学第二节二氧化硫等教案(精选3篇)教案一:二氧化硫的物理性质课时安排:1课时教学目标:1. 了解二氧化硫的物理性质;2. 掌握二氧化硫的实验室制法;3. 进一步理解化学方程式的含义和作用。
教学重点:1. 二氧化硫的物理性质;2. 实验室制法的原理和步骤。
教学难点:1. 运用化学方程式描述二氧化硫的实验室制法;2. 理解实验室制法的原理和步骤。
教学准备:1. 实验装置和试剂:反应瓶、三角瓶、水槽、干燥瓶、白磷、烧杯、氢氧化钠溶液、氢溴酸。
2. 实验底片和幻灯片。
教学过程:Step 1 引入新课(5分钟)教师通过展示一组实验底片,让学生猜测其中的实验物质是什么,并引出本节课的主题:“二氧化硫的物理性质”。
Step 2 实验演示(15分钟)教师向学生演示实验过程,展示二氧化硫的实验室制法。
具体步骤如下:1. 将适量的白磷放入干燥瓶中,加入少量水,并迅速盖好瓶口。
2. 在干燥瓶上方反应瓶内加入氢氧化钠溶液,并迅速用三角瓶浸入水槽中。
3. 打开干燥瓶的盖子,将瓶口放入三角瓶内,然后反复晃动干燥瓶,使干燥瓶内的气体逸出到三角瓶中。
4. 将三角瓶中的气体向水槽中排出,并盖好干燥瓶口。
5. 将气体的性质通过试纸和氢溴酸演示。
Step 3 理论课讲解(20分钟)教师讲解二氧化硫的物理性质,并通过化学方程式对实验过程进行解释和描述。
同时,讲解实验室制法的原理和步骤。
Step 4 知识点总结和拓展(10分钟)教师对本节课所学内容进行知识点总结,并提供一些拓展问题进行讨论。
拓展问题:1. 二氧化硫的分子式是什么?2. 二氧化硫与水反应会产生什么?3. 二氧化硫与氢氧化钠溶液反应会产生什么?教案二:二氧化硫的化学性质与应用课时安排:1课时教学目标:1. 掌握二氧化硫的化学性质;2. 了解二氧化硫的应用领域。
教学重点:1. 二氧化硫的化学性质;2. 二氧化硫的应用领域。
教学难点:1. 理解二氧化硫的化学性质对其应用领域的影响;2. 运用化学方程式描述二氧化硫的化学性质。
《无机物工艺》课程标准

《无机物工艺》课程标准(课程代码:100003,适用专业:化工工艺、石油炼制、有色冶炼等专业)一、课程性质与任务(一)课程性质《无机物工艺》是化学工程与工艺专业的专业课程,是为化学工艺,化学工程类专业及其他相近专业开设的一门专业方向必修课。
学生在学习无机化学、有机化学、物理化学、化工热力学化工原理等课程的基础上必修本课程。
(二)课程的任务本课程具有理论性和实践性较强的特点,课程内容丰富多彩,教学中要求以讲授为主,辅以演示、课后布置作业、辅导等多种形式的教学手段。
课程任务是:1、掌握合成氨、尿素、纯碱、烧碱等较常见的无机化工生产过程的工艺原理、操作条件(工艺参数)的制定。
2、了解主要设备结构。
3、熟悉有关工艺流程。
4、熟悉化工安全生产操作的程序和要求。
二、课程目标1、知识目标:⑴掌握三酸、两碱、无机盐(氮肥、磷肥、钾肥、复合肥及液体肥料)的生产方法和基本原理。
⑵理解各物质生产方法工艺条件的选择。
⑶了解主要设备构造及操作要点。
⑷了解开停车及不正常现场的分析与处理。
⑸掌握一定的工艺计算能力。
⑹能识别并绘制简单的工艺流体图、核心设备原理图。
⑺培养一定的安全意识。
⑻了解新工艺、新技术和新方法。
2、能力目标通过本课程的学习,使学生初步掌握无机化工专业实验和生产操作技能的基本技能。
培养学生学会观察、勤于思考的学习作风;培养学生严谨、细致的工作作风;培养学生理论联系实际,综合应用能力。
3、素质目标培养学生诚实守信、富有爱心的思想品质;实事求是、尊重科学的理念;吃苦耐劳、善于沟通,团结合作的职业素养;勤于思考、敢于创新的意识。
使学生具备良好的职业态度和职业道德,形成良好的职业行为,最终形成化工生产的职业综合能力。
三、课程结构八、课程内容1、硫酸掌握硫酸的生产原理、核心设备、主要流程、操作技能要点,以及之间的逻辑推理关系。
2、硝酸掌握硝酸的生产原理、核心设备、主要流程、操作技能要点,以及之间的逻辑推理关系。
3、尿素掌握尿素的生产原理、核心设备、主要流程、操作技能要点,以及之间的逻辑推理关系。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
空气加入量一定时,提高炉气中SO2的浓度,可降低SO3的浓度,SO3浓度的降低对净化工序的正常操作和提高设备能力是有利的.
炉气中SO2浓度一般控制在10%~14%为宜。控制空气过剩量可使炉气中SO2浓度保持在一定范围内。
3.炉底压力
炉底压力一般在8.8~11.8kPa(表压)。
三、沸腾焙烧工艺流程
四、沸腾焙烧炉
沸腾焙烧炉的炉体为钢壳,内衬面耐火砖。炉内空间分为空气室、沸腾层、上部燃烧空间三部分。
沸腾区耐火砖较厚。而上部耐火砖较薄,这是为了减小炉内与钢壁的温度差,减小二氧化硫在壁上凝结,从而减小腐蚀。沸腾焙烧的空气流速是重要因素。
【小结】
1.硫铁矿焙烧的基本原理。
2.沸腾焙烧的工艺条件。
2.硫酸生产原料有哪些?
教学内容、方法和过程
附记
【引课】
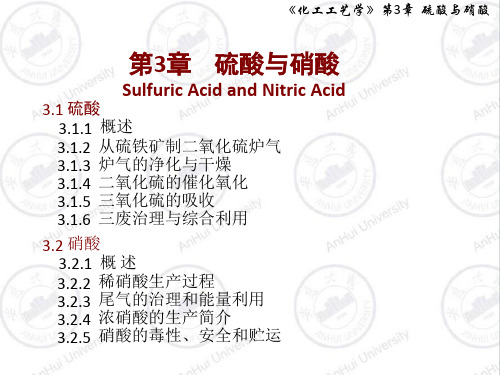
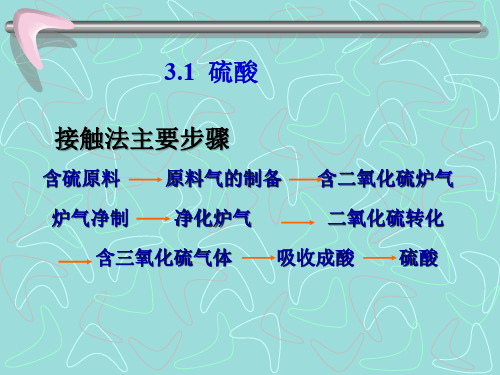
接触法主要步骤:
含硫原料原料气的制备含二氧化硫炉气
炉气净制净化炉气二氧化硫转化
含三氧化硫气体吸收成酸硫酸
【新课】
第二节硫铁矿制取二氧化硫炉气
一、硫铁矿焙烧的基本原理
1.焙烧反应
硫铁矿的焙烧主要是矿石中的FeS2与空气中的氧反应,生成SO2炉气,该反应通常需在600℃以上的温度进行。
2.硫铁矿焙烧的焙烧速度
硫铁矿焙烧是非均相反应,反应平衡常数很大,通常认为可进行到底。所以生产中关键是反应速度决定了生产能力。
在460~560℃范围为第一阶段,斜率大,活化能大。温度升高,反应速率增加很快。化学反应动力学控制。
提高焙烧速率的途径:
(1)提高操作温度。但不宜太高,温度太高会使炉内结疤,焙烧反而不能顺利进行。通常温度范围为950~850℃。
3.沸腾焙烧的工艺流程及焙烧炉。
【作业】P26 1-5
【教学反思】
通过此具体流程的讲解,使学生对硫酸的生产过程先有个整体的了解,为后面内容的学习打好基础
此部分的内容重点讲解,如何将工艺条件控制较适宜的范围
此流程较简单,学生阅读后,教师直接讲解
教案用纸
学科
无机物工艺
第一章硫酸
第二节硫铁矿制取二氧化硫炉气
审批签字授ຫໍສະໝຸດ 时数2授课方法讲授
教具
多媒体
授课时间
授课班级
教学目的
掌握沸腾焙烧的工艺条件及工艺流程,硫铁矿焙烧的基本原理及沸腾焙烧炉的结构。
教学重点
和难点
重点:沸腾焙烧的工艺条件及工艺流程。
难点:硫铁矿焙烧的基本原理。
复习提问
1.硫酸的生产方法有哪些?
教学内容、方法和过程
附记
以硫铁矿为原料水洗净化生产硫酸的原则流程,大致如下列框图所示。
焙烧反应是分两步进行的:
(1)FeS2受热分解为FeS和硫磺蒸气
2FeS2=2FeS+S2
该反应为吸热反应,温度越高,对硫铁矿的热分解越有利。随反应温度升高,其硫磺平衡蒸气压增大,说明高温对硫铁矿的热分解有利。
硫铁矿释放出硫磺后,开始形成多孔形的FeS。
(2)生成的FeS和单质硫与氧反应
S + O2→SO2↑
4FeS + 7O2→2Fe2O3+ 4SO2↑
3FeS + 5O2→Fe3O4+ 3SO2↑
其硫铁矿焙烧总反应式为:
4FeS2+ 11O2→2 Fe2O3+ 8SO2↑
3FeS2+8O2→Fe3O4+6SO2↑
此外,由于Fe2O3的催化作用,SO2可再氧化成SO3,高温下盐类分解成金属氧化物,同时再生成各种硫酸盐的副反应。焙烧阶段生成SO3是有害的,会给后续净化工序产生很多问题。
(5)适用的原料范围广。
(6)结构简单、维修方便。
沸腾焙烧炉的不足:
(1)炉尘量大,炉尘占总烧渣的60%~70%,除尘净化系统负荷大。
(2)需将硫铁矿粉碎至较小粒度,需高压鼓风机,动力消耗大。
二、沸腾焙烧的工艺条件
1.沸腾层温度
沸腾层温度一般控制在850~950℃。
影响温度的主要因素是投矿量、矿料的含硫量以及空气加入量。
(2)减小硫铁矿粒度。可以减小扩散阻力,增加接触面积,对第三阶段速度增加有利。
(3)增加空气与矿粒的相对运动。
(4)提高入炉空气氧含量。
3.沸腾焙烧
焙烧炉已由固定床型的块矿炉、机械炉发展成为流化床型的沸腾炉。
沸腾焙烧炉的优点:
(1)生产强度大。
(2)硫的烧出率高。
(3)传热系数高。
(4)产生的炉气二氧化硫浓度高。
