(完整word版)制作硫酸的工艺流程
(完整版)硫磺制酸工艺规程与操作规程要点
硫磺制酸工艺规程与操作规程第一部分:工艺规程:一:产品说明:硫酸是三氧化硫(SO3)和水(H2O)的化合物,硫酸的分子式:H2SO4, 纯硫酸的分子量为98.08,是无色、无臭而透明的油状液体。
工业上生产的硫酸都是纯硫酸(100%)的水溶液。
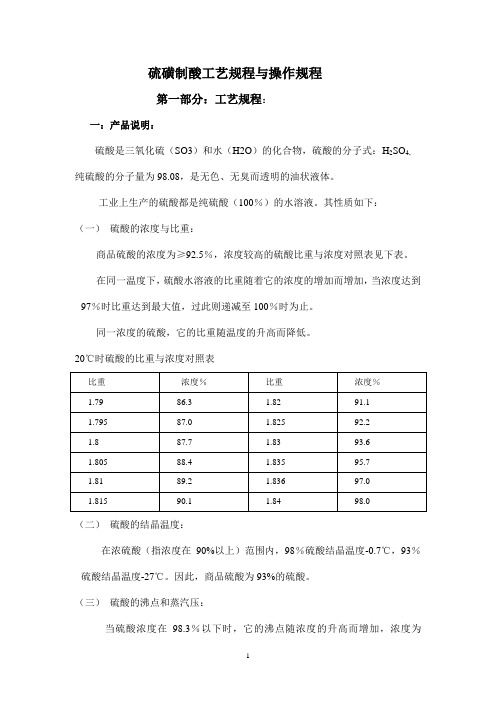
其性质如下:(一)硫酸的浓度与比重:商品硫酸的浓度为≥92.5%,浓度较高的硫酸比重与浓度对照表见下表。
在同一温度下,硫酸水溶液的比重随着它的浓度的增加而增加,当浓度达到97%时比重达到最大值,过此则递减至100%时为止。
同一浓度的硫酸,它的比重随温度的升高而降低。
20℃时硫酸的比重与浓度对照表(二)硫酸的结晶温度:在浓硫酸(指浓度在90%以上)范围内,98%硫酸结晶温度-0.7℃,93%硫酸结晶温度-27℃。
因此,商品硫酸为93%的硫酸。
(三)硫酸的沸点和蒸汽压:当硫酸浓度在98.3%以下时,它的沸点随浓度的升高而增加,浓度为98.3%的硫酸,沸点最高(336.6℃),以后则开始下降。
100%硫酸的沸点为296.2℃。
硫酸水溶液上面的总蒸汽压,随其浓度的增加而逐渐下降,当浓度增加到98.3%时,蒸汽压降至最小值。
硫酸上面的蒸汽是由H2O、H2SO4和SO3分子的混合物所组成。
在这种情况下,仅98.3%硫酸的蒸汽成分与液体成分相同。
水蒸汽压小是硫酸的重要性质。
温度越低、浓度越高,酸液面上的水蒸气平衡分压越小。
用浓硫酸来干燥气体就是利用了这一性质。
(四)硫酸的稀释热:硫酸能以任何比例与水混合。
硫酸中加入水就有热量放出,用水稀释的浓度越低,放出的热量越多。
如果将硫酸无限稀释下去,直到再加水也不会有热量发生,这样整个过程放出热量的总和称为溶解热或无限稀释热,它等于22000卡/摩尔。
由于浓硫酸的稀释热很大,同时由于酸、水比重上的差异,因此,在实验室中稀释浓硫酸时,不能将水倒入硫酸,必须将硫酸慢慢注入水中,同时不断搅拌,以防反应过剧造成酸沫飞溅伤人。
在生产过程中,需要往浓硫酸中加水时应当用密闭设备,上设足够大的水汽排出口,而且加水不可过猛。
(完整word版)化工工艺课程设计

目录第一章概论 (1)1。
1 设计题目 (1)1.2 设计规模及其内容 (1)1.3 苯的酸催化硝化方法 (2)1.3。
1 固体酸催化的液相硝化 (2)1.3.2 固体酸催化的气相硝化 (3)1.3。
3 Lewis酸催化的液相硝化 (3)1。
3。
4 离子液体催化的液相硝化 (4)第二章工艺技术方案的选择 (5)2.1 概述 (5)2。
2 硝基苯传统硝化工艺和绝热硝化工艺的比较 (5)2。
2.1 传统硝化法 (6)2.2.2 绝热硝化法 (7)2.2.3 传统硝化法和绝热硝化法的比较 (7)第三章物料衡算 (9)3.1 准备计算 (9)3.2 第一个釜的计算 (12)3.3 第二个釜的计算 (12)3.4 第三个釜的计算 (13)3.5 第四个釜的计算 (14)第四章工艺流程 (16)4。
1 反应过程 (16)4.2精制工序 (16)4。
3尾气处理工序 (17)结语 (18)参考文献 (19)第一章概论1.1 设计题目40kt/a硝基苯生产工艺设计1.2 设计规模及其内容年产4万吨硝基苯是以苯和硝酸为原料,硫酸为催化剂,在一定反应条件下硝化。
硝基苯的物理性质是,分子式是C6H5NO3,熔点为5.7 ,沸点为210.8℃,相对密度为1.20373/g cm,闪点为90℃,自燃点为495℃。
硝基苯微溶于水,易溶于溶于乙醇、乙醚、苯等有机溶剂。
纯净的硝基苯是无色油状液体,工业品常因含杂质而显黄色,有像杏仁油的特殊气味。
其水溶液有甜味,能随水蒸气蒸发.易燃易爆。
硝基苯是一种重要的基本有机化工原料,主要用途是制取苯胺,由苯胺进而生产各种有机中间体,也用于生产间硝基苯磺酸钠和偶氮苯等多种医药和染料中间体。
目前工业上制取硝基苯是以苯和硝酸为原料,硫酸为催化剂,在一定反应条件下硝化。
早期采用的是混酸间歇硝化法,逐渐发展了釜式串联、管式、环式或泵式循环等连续硝化工艺,而后又发展了绝热硝化法,这些工艺都是非均相混酸硝化工艺。
(完整word版)15种危险化工工艺

附件1
首批重点监管的危险化工工艺目录
一、光气及光气化工艺
二、电解工艺(氯碱)
三、氯化工艺
四、硝化工艺
五、合成氨工艺
六、裂解(裂化)工艺
七、氟化工艺
八、加氢工艺
九、重氮化工艺
十、氧化工艺
十一、过氧化工艺
十二、胺基化工艺
十三、磺化工艺
十四、聚合工艺
十五、烷基化工艺
附件2:
首批重点监管的危险化工工艺安全控制要求、重点监控参数及推荐的控制方案
1、光气及光气化工艺
2、电解工艺(氯碱)
3、氯化工艺
4、硝化工艺
5、合成氨工艺
6、裂解(裂化)工艺
7、氟化工艺
8、加氢工艺
9、重氮化工艺
10、氧化工艺
11、过氧化工艺
12、胺基化工艺
13、磺化工艺
14、聚合工艺
15、烷基化工艺。
(完整word版)卤化反应

第五章卤化第一节概述一、卤化反应及其重要性向有机化合物分子中引入卤素(X)生成C-X键的反应称为卤化反应。
按卤原子的不同,可以分成氟化、氯化、溴化和碘化。
卤化有机物通常有卤代烃、卤代芳烃、酰卤等。
在这些卤化物中,由于氯的衍生物制备最经济,氯化剂来源广泛,所以氯化在工业上大量应用;溴化、碘化的应用较少;氟的自然资源较广,许多氟化物具有较突出的性能,近年来人们对含氟化合物的合成十分重视.卤化是精细化学品合成中重要反应之一.通过卤化反应,可实现如下主要目的:(1)增加有机物分子极性,从而可以通过卤素的转换制备含有其它取代基的衍生物,如卤素置换成羟基、氨基、烷氧基等.其中溴化物中的溴原子比较活泼,较易为其它基团置换,常被应用于精细有机合成中的官能团转换.(2)通过卤化反应制备的许多有机卤化物本身就是重要的中间体,可以用来合成染料、农药、香料、医药等精细化学品。
(3)向某些精细化学品中引入一个或多个卤原子,还可以改进其性能.例如,含有三氟甲基的染料有很好的日晒牢度;铜酞菁分子中引入不同氯、溴原子,可制备不同黄光绿色调的颜料;向某些有机化合物分子中引入多个卤原子,可以增进有机物的阻燃性。
二、卤化类型及卤化剂卤化反应主要包括三种类型:即卤原子与不饱和烃的卤加成反应、卤原子与有机物氢原子之间的卤取代反应和卤原子与氢以外的其他原子或基团的卤置换反应。
卤化时常用的卤化剂有:卤素单质、卤素的酸和氧化剂、次卤酸、金属和非金属的卤化物等,其中卤素应用最广,尤其是氯气。
但对于F2,由于活性太高,一般不能直接用作氟化剂,只能采用间接的方法获得氟衍生物.上述卤化剂中,用于取代和加成卤化的卤化剂有:卤素(Cl2、Br2、I2)、氢卤酸和氧化剂(HCl +NaClO、HCl+NaClO3、HBr+NaBrO、HBr+NaBrO3)及其他卤化剂(SO2Cl2、SOCl2、HOCl、COCl2、SCl2、ICl)等,用于置换卤化的卤化剂有HF、KF、NaF、SbF3、HCl、PCl3、HBr 等。
年产10万吨硫酸毕业设计

1设计任务书 (2)1.1项目 (2)1.2设计内容 (2)1.3设计规模 (2)1.4设计依据 (2)1.5产品组成、性质及用途 (2)1.6产品质量规格 (5)1.7原料方案 (6)原料:硫铁矿 (6)1.8工艺技术指标 (6)1.9生产方式 (8)2工艺线路及流程设计 (8)2.1硫酸的工艺基础 (8)2.2工艺路线选择 (10)2.3流程的设计 (10)2.4工艺操作设计 (10)3物料横算 (13)3.1转化—吸收系统的物料衡算 (13)4发烟硫酸吸收塔的设计 (15)4.1发烟硫酸吸收塔的计算 (15)4.2发烟硫酸吸收塔的设计结构图 (16)5设备一览表 (17)6车间防护 (18)6.1 有毒害性物质的防护 (18)6.2 泄漏应急处理 (18)6.3 急救措施 (18)6.4 噪声的防护 (19)6.5生产要求 (19)7经济评估 (20)7.1经济投资 (20)7.2经济分析 (20)8人员配置 (21)9三废处理 (21)9.1三废处理的意义 (21)9.2三废处理 (21)致谢: (23)参考文献: (24)年产10万吨硫酸的工艺设计1设计任务书1.1项目硫酸生产的工艺设计1.2设计内容1.2.1生产工艺设计1.2.2设计转化吸收塔1.3设计规模1.3.1 年产:10万吨1.3.2 年生产日:300天1.3.3日生产能力:10/300=333吨/天1.4设计依据该设计说明书是依据湖北远大富驰医药化工股份有限公司的生产技术资料的基础上,并结合设计任务书的内容年产10万吨硫酸技术要求。
1.5产品组成、性质及用途1.5.1硫酸组成【1】硫酸(英文名:Sulphuric acid for industrial use),H2SO4或SO3·H2O,相对分子质量98.078,是指SO3与H2O摩尔比等于1的化合物,或指100%H2SO4,外观为无色透明油状液体,密度(20℃)为1.8305g/㎝³。
硫及其化合物【六大题型】(解析版)-高中化学

硫及其化合物【九大题型】【新高考通用】【知识点1硫及其氧化物的性质】【知识点2硫酸的性质和硫酸根的检验】【知识点3硫及其化合物的转化】【题型1硫的性质及其用途】【题型2二氧化硫的性质和用途】【题型3与二氧化硫有关的实验】【题型4浓硫酸的性质及用途】【题型5硫酸根的检验】【题型6硫酸盐及多硫化物】【题型7硫酸型酸雨及防治】【题型8硫及其化合物的转化】【题型9与硫有关的化学计算】【过关测试】考点要求真题统计考情分析1.掌握硫元素单质及其重要化合物的主要性质及应用。
2.了解硫及其重要化合物的制备方法。
3.了解硫及其化合物的相互转化及应用。
4.了解硫的氧化物对环境的影响。
5.掌握浓硫酸的特性。
6.掌握硫及其化合物的转化。
2024·安徽卷,3分;2024·湖北卷,3分;2023湖南卷,4分;2023浙江卷,3分;2023浙江卷1月4题,3分;2023新课标卷11题,6分;2023全国乙卷11题,6分;2022全国甲卷13题,6分;2022浙江卷10题,2分;2022湖北卷8题,3分;2022山东卷2题,2分;2022广东卷5题,2分;2022江苏卷4题,3分;1.硫及其化合物的性质是高中化学的核心内容之一,也是高考考查的热点之一,高考常结合实验考查SO 2的性质探究或检验、硫酸、硫酸根离子及亚硫酸根离子的检验、结合实验、元素化合物、氧化还原反应等进行命题,试题从注重考查教材基础知识逐渐向运用知识解决实际问题的方向转变,符合高考命题注重应用性的趋势。
2.预计2025年高考仍会结合实验考查SO 2的性质、结合环境保护、结合生产、生活实际,考查硫及其化合物之间的转化相关实验现象分析和性质探究,综合考查物质制备、性质探究。
【思维导图】【知识点1硫及其氧化物的性质】一、硫的性质1.自然界中的硫(1)游离态:硫单质俗称硫黄,主要存在于火山口附近或地壳的岩层中。
(2)化合态:主要以硫化物和硫酸盐的形式存在,有关化学式如下:黄铁矿黄铜矿石膏芒硝FeS 2CuFeS 2CaSO 4·2H 2ONa 2SO 4·10H 2O2.物理性质俗称颜色状态溶解性硫黄黄色晶体难溶于水微溶于酒精易溶于CS 23.化学性质(1)氧化性:(0→-2价)S +H 2=====△H 2S Fe +S =====△FeS2Cu +S =====△Cu 2S Hg +S ===HgS (2)还原性:(0→+4价)S +O 2=====点燃SO 2(3)与碱发生歧化反应(如NaOH 溶液):3S +6NaOH =====△2Na 2S +Na 2SO 3+3H 2O 。
(完整word版)化工的发展进展

第一章、化工的发展历程回顾近代化学工业的兴起(1)随着产业革命在西欧开始,首先无机化学工业开始形成及发展。
1740年英国人Wald制得硫酸;1749年Roeback在英国建立了用铅宝法生产硫酸的工厂(第一个化工工业产品),标志着世界第一个典型的化工厂的诞生,是近代化学工业的开始。
1771年吕布兰获取以食盐为原料制的纯碱,副产氧化氢至盐酸、氧气、漂白粉等,纯碱又可经苛化生成烧碱。
18世纪后期,炼铁用焦碳量大大增加,使煤化工产生。
1763年在英国产生了蜂窝式煤气炉,提供了大量焦碳。
1792年开始用煤生产民用煤气。
近代化学工业的兴起(2)-煤化工的发展1812年,欧洲干馏煤气用于街道照明。
1816年,美国煤干馏法生产煤气。
1825年,英国人从煤焦油中分离出苯、甲苯、萘等。
19世界中叶,欧洲已有许多国家建立了炼焦厂,德国成功建立了有化学品回收装置的炼焦炉,由煤焦油中提取了大量的芳烃,作为医药、农药、染料等工业的原料。
近代化学工业的兴起(3)-三大化工材料工业的开始1839年,美国人固特异用硫磺硫化天然橡胶,应用于轮胎及其他橡胶制品-第一个人工加工的高分子橡胶产品。
1872年,美国开始生产赛璐珞,被认为是第一个天然加工高分子的塑料产品-开创了塑料工业。
1891年,在法国建立了人造纤维(硝酸酯纤维)工厂,其产品质量差,易燃,虽未能大量发展,但仍被认为是化学纤维工业的开始。
近代化学工业的兴起(4)-炼油工业开始1854年,美国建立最早的原油分馏装置。
1860年,在美国第一个炼油厂是炼油工业。
19世纪后期,在世界已建设了许多炼油厂或炼油装置,主要生产照明用的煤油,而汽油及重质油还是用处不大的“副产”,直到80年代,电灯的发明大大减少了煤油的重要性、汽油和柴油因汽车工业的发展而成为主要炼油产品。
近代化学工业的兴起(5)-传统与化学制药及染料工业等19世纪初至60年代,科学家先后从传统的药用植物中分离得到纯的化学成分。
硫酸锌生产工艺操作规程

编号:CZ-GC-00340硫酸锌生产工艺操作规程Operation procedure of zinc sulfate production process( 操作规程)单位:_____________________审批:_____________________日期:_____________________WORD文档/ A4打印/ 可编辑硫酸锌生产工艺操作规程操作备注:安全操作规程是要求员工在日常工作中必须遵照执行的一种保证安全的规定程序。
忽视操作规程在生产工作中的重要作用,就有可能导致出现各类安全事故,给公司和员工带来经济损失和人身伤害,严重的会危及生命安全,造成终身无法弥补遗憾。
一、氧化锌浸出工序1、准备工作:穿戴好防护用具,检查各种设备是否正常(如减速机、搅拌器、水泵、硫酸管、油管及阀门、引风机)。
2、浸出操作:○1先往浸取桶内加铟尾水和红泥洗水(约1立方)至桶体积的2/3;○2启动搅拌,投入氧化锌,同时打开油加热阀加温至70℃-80℃.○3当桶内料液PH在3-3.5时,停止加氧化锌,让其反应。
○4搅拌半小时,再测PH值,若达到4.5-5.0B't时,继续搅拌半小时,PH稳定不变调整料液浓度波美度45B't左右。
○5启动输送泵将浸出液送中间桶。
○6在反应过程中,如果PH值偏低,用氧化锌调整,如果PH值偏高,用铟尾水或硫酸调至所需PH值。
○7酸化结束后,料液体积以不漫槽为准。
3.特别提示:○1投料时,必须做到均投,久搅,勤检查的办法,认真操作,不准澎料、跑料。
○2下一罐检查必须切断电源,两人在场,并挂牌警示。
○3做好原始记录,工作完成后,要清理现场,做到清洁卫生。
二、压滤工序1、检查设备状况是否正常,如泵、管道、压滤机油压、滤布,拼装好滤板、滤布。
2、确定浸取液合格后,启动水泵,打开阀门,进行压滤,滤液自流进入氧化桶进行除杂。
3、压滤困难即停泵,松开滤板,滤液送样化验(锌、铟)。
4、硫酸锌滤液必须清明、无浑浊物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、工艺流程说明
本生产装置为50kt/ a硫铁矿制酸,封闭酸洗净化,(3+2)二次转化二次吸收。
硫铁矿经原料工段、焙烧工段、净化工段、转化工段、干吸工段等工序,其工艺流程详尽介绍如下:
(一)原料岗位
在原料厂房内,经料斗至1#皮带入破碎机后经2#皮带至筛分,筛分后经3#皮带至大倾角皮带再至供料皮带进入沸腾炉料斗,料再由沸腾大炉料斗喂入沸腾炉。
(二)焙烧岗位
硫铁矿在沸腾炉内与空气鼓风机鼓入的空气在进行沸腾焙烧,焙烧出的高温炉气含SO2在12-13%,由炉顶侧向引出,沸腾层温度控制在800-850℃,经炉气冷却器冷却,沉降部分粉尘后再进入旋风除尘器进行除尘,同时SO2炉气降温至350℃左右再进入电除尘器进行除尘。
(三)电除尘器
来自焙烧工段的炉气,炉气温度约在350℃左右,含尘量约在30g/NM3,进入电除尘器,炉气中的微小尘粒受电场力的作用,经电离、荷电分别向阴极,阳极移动,并沉积于放电极线上和集尘极板上,通过振打,掉落至集灰斗,由溢流螺旋排灰机排出,炉气净化到含尘0.2g/NM3。
进入净化工段。
(四)净化工段
净化采用内喷文氏管——泡沫塔——间冷器——电除雾器封闭稀酸洗净化流程。
来自电除尘器的炉气,炉气温度约在300℃左右,含尘量约在0.2g/NM3,首先进入内喷文氏管,炉气在喉管内以50米/秒气速冲击送入稀酸,使稀酸雾化,气体与液体充分接触,炉气温度降到65℃左右,炉气中大部分灰尘、砷、氟等杂质被除去。
经增湿后的炉气进入泡沫塔进一步洗涤、冷却,炉气温度降至50℃左右,进入间冷器。
炉气在间冷器内与水间接冷却,换热使炉气温度降至35℃以下,炉气中的热量绝大部分在此设备移出系统。
进入电除雾器进一步除去残余的灰尘和酸雾,使炉气中酸雾<0.03g/NM3,砷<1.0mg/NM3,氟<3.0mg/NM3,净化后的炉气进入干燥塔。
由内喷文氏管流出的洗涤稀酸,温度60-65℃进入斜管沉降器,进行固液分离,清液回循环槽,斜管沉降器底部定期排出的酸泥及少量稀酸流至中和槽用石灰中和处理。
出泡沫塔的稀酸经脱气塔,回循环槽,循环使用。
间冷器循环酸泵,根据间冷器降温情况间断启用。
因炉气带走的水份及排出的少量稀酸,所以净化工序应相应的补充水量,以保持净化系统的水平衡。
(五)转化工段
转化采用(3+2)式,ⅢⅠ-ⅤⅣⅡ换热流程。
从净化岗位经干燥塔,干燥塔除沫器的SO2炉气进入转化工段SO2风机,依次进入Ⅲa,Ⅲb,I换热器管间换热升温,再进入电炉,到转化器一段催化剂层进行反应,控制一段进口温度在415-420℃,反应后SO2、SO3高温炉气进入第I换热器管内与来自第Ⅲb的换热器管间的SO2炉气换热降温,控制二次进口炉气温度为455-460℃之间,入二段催化剂层进行反应,反应后的SO2,SO3转化气进入Ⅱ换热器管内与来自Ⅳb换热器管间二次转化炉气进行换热,降温,控制三段进口炉气温度在435-440℃之间,进转化器三段催化剂层进行反应。
反应后SO2,SO3转化气经第Ⅲb,Ⅲa换热器管内与管外来自SO2风机出口炉气进行换热,降温至160℃左右进入第一吸收塔进行吸收。
吸收SO3后的炉气经一吸塔金属丝网除沫器,依次进入Ⅴa,ⅤbⅣ换热器,进入Ⅱ换热器管间换热升温,再进入二转电炉,到转化器第四段催化剂层进行反应,控制四段进口温度415-420℃,反应后的SO3炉气进入第Ⅳ换
热器管内与来自一吸塔的炉气进行换热,进入第五段,由第五段出来的SO3炉气经Ⅴb、Ⅴa后降温至160℃进入第二吸塔进入吸收。
(六)干吸工段
经净化后的炉气在干燥塔内用93%酸淋洒,使炉气中的水份降至0.1g/NM3以下,然后通过金属丝网除沫器除去酸沫,再经SO2鼓风机送入转化工段。
由转化工段来的转化气在第一吸收塔内用98.20-98.60硫酸淋洒进行吸收,吸收SO3后的炉气进入转化工段,进行二次转化。
来自转化工段二次转化气在第二吸收塔内用98.20-98.60%的硫酸淋洒进行吸收,吸收SO3的尾气经烟囱排空。
干燥塔,第一吸收塔,第二吸收塔各自的反应热,由各自的循环酸管壳式酸冷器却进行移热降温,干燥塔,第一吸收塔的循环酸浓度和液位的稳定通过串酸,加水来调节,第二吸收塔的酸浓通过加水来调节,产出的酸串至干燥塔循环槽。
(七)循环水岗位
循环水水流走向为蓄水池泵——管壳式酸冷器——凉水塔——蓄水池
间冷器
由于凉水塔冷却蒸发带走水份和带沫损失的水,及其他损耗的水,所以要定期的要补充一定水量。
1.阀门类型代号的Z、J、L、Q、D、G、X、H、A、Y、S分别表示:
闸阀、截止阀、节流阀、球阀、蝶阀、隔膜阀、旋塞阀、止回阀、安全阀、减压阀、疏水阀
2.阀门的连接式代号1、2、4、6、7分别表示:
1、内螺纹、
2、外螺纹、4、法兰、6、焊接、7、对夹
3.阀门的传动方式代号9、6、3分别表示:
9、电动、6、气动、3、涡轮蜗杆
4.阀体材料代号Z、K、Q、T、C、P、R、V分别表示:
灰铸铁、可锻铸铁、球墨铸铁、铜及合金、碳钢、铬镍系不锈钢、铬镍钼系不锈钢、铬钼钒钢
5.阀座密封或衬里代号R、T、X、S、N、F、H、Y、J、M、W分别表示:
奥氏体不锈钢、铜合金、橡胶、塑料、尼龙塑料、氟塑料、Cr系不锈钢、硬质合金、衬胶、蒙乃尔合金、阀门本体材料。
