九年级化学常见离子对
初中化学常见离子符号

初中化学常见的离子符号常见的金属离子:锂离子:Li+ 钾离子:K+ 钠离子:Na+ 钙离子:Ca2+ 镁离子:Mg2+ 钡离子:Ba2+ 铝离子:Al3+ 锌离子:Zn2+ 铁离子:Fe3+ 亚铁离子:Fe2+ 铜离子:Cu2+ 亚铜离子:Cu+ 银离子:Ag+常见的非金属离子:氟离子:F—氯离子:Cl—溴离子:Br—碘离子:I—硫离子:S2—氧离子O2—氢离子:H+常见的离子团:碳酸根离子:CO32—硫酸根离子:SO42—亚硫酸根离子:SO32—硝酸根离子:NO3—氢氧根离子:OH—氯酸根离子ClO3—磷酸根离子:PO43—碳酸氢根离子:HCO3—高锰酸根离子:MnO4—锰酸根离子:MnO42—铵根离子:NH4+说明:1、离子不可单独存在,有阴离子存在必然有阳离子,由阴阳离子构成的物质是离子化合物。
2、离子所带的电荷数与其在化合物中元素表现的化合价数值和正负均一致。
例如,硫离子S2—中S 的化合价为—2 3、离子团所带的电荷数与其整体表现化合价数值和正负一致,其整体化合价是其组成元素所表现化合价的代数和。
例如,铵根离子NH4+的整体化合价是+1,这是由于其中N显—3价,H显+1价决定的。
常用化合价口诀:一价氢氯(-1)钾钠银,二价氧(-2)钙钡镁锌,三铝四硅五氮磷,二三铁二四碳,二(-2)四六硫都齐全,单质为零铜正二,金正非负和为零。
负一硝酸氢氧根,负二硫酸碳酸根,负三只有磷酸根,正一价的是铵根。
一、默写。
(每空1分,共15分)1、关关雎鸠,在河之洲。
,。
2、求之不得,。
悠哉悠哉。
3、,。
所谓伊人,在水一方。
4、溯洄从之,。
,宛在水中坻。
5、李贺《雁门太守行》一诗中分别从听觉和视觉两方面铺写阴寒惨烈的战地气氛的两句是,。
6、,受上赏;,受中赏;,,受下赏。
二、课内文言文阅读(70分)(一)生于忧患,死于安乐(16分)舜发于畎亩之中,傅说举于版筑之中,胶鬲举于鱼盐之中,管夷吾举于士,孙叔敖举于海,百里奚举于市。
中考化学专题复习:常见的十对离子反应和两类反应:

如:NH4Cl+NaOH=NaCl+ H2O+ NH3↑;NH4NO3+KOH=KNO3+ H2O+ NH3↑
生成水:
(9)H++ OH-→H2O
如:HCl + NaOH = NaCl +H2OH2SO4+ 2KOH = K2SO4+2H2O
(10)非金属氧化物+碱→盐+水
CO2+Ca(OH)2==CaCO3↓+H2O、2NaOH + CO2=Na2CO3+ H2O
(11)金属氧化物+酸→盐+水
Fe2O3+6HCl==2FeCl3+3H2O、CuO + H2SO4=CuSO4+ H2O
常见离子鉴别:
①Cl-检验:用试剂硝酸银溶液、稀硝酸):加入硝酸银溶液(AgNO3),产生白色沉淀,再滴加稀HNO3,白色沉淀不溶解,则证明含有Cl-。例HCl + AgNO3=AgCl↓+ HNO3
②CO32-检验:试剂(稀盐酸、澄清灰水):加入稀盐酸(HCl),产生气泡,把气体通入澄清石灰水,石灰水变浑浊,则证明含有CO32-。例Na2CO3+ 2HCl=2NaCl + H2O + CO2↑
③SO42-检验:试剂(硝酸钡溶液、稀硝酸):先加入Ba(NO3)2溶液,产生白色沉淀,再滴加稀HNO3,沉淀不溶解,则证明含有SO42-。例Na2SO4+ BaCl2=BaSO4↓+ 2NaCl,也可用一种碱氢氧化钡或一种盐氯化钡代替硝酸钡溶液。(最好用Ba(NO3)2溶液)。
复分解反应中离子对的综合运用

例2、下列离子能在pH=11的溶液中大量共存的是 ( )
A K+ NO3- Na+ OH-
B CO3- K+ Cl- Ca2+
C H+ Ba2+ Cl- SO42-
D K+ OH- SO42- Cu2+
练习1:下列各组离子能同时存在于同一溶液的是 ( )
A Ba2+ K+ NO3- CO32- H+ B K+ NO3- H+ Cl- SO42C Fe3+ SO42- Na+ OH- Cu2+ D NO3- Cl- K+ Ba2+ Ag+
复分解反应实质的微观分析
H+ Cl-
混合后
Na+
OH-
Cl-
H2O
Na+
忽略溶液中原有的水分子,假设NaOH和HCl恰好完全反应。
复分解反应实质的微观分析
Ba+ Cl-
混合后
Cl-
Na+ Na+BaSO4
CCl-l-
忽略溶液中原有的水分子,假设Na2SO4和BaCl2恰好完全反
练习4:除去食盐水中的可溶性杂质CaCl2 和Na2SO4的操作
有:①加过量BaCl2溶液;②过滤;③加过量Na2CO3溶液;
④蒸发结晶;⑤加适量盐酸。下列操作顺序正确的是(提
示:BaSO4、BaCO3难溶于水) A.③①②⑤④ B.①⑤③②④ C.①③⑤④②
D. ①③②⑤④
(一) 判断反应发生
例3、下列各组溶液,不能发生复分解反应的是 ( )
A HCl 和 Ca(OH)2
B Na2CO3 和H2SO4
九年级化学离子基础知识点

九年级化学离子基础知识点离子是指带电的原子或分子。
在化学中,离子是非常重要的概念和基础知识点。
本文将介绍九年级化学中的离子基础知识点,包括离子的定义、离子的命名和离子的性质。
一、离子的定义离子是指带有电荷的原子或分子。
当原子或分子失去或获得电子时,就会形成带正电荷或负电荷的离子。
失去电子的离子称为阳离子,带正电荷;获得电子的离子称为阴离子,带负电荷。
二、离子的命名离子的命名遵循一定的规则。
通常,阳离子的名称与元素名称相同,而阴离子的名称在元素名称后面加上-ide。
例如,氯离子的化学式是Cl-,它的名称是氯化物离子。
有些离子名称需特别记忆,如:氧化氢离子(H+)叫做氢离子,氧化物离子(O2-)叫氧离子,氢氧根离子(OH-)叫氢氧根离子等。
三、离子的性质离子具有许多特性和性质,下面将介绍几个重要的性质:1. 电荷离子的最显著的性质是电荷。
阳离子带正电荷,阴离子带负电荷。
通常情况下,离子在化学反应中会与其他离子或非离子发生相互作用。
2. 溶解性离子是溶解在水或其他溶剂中的。
有些离子易于溶解,如氯离子(Cl-)和钠离子(Na+),而有些离子不易溶解,如银离子(Ag+)和铅离子(Pb2+)。
溶解性是离子在化学反应和溶液中运动的重要特性。
3. 离子反应离子在化学反应中起着重要的作用。
离子可以与其他离子或非离子发生反应,例如,阴离子和阳离子可以结合形成化合物。
离子反应是化学反应中的重要反应类型之一。
4. 离子的结构离子通常以晶体的形式存在。
晶体是由阳离子和阴离子组成的定序排列结构。
晶体的结构和排列方式决定了离子的性质和行为。
5. 离子的质量离子的质量等于其原子或分子的质量。
阳离子和阴离子的质量可以通过化学实验测定。
综上所述,离子是带有电荷的原子或分子。
离子的命名遵循一定的规则,阳离子和阴离子分别带有正电荷和负电荷。
离子具有电荷、溶解性、离子反应、结构和质量等特性。
理解和掌握这些基础知识点,对于学习化学的进一步深入是非常重要的。
九年级上化学式及化学方程式整理

九年级上化学式及化学⽅程式整理⼆、离⼦及化合价:带电的原⼦或原⼦团,离⼦的带电量与原⼦的最外层电⼦数紧密相关。
1、氢离⼦:H+ 锂离⼦:Li+钠离⼦:Na+钾离⼦:K+银离⼦:Ag+(这⼏种元素的原⼦最外层电⼦数均为1,化合价均为+1价)2、铍离⼦:Be2+镁离⼦:Mg2+钙离⼦:Ca2+钡离⼦:Ba2+锌离⼦:Zn2+亚铁离⼦:Fe2+(这⼏种元素的原⼦最外层电⼦数均为2(除Fe外),化合价均为+2价)3、铝离⼦:Al3+铁离⼦:Fe3+(与其他物质化合时显+3价)4、硅离⼦:Si4+ (最外层4个电⼦,显+4价)5、硫离⼦:S2- 氯离⼦:Cl-6、氢氧根:OH-(-1价)硝酸根:NO3-(-1价)硫酸根:SO42- (-2价)碳酸根:CO32- (-2价)铵根:NH4+ (+1价)O通常显-2价,Cl通常显-1价,其他化合价需根据具体化学式进⾏推导。
在化合物⾥,正负化合价的代数和为零三、化学式:正价的写左边,负价写右边,⾦属⼀般显正价,⾮⾦属⼀般显负价。
1、⽓体类:氧⽓:O2氮⽓:N2 氢⽓:H2 ⼆氧化碳:CO2 ⼀氧化碳:CO⼆氧化硫:SO2 ⼆氧化氮:NO2 甲烷:CH4 氨⽓:NH32、液体类:⽔:H2O 双氧⽔:H2O2稀盐酸:HCl 稀硫酸:H2SO4碳酸:H2CO3 硝酸:HNO33、固体类:铁:Fe 铝:Al 铜:Cu 锌:Zn碳:C ⽩磷/红磷:P 硫磺:S 五氧化⼆磷:P2O5氧化铁:Fe2O3 四氧化三铁:Fe3O4⼆氧化锰:MnO2氧化镁:MgO 氧化铜:CuO 氧化汞:HgO ⾼锰酸钾:KMnO4锰酸钾:K2MnO4氯酸钾:KClO34、含氯离⼦的物质的化学式(注意找规律)氯化氢:HCl 氯化钠:NaCl 氯化钾:KCl 氯化锂:LiCl 氯化铵:NH4Cl 氯化银:AgCl氯化镁:MgCl2氯化钙:CaCl2氯化钡:BaCl2 氯化锌:ZnCl2氯化铜:CuCl2 氯化亚铁:FeCl2 氯化铁:FeCl3氯化铝:AlCl35、含氢氧根离⼦的物质的化学式氢氧化钠:NaOH 氢氧化钾:KOH 氢氧化银:AgOH氢氧化镁:Mg(OH)2氢氧化钙:Ca(OH)2氢氧化铜:Cu(OH)2氢氧化锌:Zn(OH)2氢氧化钡:Ba(OH)2氢氧化铝:Al(OH)3氢氧化铁:Fe(OH)36、含铵根离⼦的物质的化学式氯化铵:NH 4Cl 溴化铵:NH 4Br 硫酸铵:(NH 4)2SO 4 碳酸铵:(NH 4)2CO 3 7、含碳酸根离⼦的物质的化学式碳酸钠:Na 2CO 3 碳酸钾: K 2CO 3 碳酸银:Ag 2CO 3碳酸镁:MgCO 3 碳酸钙:CaCO 3 碳酸铜:CuCO 3 碳酸钡:BaCO 3 碳酸锌:ZnCO 3 8、含硝酸根离⼦的物质的化学式硝酸镁:Mg(NO 3)2 硝酸钙:Ca(NO 3)2 硝酸铜:Cu(NO 3)2 硝酸钡:Zn(NO 3)2 9、含硫酸根离⼦的物质的化学式硫酸钠:Na 2SO 4 硫酸钾:K 2SO 4 硫酸银:Ag 2SO 4硫酸镁:MgSO 4 硫酸钙:CaSO 4 硫酸铜:CuSO 4 硫酸锌:ZnSO 4 硫酸钡:BaSO 4 硫酸亚铁:FeSO 4 硫酸铁:Fe 2(SO 4)3 硫酸铝:Al 2(SO 4)3 四、化学⽅程式 1、燃烧类:碳燃烧:(1) C + O 2CO 2点燃(充分燃烧)(2) 2C + O 22CO 点燃(不充分燃烧)(3)磷燃烧:4P + 5O 22P 2O 5点燃(4)硫燃烧:S+ O 2SO 2点燃(5)铁燃烧:3Fe +2O 2Fe 3O 4点燃(6)镁燃烧:2Mg +O 22MgO 点燃(7)氢⽓燃烧:2H 2 +O 22H 2O 点燃(8)⼀氧化碳燃烧:2CO +O 22CO 2点燃(9)甲烷燃烧:CH 4 + 2O 2CO 2 + 2H 2O 点燃(10)酒精燃烧:C 2H 5OH + 3O 22CO 2 + 3H 2O 点燃2、实验室制取氧⽓:①加热⾼锰酸钾:2KMnO 4K 2MnO 4 + MnO 2 +O 2②分解过氧化氢:2H 2O 2MnO 2③加热氯酸钾:2KClO 3MnO 22KCl + 3O 23、电解⽔:2H 2O 2H 2 + O 2通电4、铁和硫酸铜反应:Cu + FeSO 4Fe + CuSO 45、硫酸铜和氢氧化钠反应:Na 2SO 4 + Cu(OH)2 CuSO 4 + 2NaOH还原性:6、单质碳的还原性:①还原氧化铜:2CuO +C2Cu + CO 2⾼温②还原氧化铁:2Fe 2O 3 + 3C⾼温4Fe + 3CO 2③还原⼆氧化碳:CO 2 + C⾼温2CO7、⼀氧化碳的还原性:①还原氧化铜:CuO + COCu + CO 2②还原氧化铁: Fe 2O 3+ 3CO ⾼温2Fe + 3CO 2③还原四氧化三铁:3Fe + 4CO 2⾼温8、氢⽓还原氧化铜:CuO + H 2Cu + H 2O9、实验室制取⼆氧化碳原理:CaCO 3 + 2HCl CaCl 2 + CO 2 + H 2O10、⼯业制取⼆氧化碳:CaO + CO 2CaCO 3煅烧11、检验⼆氧化碳原理:CO 2 + Ca(OH)2CaCO 3 + H 2O (使澄清⽯灰⽔变浑浊)12、⼆氧化碳与⽔反应:CO 2 + H 2OH 2CO 313、碳酸分解:CO 2 + H 2O H 2CO 314、⽣⽯灰与⽔反应⽣成熟⽯灰:CaO + H 2OCa(OH)2 (此反应放出⼤量的热)15、实验室制取氢⽓:Zn + H 2SO 4ZnSO 4 + H 2九年级下册:⾦属和⾦属材料16、铝被氧化:4Al + 3O22Al2O317、镁、锌、铁与盐酸(或稀硫酸)反应制取氢⽓①镁Mg + 2HCl MgCl2 + H2②锌Zn + 2HCl ZnCl2 + H2③铁Fe + 2HCl FeCl2 + H2⾦属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au⾦属活动性由强逐渐减弱9、⼆氧化碳通过灼热碳层: C+CO22CO10、⼀氧化碳燃烧:2CO+O22CO211、⼆氧化碳和⽔反应(⼆氧化碳通⼊紫⾊⽯蕊试液):CO2+H2O==H2CO3(溶液变红)12、⽣⽯灰溶于⽔:CaO+H2O==Ca(OH)213、⽆⽔硫酸铜作⼲燥剂:CuSO4+5H2O==CuSO4·5H2O16、⽔在直流电的作⽤下分解:2H2O 2H2↑+O2↑17、碳酸不稳定⽽分解:H2CO3==H2O+CO2↑18、⾼温煅烧⽯灰⽯(⼆氧化碳⼯业制法):CaCO3 CaO+CO2↑19、铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu(湿法炼铜的反应原理)20、锌和稀硫酸反应(实验室制氢⽓):Zn+H2SO4==ZnSO4+H2↑21、镁和稀盐酸反应:Mg+2HCl==MgCl2+H2↑22、氢⽓还原氧化铜:H2+CuO Cu2Cu+CO2↑24、⽔蒸⽓通过灼热碳层:H2O+C H2+CO(⽔煤⽓)25、焦炭还原氧化铁:3C+2Fe2O34Fe+3CO2↑26、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4==Cu(OH)2↓+Na2SO4(蓝⾊沉淀)27、甲烷在空⽓中燃烧:CH4+2O2 CO2+2H2O (蓝⾊⽕焰)28、酒精在空⽓中燃烧:C2H5OH+3O2 2CO2+3H2O31、⼆氧化碳通过澄清⽯灰⽔(检验⼆氧化碳):Ca(OH)2+CO2==CaCO3↓+H2O(变浑浊)32、氢氧化钠和⼆氧化碳反应(除去⼆氧化碳):2NaOH+CO2==Na2CO3+H2O 有机物:甲烷CH4、⼄醇(俗名酒精)C2H5OH。
九年级常见化学用语和化学方程式

九年级常见化学用语和化学方程式五、课本中的化学方程式:第二单元:1、红磷在氧气中燃烧4 P + 5 O2 2 P2O52、碳在氧气中燃烧 C + O2CO23、硫在氧气中燃烧S + O2 SO24、铁在氧气中燃烧 3 Fe + 2 O2Fe3O45、铝在氧气中燃烧 4 Al + 3 O2 2 Al2O36、用过氧化氢制氧气 2 H2O2 2 H2O + O2↑7、用高锰酸钾制氧气2KMnO4K2MnO4+ MnO2+ O2↑8、用氯酸钾和二氧化锰的混合物制氧气 2 KClO3 2 KCl + 3 O2↑第三单元:9、水通电分解(电解水) 2 H2O 2 H2↑+ O2↑10、汞受热2Hg+O22HgO11、氧化汞受热分解2HgO2Hg+O2↑12、氢气在空气中燃烧 2 H2 + O2 2 H2O13、氢气还原氧化铜H2 + CuO Cu + H2O第四单元:第五单元:14、铁和硫酸铜溶液反应Fe + CuSO 4FeSO4 + Cu15、碳酸钠和盐酸反应Na 2CO3+2HCl2NaCl+H2O+CO2↑16、镁条在空气中燃烧 2 Mg + O2 2 MgO17、高温煅烧石灰石(二氧化碳的工业制法)CaCO3CaO + CO2↑第六单元:2 CO18、碳在氧气中不充分燃烧 2 C + O2 (不足)19、碳跟氧化铜反应 C + 2 CuO 2 Cu + CO2↑20、碳跟氧化铁反应 3 C + 2 Fe2O3 4 Fe + 3 CO2 ↑21、碳跟二氧化碳反应C+CO22CO+ 2HCl CaCl2 + CO2↑+ H2O22、实验室制取二氧化碳CaCO23、二氧化碳与水反应CO 2 + H2O H2CO324、碳酸分解H 2CO3CO2 ↑+ H2O25、二氧化碳与氢氧化钙溶液反应(二氧化碳的检验方法)CO 2 + Ca(OH)2CaCO3↓+ H2O26、一氧化碳燃烧 2 CO + O2 2 CO227、一氧化碳还原氧化铜CO +CuO Cu + CO228、一氧化碳还原氧化铁 3 CO +Fe2O3 2 Fe + 3 CO2第七单元:29、甲烷燃烧CH4 + 2 O2CO2 + 2 H2O30、酒精燃烧C2H5OH + 3 O2 2 CO2 + 3 H2O第八单元:31、镁和稀盐酸反应镁和稀硫酸反应Mg + 2 HCl MgCl+ H2↑Mg + H2SO4MgSO4 + H2↑32、锌和稀盐酸反应锌和稀硫酸反应(实验室制取氢气)Zn + 2 HCl ZnCl+ H2↑Zn + H2SO4ZnSO4 + H2↑33、铁和稀盐酸反应铁和稀硫酸反应+ H2↑Fe + H2SO4FeSO4 + H2↑Fe + 2 HCl FeCl34、铝和稀盐酸反应铝和稀硫酸反应+3H2↑2Al+ 3H2SO4Al2(SO4)3 +3 H2↑2Al+6HCl2AlCl35、铝和硫酸铜溶液反应 2 A l + 3 CuSO 4Al2(SO4)3 + 3CuCu(NO3)2 + 2 Ag36、铜和硝酸银溶液反应Cu + 2 AgNO第十单元:37、铁锈与稀盐酸反应铁锈与稀硫酸反应FeO3+6HCl2FeCl3+3H2O Fe2O3+3H2SO4Fe2(SO4)3+3H2O38、氧化铜与稀硫酸反应H2SO4+ CuO Cu SO4+ H2O39、氧化钙与水的反应CaO+HO Ca(OH)240、氢氧化钠溶液与二氧化碳反应2NaOH+CO 2Na2CO3+H2O41、二氧化硫与氢氧化钠溶液反应2NaOH+SO 2Na2SO3+H2O42、三氧化硫与氢氧化钠溶液反应2NaOH+SO 3Na2SO4+H2O43、氢氧化钠与盐酸反应氢氧化钠与硫酸反应NaOH+HCl NaCl+H 2O 2NaOH+H2SO4Na2SO4+H2O44、氢氧化钙与盐酸反应氢氧化钙与硫酸反应+2HCl CaCl2+2H2O Ca(OH)2+H2SO4CaSO4+2H2OCa(OH)第十一单元:45、碳酸氢钠与盐酸反应NaHCO 3+HCl NaCl+H2O+CO2↑CO3+Ca(OH)2CaCO3↓+2NaOH46、碳酸钠溶液与氢氧化钙溶液反应Na初中化学常见物质的颜色(后面是物质化学式或物质名称,前面是颜色)1. 常见物质的颜色:多数气体为无色,多数固体化合物为白色,多数溶液为无色。
初中常见离子

初中常见离子
1.金属离子
金属离子是指在化学反应中失去一个或多个电子的金属原子形成的带正电荷的离子。
在化学反应中,金属原子通常会失去它们的外层电子,形成正离子。
比如,钠原子通常会失去一个电子,形成Na+离子;铝原子通常会失去三个电子,形成Al3+离子。
2.非金属离子
非金属离子是指在化学反应中获得一个或多个电子的非金属原子形成的带负电荷的离子。
在化学反应中,非金属原子通常会获得外层电子,形成负离子。
比如,氯原子通常会获得一个电子,形成Cl-离子;氧原子通常会获得两个电子,形成O2-离子。
3.酸性离子
酸性离子是指在溶液中具有酸性的离子。
比如,硫酸根离子SO4^2-、硫代硫酸根离子S2O3^2-等都是常见的酸性离子。
4.碱性离子
碱性离子是指在溶液中具有碱性的离子。
比如,氢氧根离子OH-、氧化铁根离子FeO4^2-等都是常见的碱性离子。
5.盐类离子
盐类离子是指在化学反应中形成的带正或负电荷的离子。
比如,氯化钠NaCl、硫酸钠Na2SO4等都是常见的盐类离子。
试卷题目:
1.请简要介绍金属离子和非金属离子的定义及例子。
2.请列举两种酸性离子和两种碱性离子的例子。
3.请用化学式表示氯化钠和硫酸钠的离子形式。
常见物质化学式及离子符号
碳酸钠
氨水
Al(OH)3 碳酸钙 NH3˙H2O 碳酸锌 硝酸银 硝酸钠
亚硝酸钠
氯化铵 硝酸铵 硫酸铵
碳酸氢铵
氯酸钾
硝酸钙
硝酸亚铁
Ca(NO3)2 高锰酸钾 KMnO4 Fe(NO3)2 锰酸钾 Fe(NO3)3 碳酸氢钠 NaHCO3
硝酸铁
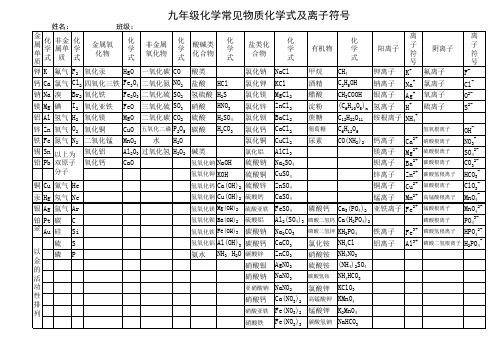
九年级化学常见物质化学式及离子符号
姓名: 金 属 单 质 钾 钙 钠 镁 铝 锌 铁 锡 铅 铜 汞 银 铂 金 氦气 氖气 氩气 碳 硅 硫 磷 非金 化 属单 学 质 式 氟气 氯气 溴 碘 氢气 氧气 氮气 金属氧 化物 氧化汞 四氧化三铁 氧化铁 氧化亚铁 氧化镁 氧化铜 二氧化锰 氧化铝 氧化钙 班级: 化 学 式 非金属 氧化物 一氧化碳 二氧化氮 二氧化硫 三氧化硫 二氧化碳
九年级化学常见物质化学式及离子符号
姓名: 金 属 单 质 钾 化 非金 化 学 属单 学 式 质 式 K 金属氧 化物 班级: 化 学 式 HgO 非金属 氧化物 化 学 式 酸碱类 化合物 酸类 盐酸 硝酸 硫酸 HCl HNO3 H2SO4 H2CO3 氢硫酸 H2S 化 学 式 盐类化 合物 氯化钠 氯化钾 氯化镁 氯化锌 氯化钡 氯化钙 氯化铜
五氧化二磷
化 学 式
酸碱类 化合物 酸类 盐酸 氢硫酸 硝酸 硫酸 碳酸 碱类
氢氧化钠 氢氧化钾 氢氧化钙 氢氧化铜 氢 氧 化 镁 氢 氧 化 钡 氢 氧 化 铁 氢氧化铝
化 学 式
盐类化 合物 氯化钠 氯化钾 氯化镁 氯化锌 氯化钡 氯化钙 氯化铜
氯化铝
化 学 式
有机物 甲烷 酒精 醋酸 淀粉 蔗糖
一氧化碳 CO
钙 Ca 氯气 Cl2 四氧化三铁 Fe3O4 二氧化氮 NO2 钠 Na 溴 镁 Mg 碘 Fe2O3 二氧化硫 SO2 FeO MgO CuO MnO2 CaO 三氧化硫 SO3 二氧化碳 CO2 水 H2O
