著名药厂的提取车间风险评估分析
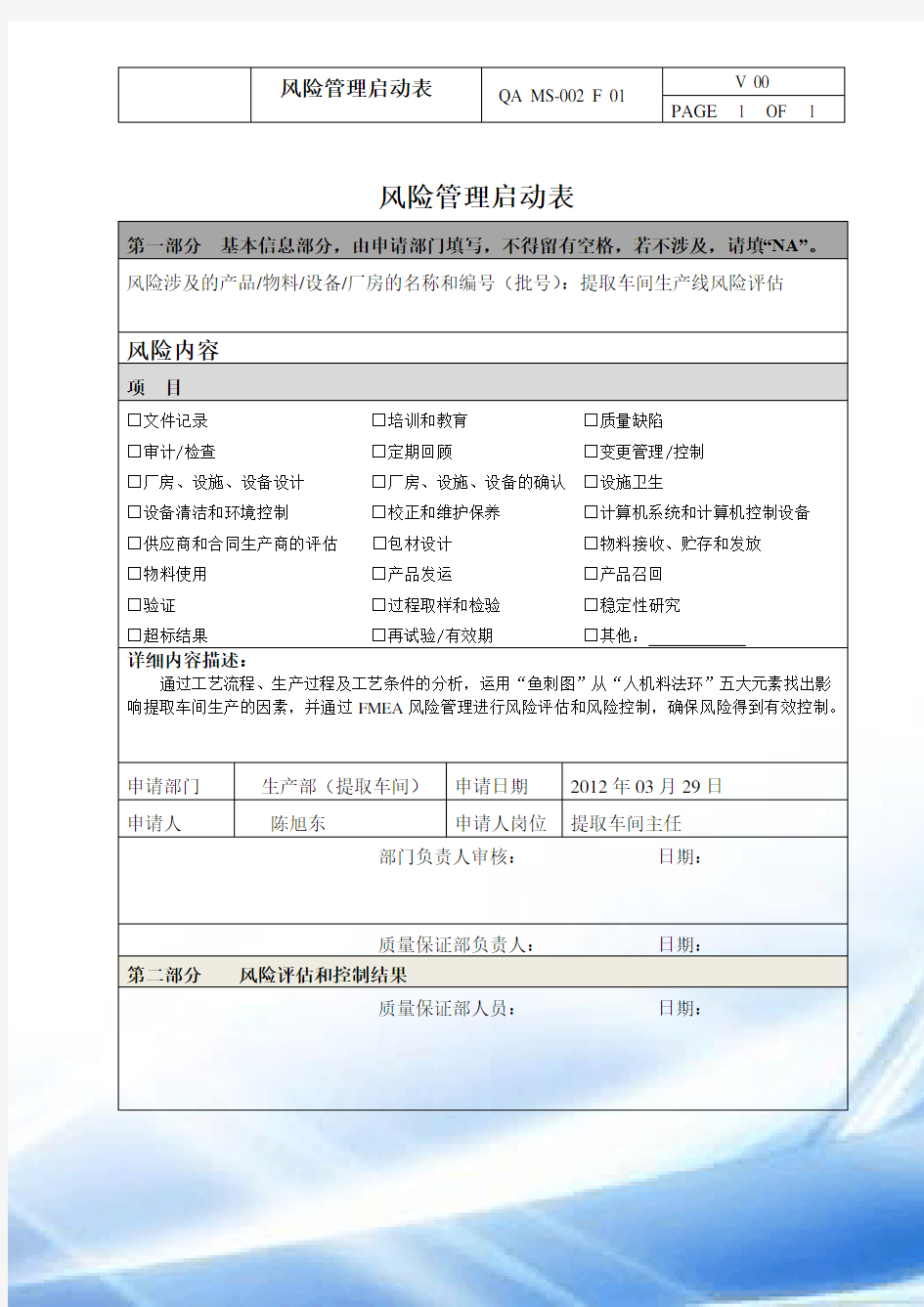

风险管理启动表QA MS-002 F 01 V 00
PAGE 1 OF 1
风险管理启动表
第一部分基本信息部分,由申请部门填写,不得留有空格,若不涉及,请填“NA”。
风险涉及的产品/物料/设备/厂房的名称和编号(批号):提取车间生产线风险评估
风险内容
项目
□文件记录□培训和教育□质量缺陷
□审计/检查□定期回顾□变更管理/控制
□厂房、设施、设备设计□厂房、设施、设备的确认□设施卫生
□设备清洁和环境控制□校正和维护保养□计算机系统和计算机控制设备
□供应商和合同生产商的评估□包材设计□物料接收、贮存和发放
□物料使用□产品发运□产品召回
□验证□过程取样和检验□稳定性研究
□超标结果□再试验/有效期□其他:
详细内容描述:
通过工艺流程、生产过程及工艺条件的分析,运用“鱼刺图”从“人机料法环”五大元素找出影响提取车间生产的因素,并通过FMEA风险管理进行风险评估和风险控制,确保风险得到有效控制。
申请部门生产部(提取车间)申请日期2012年03月29日
申请人陈旭东申请人岗位提取车间主任
部门负责人审核:日期:
质量保证部负责人:日期:
第二部分风险评估和控制结果
质量保证部人员:日期:
风险评估和控制报告
1. 目的
运用风险管理的工具,全面评估现有提取车间的生产线,通过质量风险管理方法评估后确定关键工艺参数和质量控制点,提高质量风险控制的能力,以确保持续稳定的生产出符合预定用途的物料。
2. 范围
提取生产线的风险评估及控制。
3. 定义
3.1参数/工艺参数:在某个工艺下定义单个条件的单个参数。比如工艺参数有温
度,真空度,压力,相对密度,数量等等。
3.2质量属性:一个直接或间接影响物料质量的物理化学或微生物特性(比如产
品的纯度、潜能、鉴别、稳定性)。产品指标是生产者提出和证明、由法规机构批准的质量特性。
3.3可接受范围:在确认过的范围内的工艺参数下进行操作,同时保持其他参数
不变,能生产出符合其相应质量特性的物料。
3.4失效模式和效果分析((Failure Mode and Effect Analysis,FMEA)是一种用来
确定潜在失效模式及其原因的分析方法。
3.5因果图(Cause-and-Effect Diagram),一般它是用来从不良结果反推其可能产生
的原因。如图所示。通常一个质量问题不外由人、机、料、法、环五个因素引起,进行逐项研究找出影响因素。
4. 职责
序号姓名部门职务主要职责
1 姚位平质量保证部质量监控员起草风险评估文件并组织评估小组成员参和评估讨论
2 张显坤质量保证部质量运营室主任
参和风险评估,对风险评估内
容及降低风险措施提出意见
3 彭加忠质量检验部经理
4 黄巧物流部经理
5 陈礼太生产部经理
6 谌东平设备动力部经理
7 何鸿组长质量管理负责人审批评估报告
5. 项目分析
经质量风险分析,按现有生产质量管理模式,该产品的质量风险级别为低风险级。影响产品质量的关键因素有物料的质量,设备、设施,环境,各生产工序的操作规范。见附表1。
6. 使用的风险工具及参考资料
6.1 鱼刺图
6.2 FMEA
7.风险可接受性(是否可接受)
以上风险均为低风险,通过现有措施可以控制风险,只需进行监控即可。8.风险控制措施/负责人/完成时间
8.1对物料的质量应从源头控制,需加强对供应商的管理,每批物料须检验合格,
并经审核放行后领用。
8.2对生产工序加强质量控制,根据工艺特点制定各工序的质量监控要点如下:8.2.1监控点
按生产工序设置监控点,不得遗漏。各监控点如下:(水提)投料量、加水量、煮提温度、保沸时间、水提取液量;(醇提)投料量、加醇量、煮提温度、保沸时间、回收酒精浓度、醇提药液量;(浓缩收膏)浓缩进料量、浓缩温度、真空度、蒸汽压力大小、;(沸腾制粒)投料量、喷液速度、进出风量、制出颗粒量、粉碎筛网目数、过筛后颗粒量;(喷雾干燥)投料量、进料速度、进出风温度、收粉量。
8.2.2监控频次
每个监控点均需在开工前、生产过程中、生产结束后进行监控,重点工序增加监控频次。
8.2.3监控方法
8.2.3.1 开工前及生产结束后,重点监控人、机、料、法、环是否符合工艺标准,
达到相应清场要求。监控物料数量、外观质量、标记、贮存条件及管理是否符合要求。监控设备及计量器具是否处于完好状态,有标记,有检定合格证。
监控相应的凭证、记录是否齐全规范,决定是否准许开工。
8.2.3.2 生产过程重点监控工艺规程和岗位SOP的贯彻执行情况,生产现场管理是否有序规范,状态标记是否齐全、正确,批生产记录是否及时填写,中间产品的质量是否达到标准。对物料能否流转,能否入库做出决定,为批生产记录审核提供依据。
8.2.4 重点工序监控
8.2.4.1 提取、浓缩收膏、喷雾干燥是保证产品质量的重要工序,重点监控各物
料准确投料,提出的药液量及浓缩收膏量,收膏洁净度是否达到,制粒
干燥后颗粒大小均匀、无色差。
8.2.4.2 浓缩收膏后取样,检查浸膏中的固含物应符合规定。
8.2.4.3最终制粒干燥后取样,检查颗粒水分应符合规定。
8.3风险控制措施详见FMEA风险评估分析表,完成时间为2012年07月27日。起草人/时间:审核人/ 时间:审批人/时间:
FMEA风险评估申请表QA OS-012 F 01 V 00
PAGE 1 OF 2
FMEA风险评估申请表
第一部分风险评估申请
题目提取车间生产线风险评估
适用范围设施□ 设备□
系统□子系统□ 部件□ 工艺□ 其他
问题描述1、提取车间在生产过程中的人员操作风险
2、提取车间在生产过程中的设备操作风险
3、提取车间在生产过程中的物料使用风险
4、提取车间在生产过程中的人员是否按照SOP操作
5、提取车间安装环境是否适应生产、操作
6、清场及设备清洗情况对下批次产品质量的影响
是否接受申请结论:
同意□ 不同意□
FMEA风险评估小组组长:年月日
FMEA 风险评估申请表 QA OS-012F 01
V 00
PAGE 2 OF 2
第二部分 风险评估(风险评估分析表附后) 评估结论
以上风险均为低风险,通过现有措施可以控制风险,只需进行监控即可。
签名: 日期:
第三部分 后续措施跟踪 CAPA 号: 编号 简要描述
负责人
完成时限
1
2 3 4 5
第四部分 风险评估小组批准
姓 名 部 门 职 务 工作的职责
签名/日期 姚 位 平 质量保证部 组 员 起草风险评估文件并组织评估小组成
员参和评估讨论
张 显 坤 质量保证部 组 员 参和风险评估,对风险评估内容及降低风险措施提出意见
彭 加 忠 质量检验部 组 员 黄 巧 物流部 组 员 陈 礼 太 生产部 组 员 谌 东 平 设备动力部 组 员
何 鸿
质量保证部
组 长 审批评估报告
第五部分 质量保证部批准 质量保证部批准
日期
FMEA风险评估分析表
设施/工艺/设备/系统/其他:提取车间生产线的风险
编号:_ QR201203001________ _
发起日期:_ 2012年03月29 日_____ 完成日期:__ 2012年07月27日________________ 组长:_____何鸿_______________________________副组长:_________ ——___________________
组员: 张显坤、彭加忠、黄巧、谌东平、陈礼太
风险识别
风险评估风险控制批准及执行措施结果确认(剩余风险评估)
序号项目
功能潜在失败/
故障后果
潜在失败/故
障起因/机理
现行设计控制预防措施
严
重
性
S
概
率
O
可
检
测
性
D
PRN 采取的措施责任人
目标完
成日期
严
重
性
S
概
率
O
可
检
测
性
D
PRN
1 物料物料(原辅
包及中间产
品)污染进入物料不
合格,物料在
厂区存储条
件不符合规
定
进入物料不合格,进厂物料及时退
回供应商,将中间产品存储在规定
环境内, 避免造成污染;进入洁净
区域的物料应进行消毒,除去外包,
由缓冲间进入洁净区
3 2 1 6
2 前处理造成人员伤
亡人员疲劳,设
备安装不符
合规定,材质
不符合要求
拣选-视觉疲劳-经常更换人员。药-
刀片滑落。洗药机漏电,干燥,经
常翻料,防止阴阳脸,粉碎-人员绞
伤,漏电等。筛网破裂,产品粒度
不一致,金属屑进入物料,建议用
不锈钢。确认筛网完好。加强防护
措施。
2 1 1 2
风险识别
风险评估风险控制批准及执行措施结果确认(剩余风险评估)
序号项目
功能潜在失败/
故障后果
潜在失败/故
障起因/机理
现行设计控制预防措施
严
重
性
S
概
率
O
可
检
测
性
D
PRN 采取的措施责任人
目标完
成日期
严
重
性
S
概
率
O
可
检
测
性
D
PRN
3 提取罐导致设备爆
炸压力表显示
压力和罐内
压力不符
将压力表全部更换,使表上压力显
示和罐内压力一致(将1.6MPa的压
力表全部更换为0.6MPa,使表上压
力显示和罐内压力一致)
3 1 2 6
污染物料提取罐存在
盲管
减少盲管段的使用,使用前清理盲
管,至符合规定要求为止
3 2 1 6
安全隐患提取过程中
压空突然中
断建议增加压空缓冲罐
2 1 2 4
安全隐患投料口和出
料口蒸汽过
大引起烫伤易中暑,加强通风,在高速运转部
位加防护罩,双人操作,加强复核;
排渣门,排渣时的人员安全;增加
安全阀,正确使用安全防护工具。
禁止不带防护工具触摸设备管道。
设备带压,建议增加罐内安全阀及
压力表
2 1 2 4
安全隐患醇提含有酒
精避免携带易燃易爆品,应安装防爆
装置,不应有带静电的物品 2 1 2 4
4 储液罐污染物料清洗情况对
下批次物料
的污染保证储液罐使用前已清洁、无残留
物,储液罐使用前按相关规程认真
清洁设备,保证设备清洁效果符合
要求。
4 2 1 8
风险识别
风险评估风险控制批准及执行措施结果确认(剩余风险评估)
序号项目
功能潜在失败/
故障后果
潜在失败/故
障起因/机理
现行设计控制预防措施
严
重
性
S
概
率
O
可
检
测
性
D
PRN 采取的措施责任人
目标完
成日期
严
重
性
S
概
率
O
可
检
测
性
D
PRN
导致物料流
失
管道卡箍松
动或脱落,导
致物料流失
保证储液罐使用前各管道接头无跑
冒滴漏现象,各紧固装置紧固良好。
使用前加强预防。
3 2 1 6
5 三足式
离心机污染物料清洁不符合
要求
设备使用前后认真清洁设备,保证
清洁效果符合要求
2 1 2 4 影响人体舒
适度
设备运行噪
音过大
加强隔音保护,带隔音耳套
1 2 1 2 导致物料流
失
管道连接软
管卡箍松动
或脱落,导致
物料流失
保证离心机使用前各管道接头无跑
冒滴漏现象,各紧固装置紧固良好。
使用前加强预防。
4 2 1 8
滤袋堵塞滤渣过多,堵
塞滤网
检查多层过滤效果,保证前面各层
过滤效果符合要求(检查各层过滤
滤网无问题,能有效过滤滤渣,保
证较大滤渣不流入下层管道。
2 1 1 1
6 双效浓
缩器跑料真空异常,真
空度变大
调节双效浓缩器的)真空,使其保
持在正常范围内;进料高度保持在
中下部,排空,关进料阀。
2 1 2 4
导致改变物
料性状或导
致有效成分
流失
罐内药液温
度过高
随时注意罐内温度,调节蒸汽阀门
的大小(温度过高应立即减小蒸汽,
调节蒸汽阀门)
2 2 1 4
风险识别
风险评估风险控制批准及执行措施结果确认(剩余风险评估)
序号项目
功能潜在失败/
故障后果
潜在失败/故
障起因/机理
现行设计控制预防措施
严
重
性
S
概
率
O
可
检
测
性
D
PRN 采取的措施责任人
目标完
成日期
严
重
性
S
概
率
O
可
检
测
性
D
PRN
加热器爆炸蒸汽过大调节蒸汽阀门,使其保持在正常范
围(建议增加蒸汽安全阀)
3 1 1 3
浓缩收膏洁
净度未达到
要求
每次均在洁净采样车中收膏,采样
车需达到D级要求(尘埃粒子数及
沉降菌均应符合要求,紫外灯照度
符合要求,并在规定时间内对其进
行监测)
3 1 2 6
7沸腾制
粒机跑料调节排风量,使排风量和进风量保
持平衡
3 1 1 3 塌锅将塌锅后的物料重新进行干燥粉碎
融化,再将其喷雾干燥
2 2 1 4 料仓网破裂检查料仓网是否完好,将其及时更
换,安装
2 2 1 4 筛网破裂导致物料中
有异物,不合
格颗粒过筛
后未拣出
检查筛网是否完好,将其及时更换,
安装
3 2 1 6
8 喷干塔温度异常造成物料损
失使喷干塔温度一直保持在规定条件
内,操作人员应设置温度警戒线,
启用警戒线报警设置
3 1 2 6
粘塔造成物料损
失操作人员应通过观察窗随时观察物
料沸腾状态,如塔内物料未呈现飞
絮状应停机检查
3 2 1 6
风险识别
风险评估 风险控制 批准及执行
措施结果确认(剩余风险评估)
序号 项目
功能 潜在失败/
故障后果 潜在失败/故
障起因/机理 现行设计控制预防措施
严重性S
概率O
可检测性D
PRN 采取的措施
责任人
目标完成日期 严
重
性
S 概率O
可检测性D
PRN
9
空调系
统
污染物料,压差、温湿度异常
使用之前检查空调系统是否完好;空调系统异常应及时将物料存储在符合规定的环境,操作人员应尽量
避免在洁净区内,及时请机修人员维修;初、中、高效出现漏洞,及时清洗初、中效,更换高效
4
1
2
8
外来污染源
操作人员进入洁净区应按操作规程操作进入,物料进入洁净区域应消
毒,除去外包后进入,设备设施也应消毒处理后由缓冲间进入
3
1
2
6
10 工艺 工艺缺陷
验证过程中按实际参数进行记录,
填写参数应准确及时,不写回忆录
4
2 1 8
图1
提取线生产过程中
所存在的风险
设备设施
设备设施的使用 人员操作
维护保养及定期校验
关键部件及易损部件的更换
人 员
人员自身操作失误
人员未按标准操作
人员自身操作习惯 物料(原辅包及中间产品)
进出物料的检验
生产过程中物料的使用,贮存
环 境
生产区本身环境 净化后的生产环境
外来污染源
标准操作规程
文件
文件中的缺陷
GMP 文件
工艺参数,方法
工艺风险评估
ISPE-CCPIE CHINA CONFERENCE 2012
工艺风险评估关键质量属性&关键工艺参数
September 24-25 2012 Beijing
1
目录
? 为什么必须要找到CQA&CPP? ? 如何定义CQA&CPP? ? 如何开展CQA&CPP风险评估工作? ? ISPE 知识概述
ISPE-CCPIE CHINA CONFERENCE 2012
2
术语
? CQA(Critical Quality Attribute)关键 质量属性
? CPP(Critical Process Parameter) 关 键工艺参数
ISPE-CCPIE CHINA CONFERENCE 2012
3
为什么必须要找到CQA&CPP?
ISPE-CCPIE CHINA CONFERENCE 2012
4
为什么必须找到CQA&CPP?
? 法规规定 ? 指南要求
ISPE-CCPIE CHINA CONFERENCE 2012
5
SFDA GMP2010年版
? 第二章 质量管理 第四节质量风险管理
? 第十三条 质量风险管理是在整个产品生命周期 中采用前瞻或回顾的方式,对质量风险进行评估 、控制、沟通、审核的系统过程。
? 第十四条 应当根据科学知识及经验对质量风险 进行评估,以保证产品质量。
? 第十五条 质量风险管理过程所采用的方法、措 施、形式及形成的文件应当与存在风险的级别相 适应。
ISPE-CCPIE CHINA CONFERENCE 2012
6
生产工艺质量风险评估
生产工艺质量风险评估 严重性分级标准高(H)失败使中间产品或成品质量指标出现不合格或产生质量隐患,或对批产品质量均一性产生不良影响,导致该批产品全部做报废处理。中(M)失败使中间产品某项质量指标不合格,但可经偏差处理,且不会对批产品质量均一性产生不良影响,不会导致成品有什么质量缺陷或隐患。低(L)失败只会造成个别产品质量指标不合格,但可以百分之百将不合格品剔除。1、1、2 频率分级标准高(H)发生可能性每季高于1次。中(M)发生可能性每年高于1次,低于4次。低(L)发生可能性每年低于1次。1、1、3 可检测性分级标准高(H)具有反映质量均一性的质量指标,如含量均匀度、有关物质等能被仪器、设备100%控制和检测。中间产品质量与成品质量指标均对同一质量项目进行控制和检测。中(M)涉及水分、装量等能被仪器、人员进行离线检测,但如不对过程进行有效控制,产品质量均一性无法确认,检测结果应被怀疑的质量指标。低(L)无法对影响产品质量的控制指标的真实性进行有效监控,因此可能会影响到产品质量均一性,也可能会造成整批产品报废,可通过产品质量间接反映出问题。1、2 风险分析列表项目可能的失败模式可能的失败影响风险评价控制措施风险再评价验证活动严重性S可能性O可检测性D风险级别严重性S可能性O可检测性D风险级别领料领料发料错误产品整批报废HMHM按生产指令、批生产记录进行复核。
HLHL确认复核方式、复核内容粉碎过筛使用了错误的筛网物料细度与工艺要求不一致,影响后续工艺和产品溶出度HMMH筛网应有目数标识;每次使用前操作人员必需核对筛网目数;用标准筛对物料粉末进行过筛检查;HLHL确认筛网标识、筛网目数;检查粉末细度;筛网破裂异物进入产品中HMMH每次使用前、后对筛网的完好性进行检查HMHL确认筛网的完好性;软材制备软材干湿度不均匀影响湿颗粒的制备MMMM控制设备转速、粘合剂浓度与加量、湿混时间;依据经验判定软材的干湿程度;MLML确认设备转速、粘合剂、软材外观;软材含量不均匀影响干颗粒、成品含量的均一性HMMH控制干混时间、湿混时间;MLMM确认干混、湿混时间粘合剂配制错误整批产品报废HLMM双人单独复核粘合剂名称、浓度HLLL确认复核方式湿法制粒湿法整粒刀转速过低或过高颗粒粒度不符合要求,影响后续生产MMMM每次使用前操作人员必需确认整粒刀转速;MMHL确认整粒刀转速;筛网破裂异物进入产品中HMMH 每次使用前、后对筛网的完好性进行检查HMHL确认筛网的完好性;沸腾干燥使用的干燥空气不洁净颗粒被微生物污染HHMH使用高效过滤器对空气进行过滤,并定期维护保养、更换HLMM无使用的干燥空气风量不足延长干燥时间,影响药品水分含量MMMM控制风机频率,确保风量;控制抖袋频次,防止堵塞;MLML确认风机频率、抖袋频次;加热温度不足延长干燥时间,影响药品水分含量MMMM控制进风温度、物料温度及干燥时间; MLML确认进风温度、物料温度及干燥时间;干燥颗粒损耗大物料平衡、收率不合
工艺风险评估与验证案例
2011年11月 1
2011年11月 2
Figure 28. Process map for Example MR Tablets, 10 mg 图28 实例10 mgMR片剂的工艺图 2011年11月 3
Example QbD MR Tablet Module 3 Quality 3.2.P.2 Pharmaceutical Development 实例QbD MR片剂模块3质量3.2.P.2药物开发 2.3.1 Initial Risk Assessment of the Drug Product Manufacturing Process 药品生产工艺的初始风险评估 A risk assessment of the overall drug product manufacturing process was performed to identify the high risk steps that could affect the final drug product CQAs. Subsequently, the drug product intermediate CQAs that are directly linked to the identified final drug product CQAs were identified. The process variables that could impact the identified drug product intermediate CQAs became the focus of the risk assessment to determine which variables have the highest potential to cause a CQA failure. These variables then needed to be investigated in order to optimize the drug product manufacturing process and reduce the risk of failure. For example, the overall risk assessment of the manufacturing process found assay of the tablets to be at high risk of failure due to the drug layering step. Subsequently, assay of the layered beads is directly linked to final tablet assay and was identified as the CQA of the drug-layered beads. Process variables that could directly impact the assay of the drug-layered beads were assessed to identify which of the variables could have the highest potential to cause a bead assay failure. This method of identifying process variables for further study was also illustrated previously in Figure 19. 进行整体药品生产工艺的风险评估以确定可能影响最终药品CQAs的高风险步骤。随后,确定直接与已确定的最终药品CQAs相关的药品中间体CQAs。可能影响已确定的药品中间体CQAs的工艺变量成为风险评估的焦点,以确定哪些变量最可能引起CQA不合格。然后需要研究这些变量以便优化药品生产工艺并降低不合格的风险。例如,整体生产工艺的风险评估发现片剂的含量是不合格的高风险由于层积上药步骤。随后,层积微丸的含量直接与最终片剂含量相关,曾被确定为层积上药微丸的CQA。评估可直接影响层积上药微丸含量的工艺变量以确定哪些变量最有可能引发微丸含量不合格。这种确定用于进一步研究的工艺变量的方法之前也在图19中进行了说明。 In the initial risk assessment of the overall manufacturing process shown in Table 51, drug layering, ER polymer coating, blending and lubrication, and compression were identified as high risk steps that could affect the quality of the final product. Justification for each risk assignment is presented in Table 52. 表51所示的整体生产工艺的初始风险评估中,确定层积上药,ER聚合物包衣,混合和润滑,及压缩为可影响最终药品质量的高风险步骤。每个风险分配的依据见表52。
生产车间安全风险评估报告(验厂用)
1.编制依据 1.1相关标准 1)G BT/T 13861 生产过程危险和有害因素分类与代码 2)A Q/T 9006-20101 企业安全生产标准化基本规范; 3)G B 18218-2009 危险化学品重大危险源辨识 4)Y C/T 384.1.2.3-2011烟草企业安全生产标准化规范标准 5)G B 6441-86 企业职工伤亡事故分类标准 6)其他安全标准 1.2设备的有关资料 1)使用说明书 2)设备使用情况、维修记录、顾客投诉、意外事故记录等 3)其他资料 2.目的和适用范围 本文是对车间各工段主要设备进行风险管理的报告,报告中对自查到的可能危害以及每一个危害产生的原因进行了判定。对于每种危害可能产生损害的严重度和危害的发生概率进行了估计。在某一风险水平不可接受时,采取了降低风险的控制措施。 3.安全风险自查分析 车间主要设备有:配电、锅炉、制冷、空压、真空、除尘及载货电梯等。持有特种设备操作资格证的员工有7x人,其中有5x人持有两种或两种以上资格证;车间设备管理人员中有4人持有特种设备管理资格证,车间领导、安全管理员、技术员及班组长共11人持有安全管理员资格证。形成了一支由特种设备管理人员、安全管理人员、特种设备维修及操作人员组成的评估小组。 评估小组人员组成: 评估小组从动力锅炉、配电、制冷空压、真空除尘、污水及电梯等主要设备系统中可能导致事故的致险因子进行分析、致险因子分析应采用系统安全工程的方法,通过评估小组讨论的形式实施,并采用分工段开展分析。
3.1锅炉工段安全风险自评 4.表1:锅炉工段主要作业活动与典型事故类型对照表 表2:风险源风险分析表
多品种共线生产质量风险评估报告
多品种共线生产风险评估报告 评价人:日期:2016-4-15批准人:日期:2016-4-15
目录 1.前言 2. 风险评估目的 3. 风险评估范围 4. 风险评估小组 5.评估流程 6.风险等级评估方法(FMEA)说明 7.共线产品信息 8.共线的可行性 9.支持性文件 10.风险评估实施 11.风险评估结论
1.前言 我公司化妆品(一般液态单元、膏霜乳液单元和蜡基单元)生产车间,根据国家化妆品生产质量管理规范及可生产品种特性、工艺流程及相应法规要求,对厂房、生产设施和设备进行了合理设计造型和布局,设计多品种多规格共线生产,依据新版GMP第四十六条(为降低污染和交叉污染的风险,厂房、生产设施和设备应当根据所生产药品的特性、工艺流程及相应洁净度级别要求合理设计、布局和使用,并符合要求)规定,本着对生产安全和有效性进行风险评估,以期对其生产安全风险能正确认识并采取降低安全风险意见的控制措施,使生产质量及风险降低到可以接受的水平。 2.风险评估目的 2.1.评估厂房、生产设施和设备多产品共用的可行性; 2.2.提出降低预防污染与交叉污染措施实施过程中可能发生质量风险的措施; 2.3.根据风险评估的结果确定的验证活动范围及深度。 3.风险评估范围 本次评估仅限于对配料、乳化、静置、灌装、包装车间多品种多规格共线生产时可能存在的潜在风险的评估,其它与共线生产无关的质量风险不在此次评估范围内。 4.风险评估小组 本次质量风险评估项目为“多品种共线生产”,因此选择的成员的资质应对该项目有相适应的科学知识及经验,为此特确定以下人员为本次质量风险评估小组成员:
某原料药工艺风险评估
XXXXX原料药工艺风险评估(样本) 一、风险等级评估 风险等级严重性可能性可检测性 对关键质量属性有影响操作范围接近设计空间或注风险发生及有 高必须严格控制才能保证册范围或参数范围较窄,参发生趋势时可以质量参数偏离范围为关数本身较难控制,正常情况立即被发现。 键性偏差。下可能会偏离范围。 对关键质量属性可能有操作范围接近设计空间或注发现发生后稍 中影响,不严格控制会出册范围或参数范围较宽,参后才能被发现 现质量大的偏差数本身容易控制,异常情况 下才会偏离范围。 对关键质量属性影响很操作范围远比设计空间或注发现发生后很 低小,参数偏离范围为小册范围窄或参数范围比较宽,久后才能被发现偏差或微偏差紧急情况下才会偏离设计空 间 二、风险评估矩阵 1、风险等级矩阵 2、内在关键性矩阵 高高高高严高潜在关键关键 严 中低中高重中非关键潜在关键 重 低低低中性低非关键非关键潜在 性低低中高低中高 可能性可能性 3、可检测性和内在关键性矩阵 4、评估相关性报告文件 最终关键性序名称描述 可高非关键非关键关键号 1 产品属性评估表影响工艺步骤评估 检中非关键关键关键 2 产品质量属性评估表影响工艺参数评估 3 产品质量属性评估表工艺参数关键性评估 测低非关键关键关键 4 产品质量属性评估表工艺参数关键性评估 性非关键潜在关键(采取控制措施后)内在关键性 三:产品工艺风险评估 1、风险评估小组确定评估小组负责人,成员有研发专家、技术转移人员、生产操
作人员、工程人员、项目人员、验证人员、QA、QC、供应商(如必要); 2、寻找产品质量属性(CQA)和关键工艺参数(CPP)的必要前提条件: 1)文件资源: A 保证评估前已具备所有必要的文件; B 详细的文件资料能有效支持CQA和CPP风险评估的执行,有资料需求单。 2)良好培训 A GMP知识培训; B 质量风险管理(ICHQ9); C 公司质量风险管理规程; D 产品工艺知识; E 产品质量属性和关键工艺参数评估程序; F 产品质量属性和关键工艺参数风险评估模板。 3)评估会议 A 风险评估小组成员的资质和业务能力; B 风险评估的主题; C 细致的风险评估记录。 4)风险评估工具失效模式分析(FMEA)。 3、名词定义 1)产品质量属性和关键工艺参数:原料药产品→原料药关键质量属性→潜在关键参数→关键参数→关键步骤→其他控制点 2)产品质量属性:如鉴别、物化性质、外观性状、含量、纯度、粒度、晶型、微生物限度(如需要)。 3)关键工艺参数:工艺设计空间范围或注册参数范围,范围按宽、窄划分。 4)操作参数:指生产过程中可直接控制的输入变量或条件,通常这些参数是物理或化学参数,如温度、加工时间、柱流速、柱清洗体积或浓度、缓冲液、pH对。也称工艺参数。 5)关键操作参数:指一个输入的工艺参数,应控制在有意义、较窄的操作范围的以保证药物成分的质量属性符合要求。尽管较宽运行范围的参数也可能影响产品质量,但一般这些参数比较容易控制,而不易出现影响产品质量偏离,所以有较低的风险。与关键工艺参数为同义词。 6)非关键操作参数:关键运行参数以外所有输入工艺参数,非关键操作参数分为关键操作步骤和非关键操作步骤。 7)重要操作参数:应谨慎的控制在狭窄的范围内是工艺性能必不可少的输入工艺参数,关键操作参数不会影响产品质量关键产品属性,如果超过规定范围则可能影响工艺(如收率、持续时间等),但不会影响到产品质量。 8)非重要操作参数:经过证明的容易控制或有较宽接受限度的输入工艺参数。如果超出非关键操作参数的运行范围,可能对药物成分的质量或工艺性能有影响。 9)设定点:一个操作参数的目标值,设定点范围通常需要在生产规程或批记录中确定。 10)操作单元:一个在生产工艺中独立的步骤或操作,工艺和操作参与被定义以实现一个特殊的工艺目标。也称操作步骤。 4、产品质量属性的判定
共线生产风险评估实施报告
XXXXXX 共线生产风险评估报告 编号:RA/05/01
方案批准
1. 目的和围 1.1. 目的 通过对多品种共线生产的安全性进行风险管理,对多品种共线生产过程中可能产生混淆和交叉污染的风险要素进行分析判定。通过对产品特性、生产场地、生产设备、生产人员进行定性估计。在某一风险水平不可接受时,提出降低风险预见的控制措施,将剩余风险降低到可以接受的水平。 1.2. 围 适用于我公司XXX剂药品生产车间的共线安全风险评估。 2. 概括 我公司XXX剂药品生产车间建于2015年,位于XXXX工业园。根据所生产药品的特性、工艺流程和洁净级别要求,对厂房、生产设施和设备进行了合理设计、选型和布局,有效地降低污染和交叉污染的风险。本报告通过对XXX剂生产过程风险评估,使风险能正确认识并采取控制措施降低风险,使生产质量的风险降低到可以接受的水平。 3. 共线生产品种描述 3.1. 基本生产情况 我公司生产的XXX剂品种有5个品种,共10个规格,其中没有细胞毒性类、激 素类、高活性化学药、β-酰胺结构类药品、性激素类避孕药及特殊性质的药品 (如高致敏性和生物制品),所有品种均为非无菌制剂,且为外用XXX剂,属 低风险品种。 共线生产的全部10个品种规格均为普通药品,彼此间不存在相互反应或配伍禁 忌;配备了先进的符合最新GMP要求的生产设备,配套了完善的GMP文件软件 系统,对生产线的各个关键操作环节进行同步监控。 3.2. 品种明细
4. 各品种情况简介 4.1. A1 【药品名称】 通用名称:A1 汉语拼音: 【成份】XXXX,XX,XXX,XX。 【性状】本品为棕色的溶液;XXXXXXX。 【功能主治】活血化瘀,消肿止痛。XXXX损伤,症见关节肿胀、疼痛、活动受限。 【规格】50ml/瓶、100ml/瓶 【用法用量】外用,涂于患处,热敷20~30分钟,一次2~5ml,一日2~3次, 十四日为一疗程,间隔一周,一般用药二疗程或遵医嘱。 【不良反应】偶见皮肤瘙痒。 【禁忌】尚不明确。 【注意事项】孕妇禁用;使用过程中皮肤出现发痒、发热及潮红时,就停用。 【临床试验】本品于2000年及2005年经国家食品药品监督管理局批准进行过共 453例临床试验。 【药理毒理】A1对热板法致痛的小鼠有明显的镇痛作用,对二甲苯致炎的小鼠耳 廓炎肿胀及蛋清所致大鼠足跖炎症肿胀均有明显抑制作用。通过对大白鼠的完整 及破损皮肤的急性毒性试验、长期毒性试验、刺激性试验及过敏性试验、均未见 毒副反应及过敏反应。 【贮藏】密封,置阴凉处(不超过20℃)。 【有效期】36个月。 【执行标准】《中国药典》2010年版一部 【批准文号】国药准字ZXX。 4.2. A2 【药品名称】
生产工艺验证风险评估报告
制药有限公司GMP管理文件 生产工艺验证风险评估报告 一、目的:建立一个生产工艺验证的质量风险管理报告,为生产工艺验证的风险管理提供指导和参考,并为生产工艺验证质量风险管理提供通用性的文件范例。 二、适用范围:适用于生产工艺验证的风险管理。 三、职责:质管部负责组织和实施质量风险管理,质量管理体系相关部门负责本规程的具体实施。 四、正文: 1.风险评估计划: 1.1风险评估名称:生产工艺验证的质量风险评估; 1.2风险评估范围:本次风险管理计划主要是对本公司生产工艺验证进行风险评估活动的策划,包括参与人员和职责,风险分析、风险评价、风险控制,风险改进措施与支持活动,风险管理评审等; 1.3参与人员和职责: 1.3.1生产工艺验证质量风险评估小组包括质管部负责人,生产部负责人,检验室主管,工程部,QA,设备操作人员; 1.3.2生产工艺验证质量风险评估小组负责组织实施质量风险评估; 1.3.3质管部负责人负责制定质量风险评估计划,风险评估组织,风险评估后改进措施监督落实等; 1.3.4质管部负责整理质量风险管理文档。
1.4风险评估小组人员 2.风险分析:本次采用失败模式效果分析(FMEA),识别潜在的失败模式,按照风险评 估操作规程,对生产工艺验证的严重程度、发生的几率、发现的可能性评分,其评分结果见表1-1、表1-2 、表1-3 表1-1 生产工艺验证中的关键控制点失败影响的严重程度
表1-2 生产工艺验证中的关键控制点失败影响的发生慨率 表1-3 生产工艺验证中的关键控制点失败影响的可检测性
3.风险评价 3.1按照风险评估操作规程,对生产工艺验证质量风险进行评价,见表2。 3.2风险评价标准按照风险等级确定,可接受的风险不需要改进措施即可接受;合理可降低的风险与不经过风险/收益分析即判定为不可接受的风险,需制定相关的改进措施并有效执行以减少其质量风险后才能予以接受,(表3)。
药品生产过程质量风险评估报告模板.doc
药品生产过程质量风险评估报告模板 XXXX胶囊生产过程质量风险管理报告 起草人:审核人:审核人:批准人:质量风险管理号:QRM- 起草日期:审核日期:审核日期:批准日期: XXXX药业有限公司 年月年月年月年月 日日日日 目录 XXXX胶囊生产过程质量风险管理报告 1、简介 2、目的 3、范围 4、引用资料 5、风险管理小组组员及职责分工 6、质量风险管理流程 7、风险管理过程 8、风险管理总结及结论 9、风险管理回顾审核 XXXX胶囊生产过程质量风险管理报告 1.简介: 1.1产品概述:XXXX胶囊为以化学原料药XXXX和适量等辅料制成的化学药胶囊剂制剂,为耳鼻喉科及皮肤科用药类非处方药药品。用于缓解过敏性鼻炎有关的症状,如喷嚏、流涕、鼻痒、鼻塞以及眼部痒及灼烧感。口服药物后,鼻和眼部症状及体征得以迅速缓解。亦适用于缓解慢性荨麻疹、瘙痒性皮肤病及其他过敏性皮肤病的症状和体征。规格为10 毫克;贮藏:遮光,密闭保存;包装:铝塑泡罩包装。每板6粒,每盒1板;每板6粒,每盒2板;每板12粒,每盒1板,每板4粒,每盒1板。有效期:30个月。 1.2生产批量:35万粒,140万粒。 1.3主要生产工艺过程及参数: ,混合速度900转/分,混合时间20分钟;批量为140万粒的预混合和35万粒相同,但原辅料均分4等分进行4次混合。 1.3.3 粘合剂15%聚维酮K30的乙醇溶液的配制:按聚维酮K30:95%乙醇量=1.5:8.5(重
量比)进行配置,溶解完全100目滤布过滤。 ,用GHL-250型高效混合制粒机中(每次35万粒量),设定混合I和切割I开动设备混合10分钟后,徐徐加入粘合剂(15%聚维酮K30的乙醇溶液),加完后继续混合3-4分钟,收集软材。 ,筛网目数为24目。 ,每次干燥量为35万粒胶囊的颗粒量,控制干燥温度为50℃~70℃,干燥时间20分钟。,筛网目数为24目。 ,混合速度900转/分,混合时间20分钟;批量为140万粒的总混:用EYH-1000型二维运动混合机进行,混合时间35分钟(此设备无速度调节)。 ,二号胶囊充填模具,用二号空心胶囊进行充填,装量差异控制在充填量的±8%范围内,充填速度为800~1200粒/分。充填过程中,每20分钟检查一次装量。将充填好的胶囊用HTP-Ⅱ型胶囊、片剂抛光机抛光。 ,同时产品冲印批号、有效期。按4粒/板、6粒/板或12粒/板泡罩规格采用相应的二号胶囊泡罩模具,上、下封温度约为120℃,热封温度为160℃。 ,每个盒子及纸箱均打印产品批号、生产日期、有效期,电子监管码?;按6粒/板×1板/盒×200盒/箱或12粒/板×1板/盒×200盒/箱或6粒/板×2板/盒×200盒/箱或4粒/板×1板/盒×200盒/箱的包装规格进行包装。 1.4中间产品的贮存要求:XXXX胶囊颗粒(总混后)用洁净塑料袋盛装,扎紧袋口置洁净的不锈钢桶中密闭,在口服制剂车间中间站贮存,贮存期:天;XXXX胶囊(批,产品均符合标准规定,未产生过质量事故,也发生过严重的毒副作用及不良反应。 2、目的: 2.1通过对XXXX胶囊生产过程质量风险管理,对其带来的质量风险进行有效控制,保证产品质量。 面进行风险梳理识别。 (1)风险严重程度、发生几率、发现的可能性评分标准及风险级别评判标准及风险控制措施:见下表1. 表2. 表3.表4.
油品车间风险评估报告
油品车间风险评估报告 Corporation standardization office #QS8QHH-HHGX8Q8-GNHHJ8
XX石化公司炼油业务 风险评估报告 单位:油品车间 编制: 审核: 2009年12月1日—2009年12月4日
目录 (二)生产设备和设施的危险性 (17) (三)油品车间危险物质的重大危险源辨识 一.油品车间业务情况 1.1 油品车间简介 油品车间担负着XX石化公司与XX管输末站原油的接收,汽车、火车原油的卸车,原油加温、脱水、储存和付装置任务;收付、储存和输转各种原料油、半成品汽油、柴油,按要求对半成品汽油、柴油进行加剂调和,并负责成品汽油(90#、93#、97#)、柴油(0#、-10#、-20#)、石脑油、4#燃料油、油浆、液化气、丙烷等十几种油气产品的储存和发售工作,负责XX石化公司炼油业务部各类油品的计量交接工作。 油品车间共分三大生产区域,11个岗位:即油罐区、液化气及瓦斯系统、装卸油台区。油罐区由原油罐区、重油罐区、成品罐区、中间罐区、二成品罐区5个岗位组成;液化气系统包括液化气罐区和装瓶站2个岗位,瓦斯系统包括气柜和火炬2个岗位;装卸油台区包括汽槽、原卸、柴油台和轻油台4个岗位。 1.2车间的基本情况见表1.2-1。 表1.2-1 车间基本情况表
投产以来的工艺技改技措情况见表1.2-2。 表1.2-2 工艺技改技措表 1. 3工艺流程简介 1)原油流程 从XX站管输来的原油经XX末站进入原油罐区;汽车原油在原卸经1#、2#、3#下卸地槽卸入高位罐区,再转入原油罐区;火车原油经原卸厂3、厂4两道栈台38个下卸鹤位卸入原油罐区G-1、G-2零位罐,再转入原油罐区。原油在原油储罐内沉降、加温、脱水,含水合格后经原油泵房由付装置原油泵输送给常压装置。
固体制剂车间多品种共线生产风险评估报告
固体制剂车间多品种共线生产风险评估报告
编号:FX-SC-2015-002 固体制剂车间多品种共线生产 风险评估报告 起草部门及职务责任人签名起草日期 审核部门及职务责任人签名审核日期批准人责任人签名批准日期 吉林九鑫制药股份有限公司 二零一五年五月
固体制剂车间多品种共线生产风险评估报告 目录 1 概述 1.1相关品种明细 1.2具体的设备明细 2 风险评估标准 3 找出评估风险点 4 对提出的风险点进行评估 4.1原料性质风险评估 4.2设备清洁风险评估 5 结论
1 概述 公司生产的口服固体制剂品种有39个品种, 39个批准文号,其中片剂品种2个,胶囊剂品种3个,颗粒剂品种2个,水丸、水蜜丸、浓缩丸剂品种5个,大蜜丸剂品种27个。常年生产的品种4个。公司配备了先进的符合2010版GMP 要求的生产设备,配套了完善的GMP 文件软件系统,对生产线的各个关键操作环节进行同步监控。 1.1相关品种明细如下: 剂型 品种名称 丸剂 大蜜丸 偏瘫复原丸、补中益气丸、大山楂丸、二十七味定坤丸(定坤丸)、附子理中丸、舒肝丸、太极丸、天王补心丸、小活络 丸、杞菊地黄丸、大活络丸、回天再造丸、琥珀安神丸、八珍益母丸、桂附地 黄丸、参桂再造丸、通宣理肺丸、艾附暖宫丸、橘红丸、牛黄上清丸、利膈丸、 紫蔻丸、朱砂安神丸、百合固金丸、十 全大补丸、人参归脾丸、六味地黄丸、 水丸、 水蜜丸、浓 缩丸 清热暗疮丸、六味地黄丸、更年宁、人 参再造丸、银翘解毒丸 胶囊剂 胃乐新胶囊、乙肝扶正胶囊、速感宁胶 囊 片剂 咽炎片、消积健儿片 颗粒剂 益肾灵、通脉颗粒 1.2具体的设备明细如下: 序号 设备名称 型号规格 设备编号 生产厂家 1 高效强力性竖式混合机 SGTJ-046 黑龙江省迪尔 制药机械有限公司 2 不锈钢粉碎机 FS-320 SGTJ-013 丹东市制药机械有限公司
车间厂房设施风险评估报告
【最新资料,WORD文档,可编辑修改】 一、风险评估小组组成 报告起草部门责任人签名报告日期 质量保证部QA 审核部门责任人签名报告日期 冻干车间 设备工程部 质量保证部主任 批准人责任人签名报告日期质量部经理 二.风险评估小组的职责 1.起草部门 1.1负责风险评估工作安排 1.2负责风险评估报告的实施 2.审核部门 2.1负责收集设备评估参数 2.2负责设备评估参数的审核 2.3负责生产工艺参数评估审核 3.批准人 负责风险评估总计划 三.概述 新建车间包括:冻干车间、粉针车间、头孢粉针车间、抗肿瘤冻干车间、水针车间和抗肿瘤水针车间。 新建车间位于生产区中部,位于现有车间的后面。车间北部为物流通道通道为混凝土硬路面。
新建生产厂房为四层(局部)框架结构,冻干生产车间位于一层,粉针车间位于二层左,头孢粉针车间位于二层右,水针车间位于三层左,抗肿瘤水针车间位于三层中,抗肿瘤冻干车间位于三层右,建筑抗震设防烈度为7度。 冻干车间总建筑面积为1668m2,空气净化总面积为513 m2,其中D级洁净区面积为120m2,C级洁净区面积为162 m2,无菌B级洁净区面积为231m2,洁净区气流组织为紊流。 头孢车间总建筑面积为 m2,空气净化总面积为465m2,其中D级洁净区面积为20m2,C级洁净区面积为280 m2,无菌B级洁净区面积为165m2,洁净区气流组织为紊流。 抗肿瘤头孢车间总建筑面积为1668m2,空气净化总面积为513 m2,其中D 级洁净区面积为120m2,C级洁净区面积为162 m2,无菌B级洁净区面积为231m2,局部A级洁净区面积为18m2,洁净区气流组织为紊流。 水针车间总建筑面积为1668m2,空气净化总面积为323 m2,其中D级洁净区面积为175m2,C级洁净区面积为148 m2,洁净区气流组织为紊流。 抗肿瘤水针车间总建筑面积为1668m2,空气净化总面积为250 m2,其中D 级洁净区面积为95m2,C级洁净区面积为145 m2,洁净区气流组织为紊流。 抗肿瘤冻干车间总建筑面积为1668m2,空气净化总面积为355 m2,其中D 级洁净区面积为10m2,C级洁净区面积为205 m2,无菌B级洁净区面积为 140m2,洁净区气流组织为紊流。 空调系统由B级、C级和D级三个空调系统组成,是按照GMP要求设计、制造、安装的。三个系统机组集中安装在空调机房,机组设有蒸汽加热、加湿,冷冻水表冷及除湿,能够调节洁净房间的温湿度,B万级空调区设计风量25000m3/小时,该系统覆盖11个房间,C级空调区设计风量15000m3/小时,该系统覆盖16房间,D级空调区设计风量15000 m3/小时,该系统覆盖11个房间。 送风口类型 S1—500m3/h设计风量风口面积320×320mm2 S2—1000m3/h设计风量风口面积484×484mm2 S3—1500m3/h设计风量风口面积630×630mm2 S4—1500m3/h设计风量风口面积1175×580mm2
工艺质量风险评估标准操作规程
第 1 页 共 7 页 工艺质量风险评估标准操作规程 文件编码 Copy № 起草: 日期: 审核: 日期: 批准: 日期: 执行确认: 日期: 变更内容 修订号 修订原因与内容 执行日期 00 新建
1 主题内容 建立风险评估标准操作规程对可能影响到最终产品质量的风险因素进行风险识别、风险分析、风险评价及控制,保证最终的产品质量。指导公司规避质量事故或药害事件的发生,规范产品生产质量风险点的评估、控制及审核操作行为,从而降低药品的质量风险。 2 适用范围 适用于xxxx公司所有产品的风险评估。 3 职责 风险评估机构 风险评估管理小组 人员职责 质量受权人 主要负责风险管理过程中的决策和计划,批准质量风险评估 的启动,评估报告的评估批准。 质量部长 负责组织进行质量风险评估、控制与审核协调、管理等相关 事宜 各部门负责人 各部门主要负责日常对本部门的风险的识别和上报,涉及到 项目时对涉及到的项目进行风险预评估,参与公司其他部门 的与本部门相关的风险评估活动。 执行小组风险管理专员 负责本公司风险评估工作的组织和协调,召集风险评估会 议,审核存档风险文件 风险评估人员 具体负责对风险的评估,日常的风险识别、风险分析、风险 评价和制定风险控制措施,起草本公司的风险评估报告。 4 工艺质量风险评估的流程 1)列出工艺流程,并将工艺分解成单元操作,从人、机、物、法、环的角度识别单元操作中可能存在的污染、交叉污染、混淆、差错、质量不合格和违背GMP和SOP规定等质量风险,并按其对质量的影响程度进行初步分类。 2)列出生产过程中的工艺参数,根据历史数据、生产经验或科学判断其对质量的影响程度。3)对2)中筛选出的对质量影响程度高和中的参数进行质量风险评估。 5 风险评估内容 5.1 风险评估流程一般包括风险识别(Risk Identification),风险分析(Risk Analysis)和 风险评价(Risk Evaluation)三个部分,即:
安全生产风险评估报告
安全生产风险评估报告 1 企业基本情况 1.1 企业概况 XX有限公司成立于2013年10月,公司位于XX园区9号,占地面积100亩,于2014年7月开工建设,2015年12月竣工并投入生产,2017年4月通过竣工验收。公司主要从事各类ST钢排钉,直排钉,特种钢钉等系列产品的研发与生产。现已形成1.5万吨/年ST钢排钉,直排钉,特种钢钉的生产能力。 ⑴企业名称:XX有限公司 ⑵法定代表人:XX ⑶生产地址:XX园区9号 ⑷行业类别:机械制造 ⑸组织机构代码:078892619 ⑹企业规模:小型企业 ⑺产品方案:ST钢排钉,直排钉,特种钢钉 ⑻设计能力:1.5万吨/年 ⑼劳动定员:180人 1.2 主要建设内容 项目建设内容为生产车间、办公楼、库房和污水处理站。其中,生产车间包括制钉车间、抛光车间、热处理车间、表面处理车间;库房包括原材料和成品库房。项目建设内容详见表1-1。 表1-1 项目建设内容组成表
1.3 项目周边环境关系 项目位于XX经济开发区中部,建设用地占地约120亩。本项目厂址北侧紧邻XX食品厂,北侧500m处为XX堰水库;西北侧70m处为XX有限公司,西侧一路之隔为原XX有限公司;南侧110m处为原XX发电项目;东侧紧靠山坡高差50m。项目距西北侧园区安置小区约560m;南面1.8km处为XX。项目地理位置图见附图1,项目外环境关系见附图2。 表1-2 项目外环境关系及主要环境保护目标表
1.4 项目总平面布置 厂区整体呈三角形,其中污水处理站位于厂区西北侧,便于与园区污水管网的接入;生产区位于厂区中部,自北向南依次为热处理车间、包装车间、抛光车间、表面处理车间和制钉车间;产品库房和原材料库房位于厂区东侧,紧邻包装车间和制钉车间;办公区位于厂区南侧,靠近园区道路,方便人员出入。厂区分区明确,总图布置见附图3。 1.5 生产基本情况 1.5.1 主要原辅材料及能耗 主要原辅材料消耗情况详见下表1-3所示。 辅材料一览表
化学合成制药厂风险评估分析
目录 1 前言 (1) 2 总则 (3) 2.1编制原则 (3) 2.2编制依据 (3) 2.3环境风险评估的程序 (6) 3 资料准备与环境风险识别 (7) 3.1企业基本信息 (7) 3.2企业周边环境风险受体情况 (11) 3.3涉及环境风险物质情况 (13) 3.4生产工艺 (32) 3.5安全生产管理 (41) 3.6现有环境风险防控与应急措施情况 (41) 3.7现有应急物资与装备、救援队伍情况 (45) 4 突发环境事件及其后果分析 (49) 4.1突发环境事件情景分析 (49) 4.2突发环境事件情景源强分析 (57) 4.3释放环境风险物质的扩散途径、涉及环境风险防控与应急措施、应急 资源情况分析 (62) 4.4突发环境事件危害后果分析 (69) 5.现有环境风险防控和应急措施差距分析 (72) 5.1环境风险管理制度 (72)
5.2环境风险防控与应急措施 (75) 5.3环境应急资源 (77) 5.4历史经验教训总结 (80) 5.5需要整改的短期、中期和长期项目内容 (81) 6.完善环境风险防控和应急措施的实施计划 (84) 7.企业突发环境事件风险等级 (88) 7.1环境风险物质数量与临界量比值值 (88) 7.2生产工艺与环境风险控制水平 (92) 7.3环境风险受体敏感性性(E) (97) 7.4企业环境风险等级划分 (99)
1 前言 ................制药股份有限公司的前身——河南...制药厂始建于1969 年,1997 年股改成立股份公司,现已发展成为国家级制药骨干企业之一,...市高新技术产业。公司位于...县城东南部。主营业务为中西药品和化学原料药的研发、生产和销售。主要产品为大容量注射液、小容量注射液、片剂、胶囊剂、颗粒剂、露剂、酊剂和原料药等八大剂型160多个品种,全部生产车间均多次通过国家GMP认证。主导产品有国家级新药援生力维片、精制冠心颗粒、清热解毒颗粒、马来酸曲美布汀原料,国家中药保护品种有猫爪草胶囊、伤痛宁、桑姜感冒片等。产品销售全国二十多个省区。其中马来酸曲美布汀片(商品名:援生力维)是公司与上海医工院联合研制的国家级新一代胃肠功能调节剂,自上市以来产品销量稳居市场前列,自2004年以来连续二次被评为河南省名牌产品、...市高新技术产品;在此基础上,公司对此产品进行了深度开发,2010年5月公司联合中国药科大学开发的具速释部分的马来酸曲美布汀缓释片及其制备工艺获得国家发明专利,已获得新药证书并已经上市。马来酸曲美布汀原料质量产量国内领先,通过韩国、日本、墨西哥官方GMP认证。出口亚洲、欧洲、美洲多个国家,销量居国内前列。 ................制药股份有限公司1997年进行股份制改造,2001年与上海开开实业公司增资扩股组建为县公司,目前属大型二类企业,注册资本8400万元,总资产为1.6亿元,年销售收入为2亿多元,
原料药工艺验证
原料药工艺验证通则 在原料药生产过程中,工艺验证是提供文件化的证据,证明用于原料药生产的人员、材料、设备、方法、环境条件以及其他有关公用设施的组合,可以持续生产出符合预定用途和注册要求的产品。本通则对ICH-Q7A中关于工艺验证的方法及工艺验证的执行进行了详细解析,包括工艺验证目的,针对不同情况的工艺验证方法,以及使用适当的风险管理工具进行工艺风险评估和相应工艺验证方案的实施。 1 工艺验证的目的 工艺验证是利用文件化的证据,证明将生产无菌原料药产品的人员、材料、设备、方法、环境条件以及其他有关公用设施进行有机组合,可以持续地生产出符合预定用途和注册要求的产品,工艺稳定可靠,符合GMP要求。 工艺验证方案将对工艺验证过程中的中间控制及检查结果进行合理设计并进行详细记录。通过工艺验证可以建立定期的生产工艺再评估工作,并对每一步的生产工艺进行监控,以确保产品始终符合既定的标准和质量特性。同时,对中间体进行检测和成品检测,使工艺过程始终处在良好的控制之下。 2 工艺验证的分类 工艺验证有三种类型,分为前验证、同步验证、回顾性验证。其中,前验证是首选的验证方法。 2.1 前验证 对于ICH-Q7A定义的所有原料药工艺,一般都采用前验证。对一种原料药实施的工艺验证应该在商业销售之前完成。 2.2 同步验证 特殊情况下,可以采用同步验证的方式进行产品的工艺验证,例如,所验证原料
药产品生产批次较少或不经常生产,或是因为经过验证的生产工艺变更引起的工艺验证,可以采用同步验证方式。在同步验证完成之前,如果有周密的监控和检验,原料药可以放行并用于制剂的生产,并且可以进行商业销售。 2.3 回顾性验证 回顾性验证仅适用于已生产多年、工艺足够成熟的产品,产品的关键工艺参数和控制点也已完全确定,并且在产品生产过程中,相关的工艺、设备、原料、厂房设施均没有发生重大的变化。 回顾性验证的验证方案要涵盖可接受标准和详细的生产信息。对于不合格的批号和存在异常趋势的批号要进行调查。回顾性验证批数的选择要符合统计学,一般规律是要求20~30批,但公司验证的批数可以不是20~30批,只要有统计数据或其他依据支持此验证批数的选择方式即可。 3 工艺过程风险评估 风险评估将所识别和分析的风险与给定的风险标准进行对比,确定生产产品的质量。 3.1 危害分析 组建专门的风险评估团队,开展二个阶段的危害分析: 在第一阶段中,评估团队将对无菌原料药生产过程中所涉及的物料、活动、设备、储存、分发和预计用途进行分析。将写出每一步骤可能引入、增加或控制的潜在的危害(生物、化学和物理)的清单。 在危害分析中,可能包括但不限于下述问题:(1)可能发生的危害及其危害的严重性;(2)危害存在的定性和/或定量评估;(3)相关微生物的残存或繁殖;(4)毒性、物理或化学试剂的生产或在药品中的残留;(5)上述内容的引导条件。 第二阶段,危害评估的执行,即潜在危害的严重性和发生的可能性的评估。 评估团队将决定在关键工艺控制点计划中说明存在有哪些潜在的危害,采取什么控制措施。控制一个具体的危害可能要求至少有一个控制措施,一个具体的控制措施
油品车间风险评估报告
XX石化公司炼油业务 风险评估报告 单位:油品车间 编制: 审核: 2009年12月1日—2009年12月4日
目录 (二)生产设备和设施的危险性 (17) (三)油品车间危险物质的重大危险源辨识 一.油品车间业务情况 1.1 油品车间简介 油品车间担负着XX石化公司与XX管输末站原油的接收,汽车、火车原油的卸车,原油加温、脱水、储存和付装置任务;收付、储存和输转各种原料油、半成品汽油、柴油,按要求对半成品汽油、柴油进行加剂调和,并负责成品汽油(90#、93#、97#)、柴油(0#、-10#、-20#)、石脑油、4#燃料油、油浆、液化气、丙烷等十几种油气产品的储存和发售工作,负责XX石化公司炼油业务部各类油品的计量交接工作。 油品车间共分三大生产区域,11个岗位:即油罐区、液化气及瓦斯系统、装卸油台区。油罐区由原油罐区、重油罐区、成品罐区、中间罐区、二成品罐区5个岗位组成;液化气系统包括液化气罐区和装瓶站2个岗位,瓦斯系统包括气柜和火炬2个岗位;装卸油台区包括汽槽、原卸、柴油台和轻油台4个岗位。 1.2车间的基本情况见表1.2-1。 表1.2-1 车间基本情况表
投产以来的工艺技改技措情况见表1.2-2。 表1.2-2 工艺技改技措表 1. 3工艺流程简介 1)原油流程 从XX站管输来的原油经XX末站进入原油罐区;汽车原油在原卸经1#、2#、3#下卸地槽卸入高位罐区,再转入原油罐区;火车原油经原卸厂3、厂4两道栈台38个下卸鹤位卸入原油罐区G-1、G-2零位罐,再转入原油罐区。原油在原油储罐内沉降、加温、脱水,含水合格后经原油泵房由付装置原油泵输送给常压装置。 2)汽油流程 常压、重整、催化装置生产的半成品汽油经相应汽油输油线进入成
