高考化学大二轮复习 第1部分 知识整合 专题5 选考模块 第15讲 物质结构与性质课件
2024届全国高考化学二轮复习课件 第一篇 高考专题 微主题3 物质的结构与性质 元素周期律

命题规律 高考回溯
2.(2022·广东卷)北京冬奥会成功举办、“神舟十三号”顺利往返、“天宫课
堂”如期开讲及“华龙一号”核电海外投产等,均展示了我国科技发展的巨大成
就。下列相关叙述正确的是
A.冬奥会“飞扬”火炬所用的燃料H2为氧化性气体 B.飞船返回舱表层材料中的玻璃纤维属于天然有机高分子 C.乙酸钠过饱和溶液析出晶体并放热的过程仅涉及化学变化 D.核电站反应堆所用轴棒中含有的29325 U 与29328 U 互为同位素
(B)
【解析】 BeCl2的中心原子为Be,孤电子对数为0,为直线形分子,A错误;P4 分子中相邻的P原子之间形成非极性共价键,B正确;Ni的原子序数为28,其基态原 子的价层电子排布式为3d84s2,C错误;顺-2-丁烯的结构中2个甲基应该在双键的同 一侧,D错误。
命题规律 高考回溯
5.(2023·浙江卷)下列化学用语表示正确的是
B.火星全球影像彩图显示了火星表土颜色,表土中赤铁矿主要成分为FeO
C.创造了可控核聚变运行纪录的“人造太阳”,其原料中的2H与3H互为同位素
D.“深地一号”为进军万米深度提供核心装备,制造钻头用的金刚石为金属
晶体
【解析】Xe的原子序数为54,在元素周期表中位于第5周期0族,A错误;赤铁 矿的主要成分是Fe2O3,B错误;金刚石是共价晶体,D错误。
命题规律 高考回溯
13.(2023·山东卷)下列分子属于极性分子的是
A.CS2 C.SO3
B.NF3 D.SiF4
(B)
【解析】 NF3分子空间结构为三角锥形,正、负电荷中心不重合,属于极性分 子,B符合题意。
命题规律 高考回溯
14.(2023·湖南卷)下列有关物质结构和性质的说法错误的是
高考化学二轮复习专题十五物质结构与性质(选考)(new)

专题十五物质结构与性质(选考)[考纲要求]1。
原子结构与元素的性质:(1)了解原子核外电子的排布原理及能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子、价电子的排布,了解原子核外电子的运动状态;(2)了解元素电离能的含义,并能用以说明元素的某些性质;(3)了解原子核外电子在一定条件下会发生跃迁,了解其简单应用;(4)了解电负性的概念,知道元素的性质与电负性的关系。
2.化学键与物质的性质:(1)理解离子键的形成,能根据离子化合物的结构特征解释其物理性质;(2)了解共价键的形成,能用键能、键长、键角等说明简单分子的某些性质;(3)了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系;(4)理解金属键的含义,能用金属键理论解释金属的一些物理性质,了解金属晶体的常见堆积方式;(5)了解杂化轨道理论及常见的杂化轨道类型(sp、sp2、sp3),能用价层电子对互斥理论或者杂化轨道理论推测常见的简单分子或者离子的空间结构.3。
分子间作用力与物质的性质:(1)了解化学键和分子间作用力的区别;(2)了解氢键的存在对物质性质的影响,能列举含有氢键的物质;(3)了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别;(4)能根据晶胞确定晶体的组成并进行相关的计算;(5)了解晶格能的概念及其对离子晶体性质的影响.1.排布规律(1)能量最低原理:基态原子核外电子优先占据能量最低的原子轨道,如Ge:1s22s22p63s23p63d104s24p2。
(2)泡利原理:每个原子轨道上最多只能容纳2个自旋状态相反的电子。
(3)洪特规则:原子核外电子在能量相同的各轨道上排布时,电子总是优先单独占据一个轨道,且自旋状态相同。
2.表示方法(1)电子排布式按电子排入各电子层中各能级的先后顺序,用能级符号依次写出各能级中的电子数,同时注意特例。
如:Cu:1s22s22p63s23p63d104s1(2)简化电子排布式“[稀有气体]+价层电子”的形式表示。
(浙江选考)2020高考化学 第15题 有机物结构与性质

第15题:有机物结构与性质满分:70分1.下列与有机物结构、性质相关的叙述错误的是A.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2B.蛋白质和油脂都属于高分子化合物,一定条件下都能水解C.甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同D.苯不能使溴的四氯化碳溶液发生化学反应褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键2.下列叙述中,错误的是( )A.苯酚具有弱酸性,但不能使紫色石蕊变红B.因发生化学反应而使溴水褪色的物质一定是和溴水发生加成反应C.用核磁共振氢谱鉴别1溴丙烷和2溴丙烷D.含醛基的有机物都能发生银镜反应3.下列关于常见有机物的说法正确的是A.乙烯和苯都能和溴水发生化学反应而使溴水褪色B.乙烷可使酸性高锰酸钾溶液褪色C.糖类和蛋白质都是高分子化合物D.乙酸和油脂都能与氢氧化钠溶液反应4.关于有机物主要特点的下列说法中不正确的有A.大多数有机物难溶于水,易溶于汽油、酒精、苯等有机溶剂B.有机物的熔点低、受热易分解,且都能燃烧C.绝大多数有机物是非电解质,不易导电D.有机物的化学反应比较复杂一般较慢且有副反应5.下列关于碳原子的成键特点及成键方式的理解,正确的是()A.饱和碳原子不能发生化学反应B.C原子只能与C原子形成不饱和键C.任何有机物中H原子数目不可能为奇数D.五个C原子之间能够形成五个碳碳单键6.下列说法不正确的是()A. 法国化学家维勒首次提出有机化学的概念;德国化学家贝采里乌斯由氰酸铵合成了尿素,首次打破了有机物和无机物的界限B. 李比希用燃烧法来测定有机化合物中碳氢元素质量分数C. 用核磁共振氢谱和红外光谱法可以区别乙醇和二甲醚(CH3OCH3)D. 用“同位素示踪法”是研究有机化学反应历程的手段之一7.下列关于有机化学发展史的说法错误的是网]A. 中国科学家成功合成了结晶牛胰岛素,标志着人类合成蛋白质时代的开始B. 德国化学家李比希提出运用同位素示踪法研究化学反应历程C. 瑞典科学家贝采利乌斯提出有机化学的概念,使之成为化学的一个重要分支D. 德国化学家维勒用氰酸铵合成尿素,从而打破了无机物和有机物的界限8.下列关于一些有机物在合适条件下的化学反应说法正确的是()A .能催化氧化生成醛B .能在浓硫酸的作用下生成烯C.CH3Br 能在氢氧化钠的乙醇溶液的作用下生成醇D .既能与酸反应也能与碱反应生成盐9.下列说法不正确的是()A.李比希燃烧法、钠熔法、铜丝燃烧法都是用来分析有机物元素组成的方法B.红外光谱法、紫外光谱法、核磁共振、质谱仪等都是现代化学测定有机物结构的常用方法C.同位素示踪法是研究化学反应历程的手段之一D.CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别10.下列说法正确的是A. 沸点:邻二甲苯>间二甲苯>对二甲苯B. 鸡蛋淸在NH4Cl溶液中能发生盐析,但是不能和盐酸发生化学反应C. 有机物A的分子式为C16H16O3D. 滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键11.有关下列物质分子结构特征描述正确的是A.1 mol CH3CH2OH与Na完全反应只生成0.5 mol H2,不能说明乙醇分子中有一个氢原子与其它氢原子不同B.苯分子的结构中存在碳碳单键和碳碳双键交替出现的结构C.CHCl HCl和CClH HCl属于同一种物质,不能用来解释甲烷是一种正四面体结构D.乙烯容易与溴的四氯化碳溶液发生反应,且1 mol乙烯完全加成消耗1 mol溴单质,证明乙烯分子里含有一个碳碳双键12.有关下列物质分子结构特征描述正确的是A.乙烯分子中碳、氢原子个数比为1:2,证明乙烯分子里含有一个碳碳双键B.表示苯分子的结构,因此能解释邻二甲苯有CH3CH3和CH3CH3两种结构C.因为甲烷是一种正四面体结构,所以CHCl HCl和CClH HCl属于同一种物质D.苯的分子式是C6H6,分子式中碳原子远没有饱和,因此苯能使溴水褪色13.下列与有机物的结构、性质有关的叙述正确的是A.苯、油脂均不能使酸性KMnO4溶液褪色B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应C.葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体D.乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同14.下列说法不正确...的是A.利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学B .蔗糖、淀粉、油脂及其水解产物均为非电解质C .通过红外光谱分析可以区分乙醇和乙酸乙酯D .石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃. 15.下列说法正确的是A .按系统命名法,化合物CH 2CHCH 2CH(CH 3)2CH 3CH 2CH(CH 3)2的名称为2,6-二甲基-5-乙基庚烷B .丙氨酸和苯丙氨酸脱水,最多可生成3种二肽C .化合物是苯的同系物D .三硝酸甘油酯的分子式为C 3H 5N 3O 9 16.下列关于有机物的叙述正确的是A.乙醇不能发生取代反应B.C 4H 10 有三种同分异构体C.氨基酸、淀粉均属于高分子化合物D.乙烯和甲烷可用溴的四氯化碳溶液鉴别 17.(2014届浙江省金丽衢十二校高三第二次联考理综化学试卷) 下列说法正确的是 A.按系统命名法的名称为2一甲基一3,5一二乙基己烷B.用Na 2 C03溶液能区分CH 3COOH 、CH 3CH 2OH,苯、硝基苯四种物质C .等质量的甲烷、乙烯、1,3一丁二烯分别充分燃烧,所耗氧气的量依次增加D.下列物质的沸点按由低到高顺序为:(CH 3CH 2)2CH 3<(CH 3)3CH <CH 3(CH 2)3CH 3<(CH 3)2CHCH 2CH 3 18.下列叙述中,错误的是( )A.苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯B.苯乙烯在合适条件下催化加氢可生成乙基环己烷C.乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷D.甲苯与氯气在光照下反应主要生成2,4-二氯甲苯19.(2014届浙江省嘉兴市高三教学测试(二)理综化学试卷) 下列说法正确的是A .按系统命名法,化合物 的名称为2,4—二乙基—6—丙基辛烷B .月桂烯 ()所有碳原子一定在同一平面上C .取卤代烃,加入氢氧化钠的乙醇溶液加热一段时间后冷却,再加入稀硝酸酸化的硝酸银溶液,一定会产生沉淀,并根据沉淀颜色判断卤代烃中卤原子的种类D .通常条件下,1mol 的 分别与H 2 和浓溴水完全反应时,消耗的H 2和Br 2的物质的量分别是 4mol 、3mol20.(2014届浙江省金华十校高考模拟考试理综化学试卷) 下列说法正确的是A .按系统命名法,有机物的名称为3,7一二.甲基-4-乙基辛烷B .高聚物脲醛树脂()的合成单体之一是C .1 mol 葡萄糖能水解生成2 rnol CH 3CH 2OH 和2 mol CO 2D .在酸性条件下,CH 3CO 18OC 2 H 5的水解产物是CH 3CO 18OH 和C 2H 5OH 21.下列对有机物结构或性质的描述,错误..的是 A .乙酸与乙醇在一定条件下发生酯化反应,加入浓H 2SO 4有利于酯化反应的进行B .鉴别己烯中是否混有少量甲苯,先加足量的酸性高锰酸钾溶液,然后再加入溴水C .乙烷和丙烯的物质的量各1mol ,完成燃烧生成3molH 2OD .蛋白质溶液中分别加入饱和(NH 4)2SO 4和CuSO 4溶液,均出现白色沉淀,但原理不同 22.下列有机物结构、性质相关的叙述错误的是A 、乙酸分子中含有羧基,可与NaHCO 3溶液反应生成CO 2B 、蛋白质和油脂都属于高分子化合物,一定条件下都能水解C 、甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同D 、苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 23.下列对有机物结构或性质的描述,错误..的是 A .一定条件下,乙醇可以发生取代反应或消去反应B .苯酚钠溶液中通入CO 2生成苯酚,则碳酸的酸性比苯酚弱C .乙烷和丙烯的物质的量各1mol ,完全燃烧都生成3molH 2OD .光照下2,2—二甲基丙烷与Cl 2反应,其一氯取代物只有二种 24.下列对有机物结构或性质的描述,错误的是A .一定条件下,Cl 2可在甲苯的苯环或侧链上发生取代反应B .苯酚钠溶液中通入CO 2生成苯酚,则碳酸的酸性比苯酚弱C .乙烷和丙烯的物质的量共1mol ,完成燃烧生成3molH 2OD .光照下2,2—二甲基丙烷与Br 2反应其一溴取代物只有一种 25.下列对有机物结构或性质的描述错误的是A .乙酸与乙醇在一定条件下发生酯化反应,加入浓H 2SO 4有利于酯化反应的进行B .鉴别己烯中是否混有少量苯,加入少量溴水C .乙烷和丙烯的物质的量各1mol ,完全燃烧均生成3molH 2OD .蛋白质溶液中分别加入饱和(NH 4)2SO 4和CuSO 4溶液,均有白色沉淀,但原理不同 26.下列对有机物结构或性质的描述,错误..的是 A .苯酚钠溶液中通入CO 2生成苯酚,则碳酸的酸性比苯酚弱 B .一定条件下,Cl 2可在甲苯的苯环或侧链上发生取代反应 C .乙烷和丙烯的物质的量共1mol ,完全燃烧生成3molH 2O D .硬脂酸甘油酯的皂化反应的两种产物均可溶于水 27.下列与有机物结构、性质相关的叙述错误的是A .甲烷与氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同B .溴水、酸性高锰酸钾溶液均可用于鉴别乙烯和乙烷,也均可以除去乙烷中的乙烯C .核磁共振氢谱可以鉴别某些不同物质,质谱可快速、准确测定物质的分子量D .实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol 、-3747 kJ/mol 和-3265 kJ/mol ,可以证明在苯分子中不存在独立的碳碳双键 28.下列与有机物结构、性质相关的叙述错误的是A.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2B.蛋白质和油脂都属于高分子化合物,一定条件下能水解C.甲烷和氯气反应生成一氯甲烷、苯和硝酸反应生成硝基苯的反应类型相同D.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键29.下列对有机物结构或性质的描述,错误..的是A.一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应B.甲苯与浓硝酸和浓硫酸的混酸反应制TNT体现了苯环对侧链的影响。
高考化学二轮复习 第一部分 专题篇 五 选考模块 第16讲 物质结构与性质课件

数是 3d 能级上的电子数。如 23 号元素钒(V)为[Ar]3d34s2,28 号元
素镍(Ni)为[Ar]3d84s2。
2 题组训练
③31~36 号元素,个位数就是 4p 能级上的电子数,如 35 号元素
溴(Br)为[Ar]3d104s24p5。
考点 1
考点 2
考点 3 考点 4 考点 5 限时规范训练
(2)由原子序数书写: ①原子序数大于 18 的,如 31 号元素,我们也可以用 31-18=13, 然后再填充 13 个电子,如[Ar]3d104s24p1。
考点一
考点 1
考点 2
考点 3 考点 4 考点 5 限时规范训练
②21~30 号元素除 Cr 和 Cu 外,4s 能级上都是 2 个电子,个位
2 题组训练 (6)(2014·江苏高考卷)Cu+基态核外电子排布式为 ________________________________________________________。
(4)1s22s22p63s23p63d9或[Ar]3d9 (5)4 1s22s22p63s23p63d5或[Ar]3d5 血红色 (6)[Ar]3d10或1s22s22p63s23p63d10
考点 1
考点 2
考点 3 考点 4 考点 5 限时规范训练
考点一
试题
(4)(2015·浙江自选模块)Cu2+的电子排布式是_________________。
(5)(2014·全国高考新课标卷Ⅰ)基态 Fe 原子有________个未成对电
1 精华聚集 子。Fe3+的电子排布式为________________________。可用硫氰化 钾检验 Fe3+,形成的配合物的颜色为________。
2019届高考化学二轮复习物质结构与性质(选考)课件(共82张PPT)

2.(全国卷Ⅱ,37)东晋《华阳国志·南中志》卷四中已有关于白铜的记载, 云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰 品。回答下列问题: (1)镍元素基态原子的电子排布式为_1_s_22_s_2_2_p_63_s_2_3_p_6_3_d_84_s_2_(_________或___, 3d能级上的未成对电子数为_2__。 [Ar]3d84s2) 解析 镍是28号元素,位于第四周期第Ⅷ族,根据核外电子排布规则, 其基态原子的电子排布式为1s22s2 2p63s23p63d84s2;3d能级有5个轨道,根 据洪特规则,先占满5个自旋方向相同的电子,再分别占据三个轨道,电 子自旋方向相反,所以未成对的电子数为2。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_G_e_C_l_4_、__G_e_B_r4、 G__e_I4_的__熔__、__沸__点__依__次__增__高__。__原__因___是__分__子__结__构__相__似__,__相__对__分__子__质__量__依__次__增__大_ , 分__子__间__相__互__作__用__力__逐__渐__增__强__。
子总是优先单独占据一个轨道,而且自旋状态相同
(2)几种表示方法 表示方法
电子排布式 简化表示式 价电子排布式 外围电子排布式(图)
电子排布图(或轨道表示式)
举例 Cr:1s22s22p63s23p63d54s1
Cu:[Ar]3d104s1 Fe:3d64s2
(3)常见错误防范
①电子排布式
a.3d、4s书写顺序混乱
解析 Zn、Ge、O三种元素中,Zn和Ge是金属元素,O是非金属元素。O 的电负性比Zn和Ge的大,又根据同周期元素的电负性从左到右逐渐增大 的规律,可知电负性:O>Ge>Zn。 (5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_s_p_3_,微粒之间 存在的作用力是_共__价__键___。 解析 由于锗单晶具有金刚石型的结构,故每个锗原子与相邻的四个锗 原子形成四个共价键,其原子轨道杂化类型为sp3杂化。
高考化学二轮复习 第一部分 专题五 选修内容 第15讲 物质结构与性质课件

答 案 : (1) 电 子 云 2 (2)O > S > Se (4)C(碳)
(5)K F
(3) 小
1.把握原子核外电子排布的“三”规律。
①能量最 原子核外电子总是先占有能量最低 低原理 的原子轨道
②泡利原 每个原子轨道上最多只容纳2个自
理
旋状态相反的电子
③洪特规 则
当电子排布在同一能级的不同轨道 时,基态原子中的电子总是优先单 独占据一个轨道,而且自旋状态相 同
2.明确表示基态原子核外电子排布的“四”方法。
表示方法 电子排布式
举例 Cr∶1s22s22p63s23p63d54s1
简化表示式 Cu:[Ar]3d104s1
价电子排布式 Fe:3d64s2
及对晶体性质的影响; 关量。能根据晶体中存
常见晶体的结构及熔、 在的作用力,利用不同
沸点的比较。
方法判断比较熔、沸点
的高低。
考点一 原子结构和性质
[例 1] (2016·全国Ⅰ卷)锗(Ge)是典型的半导体元 素,在电子、材料等领域应用广泛。(导学号 58870074)
(1)基态 Ge 原子的核外电子排布式为[Ar]________, 有________个未成对电子。
电子排布图 (或轨道表示式)
3.牢记元素第一电离能和电负性的递变性。
项目
同主族 同周期(从左到右)
(自上而下)
第一电离 能
增大趋势(注意第 ⅡA、ⅤA旋的特殊 性)
依次减小
电负性
依次增大
依次减小
考点二 分子结构和性质
[例 2] (2016·全国Ⅰ卷)(1)Ge 与 C 是同族元素,C 原子之间可以形成双键、三键,但 Ge 原子之间难以形成 双键或三键。从原子结构角度分析,原因是___________。
2022届高三化学高考备考二轮复习专题:物质结构与性质综合题课件

(
),三种分子中键角由大到小的顺序为________________。
[解析] N、P、As 属于同一主族元素,其电负性:N>P>As,因三种氢化 物分子中的中心原子电负性逐渐减弱,则分子中成键电子对逐渐远离中心原子, 致使成键电子对的排斥降低,键角逐渐减小,即键角由大到小的顺序为 NH3>PH3 >AsH3。
的沸点比
高,原因是_______________。
(4)硼酸晶体是片层结构,其中一层的结构如图所示。硼酸在冷水中溶解度很小,但在 热水中较大,原因是_____________________________________________________ ________________________________________________________________________ ________________________________________________________________________。
(3)HF、C2H2 都是由分子构成的分子晶体,分子晶体的熔、沸点受分子间作用力的影响,由于 在 HF 分子之间除了存在范德华力外,还存在氢键,增加了分子之间的吸引力,使物质气化需 要消耗的能量比一般的普通分子消耗的能量高,即 HF 的沸点比乙炔的高。在 BF3 分子中的 B 原子上有空轨道,而 HF 分子中的 F 原子上有孤电子对,当 BF3 与 HF 靠近时,HF 分子中 F 原子的孤电子对填充 BF3 分子中 B 原子的空轨道,二者形成配位键,从而结合形成 HBF4。
间难以形成双键或三键。从原子结构角度分析,原因是______________。
(2)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因________________
江苏省2014届高考化学二轮复习简易通:第15讲 实验化学
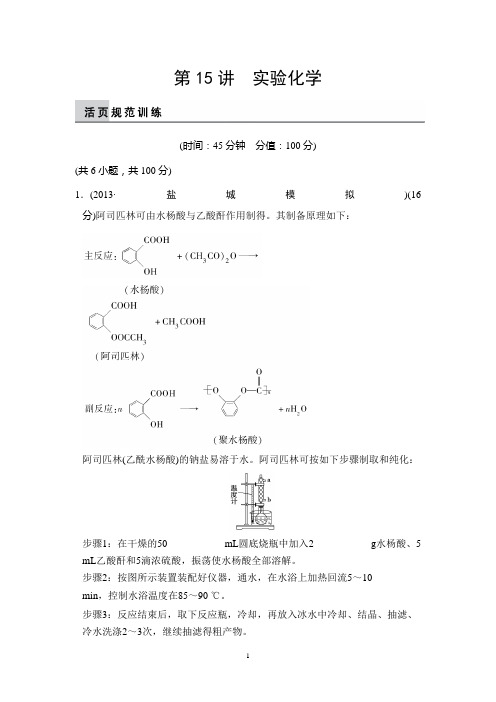
第15讲实验化学(时间:45分钟分值:100分)(共6小题,共100分)1.(2013·盐城模拟)(16分)阿司匹林可由水杨酸与乙酸酐作用制得。
其制备原理如下:阿司匹林(乙酰水杨酸)的钠盐易溶于水。
阿司匹林可按如下步骤制取和纯化:步骤1:在干燥的50 mL圆底烧瓶中加入2 g水杨酸、5 mL乙酸酐和5滴浓硫酸,振荡使水杨酸全部溶解。
步骤2:按图所示装置装配好仪器,通水,在水浴上加热回流5~10min,控制水浴温度在85~90 ℃。
步骤3:反应结束后,取下反应瓶,冷却,再放入冰水中冷却、结晶、抽滤、冷水洗涤2~3次,继续抽滤得粗产物。
步骤4:将粗产物转移至150 mL烧杯中,在搅拌下加入25mL饱和碳酸氢钠溶液,充分搅拌,然后过滤。
步骤5:将滤液倒入10 mL 4 mol·L-1盐酸,搅拌,将烧杯置于冰浴中冷却,使结晶完全。
抽滤,再用冷水洗涤2~3次。
(1)步骤1浓硫酸的作用可能是________。
(2)步骤2中,冷凝管通水,水应从________口进(填“a”或“b”)。
(3)步骤3抽滤时,有时滤纸会穿孔,避免滤纸穿孔的措施是________________ ______________________________________________。
(4)步骤4发生主要反应的化学方程式为_____________________;过滤得到的固体为________。
(5)取几粒步骤5获得的晶体加入盛有5mL水的试管中,加入1~2滴1%三氯化铁溶液,发现溶液变紫色,可采用____ ____方法,进一步纯化晶体。
解析(1)由制备原理可以看出,浓硫酸的作用是在该反应中作为催化剂。
(2)冷凝水的流向是“下进上出”,故从b管进水,a管出水。
(3)避免滤纸穿孔的措施是减小真空度或者加一层(或多层)滤纸。
(4)根据产物的结构特点可知是羧基(—COOH)与NaHCO3发生反应+NaHCO3―→+CO2↑+H2O;粗产品还有可能发生副反应得到聚水杨酸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规 律及原因____________________________。
熔点/℃
GeCl4 -49.5
GeBr4 26
GeI4 146
沸点/℃
83.1
186
约400
(4) 光 催 化 还 原 CO2 制 备 CH4 反 应 中 , 带 状 纳 米 Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由 大至小的顺序是____________。
(5)Ge 单晶为金刚石型结构,金刚石中碳原子的杂化方 式为 sp3,因此 Ge 原子的杂化方式也为 sp3。微粒之间存在 的作Байду номын сангаас力为共价键。
(6)①根据题给图示可知,D 原子的坐标参数为(14,14,14)。 ②每个晶胞中含有锗原子 8×1/8+6×1/2+4=8(个),每 个晶胞的质量为8×73NgA·mol-1,晶胞的体积为(565.76×10-10 cm)3,所以晶胞的密度为NA×(85×657.736g×·m1o0l--110 cm)3。
(5)Ge 单晶具有金刚石型结构,其中 Ge 原子的杂化 方式为________,微粒之间存在的作用力是___________。
(6)晶胞有两个基本要素: ①原子坐标参数,表示晶胞内部各原子的相对位置。 下图为 Ge 单晶的晶胞,其中原子坐标参数 A 为 (0,0,0);B 为(12,0,12);C 为(12,12,0),则 D 原子的坐 标参数为____________。
(3)AsCl3分子的立体构型为________,其中As的杂 化轨道类型为____________。
(4)GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是__________________________________。
(5)GaAs的熔点为1 238 ℃,密度为ρ g·cm-3,其晶 胞结构如图所示。该晶体的类型为________,Ga与As 以 ________ 键 键 合 。 Ga 和 As 的 摩 尔 质 量 分 别 为 MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体 积占晶胞体积的百分率为________。
专题五 选考模块
第15讲 物质结构与性质
高考调研·明确考向
[考纲要求]
(一)原子结构与元素的性质 1.了解原子核外电子的能级分布,能用电子排布 式表示常见元素(1~36号)原子核外电子的排布。了解原 子核外电子的运动状态。 2.了解元素电离能的含义,并能用以说明元素的 某些性质。
3.了解原子核外电子在一定条件下会发生跃迁, 了解其简单应用。
(三)分子间作用力与物质的性质 1.了解化学键和分子间作用力的区别。 2.了解氢键的存在对物质性质的影响,能列举含 有氢键的物质。 3.了解分子晶体与原子晶体、离子晶体、金属晶 体的结构微粒、微粒间作用力的区别。
[真题导航]
1.(2016·全国Ⅰ卷)锗(Ge)是典型的半导体元素, 在电子、材料等领域应用广泛。回答下列问题:
2.(2016·全国Ⅲ卷)砷化镓(GaAs)是优良的半导体 材料,可用于制作微型激光器或太阳能电池的材料等。 回答下列问题:
(1) 写 出 基 态 As 原 子 的 核 外 电 子 排 布 式 ____________。
(2)根据元素周期律,原子半径Ga________As,第 一电离能Ga________As。(填“大于”或“小于”)
(3)由锗卤化物的熔沸点由Cl到I呈增大的趋势且它 们的熔沸点较低,可判断它们均为分子晶体,而相同类 型的分子晶体,其熔沸点取决于相对分子质量的大小, 因为相对分子质量越大,分子间的作用力就越大,熔沸 点就越高。
(4)Zn和Ge为同周期元素,Ge在Zn的右边,因此 Ge的电负性比Zn的强;O为活泼的非金属元素,电负 性强于Ge和Zn,因此三者电负性由大至小的顺序为O 、Ge、Zn。
(1) 基 态 Ge 原 子 的 核 外 电 子 排 布 式 为 [Ar] ____________,有________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、 叁键,但Ge原子之间难以形成双键或叁键。从原子结 构角度分析,原因是______________________________ ______________________________________________。
4.了解电负性的概念,知道元素的性质与电负性 的关系。
(二)化学键与物质的性质 1.理解离子键的形成,能根据离子化合物的结构 特征解释其物理性质。 2.了解共价键的主要类型σ键和π键,能用键能、 键长、键角等说明简单分子的某些性质。
3.了解简单配合物的成键情况。 4.了解原子晶体的特征,能描述金刚石、二氧化 硅等原子晶体的结构与性质的关系。 5.理解金属键的含义,能用金属键理论解释金属 的一些物理性质。 6.了解杂化轨道理论及常见的杂化轨道类型(sp, sp2,sp3),能用价层电子对互斥理论或者杂化轨道理论 推测常见的简单分子或者离子的空间结构。
②晶胞参数,描述晶胞的大小和形状。已知Ge单 晶的晶胞参数a=565.76 pm,其密度为________g·cm-3( 列出计算式即可)。
解析 (1)锗元素在周期表的第四周期、第ⅣA族, 因此核外电子排布式为[Ar]3d104s24p2,p轨道上的2个电 子是未成对电子。
(2)锗虽然与碳为同族元素,但比碳多了两个电子层 ,因此锗的原子半径大,原子间形成的σ单键较长,pp 轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π 键。
答案 (1)3d104s24p2 2 (2)Ge 原子半径大,原子间形成的 σ 单键较长,p- p 轨道肩并肩重叠程度很小或几乎不能重叠,难以形成 π 键 (3)GeCl4、GeBr4、GeI4 的熔、沸点依次增高。原因 是分子结构相似,相对分子质量依次增大,分子间相互 作用力逐渐增强 (4)O>Ge>Zn (5)sp3 共价键 (6)①(14,14,14) ②6.028××57635.763×107
