专三、物质推断答案
初三化学推断题专项练习(含答案)

--初三化学——推断题专题复习衡一、考点、热点回顾1、固体物质的颜色A 白色固体:氧化钙CaO 、氢氧化钙Ca(OH)2、碳酸钠Na2CO3、碳酸钙CaCO3、氢氧化钠NaOH、B 黄色固体:硫粉SC 红色固体:红磷P、氧化铁Fe2O3、铜CuD蓝色固体:胆矾CuSO4.5H2OE黑色固体:木炭C、氧化铜CuO、二氧化锰MnO2、四氧化三铁Fe3O4、F 绿色固体:碱式碳酸铜Cu2(OH)2CO3G紫黑色固体:高锰酸钾KMnO4H 无色固体:冰,干冰,金刚石I 银白色固体:银,铁,镁,铝,汞等金属2、生成沉淀的颜色A白色沉淀:不溶于水也不溶于稀硝酸:氯化银AgCl、硫酸钡BaSO4不溶于水但溶于稀硝酸或稀盐酸:氢氧化镁Mg(OH)2、碳酸钙CaCO3、碳酸钡BaCO3B 红褐色沉淀:氢氧化铁Fe(OH)3C蓝色沉淀:氢氧化铜 Cu(OH)23、溶液的颜色A 蓝色溶液Cu2+:硫酸铜CuSO4、硝酸铜Cu(NO3)2、氯化铜CuCl2等B 黄色溶液Fe3+:氯化铁FeCl3、硫酸铁Fe2(SO4)3、硝酸铁Fe(NO3)3等C 浅绿色溶液Fe2+:氯化亚铁FeCl2、硫酸亚铁FeSO4、硝酸亚铁Fe(NO3)2等D无色液体:水,双氧水E紫红色溶液:高锰酸钾溶液 F 紫色溶液:石蕊溶液4、气体的颜色A红棕色气体:二氧化氮 B 黄绿色气体:氯气C无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体。
解题技巧:抓住题目的题眼进行突破,常见的题眼就是上述物质的颜色与状态,还有就是某些物质的制备原理二、典型例题1.A、B、C、D、E、F、G为常见的物质,其中B、E、G属于单质,反应②是炼铁工业中的主要反应,下图是它们之间的相互转化关系。
请回答:--样品 A 溶 液 B 滤 液 甲 沉淀乙 沉 淀 C 滤 液① 水 溶解 ③ 过量 BaCl 2溶液过滤② 过量NaOH 溶液 过滤 ④ 过量 Na 2CO 3溶液过滤 丙 沉 淀 D 滤 液⑤ 过量 盐酸加热蒸发 固体丁(1)A 物质的化学式 。
初中化学物质的变化和性质推断题专题训练含答案
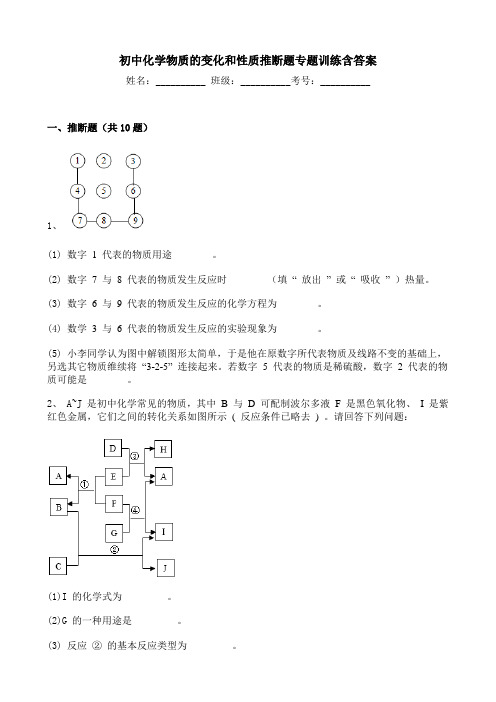
初中化学物质的变化和性质推断题专题训练含答案姓名:__________ 班级:__________考号:__________一、推断题(共10题)1、(1) 数字1 代表的物质用途______ 。
(2) 数字7 与8 代表的物质发生反应时______ (填“ 放出” 或“ 吸收” )热量。
(3) 数字6 与9 代表的物质发生反应的化学方程为______ 。
(4) 数学3 与 6 代表的物质发生反应的实验现象为______ 。
(5) 小李同学认为图中解锁图形太简单,于是他在原数字所代表物质及线路不变的基础上,另选其它物质维续将“3-2-5” 连接起来。
若数字 5 代表的物质是稀硫酸,数字 2 代表的物质可能是______ 。
2、 A~J 是初中化学常见的物质,其中 B 与 D 可配制波尔多液 F 是黑色氧化物、I 是紫红色金属,它们之间的转化关系如图所示( 反应条件已略去) 。
请回答下列问题:(1)I 的化学式为_______ 。
(2)G 的一种用途是_______ 。
(3) 反应②的基本反应类型为_______ 。
(4) 反应③的化学方程式为_______ 。
3、 A~G 表示初中化学常见的物质,它们之间的转化关系如图所示 ( 部分生成物已略去 ) ,其中 B 用于铅酸蓄电池, D 是一种蓝色溶液, G 是一种浅绿色溶液。
请回答下列问题:( 1 )物质 B 的化学式为 _____ 。
( 2 )写出反应②的化学方程式 ______ 。
( 3 )反应①②③的基本反应类型是否相同 ___ ( 填“ 是” 或“ 否”) 。
( 4 )写出 E 的一种用途 _____ 。
4、 A—K 及X 、Y 均为初中化学所学的物质,它们相互转化的关系如下图所示(部分生成物未标出)。
其中 A 、 C 在常温下均为液态且组成元素相同,X 、 E 均为黑色固体且为氧化物,I 为石灰石的主要成分。
请根据要求回答下列问题:( 1 )写出E 的化学式___________ ,物质 D 的一种用途___________ 。
《物质的推断与转化》2022年中考化学试题分项详解(苏州专用)(附答案)

A.该反应一定在溶液中进行
B.若丙、丁分别为CO2和H2O,则反应条件一定是点燃
C.若丙、丁分别代表盐和水,则甲、乙中一定有一种物质为酸
D.若该反应是复分解反应且丙为不溶性碱,则反应物中一定有可溶性的盐
【答案】D
(1)写出化学式:G_______;J________。
(2)写出F— D反应的化学方程式_________。
(3)写出E—B反应的化学方程式___________。
(4)从微观粒子角度分析,C— D反应的微观变化是_______(填序号)。
①分子与原子的转化
②原子与离子的转化
③离子转化为分子
【答案】Fe2O3Cu(OH)2(答案合理即可) (答案合理即可) ②
【解析】根据A-J为初中化学常见的物质,A、B、G、H由两种元素组成,C在空气中表面生成一层致密的氧化膜,具有很好的抗腐蚀性能,所以C是铝,D为紫红色固体,所以D是铜,G是铁锈的主要成分,所以G是氧化铁,I和J物质类别(指酸、碱、盐)相同,但颜色不同,C会与F反应,F会转化成铜,所以F可以是铜盐,F会与I反应,会转化成J,I也会转化成J,所以F可以是硫酸铜,硫酸铜和铝反应生成硫酸铝和铜,I可以是氢氧化钠(无色),J可以是氢氧化铜(蓝色),氢氧化钠和氢氧化铜均为碱,硫酸铜和氢氧化钠反应生成氢氧化铜蓝色沉淀和硫酸钠;E会与氧化铁反应,会转化成硫酸铜,所以E是硫酸,硫酸和氧化铁反应生成硫酸铁和水,硫酸和氧化铜反应生成硫酸铜和水,硫酸、氧化铁都会转化成H,H由2种元素组成,所以H是水,也可以是二氧化碳(硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳,氧化铁和一氧化碳在高温下反应生成铁和二氧化碳);硫酸会转化成B,B转化成的A会与硫酸反应,所以B是氯化氢,A是氯化钡,硫酸和氯化钡反应生成硫酸钡和氯化氢,氯化氢和氢氧化钡反应生成氯化钡和水,然后将推出的物质进行验证,推导正确。
备考2021年中考科学二轮复习:物质的推断,填空题专训及答案

为改良酸性土壤常用的物质,如图它们之间的转化关系,请回答:组成,某科学兴趣小组的成员进行了如图所示的实验。
请回答下列问题:
验及现象如下(微溶性物质按可溶处理):
组成,为探究该样品的组成,某小组取适量样品按下列流程进行实验。
(2018杭州.中考模拟) 如图是氧化沉淀法生产复印用高档Fe O粉的工艺流程简图,请回答:
34
水硫酸铜遇水会变蓝色。
经一步反应可转化为另一种物质,部分反应物、生成物及反应条件已略去)。
请回答:间能发生化学反应,“→”表示在一定条件下的物质转化。
成,取少量固体加足量水溶解得到无色溶液M,进行如图实验。
B、C、D中均含有一种相同的元素,常温下,
下列铜制品中,利用金属导热性的是
铜质奖牌
铜导线
铜火锅
已知2Cu+2H SO+O 2CuSO+2H O
24242
发生化学反应,其中C
少量A进行如下实验。
其组成,小明进行了探究,方案及现象如图所示。
据此推断:常见物质。
1“”
(2020桐乡.中考模拟
2.答案:
3.答案:
4.答案:
5.答案:
6.答案:
7.答案:
8.答案:
9.答案:
10.答案:
11.答案:
12.答案:
13.答案:
14.答案:
15.答案:
16.答案:
17.答案:
18.答案:
19.答案:
20.答案:。
九年级科学上册第2章物质转化与材料利用专项训练三:物质的转化推断习题课件新版浙教版

14 (中考·金华)实验室有一久置的生石灰样品,科学小组 同学利用该样品进行了一系列探究活动,具体操作步 骤如下: ①称取0.75 g样品,加足量的水充分溶解,过滤得滤 液A和0.1 g沉淀B; ②将滤液A等分成两份,一份先加少量酚酞试液再滴 加稀盐酸至过量,得混合物C,另一份加过量的碳酸 钠溶液,得混合物D;
③将混合物C、D倒入一个洁净的烧杯中,发现烧杯中有 白色沉淀且上层清液呈红色,过滤,得滤液E和1 g滤渣; ④向滤液E中滴加CaCl2溶液,有白色沉淀生成。 (1)则滤液E中一定含有的溶质是__碳__酸___钠__、__氯__化__钠_____。 (2) 根 据 实 验 现 象 及 数 据 判 断 , 原 样 品 的 成 分 是
_____氢__氧__化__钙__和__碳__酸__钙_______。
【点拨】 (1)通过实验分析可知:将混合物C、D倒入一个洁净
的烧杯中,发现烧杯中有白色沉淀且上层清液呈红色,过 滤,得滤液E和1 g滤渣,向滤液E中滴加CaCl2溶液,有白 色沉淀生成,说明滤液E中一定含有的溶质是:碳酸钠、 氯化钠,一定没有盐酸,氢氧化钠可能有也可能没有;
(3)试剂X的名称是 _稀__盐__酸__(_合__理___ _即__可__)_______。
【点拨】 棕黑色粉末与试剂X反应后得到黄色溶液和黑色固体,
黄色溶液中含有铁离子,则棕黑色粉末中含有氧化铁,氧 化铁能与酸反应生成盐和水,则X可能是稀盐酸或稀硫酸。
13 (中考·荆州)有一种固体混合物M,其中只可能含有 Na2CO3、NaNO3、Na2SO4、CuCl2、BaCl2中的一种 或几种。请根据以下实验操作回答下列问题。 操作①:取少量M放入足量的水中,充分搅拌、静置, 得到白色沉淀和无色溶液,过滤。操作②:向滤出的 沉淀中加入足量稀盐酸,沉淀全部溶解,此时所得溶 液仍为无色。
专题3离子推断及鉴别-答案

3离子推断及鉴别答案和解析【答案】1.C l-;A g+、CO32-、OH-;如为蓝色则有C u2+,加足量铁粉有气泡产生则有H+;有H+,2H++F e=F e2++H2↑2.C a CO3、N a2SO4、C u SO4;N a2CO3;N a C l;硝酸银、稀硝酸;A g++C l-=A g C l↓3.A g+、B a2+、NH44+,;F e3+;焰色反应、透过蓝色钴玻璃可以观察到紫色火焰.NH3↑+H2O 4.A g+、B a2+、NH4+;F e3+;A g++C l-=A g C l↓;B a2++SO42-=B a SO4↓;NH4++OH-△5.CO32-和SO42-;N a+;C l-;取样品加入过量的稀硝酸,再加入A g NO3溶液,若生成白色沉淀,则说明原溶液中一定含有C1-.6.CO32-、SO42-、NH+4、K+;M g2+、B a2+;C l-7.B a2++SO42-=B a SO4↓;H++OH-=H2O、NH4++OH-=NH3↑+H2O;A g+、B a2+、NH4+;M g2+;焰色反应;透过蓝色钴玻璃看是否呈紫色,呈紫色说明有K+,不呈紫色说明无K+8.NH4+;0.4mol/L;CO32-,SO42-;AC9.SO42-、CO32-;F e3+、A l3+、C l-;K+;焰色反应10.M g2+、A l3+、SO42-;K+;焰色反应;M g2++2OH-=M g(OH)2↓;A l3++3OH-=A l(OH)3↓;A l(OH)3+OH-=A l O2-+H2O11.C u SO4;A g NO3;N a2CO3;B a C l2;CO32-+2H+═H2O+CO2↑;B a2++SO42-═B a SO4↓;2A g NO3+B aC l2═2A g C l↓+B a(NO3)212.B a C l2、K2CO3;M g C l2;N a C l;B a2++CO32-=B a CO3↓;B a CO3+2H+=B a2++CO2↑+2H2O;B a2++SO42-=B a S O4↓;A g++C l-=A g C l↓13.H++HCO3-═CO2↑+H2O;F e S+2H+═F e2++H2S↑;CO32-+H+═HCO3-;C a2++HCO3-+OH-═Ca CO3↓+H2O;A g+、B a2+、A l3+、M n O4-;N a+、CO32-、A l O2-【解析】1. 解:因OH-分别与A g+、C u2+、H+反应,CO32-分别与A g+、C u2+、H+反应,则一定存在C l-,电解质为HC l或氯化铜,如为蓝色则有C u2+,电解质为氯化铜,如家铁粉有气泡产生,则有H+,电解质为HC l,鉴别氢离子,对应发生离子反应为2H++F e=F e2++H2↑,故答案为:C l-;A g+、CO32-、OH-;如为蓝色则有C u2+,加足量铁粉有气泡产生则有H+;有H+,2H++F e=F e2++H2↑.2. 解:由实验可知,C a CO3不溶于水,C u SO4溶于水后为蓝色液体,所以原固体粉末中一定不含这两种物质;滴加B a C l2溶液,出现白色沉淀,白色沉淀可能是碳酸钡或硫酸钡,碳酸钡溶于盐酸,硫酸钡不溶,加盐酸时沉淀完全消失,所以一定含有碳酸根离子,一定不含有硫酸根离子,即一定不存在的物质是C a CO3、N a2SO4、C u SO4,一定有N a2CO3,无法确定N a C l,(1)由上述分析可知,一定不存在C a CO3、N a2SO4、C u SO4,故答案为:C a CO3、N a2SO4、C u SO4;(2)一定存在的物质是,故答案为:N a2CO3;(3)可能存在的物质是N a C l,故答案为:N a C l;(4)氯化钠的存在与否,可以通过检验氯离子来确定,氯离子的检验可以用硝酸酸化的硝酸银来检验,操作是:取实验(1)溶液先加入过量硝酸,再加硝酸银溶液,若有白色沉淀产生,则固体中含N a C l,若无白色沉淀产生,则固体中不含N a C l,则试剂为硝酸银、稀硝酸,发生的离子反应为A g++C l-=A g C l↓,故答案为:硝酸银、稀硝酸;A g++C l-=A g C l↓.由实验可知,C a CO3不溶于水,C u SO4溶于水后为蓝色液体,所以原固体粉末中一定不含这两种物质;滴加B a C l2溶液,出现白色沉淀,白色沉淀可能是碳酸钡或硫酸钡,碳酸钡溶于盐酸,硫酸钡不溶,加盐酸时沉淀完全消失,所以一定含有碳酸根离子,一定不含有硫酸根离子,即一定不存在的物质是C a CO3、N a2SO4、C u SO4,一定有N a2CO3,无法确定N a C l,以此来解答.本题考查物质检验和鉴别,为高频实验探究题,把握物质的特性质、离子检验(硫酸根离子、氯离子等)为解答的关键,注意实验现象与结论的关系,题目难度不大.3. 解:(1)加入过量盐酸有白色沉淀生成,说明一定含有银离子;(2)在滤液中加入过量的稀硫酸,又有白色沉淀生成说明含有钡离子;(3)滴入2滴KSCN溶液,没有明显的现象出现证明无铁离子;(4)加入N a OH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体,证明含有铵根离子;综上所述:溶液中一定含有A g+、B a2+、NH44+;一定不含F e3+;K+不能确定,需要用焰色反应检验,透过蓝色钴玻璃可以观察到紫色火焰;故答案为:A g+、B a2+、NH44+;F e3+;焰色反应、透过蓝色钴玻璃可以观察到紫色火焰.4. 解:氯离子和银离子反应生成白色沉淀,所以根据实验(1)现象判断一定有A g+;钡离子和硫酸根离子反应生成白色沉淀,根据实验(2)现象判断一定有B a2+;F e3+与KSCN反应使溶液呈血红色,根据实验(3)现象判断一定没有F e3+;铵根离子和碱在加热条件下能反应生成刺激性气味的氨气,根据实验(4)现象判断一定有NH4+;(1)氯离子和银离子生成氯化银白色沉淀,A g++C l-=A g C l↓;(2)钡离子和硫酸根离子反应生成硫酸钡白色沉淀,B a2++SO42-=B a SO4↓;(4)铵根离子和碱在加热条件下能反应生成刺激性气味的氨气,NH4++OH-△NH3↑+H2O.故答案为:A g+、B a2+、NH4+;F e3+;(1)A g++C l-=A g C l↓;(2)B a2++SO42-=B a SO4↓(4)NH4++OH-△NH3↑+H2O.5. 解(1)取少量该溶液加入B a C l2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,并有气体生成,说明白色沉淀为B a CO32-和B a SO4,则溶液中含有CO32-、SO42-;故答案为:CO32-和SO42-;(2)用铂丝蘸取少量该溶液置于无色酒精灯火焰中灼烧,火焰呈黄色,透过蓝色钴玻璃观察,未见紫色火焰,说明溶液中只有N a+而没有K+,故答案为:N a+;(3)另取少量该溶液加入N a OH溶液并加热,将湿润的红色石蕊试纸靠近试管口无颜色变化,说明溶液中没有NH4+;所以第①步可以检验出的离子是CO32-和SO42-;定第②步说明一定含有的离子是N a+;不能判断是否存在的离子是C l-;为了检验C l-向溶液中加入过量的稀硝酸,再加入A g NO3溶液,若生成白色沉淀,则说明原溶液中一定含有C1-;故答案为:C l-;取样品加入过量的稀硝酸,再加入A g NO3溶液,若生成白色沉淀,则说明原溶液中一定含有C1-.6. 解:(1)第一份加入A g NO3溶液有沉淀生成,可能为A g C l、A g2CO3或A g2SO4等沉淀,则原溶液中可能含有C l-、CO32-、SO42-中的一种或几种;(2)第二份加入足量N a OH溶液并加热后,收集到气体0.04mol,应为NH3,说明原溶液中含有NH4+离子;(3)第三份加入足量B a C l2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤,干燥后,沉淀质量为2.33g,说明原溶液中含有CO32-、SO42-离子,则一定不含有M g2+、B a2+离子,因二者与CO32-不能共存,又n(CO32-)=6.27g−2.33g197g/mol =0.02mol,n(SO42-)= 2.33g233g/mol=0.01mol,n(NH4+)=n(NH3)=0.04mol,根据溶液的电中性原则可知一定含有K+,可能含有C l-.故答案为:CO32-、SO42-、NH4+、K+;M g2+、B a2+;C l-.7. 解:第一步:加入过量的稀盐酸,有白色沉淀生成,沉淀为A g C l,则一定含有A g+;第二步:过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成,沉淀为硫酸钡,则一定含有B a2+;第三步:再过滤,取少量滤液,滴入N a OH溶液至溶液呈碱性,在此过程中溶液无明显现象,加热该溶液,可产生使湿润的红色石蕊试纸变蓝色的气体,气体为氨气,说明一定含NH4+,一定没有M g2+,(1)第二步离子反应为B a2++SO42-=B a SO4↓,第三步离子反应为H++OH-=H2O、NH4++OH-=NH3↑+H2O,故答案为:B a2++SO42-=B a SO4↓;H++OH-=H2O、NH4++OH-=NH3↑+H2O;(2)由上述分析可知,一定含有的阳离子为A g+、B a2+、NH4+,一定不含M g2+,钾离子不能确定,可利用焰色反应来检验,方法为透过蓝色钴玻璃看是否呈紫色,呈紫色说明有K+,不呈紫色说明无K+,故答案为:A g+、B a2+、NH4+;M g2+;焰色反应;透过蓝色钴玻璃看是否呈紫色,呈紫色说明有K+,不呈紫色说明无K+.第一步:加入过量的稀盐酸,有白色沉淀生成,沉淀为A g C l,则一定含有A g+;第二步:过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成,沉淀为硫酸钡,则一定含有B a2+;第三步:再过滤,取少量滤液,滴入N a OH溶液至溶液呈碱性,在此过程中溶液无明显现象,加热该溶液,可产生使湿润的红色石蕊试纸变蓝色的气体,气体为氨气,说明一定含NH4+,一定没有M g2+,以此来解答.本题考查离子的检验、离子的反应等,注意步骤中试剂过量的作用分析存在的离子是解答的关键,明确第三步中酸过量为易错点,题目难度中等.8. 解:根据题意,B a2+和SO42-,可发生离子反应生成B a SO4沉淀,因此两者不能大量共存.B a2+和CO32-可发生离子反应生成B a CO3沉淀,因此两者也不能大量共存.第一份加入A g NO3溶液有沉淀产生,可能发生C l-+A g+═A g C l↓、CO32-+2A g+═A g2CO3↓、SO42-+2A g+═A g2SO4↓,所以可能含有C l-、CO32-、SO42-.第二份加足量N a OH溶液加热后,收集到气体0.04mol,能和N a OH溶液加热产生气体的只能是NH4+,而没有沉淀产生说明一定不存在M g2+(M g2+可以和OH-反应生产氢氧化镁沉淀).故可确定一定含有NH4+,一定不存在M g2+.根据反应NH4++OH-△NH3↑+H2O,产生NH3为0.04mol,可得NH4+也为0.04mol.第三份加足量B a C l2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤.干燥后,沉淀质量为2.33g.部分沉淀溶于盐酸为B a CO3,部分沉淀不溶于盐酸为B a SO4,发生反应CO32-+B a2+═B a CO3↓、SO42-+B a2+═B a SO4↓,因为B a CO3+2HC l═B a C l2+CO2↑+H2O而使B a CO3溶解.因此溶液中一定存在CO32-、SO42-,一定不存在B a2+.由条件可知B a SO4为2.33g,物质的量=2.33g233g/mol0.01mol,B a CO3为6.27g-2.33g=3.94g,物质的量= 3.94g197g/mol=0.02mol,则CO32-物质的量为0.02mol,CO32-物质的量浓度=0.02mol0.1L=0.2mol/L,由上述分析可得,溶液中一定存在CO32-、SO42-、NH4+,一定不存在M g2+、B a2+.而CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol,CO32-、SO42-所带负电荷分别为0.02mol×2、0.01mol×2,共0.06mol,NH4+所带正电荷为0.04mol,根据溶液中电荷守恒,可知K+一定存在;(1)由实验②可知溶液中含有的离子为NH4+,浓度=0.04mol0.1L=0.4mol/L,故答案为:NH4+,0.4mol/L;(2)由实验③可以判断中溶液中含有的离子为CO32-,SO42-,故答案为:CO32-,SO42-;(3)由上述分析可得,溶液中一定存在CO32-、SO42-、NH4+,一定不存在M g2+、B a2+.而CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol,CO32-、SO42-所带负电荷分别为0.02mol×2、0.01mol×2,共0.06mol,NH4+所带正电荷为0.04mol;A、根据溶液中电荷守恒,可知K+一定存在,K+物质的量≥0.02mol,当K+物质的量>0.02mol 时,溶液中还必须含有C l-,故A正确;B、由上述分析可得,B a CO3为6.27g-2.33g═3.94g,CO32-物质的量为0.02mol,故B错误;C、CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol,CO32-、SO42-所带负电荷分别为0.02mol×2、0.01mol×2,共0.06mol,NH4+所带正电荷为0.04mol,根据溶液中电荷守恒,可知K+一定存在,且K+物质的量≥0.02mol,当K+物质的量>0.02mol时,溶液中还必须存在C l-.因此当K+物质的量═0.02mol,溶液中不存在C l-,当K+物质的量>0.02mol时,溶液中一定存在C l-,故C正确;D、溶液中一定存在CO32-、SO42-、NH4+,B a2+和CO32-、SO42-可发生离子反应生成B a CO3↓、B a SO4↓而不共存,因此B a2+一定不存在.同时第二份加足量N a OH溶液加热后,收集到气体,没有产生沉淀,说明一定不含M g2+,故D错误;故选AC.9. 解:(1)加入稀硝酸无气体放出,说明原溶液中无CO32-;(2)加入一定量B a(OH)2溶液,生成有色沉淀,说明原溶液中含有F e3+,可能含有SO42-,过滤后在滤液中加入稀硝酸酸化,然后滴入A g NO3溶液,有白色沉淀生成,说明原溶液中含有C l-;(3)有色沉淀加入足量的稀盐酸后,沉淀全部溶解,说明沉淀中不含有硫酸钡.即原溶液中不存在SO42-;(5)加入氨水使溶液呈碱性,有沉淀生成,过滤.往得到的沉淀中加入过量的N a OH溶液,沉淀减少,说明原溶液中肯定含有F e3+、A l3+.因此,一定不含有的离子是SO42-、CO32-;肯定含有的离子是F e3+、A l3+、C l-;因实验没有涉及到K+,则不能确定是否含有的离子是K+,可通过焰色反应进行鉴别.故答案为:SO42-、CO32-;F e3+、A l3+、C l-;K+;焰色反应.10. 解:由澄清溶液知,该溶液中没有沉淀产生;由实验①的现象判断,根据“逐滴加入稀N a OH溶液先产生白色沉淀后部分溶解”知原溶液中存在M g2+、A l3+,不存在与其反应的CO32-;根据实验②的现象判断,步骤①得到的碱性溶液不含NH4+;由实验③的现象判断,根据“B a C l2溶液,有白色沉淀生成,加入盐酸,沉淀不溶解”知,原溶液中含SO42-,不含与其反应的B a2+;根据以上实验现象不能判断是否含有K+,只能通过其特殊实验--焰色反应来判断.(1)通过以上分析知,溶液中肯定存在的离子有M g2+、A l3+、SO42-,不能确定是否存在的离子有K+,为确认是否含有该离子,应做焰色反应实验.故答案为:M g2+、A l3+、SO42-;K+;焰色反应;(2)①中发生的离子反应,一个是M g2+和OH-的反应,一个是A l3+和OH-生成A l(OH)3沉淀的反应,一个是A l(OH)3和OH-生成A l O2-的反应.故答案为:M g2++2OH-=M g(OH)2↓;A l3++3OH-=A l(OH)3↓;A l(OH)3+OH-=A l O2-+H2O;11. 解:由于是可溶性盐,所以溶液中存在的盐离子和阴离子对应物质一定是可溶性,根据盐类物质溶解性情况可知:B a2+不能和SO42-、CO32-结合,而只能和NO3-、C l-,A g+不能和SO42-、C l-、CO32-三种离子结合,而只能和NO3-结合,则一定是B a C l2、A g NO3.C u2+不能和CO32-结合,所以为C u SO4,N a+对应CO32-为N a2CO3.即四种物质为B a C l2、A g NO3、C u SO4、N a2CO3;由于A盐是蓝色的,所以A为C u SO4;四支试管加入盐酸,B有沉淀,则B溶液为A g NO3;C生成无色气体,则为二氧化碳,即C为N a2CO3,所以D为B a C l2,(1)因A为C u SO4;B为A g NO3;C为N a2CO3;D为B a C l2;故答案为:C u SO4;A g NO3;N a2CO3;B aC l2;(2)N a2CO3与盐酸反应:N a2CO3+2HC l═2N a C l+H2O+CO2↑,故答案为:CO32-+2H+═H2O+CO2↑;C u SO4和B a C l2反应:C u SO4+B a C l2=C u C l2+B a SO4,故答案为:B a2++SO42-═B a SO4↓;A g NO3和B aC l2反应:2A g NO3+B a C l2═2A g C l↓+B a(NO3)2,故答案为:2A g NO3+B a C l2═2A g C l↓+B a(NO3)2.12. 解:向(1)的悬浊液中加入过量的稀硝酸,白色沉淀消失,并有气泡产生,说明含有K2CO3,取少量(2)的溶液滴入稀硫酸,有白色沉淀生成,说明含有B a C l2,由于含有B a C l2,发生反应的离子方程式为B a2++SO42-=B a SO4↓,则另取少量(2)的溶液滴入A g NO3溶液.有白色沉淀生成,应为A g C l,反应的离子方程式为A g++C l-=A g C l↓,但不能证明含有N a C l,另取少量(2)的溶液滴入过量的N a OH溶液,无明显现象,则一定不含M g C l2,则(1)中反应为B a2++CO32-=B a CO3↓,(2)反应为B a CO3+2H+=B a2++CO2↑+2H2O,故答案为:B a C l2、K2CO3;M g C l2;N a C l;①B a2++CO32-=B a CO3↓;②B a CO3+2H+=B a2++CO2↑+2H2O;③B a2++SO42-=B a SO4↓;④A g++C l-=A g C l↓.13. 解:(一)(1)硫酸氢钠溶液与碳酸氢钠溶液的反应的实质为H+与HCO3-反应,其离子反应为H++HCO3-═CO2↑+H2O,故答案为:H++HCO3-═CO2↑+H2O;(2)硫化亚铁投入稀硫酸中反应的实质为F e S与H+反应,其离子反应为F e S+2H+═F e2++H2S↑,故答案为:F e S+2H+═F e2++H2S↑;(3)向N a2CO3溶液中加入少量稀盐酸生成N a HCO3和N a C l,反应实质为CO32-与H+反应生成HCO3-,其离子反应为CO32-+H+═HCO3-,故答案为:CO32-+H+═HCO3-;(4)向碳酸氢钙溶液中加入少量烧碱溶液的反应实质为C a2+和HCO3-、OH-反应,其离子反应为C a2++HCO3-+OH-═C a CO3↓+H2O,故答案为:C a2++HCO3-+OH-═C a CO3↓+H2O;(二)因M n O4-在溶液中为紫色,则无色溶液中一定没有M n O4-,由①可知一定含有CO32-,则没有A g+、B a2+、A l3+,由在①所得溶液中再加入过量碳酸氢铵溶液可知生成的气体为二氧化碳,沉淀甲为A l(OH)3,则溶液中一定存在A l O2-,由在②所得溶液中加入过量B a(OH)2溶液,也有气体生成,并有白色沉淀乙析出可知,生成的气体为氨气,沉淀乙中一定含有B a CO3,可能含有B a SO4,即溶液中可能含有SO42-,又溶液不显电性,则一定存在的阳离子为N a+,(1)综上所述,溶液中一定不存在的离子为A g+、B a2+、A l3+、M n O4-,故答案为:A g+、B a2+、A l3+、M n O4-;(2)一定存在的离子为N a+、CO32-、A l O2-,故答案为:N a+、CO32-、A l O2-.。
2020中考化学复习《物质的鉴别、推断和分离、提纯》专项检测题(含答案)
《物质的鉴别、推断与分离、提纯》专项检测题一、单选题1.下列方法中,不能达到目的是A.A B.B C.C D.D2.除去下列各组物质中的杂质,所用试剂和方法均正确的是A.A B.B C.C D.D3.下列有关物质的提纯、除杂和鉴别所用的试剂或方法错误的是()A.A B.B C.C D.D4. 下列实验方法一定能达到实验目的是( )A .AB .BC .CD .D5.除去下列物质中的杂质,所选方法正确的是( )A .AB .BC .CD .D6.将饱和溶液放在蒸发皿里利用酒精灯加热,使溶质从溶液中结晶析出,何时可停止加热( )A .滤液开始沸腾B .水分完全蒸干C .出现大量固体D .出现少量固体 7.一定条件下,下列物质的转化可一步实现的是( )A .32CaCO Ca(OH)→B .324HNO H SO →C .23Na CO NaOH →D .233Fe O Fe(OH)→ 8.区分日常生活中的下列各组物质,所加试剂或操作方法完全正确的是A.A B.B C .C D.D9.下列各组物质可按溶解、过滤、蒸发的操作顺序将它们分离的是()A.水和植物油B.氯化镁和氯化银C.二氧化锰粉末和铁粉D.硝酸钠和氯化钠10.粗盐提纯实验中,搭建蒸发装置时,下述操作中应首先进行的是 ( ) A.将蒸发皿放置在铁圈上B.固定铁圈位置C.点燃酒精灯D.放置酒精灯11.下列实验操作正确的是()A.滴加液体B.稀释浓硫酸C.检查气密性D.过滤12.下列实验操作错误的是()A.检查装置的气密性B.过滤C.液体的量取D.稀释浓硫酸二、实验题13.根据下列装置和仪器的示意图,回答下列问题。
(1)图中仪器A的名称_________;(2)写出实验室制取二氧化碳的化学方程式_______________,要制取8.8g CO需要_______g2,应选择的仪器有F、C、____(填序号);含碳酸钙80%的大理石;若要制取并收集较多的CO2(3)上述装置,还可用于实验室制取氧气,反应后要过滤分离出二氧化锰,除了烧杯,玻璃棒外,还需补充的玻璃仪器名称是________。
2022年化学中考备考专题复习——物质的推断(四)
7. 常用干燥剂:__C__a_O___(作食品干燥剂)、_浓__H__2S_O__4__(干燥酸性和中性 气体)、氢氧化钠固体。
8. 发酵粉的主要成分、用于焙制糕点:_N_a_H__C_O__3__。 9. 治疗胃酸过多的药物中含有的碱:_M__g_(_O_H__)_2_,盐:_N_a_H__C_O__3_。 10. 常用于改良酸性土壤:_C__a_(O__H__)2__。 11. 炉具清洁剂的有效成分:_N__a_O_H___。 12. 常用作复合肥的盐:__K__N_O_3__。 13. 常用于配制农药波尔多液的盐:__C_u_S_O__4_。 14. 实验室常用的燃料:_C__2H__5_O_H___。 15. 常用的调味品、配制生理盐水的物质:__N_a_C_l___。
★酸
①NaOH ②Na2CO3 ③Fe ④Fe2O3
完成下列一步转化的化学方程式(任写一个,后同)
(1)HCl→H2:__Z_n_+__2_H__C_l_=_=_=__Z_n_C__l2_+__H_2_↑___。 (2)HCl→FeCl2:_F_e_+__2_H__C_l_=_=_=__F_e_C__l2_+__H_2_↑___。 (3)H2SO4→FeSO4:_F_e_+__H__2S_O__4_=_=_=__F_e_S_O__4+__H__2_↑___。 (4)HCl→FeCl3:_F_e_2_O__3+__6_H__C_l_=_=_=__2_F_e_C_l_3_+__3_H_2_O___。 (5)H2SO4→Fe2(SO4)3:_F_e_2_O_3_+__3_H_2_S_O__4 _=_=_=__F_e_2(_S_O__4)_3_+__3_H_2_O___。 (6)HCl→CO2:_C_a_C__O_3_+__2_H__C_l_=_=_=__C_a_C__l2_+__C_O__2_↑_+__H_2_O___。 (7)H2SO4→H2O:_2_N__a_O_H__+__H_2_S_O__4 _=_=_=_N__a_2_S_O_4_+__2_H_2_O___。 (8)HCl→CuCl2:_C__u_O_+__2_H__C_l_=_=__=_C__u_C_l_2+__H__2_O___。 (9)H2SO4→CuSO4:_C__u_O_+__H__2_S_O_4_=_=_=__C__u_S_O_4_+__H__2O___。
2022-2023学年中考化学《物质的鉴别、推断与分离、提纯》专项测试题(含答案)
D.若A和C都是单质,B和D都是化合物,则该反应一定是置换反应
8.除去下列物质中含有的少量杂质(括号内的物质),所选试剂不合理的是
A.CO2(CO):灼热的氧化铜
B.KOH溶液[Ca(OH)2]:碳酸钾溶液
C.CaO(CaCO3):高温煅烧
D.CuSO4溶液(FeSO4):铁粉
(1)写出物质 B、C 的化学式:B_____________ C__________________;
(2)写出 D 与 E 反应的实验现象:___________________ ;
(3)写出 E 与 C 相互转化的化学方程式:_____________________。
21.A、B、C三种物质之间有如下图所示的转化关系(部分物质和反应条件已经略去)。
(4)请写出铁与硫酸铜反应的化学方程式___________________。
24.某班同学在实验室进行了“酸的性质”实验,使用过的试剂有:①铁屑②氧化铁③盐酸④氢氧化钠溶液⑤碳酸钠溶液。
(1)实验结束,他们将废液全部废液倒入废液缸。为了使废液能无害排放,需要用__________测定废液的酸碱度,测定废液的pH=1,废液呈______性。
A.AB.BC.CD.D
二、填空题
15.化学就在我们身边,一些物质在生产生活中有重要的用途。现有①干冰②活性炭③氮气④石油⑤金刚石⑥不锈钢,选择适当的物质填空(填序号)。
(1)可用于冰箱除味剂的是_____;
(2)用于人工降雨_____;
(3)属于化石燃料是_____;
(4)可充入食品包装袋中以防腐的是_____;
(2)要证明另外两种粒子能否加快过氧化氢分解的速率,还需要进行实验②和③:在实验②中加入稀硫酸后,无明显变化,说明___________不起催化作用;在实验③中加入_____________后,会观察到大量气泡,证明起催化作用的是_________________。
中考化学推断题50题专题训练(含答案)
5.A、B、C、D、E、F都是初中化学中常见的化合物,其中A、B是盐,且B中含有钠元素;D是酸,C为白色沉淀。它们相互之间在溶液中可发生如下反应:
(3)分别写出物质F和H的一种用途___________;____________________。
【答案】CaCl2Fe+2HCl=FeCl2+H2↑置换反应Ca(OH)2+CO2=CaCO3↓+H2O供给呼吸重要的建筑材料
【解析】
【分析】
A是人体胃液中帮助消化的物质,那么A是稀盐酸;B用于改良酸性土壤,故B是熟石灰氢氧化钙;稀盐酸与氢氧化钙发生中和反应生成氯化钙和水,根据反应条件可知C是水,D是氯化钙;水电解生成氢气和氧气,稀盐酸能转化为E,故E是氢气,那么F是氧气;氯化钙能与碳酸钠等物质反应生成碳酸钙,即白色沉淀物是碳酸钙。
考点:物质的推断
2.A、B、C、D是初中化学常见的物质,其中A为无色气体单质,B、C为氧化物,且B为有毒气体,D是大理石的主要成分,它们之间的转化关系如图所示(图中反应条件及部分反应物、生成物已省略)。
回答下列问题:
(1)写出下列物质的化学式:A_____;B_____;C_____。
(2)实验室常用_____鉴别B和C。
【解析】
【分析】
根据反应①C+D=A+2F,且D是酸,C为白色沉淀,A为盐,可知该反应为复分解反应,生成物中没有气体没有沉淀,则F是水,由于F的化学计量数是2,酸是二元酸硫酸,白色沉淀C为难溶性的二元碱氢氧化亚铁或氢氧化镁,则A可能为硫酸亚铁或硫酸镁;根据②2E+D=B+2F,E和酸反应生成盐和水,且E的化学计量数是2,那么E可能是一元碱氢氧化钠或氢氧化钾或氨水,则B可能为硫酸钠或硫酸钾或硫酸铵;将上述物质带入③A+2E=C↓+B检验,推断成立。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题三、物质的推断
1.以物质特征颜色为突破口
⑴ 固体颜色:
Fe、C、CuO、MnO2、Fe3O4(黑色);
Cu(红色) Fe2O3(红褐色);
Cu2(OH)2CO3(绿色); CuSO4·5H2O(蓝色)。
⑵ 溶液颜色:CuCl2、CuSO4(蓝色);
FeCl2、FeSO4(浅绿色);
FeCl3、Fe2(SO4)3(黄色)。
⑶ 火焰颜色: S在O2中燃烧(明亮蓝紫色);
S、H2在空气中燃烧(淡蓝色);
CO、CH4在空气中燃烧(蓝色)。
⑷ 沉淀颜色:BaSO4、AgCl、CaCO3、BaCO3(白色);
Cu(OH)2(蓝色絮状);Fe(OH)3(红褐色)。
2.以物质特征状态为突破口
常见固体单质有C、S、P、Fe;
常温下呈液态的物质有H2O。
常温下气体单质有N2 、O2、H2 ;
无色无味气体CO2 、O2 、CO、CH4 、H2;
刺激性气味的气体SO2、NH3 、HCl
3.以物质特征反应条件为突破口
点燃(有O2参加的反应);通电(电解H2O);
催化剂(KClO3分解制O2);高温(CaCO3分解,C、CO还原CuO、Fe2O3);
加热(KClO3、KMnO4、Cu2(OH)2CO3等的分解,H2还原CuO、Fe2O3)。
4.以物质特征现象为突破口
⑴ 能使澄清石灰水变浑浊的无色无味气体是CO2。
⑵ 能使黑色CuO变红(或红色Fe2O3变黑)的气体是H2或CO,固体是C。
⑶ 能使燃烧着的木条正常燃烧的气体是空气,燃烧得更旺的气体是O2 ,熄灭的
气体是CO2 或N2;能使带火星的木条复燃的气体是O2 。
⑷ 能使白色无水CuSO4粉末变蓝的气体是水蒸气。
⑸ 在O2中燃烧火星四射的物质是Fe 。
⑹ 在空气中燃烧生成CO2和H2O的物质是有机物,如CH4、C2H5OH等。
⑺ 能溶于盐酸或稀HNO3的白色沉淀有CaCO3 、BaCO3 ;不溶于稀HNO3的白色沉淀有BaSO4、AgCl 。
5.以元素或物质之最为突破口
⑴ 地壳中含量最多的元素是O ,含量最多的金属元素是Al。
⑵ 人体中含量最多的元素是O 。
⑶ 空气中含量最多的元素是 N 。
⑷ 形成化合物最多的元素是C。
⑸ 质子数最少的元素是H 。
⑹ 相对分子质量最小、密度也最小的气体是H2
⑺ 相对分子质量最小的氧化物是H2O。
⑻ 自然界中硬度最大的物质是金刚石。
⑼ 空气中含量最多的气体是N2。
⑽ 最简单的有机物是CH4。
⑾ 最常用的溶剂是H2O 。
⑿ 人体中含量最多的物质是H2O 。
