2005物理化学与有机化学解析
2005物理化学与有机化学
S2= [H-G+T1S1]/T2= [-2909.9-15957+300×191.83]/200=193.41 J/K.mol
S= 193.41-191.83=1.58 J/K.mol
∵S= Cpln(T2/T1)+Rln(p1/p2)=3.5Rln(200/300)+Rln(5p /p2)=1.58
Qp=H=(G+TS)=G +TS=-nFE+Qr
Qp=-10270 J
(3)∵Cp= d(H)/dT
J.K-1
(4)对于题给的反应,可以设计为下列电池:
(-)Cu| CuSO4(m)|CuHg(s), Hg(l) (*O=H++OH-在298K时的弛豫时间=37s,试求该反应的正向和逆向反应速率常数kf和kr。
M武汉大学
2005年攻读硕士学位研究生入学考试试题答案
科目名称:物理化学和高分子化学科目代码:
注意:所有的答题内容必须答在答题纸上,凡答在试题或草稿纸上的一律无效。
物理化学部分(75分)
k: 1.381×10-23J·K-1h: 6.626×10-34J·s
1.(15分)一.有一双原子分子理想气体,T1=300K,p1=5p ,Sm (300K,5 p )=191.83 J/K.mol,经历一途径到达末态,已知此始末两态间的G=15957 J/mol,G-F=-831.4 J。试求:此始末两态间的U、H、S、F;以及末态的温度和压力?
(1)分别写出相区A、B、C、D、E、F的相态、相数和自由度;
(2)指明图中自由度为零的地方,并标明相态。
(3)绘出点x的溶液体系降温过程的步冷曲线;
(4)北极爱斯基摩人根据季节的变换,从海水中取出淡水,根据相图分析其科学依据;
(2021年整理)2005物理化学

(完整版)2005物理化学编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整版)2005物理化学)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整版)2005物理化学的全部内容。
(完整版)2005物理化学编辑整理:张嬗雒老师尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布到文库,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是我们任然希望 (完整版)2005物理化学这篇文档能够给您的工作和学习带来便利。
同时我们也真诚的希望收到您的建议和反馈到下面的留言区,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请下载收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为〈(完整版)2005物理化学> 这篇文档的全部内容。
青岛科技大学2005年研究生入学考试试卷(A)考试科目:物理化学(答案全部写在答案纸上)一.填空与选择题(每题3分,共30分)1。
某系统为被隔板分隔成等体积两部分的刚性绝热箱,左边装空气,压力为 200kPa,右边也为空气,压力为 100kPa。
抽掉隔板后,至两边空气的压力相等,此过程 W0 和∆U0 (填〉,〈或 =).2。
0℃,101。
3kPa下,1mol冰溶化成水,吸热 6.02kJ,此过程∆G =。
3.动电电位为双电层的电位,只有在和作反向移动时,才能显出电位差。
4.质量摩尔浓度为1mol·kg—1的 Na2SO4水溶液,平均活度系数为γ± ,该溶液的平均活度a±=γ± 。
5. 非理想气体进行某不可逆循环,则.(A)∑δQ/T = 0 (B) ∑δQ/T 〈0 (C) ∑δQ/T > 0 (D)∆S > 0 6。
物理化学B-第一章-热力学第一定律

处于热力学平衡的系统必须满足 下列平衡:
热平衡 热
力
学 力平衡 平
衡
相平衡
物质平衡
化学平衡
(1) 热平衡(thermal equilibrium):
如果没有绝热壁存在,系统内各部分之间 以及系统与环境之间没有温度差别。
热力学第零定律
如果系统A与B成热平衡,系统B与C成热平衡, 则系统A与C也必然成热平衡。一切互为热平衡的 物体具有相同的温度。(热平衡定律)
(2) 一般Q ≠-Q逆, W ≠-W逆; 但Y =- Y逆
6、内能 (Internal energy)
热力学能(thermodynamic energy)
系统的能量
动能 势能
机械能
➢ 定义:
内能
是系统内部所有粒子的各种运动和相互作用 的能量总和,包括体系内分子运动的平动能、转动 能、振动能、电子及核的能量以及分子与分子相互 作用的位能等能量。也叫热力学能,用符号 U 表 示,单位焦耳(J)。
3、平衡状态的描述与状态函数
(1) 定义:用于描述系统状态的各宏观物理性 质(如物质的量、温度、压力、体积等)称为 系统的热力学性质,习惯称为状态函数。
容量性质:与n成正比,有加和性。 (广延性质) 如m,V;是n的一次齐函数
(2) 分类:
强度性质:与n无关,无加和性。 如T,p,Vm;是n的零次齐函数
-
A+B
C
(4) 可逆过程的重要性
实际过程能量利用的极限
实际过程状态函数的变化计算(如熵函数)
§1-5 热的计算 (How to calculate heat)
1、 等容热(Qv)
过程特点:dV=0
W=0
U QV (W W ) QV W
[物理化学(上册)完整习题答案解析]第五版高等教育出版社
![[物理化学(上册)完整习题答案解析]第五版高等教育出版社](https://img.taocdn.com/s3/m/18541d01a45177232f60a2e2.png)
第一章 气体pVT 性质1-1物质的体膨胀系数V α与等温压缩系数T κ的定义如下:1 1TT p V p V V T V V ⎪⎪⎭⎫⎝⎛∂∂-=⎪⎭⎫ ⎝⎛∂∂=κα 试导出理想气体的V α、T κ与压力、温度的关系? 解:对于理想气体,pV=nRT111 )/(11-=⋅=⋅=⎪⎭⎫⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂=T TVV p nR V T p nRT V T V V p p V α 1211 )/(11-=⋅=⋅=⎪⎪⎭⎫ ⎝⎛∂∂-=⎪⎪⎭⎫ ⎝⎛∂∂-=p p V V pnRT V p p nRT V p V V T T T κ 1-2 气柜内有121.6kPa 、27℃的氯乙烯(C 2H 3Cl )气体300m 3,若以每小时90kg 的流量输往使用车间,试问贮存的气体能用多少小时?解:设氯乙烯为理想气体,气柜内氯乙烯的物质的量为mol RT pV n 623.1461815.300314.8300106.1213=⨯⨯⨯== 每小时90kg 的流量折合p 摩尔数为13353.144145.621090109032-⋅=⨯=⨯=h mol M v Cl H C n/v=(14618.623÷1441.153)=10.144小时1-3 0℃、101.325kPa 的条件常称为气体的标准状况。
试求甲烷在标准状况下的密度。
解:33714.015.273314.81016101325444--⋅=⨯⨯⨯=⋅=⋅=m kg M RT p M V n CH CH CHρ 1-4 一抽成真空的球形容器,质量为25.0000g 。
充以4℃水之后,总质量为125.0000g 。
若改用充以25℃、13.33kPa 的某碳氢化合物气体,则总质量为25.0163g 。
试估算该气体的摩尔质量。
解:先求容器的容积33)(0000.10010000.100000.250000.1252cm cm V l O H ==-=ρn=m/M=pV/RTmol g pV RTm M ⋅=⨯-⨯⨯==-31.301013330)0000.250163.25(15.298314.841-5 两个体积均为V 的玻璃球泡之间用细管连接,泡内密封着标准状况条件下的空气。
化学有机物物理化学性质及方程式

烷烃:化学性质不活泼,尤其是直链烷烃。
它与大多数试剂如强酸、强碱、强氧化剂,强还原剂及金属钠等都不起反应,或者反应速率缓慢。
但是在适当的温度、压力和催化剂的条件下,也可与一些试剂反应。
主要有:氧化、裂化和取代等反应。
烯烃:1`与X2,H2,H2O,HX等加成反应2`加聚反应3 氧化反应炔烃加成反应;氧化反应苯易进行取代,只在特定条件下进行加成和氧化反应,主要:硝化反应;卤代反应;磺化反应苯的同系物氧化反应,取代反应(甲苯和溴能发生取代反应,但条件不同,取代位置不同,发生在苯环上,即侧链对苯环的影响,发生在侧链上,即类似烷烃的取代反应,还能继续进行。
)加成反应物理性质烷烃都是无色的,碳原子数5-11时常温常压下为液态,以下为气态,以上为固态。
标准状况下密度都比水小。
熔点和沸点都很低,并且熔点和沸点随分子量的增加而升高.烯烃物理性质和烷烃相似,如烯烃是不溶于水的,虽然在水中的溶解度比烷烃还略大一点。
烯烃还能与某些金属离子以π键相结合,从而大大增加烯烃的溶解度,生成水溶性较大的配合物。
烯烃也易于苯、乙醚、氯仿等非极性有机溶剂中。
一般C2~C4的烯烃是气体,C5~C18的为气体,C19以上的高级烯烃为固体。
烯烃的沸点也随着分子量的增加而升高,双键在碳链终端的烯烃的沸点比相应的烷烃为固体。
烯烃的沸点也随着分子量的增加而升高,双键在碳链中间的沸点比相应的烷烃还略低一点。
与烷烃一样,直链烯烃的沸点比带支链的高炔烃和烷烃,烯烃基本相似. 炔烃的沸点,相对密度等都比相应的烯烃略高些.4个碳以下的炔烃在常温常压下为气体.随着分子中碳原子数的增多,它们的沸点也升高苯无色有特殊气味的液体,易挥发,比水轻,不溶于水苯的同系物在性质上跟苯有许多相似之处,如燃烧时都发生带有浓烟的火焰,都能发生取代反映等,不能使溴水褪色(不发生反应),但能使溴水层褪色(物理性质)归纳同系物的物理性质不同,但有相同的官能团,所以化学性质相似烷烃.烯烃.炔烃物理性质相似检举回答人的补充 2010-08-29 17:48 物理性质烷烃都是无色的,碳原子数5-11时常温常压下为液态,以下为气态,以上为固态。
[物理化学(上册)完整习题答案解析]第五版高等教育出版社
![[物理化学(上册)完整习题答案解析]第五版高等教育出版社](https://img.taocdn.com/s3/m/ef45d9fe240c844769eaee4b.png)
第一章 气体pVT 性质1-1物质的体膨胀系数V α与等温压缩系数T κ的定义如下:11TT p V pV V T V V⎪⎪⎭⎫ ⎝⎛∂∂-=⎪⎭⎫⎝⎛∂∂=κα 试导出理想气体的V α、T κ与压力、温度的关系? 解:对于理想气体,pV=nRT111 )/(11-=⋅=⋅=⎪⎭⎫⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂=T T VV p nR V T p nRT V T V V p p V α 1211 )/(11-=⋅=⋅=⎪⎪⎭⎫ ⎝⎛∂∂-=⎪⎪⎭⎫ ⎝⎛∂∂-=p p VV pnRT V p p nRT V pV V T T T κ 1-2 气柜内有121.6kPa 、27℃的氯乙烯(C 2H 3Cl )气体300m 3,若以每小时90kg 的流量输往使用车间,试问贮存的气体能用多少小时?解:设氯乙烯为理想气体,气柜内氯乙烯的物质的量为mol RT pV n 623.1461815.300314.8300106.1213=⨯⨯⨯== 每小时90kg 的流量折合p摩尔数为 133153.144145.621090109032-⋅=⨯=⨯=h mol M v Cl H Cn/v=(14618.623÷1441.153)=10.144小时1-3 0℃、101.325kPa 的条件常称为气体的标准状况。
试求甲烷在标准状况下的密度。
解:33714.015.273314.81016101325444--⋅=⨯⨯⨯=⋅=⋅=m kg M RT p M V n CH CH CHρ 1-4 一抽成真空的球形容器,质量为25.0000g 。
充以4℃水之后,总质量为125.0000g 。
若改用充以25℃、13.33kPa 的某碳氢化合物气体,则总质量为25.0163g 。
试估算该气体的摩尔质量。
解:先求容器的容积33)(0000.10010000.100000.250000.1252cm cm V l O H ==-=ρn=m/M=pV/RTmol g pV RTm M ⋅=⨯-⨯⨯==-31.301013330)0000.250163.25(15.298314.841-5 两个体积均为V 的玻璃球泡之间用细管连接,泡内密封着标准状况条件下的空气。
2005年高考化学试题解析

2005年普通高等学校招生全国统一考试理科综合能力测试(Ⅱ)化学试题6.分析发现,某陨石中含有半衰期极短的镁的一种放射性同位素28Mg,该同位素的原子核内的中子数是()A.12 B.14 C.16 D.18思路点拨:组成原子的基本粒子(质子、中子和核外电子)之间的基本关系体现在两个重要的等式(质量关系式和电量关系式)上,理解了这两个等式就容易解答本题。
镁是12号元素,其原子核内质子数为12,该同位素的质量数为28,所以该原子核内的中子数为28-12=16。
正确解答:C小结点评:原子结构是高考的常考知识点,虽然经常结合最新的科技成果考查,但需要用到的知识点一般都很基本。
7.下列说法正确的是()A.常温常压下,只有一种元素的单质呈液态B.周期表中所有元素都是从自然界中发现的C.过渡元素不全是金属元素D.常温常压下,气态单质的分子都是由非金属元素的原子形成的思路点拨:本题考查的是元素周期表的基本知识,需要根据化学常识逐一筛选。
常温常压下,呈液态的单质有Hg和Br2;周期表中铀后面的元素多数是人工进行核反应制得的元素,叫做超铀元素;过渡元素全部都是金属元素。
正确解答:D小结点评:元素周期表是我们学习化学的工具,必须熟悉其基本结构和各种元素的基本性质。
8.下列单质中,最容易跟氢气发生反应的是()A.O2B.N2C.F2D.Cl2思路点拨:本题需要根据元素的非金属性强弱作出判断。
因为F的非金属性最强,所以F2最容易与H2发生反应,混合即发生爆炸。
正确解答:C小结点评:判断元素金属性和非金属性强弱的实验依据有很多,需要在学习中不断归纳总结,这也是我们进行一些实验设计的原理和依据。
9.N A代表阿伏加德罗常数,下列说法正确的是()A.在同温同压下,相同体积的任何气体单质所含的原子数目相同B.2 g氢气所含的原子数目为N AC.在常温常压下,11.2 L氮气所含的原子数目为N AD.17 g氨气所含的电子数目为为10N A思路点拨:根据阿伏加德罗定律,在同温同压下,相同体积的任何气体单质所含的分子数目相同,原子数目不一定相同;2 gH2即1molH2,所含H原子的数目为2N A;在常温常压下,11.2 L氮气的物质的量小于0.5mol,所含的N原子数目小于N A;1个NH3分子中有10个电子,所以1molNH3中有10mol(即10N A个)电子。
物理化学原理在有机化学教与学中的应用(四)——氢化热与有机分子稳定性的关系

烃的氢化热数据 中我们紧紧围绕“ 兴趣 ” 做文章 . 从兴趣 的激发到
兴趣 的延续 再 到高潮 的 引发最后 到 兴趣 的再 生 一
按组的序号一字排好 , 大家一起大声读 出来 : w—
E L 一 0 M— E!这 时课 堂里 响起 了热烈 的 — —C 一
体. 课堂气氛和谐热烈 。 充分调动了学生学习的积 那样 ,学习中经常取得成功体验可能会导致更大 极性 , “ 使学生易学 、 好学、 乐学 。 体现了新课程背景 的学 习兴趣 . 改善 学生 作为 学 习的 自我 概念 。 并 学 下化学 教学 的有 效Байду номын сангаас 校 学 习将变 得更 具有 吸 引力 .学生精 神 涣散 的 问
多, 氢化 热 越小 , 烃就 越稳 定 。根 据表 1中 的氢 烯 化热 数 据 。 烯烃 的稳定 性顺 序一 般 如下 :
R2 C C= R2> R C=C 2 HR > RC = HR~ R2 H C C= C H2 RCH= H2> C = > C H2 CH2
和不 同碳架的烯烃 的相对稳定性 通过 比较各种 烯烃的氢化热( 见表。 , 以发现双键上有取代基 1可 ) 的烯烃的氢化热要小些 , 取代基越多烯烃越稳定。 例如 . 乙烯的氢化热为 17 . o 1 中一个氢 3 .k m ]. 2 J .其 - 被 甲基 取 代 后 的丙 烯 的氢 化 热为 159k . o- 2 . Jm 1. 1 而乙烯的四个氢都被甲基取代后的 23 二甲基一 .一 2 丁烯 的氢化热 只有 111 JmO1 一 .k . 1 1 - 烯烃 的稳定性还可以用超共轭效应 ( 一种 由 于 C C双键的 1 电子云和相邻 的 c H盯键 电子 = 『 — 云相互交盖而引起的离域效应 . 叫做 仃 霄超共 也 一 轭效应 ) 来解释。以丙烯为例 ( 参见 图 1 , ) 由于甲 基上三个 c H仃键 电子的离域 .使得丙烯 c c — — 单键的键长缩短为 010姗 ( . 5 一般烷烃 的 c C单 — 键的键长为 014n , . m)分子因共轭而稳定 。 5 同理 , 在 2 丁烯 中.有六个 C H键与双键发生超共轭 一 — 效 应 : 在 1 丁烯 中 , 而 一 仅有 两 个 C H键 与 双键 发 — 生 超共 轭效 应 故 2 丁烯 比 1丁烯 稳 定 。 一 一
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
M 武汉大学
2005年攻读硕士学位研究生入学考试试题答案
科目名称:物理化学和高分子化学科目代码:
注意:所有的答题内容必须答在答题纸上,凡答在试题或草稿纸上的一律无效。
物理化学部分(75分)
k: 1.381×10-23 J·K-1h: 6.626×10-34J·s
1.(15分)一.有一双原子分子理想气体,T1=300K,p1=5p,S m(300K,5 p)=191.83 J/K.mol,经历一途径到达末态,已知此始末两态间的∆G=15957 J/mol,∆G-∆F=-831.4 J。
试求:此始末两态间的∆U、∆H、∆S、∆F;以及末态的温度和压力?
解:∵∆G=∆(F+pV)
∴∆G-∆F=∆(F+pV)-∆F=∆ (pV)=RT2-RT1= -831.4 J
T2= T1+(-831.4/R)= 300-100=200 K
∆U=C V∆T=2.5R·(200-300)=-2078.5 J
∆H=C p∆T=3.5R·(200-300)=-2909.9 J
∆F= ∆G+831.4=16788.4 J
∆G=∆H-∆(TS) =∆H-(T2S2-T1S1)
S2= [∆H-∆G+T1S1]/T2= [-2909.9-15957+300×191.83]/200=193.41 J/K.mol
∆S= 193.41-191.83=1.58 J/K.mol
∵∆S= C p ln(T2/T1)+Rln(p1/p2)=3.5Rln(200/300)+Rln(5p/p2)=1.58
Rln(5p/p)=1.58-3.5Rln(2/3)=1.58+11.80=13.38
ln(5p/p2)=1.609p2=1p
解得:∆U=-2078.5 J∆H=-2910 J∆F= 16788.4 J
∆S= 1.58 J/K T2=200K p2=1p
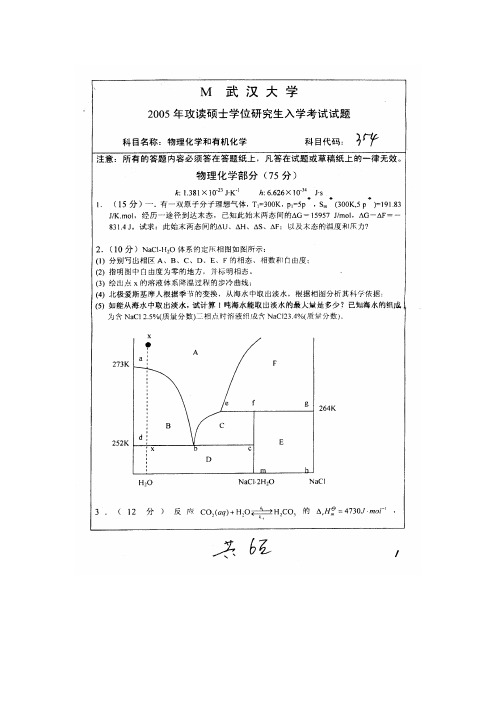
2.(10分)NaCl-H2O体系的定压相图如图所示:
(1) 分别写出相区A、B、C、D、E、F的相态、相数和自由度;
(2) 指明图中自由度为零的地方,并标明相态。
(3) 绘出点x的溶液体系降温过程的步冷曲线;
(4) 北极爱斯基摩人根据季节的变换,从海水中取出淡水,根据相图分析其科学依据;
(5) 如能从海水中取出淡水,试计算1吨海水能取出淡水的最大量是多少?已知海水的组
成为含NaCl 2.5%(质量分数)三相点时溶液组成含NaCl23.4%(质量分数)。
273K
A
F x
a
4730=m 33.5=-m S 0.00210s 正反应的的活化能;m 在此温度范围内不变,且)由阿仑尼乌斯方程m r m H ≈∆
m 在此温度范围内不变,可求得4730m r m r m G H T S =∆-⋅∆=-exp exp m a G ⎛⎫-∆==⎪⎭不包括在平衡常数表示式或速率方程式中,且近似认为2.216a =。
