白介素-6(IL-6) 降钙素原(PCT)联合测定试剂盒(荧光免疫层析法)产品技术要求北京贝尔生物
血清降钙素原(PCT)及白介素6(IL-6)对实验型兔感染性心内膜炎的早期诊断价值

2004届颀●i事业}卺文中文摘要血清降钙素原(PCT)和自介素6(IL-6)对实验型兔感染性心内膜早期诊断价值硕士研究生波顺庆导师韩继媛教授目的:研究感染性心内膜炎(infectiveendocarditis,IE)兔不同时间血清降钙素原(procalcitonin,PcT)、白介素6(interleukin-6,IL-6)测定值的变化情况及其对早期预测和诊断感染性心内膜炎的价值。
方法:实验组采用心导管从兔左颈总动脉插入左心室并留置导管,造成主动脉瓣和左心室内膜损伤,术后24小时静脉注射含有109cfu的甲型溶血链球菌洗涤液Iml,制造大白兔感染性心内膜炎模型。
对照组同样采用一tl,导管从兔左颈总动脉插入左心室并留置导管,术后24小时静脉注射lml生理盐水作为对照。
术前当R、术后第2天、术后第4天、术后第6天取兔血清检测降钙素原(PcT)、白介素6(IL-6)。
血清降钙素原(PCT)测定采用化学发光分析法进行检测;白介素6(IL一6)采用IL一6酶联免疫吸附法(Enzyme—linkedinununoadsordentassay.ELISA)检测试剂盒进行测定。
实验组与对照组对应同的血清PCT值分别进行方差f扛中辩披太学翰济医学院2004弱颀t毕业论文分析,行t检验:实验组与对照组对应日的血清IL一6值分别进行方差分析,行t检验。
术后第6天取兔血5ml做细菌培养,取兔主动脉瓣、心内膜做瘸理切片。
结果:①实验组术后第2天、术后第4天、术后第6天血清PCT值分别较对照组术后第2天、术后第4天、术后第6天血清PCT值有明显升高,两组对应日相比具有显著差异性(P<O.01)。
②实验组术后第2天、术后第4天、术后第6天血清IL一6值分别较对照组术后第2天、术后第4天、术后第6天血清IL一6值有明显升高,两组对应同相比具有显著差异性(P<O.01)。
③对照组PCT与IL一6的相关系数r一0.169,P=O.23;实验组PCT与IL-6的相关系数r=O.71l,P<O.Ol。
白介素-6(IL-6)测定试剂盒(荧光免疫层析法)产品技术要求
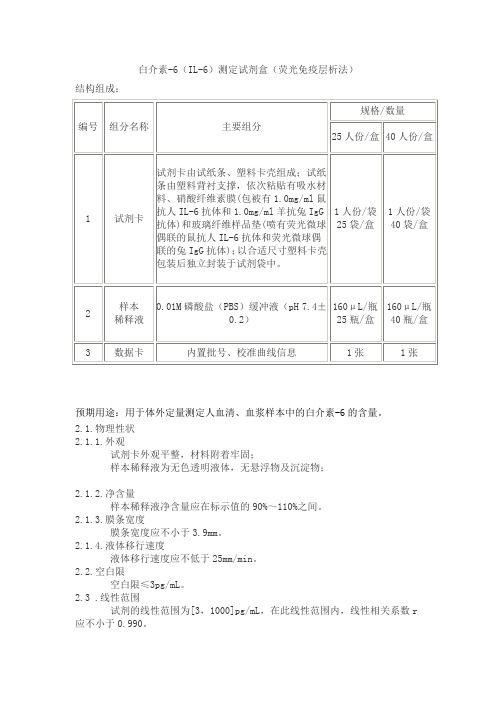
白介素-6(IL-6)测定试剂盒(荧光免疫层析法)
结构组成:
预期用途:用于体外定量测定人血清、血浆样本中的白介素-6的含量。
2.1.物理性状
2.1.1.外观
试剂卡外观平整,材料附着牢固;
样本稀释液为无色透明液体,无悬浮物及沉淀物;
2.1.2.净含量
样本稀释液净含量应在标示值的90%~110%之间。
2.1.
3.膜条宽度
膜条宽度应不小于3.9mm。
2.1.4.液体移行速度
液体移行速度应不低于25mm/min。
2.2.空白限
空白限≤3pg/mL。
2.3 .线性范围
试剂的线性范围为[3,1000]pg/mL,在此线性范围内,线性相关系数r 应不小于0.990。
2.4.测量精密度
2.4.1.重复性
用质控品重复测试,所得结果的变异系数(CV)≤15%;
2.4.2.批间差
用质控品重复测试3个批号的试剂盒,所得结果的变异系数(CV)≤15%。
2.5.准确度
回收率在85%~115%之间。
2.6 .稳定性
试剂在4℃~30℃密封避光保存,原包装存放的试剂有效期为12个月;取效期末的样品检测外观、膜条宽度、液体移行速度、空白限、线性范围、重复性、准确度,应分别符合2.1.1、2.1.3、2.1.4、2.2、2.3、2.4.1、2.5的要求。
2.7.溯源性
根据GB/T21415-2008的要求提供含有产品校准曲线信息的数据卡,本产品校准曲线信息可溯源至企业工作校准品。
白细胞介素6(IL-6)测定试剂盒(电化学发光免疫分析法)产品技术要求lztk
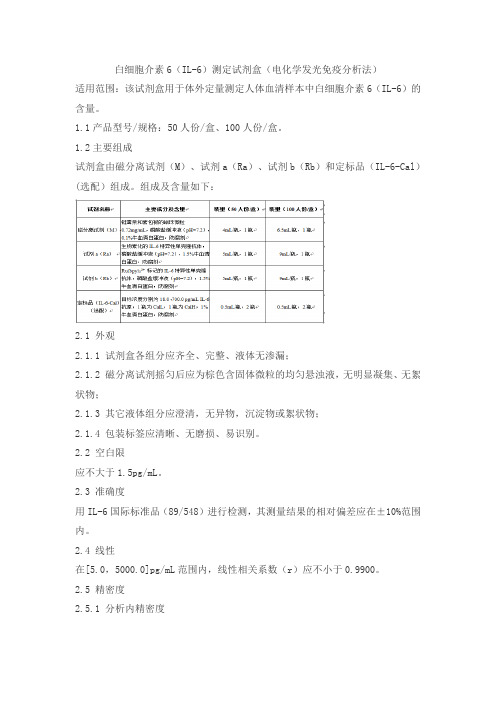
白细胞介素6(IL-6)测定试剂盒(电化学发光免疫分析法)适用范围:该试剂盒用于体外定量测定人体血清样本中白细胞介素6(IL-6)的含量。
1.1产品型号/规格:50人份/盒、100人份/盒。
1.2主要组成试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(IL-6-Cal)(选配)组成。
组成及含量如下:2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限应不大于1.5pg/mL。
2.3 准确度用IL-6国际标准品(89/548)进行检测,其测量结果的相对偏差应在±10%范围内。
2.4 线性在[5.0,5000.0]pg/mL范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度2.5.1 分析内精密度在试剂盒的线性范围内,浓度为(30.0±6.0pg/mL)和(500.0±100.0pg/mL)的样品检测结果的变异系数(CV)应不大于8%。
2.5.2 批间精密度在试剂盒的线性范围内,用3个批号试剂盒分别检测浓度为(30.0±6.0pg/mL)和(500.0±100.0pg/mL)的样品,检测结果的变异系数(CV)应不大于15%。
2.6 效期末稳定性本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.7 溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,定标品溯源到IL-6国际标准品(89/548)。
白介素6(IL-6)测定试剂盒产品技术要求深圳市锦瑞生物
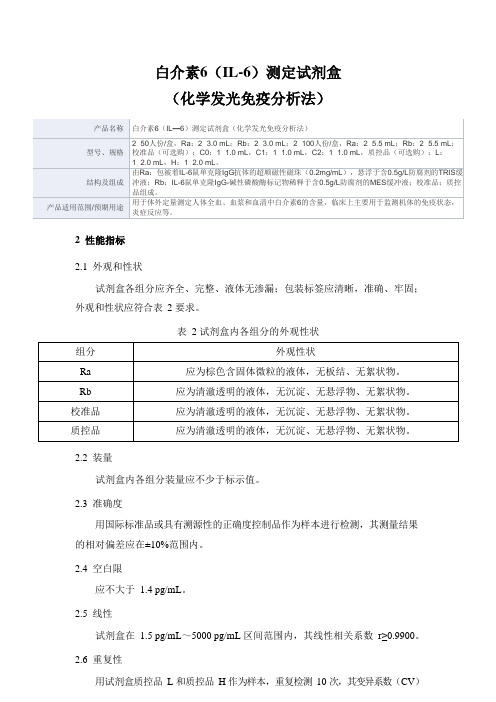
白介素6(IL-6)测定试剂盒
(化学发光免疫分析法)
2性能指标
2.1外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;外观和性状应符合表2 要求。
表 2 试剂盒内各组分的外观性状
2.2装量
试剂盒内各组分装量应不少于标示值。
2.3准确度
用国际标准品或具有溯源性的正确度控制品作为样本进行检测,其测量结果的相对偏差应在±10%范围内。
2.4空白限
应不大于 1.4 pg/mL。
2.5线性
试剂盒在 1.5 pg/mL~5000 pg/mL 区间范围内,其线性相关系数r≥0.9900。
2.6重复性
用试剂盒质控品L 和质控品H 作为样本,重复检测10 次,其变异系数(CV)
应不大于7%。
2.7批间差
用3 个批号试剂盒分别检测同一瓶质控品L 和质控品H,3 个批号试剂盒之间的批间变异系数(CV)应不大于9%。
2.8质控品测定值
用试剂盒配套的校准品校准测量系统后,以试剂盒配套的质控品作为样本进行检测,其测定结果应在标示范围内。
2.9质控品均一性
瓶间变异系数(CV)应不大于10%。
2.10校准品测量准确度
用工作校准品校准测量系统后,以试剂盒配套的校准品作为样本进行检测,其测定结果与标示值的相对偏差应在±10%范围内。
2.11校准品均一性
瓶间变异系数(CV)应不大于10%。
血清肝素结合蛋白、白介素-6、降钙素原和C-反应蛋白对2型糖尿病并发感染的预测价值

DOI:10.19368/ki.2096-1782.2023.10.025血清肝素结合蛋白、白介素-6、降钙素原和C-反应蛋白对2型糖尿病并发感染的预测价值于娟,张力,彭小龙,张健,孙翠平南京市溧水区人民医院检验科,江苏南京211200[摘要]目的探讨检测血清肝素结合蛋白(heparin binding protein, HBP)、白介素-6(interleukin-6, IL-6)、降钙素原(procalcitonin, PCT)和C-反应蛋白(C-reactive protein, CRP)对2型糖尿病并发感染的预测价值。
方法回顾性分析2022年1—10月溧水区人民医院收治的35例2型糖尿病并发感染患者为2型糖尿病感染组,选择同期控制良好的30例2型糖尿病门诊患者为2型糖尿病未感染组,30例健康体检者为健康对照组。
分别检测3组患者血清HBP、IL-6、PCT和CRP水平,比较3组不同炎性标志物水平的差异,绘制受试者工作特征(receiver operator characteristic, ROC)曲线分析4种指标单独及联合检测预测2型糖尿病并发感染的灵敏度和特异度。
结果 2型糖尿病感染组血清HBP、IL-6、PCT和CRP分别为29.95(8.11,51.22)ng/mL、40.72(4.64, 52.65)pg/mL、0.24(0.03,0.08)ng/mL、40.44(1.94,46.23)mg/L,均较未感染组和健康对照组显著增加,差异有统计学意义(P<0.05);HBP诊断曲线下面积(area under the curve, AUC)=0.85 (95%CI=0.75~0.94);IL-6诊断AUC=0.90(95%CI=0.82~0.98);PCT诊断AUC=0.84(95%CI=0.76~0.92);CRP诊断AUC=0.71(95%CI=0.57~ 0.85);联合诊断AUC=0.97(95%CI=0.93~1.00)。
降钙素原协同C-反应蛋白和白介素-6检测对新生儿细菌感染的诊断价值

降钙素原协同C-反应蛋白和白介素-6检测对新生儿细菌感染的诊断价值作者:陈巧红葛勤陈珊珊来源:《中国医药导报》2012年第13期[摘要] 目的探讨降钙素原(procalcitonin,PCT)在新生儿细菌感染(neonatal bacterial infection,NBI)中的应用价值。
方法对出生4 d后108例疑为细菌感染的新生儿临床资料进行回顾性分析。
所有患儿通过细菌学或影像学方法判断是否为细菌性感染,并检测血清中PCT、C-反应蛋白(C-reactive protein,CRP)和白介素-6(IL-6)含量。
结果共检测出38例细菌感染患儿,CRP(>10 mg/L)联合IL-6(>100 ng/L)对诊断NBI的敏感性为91.7%,特异性为79.9%,阳性预测值为70.8%,阴性预测值为93.9%;结合PCT后,其敏感性为98.5%,特异性为66.7%,阳性预测值为58.5%,阴性预测值为98.8%。
结论 PCT能进一步提高CRP 和IL-6在诊断NBI的敏感性和阴性预测值,是对现有标记物的有益补充。
[关键词] 新生儿细菌感染;降钙素原;敏感性;特异性[中图分类号] R446.1 [文献标识码] A [文章编号] 1673-7210(2012)05(a)-0094-02在早产儿和新生儿期,细菌感染是引起婴儿死亡的主要原因。
目前各大医院采用的相关实验室指标,如血细胞计数、C-反应蛋白(C-reactive protein,CRP)、血清淀粉样蛋白A、降钙素原(procalcitonin,PCT)以及TNF-α、IL-6等是辅助诊断新生儿细菌感染(neonatal bacterial infection,NBI)的重要指标[1]。
为了增加对NBI的敏感性和阴性预测值,多种指标联合检测经常被采用。
CRP是最早用来辅助诊断NBI的标记物之一,和其他指标(如白细胞计数、未成熟与总中性粒细胞)相比,CRP具有更大的参考价值。
4.01 降钙素原 ∕ 白介素-6测定试剂盒(荧光免疫层析法)技术要求

医疗器械产品技术要求编号:降钙素原/白介素-6测定试剂盒(荧光免疫层析法)1 产品型号/规格及其划分说明1.1 型号型号:型号G、型号Q。
1.2 规格1人份/盒,2人份/盒,3人份/盒,5人份/盒,10人份/盒,20人份/盒,25人份/盒,30人份/盒,40人份/盒,50人份/盒,100人份/盒,200人份/盒。
1.3 产品型号/规格划分说明产品型号划分主要根据产品注册单元进行划分,其中型号G由检测卡、样本缓冲液组成;型号Q由检测卡、样本缓冲液、质控物组成。
规格划分主要根据产品单人份铝箔包装的检测卡装量来进行规格划分。
产品形式由产品型号和规格组合形成。
产品型号/规格划分类型(例子)2 性能指标2.1 物理检查2.1.1 外观试剂盒各组分齐全、完整,包装无破损;液体组分澄清、无漏液;标签牢固,内容清晰、准确。
质控物应外观均匀,形成完整的冻干品,复溶后清亮,无浑浊及沉淀。
2.1.2 液体移行速度液体移行速度应不小于10mm/min。
2.2 线性2.2.1 PCT项目试剂盒项目PCT线性在0.1ng/mL~50.0ng/mL范围内,线性相关系数|r|应≥0.990。
2.2.2 IL-6项目试剂盒项目IL-6线性在3.0pg/mL~4000.0pg/mL范围内,线性相关系数|r|应≥0.990。
2.3 准确性2.3.1 PCT项目测定回收率应在85%~115%范围内。
2.3.2 IL-6项目用IL-6国际标准品配制的准确性校准品或经标化的准确性校准品进行检测,其检测结果的相对偏差应在±15.0%范围内。
注:国家、省质量监督抽检和风险监测、第三方仲裁检验时应采用国家/国际标准品。
2.4 检出限试剂盒项目PCT检出限不高于0.05ng/mL,项目IL-6检出限不高于1.5pg/mL。
2.5 重复性试剂盒项目PCT和IL-6每个项目的重复性变异系数(CV)不高于10%。
2.6 批间差试剂盒项目PCT和IL-6每个项目的批间变异系数(CV)不高于15%。
降钙素原(PCT)测定试剂盒(荧光免疫层析法)产品技术要求puenguangde

降钙素原(PCT)测定试剂盒(荧光免疫层析法)
适用范围:用于体外定量测定人血清、血浆或全血中降钙素原(PCT)含量。
1.1包装规格
10人份/盒,25人份/盒,50人份/盒。
1.2主要组成成分
试剂盒由PCT荧光免疫层析检测卡、PCT样品稀释液(F)、PCT校准卡组成,各组分及数量见表1。
表1:试剂盒组成成分
2.1外观
外包装盒应完整,无破损;单包铝箔袋应完整,无破损,保持密封包装;液体组分应澄清透明,无沉淀、无渗漏。
2.2物理性状
2.2.1 试纸条的宽度:应不超于(
3.40±0.10)mm 。
2.2.2 液体移行速度:应不低于5mm/min。
2.3空白检出限
空白检出限浓度应不高于0.05ng/ml。
2.4线性范围
在[0.05,40]ng/ml范围内线性相关系数r≥0.990。
2.5精密度
2.5.1 重复性
变异系数CV不超于15%。
2.5.2 批间差
变异系数CV不超于20%。
2.6准确度
回收率应在85%~115%之间。
2.7分析特异性
测试按表2规定浓度范围的降钙素、白介素-6、C反应蛋白的样品,检测结果应不超过0.1ng/ml。
表2:交叉反应物及浓度列表
2.8效期稳定性试验
试剂盒2℃~30℃保存,铝箔袋密封状态下存放,取有效期满后两个月内的产品进行检测,结果应符合2.2、2.3、2.4、2.5.1、2.6项要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
白介素-6(IL-6)/降钙素原(PCT)联合测定试剂盒(荧光免疫层析法)
适用范围:本试剂盒用于体外定量测定人血清、血浆或全血中白介素-6(IL-6)与降钙素原(PCT)的含量。
1.1 包装规格
10人份/盒;20人份/盒;50人份/盒
1.2主要组成成分
试剂盒由相应人份检测卡组成。
2.1 物理性状
2.1.1 外观
试剂盒各组分齐全、完整;包装袋应密封性好无破损;标签清晰;材料附着牢固,条宽应适应于卡壳且装配紧密。
2.1.2 膜条宽度
膜条宽度应不低于2.5mm。
2.1.3 液体移行速度
移行速度应不低于10mm/min。
2.2 空白限
IL-6应不高于3pg/ml,PCT应不高于0.1ng/ml。
2.3 分析特异性
用浓度为10.0ng/ml白介素-4、10.0ng/ml白介素-8、10.0ng/ml降钙素、30.0ng/ml钙抑肽分析特异性参考品进行交叉反应测定,测定结果IL-6均应小于3pg/ml,PCT均应小于0.1ng/ml。
2.4 重复性
2.4.1 用高低浓度的白介素-6(IL-6)参考品重复检测10次,IL-6测定结果变异系数(CV)均应不大于15%。
2.4.2 用高低浓度的降钙素原(PCT)参考品重复检测10次,PCT测定结果变异系数(CV)均应不大于15%。
2.5 准确度
2.5.1 利用NIBSC 编号为 89/548 的标准品配制出IL-6含量为500pg/ml的准确度参考品,IL-6检测结果的相对偏差在±15%范围内。
2.5.2 将40ng/ml降钙素原(PCT)标准溶液加入到正常人血清中,按照体积比1:9混合,对混合后样本进行检测,PCT回收率应在85%~115%范围内。
2.6 线性
IL-6线性范围为[3,1400]pg/ml,线性回归相关系数r应≥0.99。
PCT线性范围为[0.2,40]ng/ml,线性回归相关系数r应≥0.99。
2.7 批间差
2.7.1 用3个批号试剂盒对高低浓度的白介素-6(IL-6)参考品各重复检测10次,则3个批号试剂盒IL-6测定结果批间变异系数(CV)均应不大于20%。
2.7.2 用3个批号试剂盒对高低浓度的降钙素原(PCT)参考品各重复检测10次,则3个批号试剂盒PCT测定结果批间变异系数(CV)均应不大于20%。
2.8 稳定性
效期稳定性:2~30℃条件下放置有效期18个月后一个月内,检测产品空白限、分析特异性、重复性、准确度、线性指标,检测结果均应符合2.2~2.6的要求。
2.9 校准信息溯源性
按照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,IL-6校准信息溯源至国际标准品NIBSC
89/548;PCT校准信息溯源至公司工作校准品。
