含量均匀度检查
含量均匀度测定方法

含量均匀度测定方法嘿,咱今儿就来聊聊含量均匀度测定方法。
你说这玩意儿重要不?那可太重要啦!就好比是给一个大蛋糕分份儿,得保证每一块儿都差不多大小,不能这块儿大得离谱,那块儿小得可怜呀。
含量均匀度测定,那就是要看看一个药品或者其他东西里面的有效成分是不是分布得均匀。
这就像是一场考试,得考个好成绩,才能让人放心。
想象一下,如果一个药,有的地方药效强得要命,有的地方几乎没啥药效,那用起来多吓人呀!那怎么测定呢?这可有好几种办法呢。
有一种方法就像是用筛子筛东西,把大的小的分开,看看比例对不对。
通过一些仪器和技术,把里面的成分一点点分析出来,然后和标准一对比,就知道均匀度咋样啦。
还有一种方法呢,就像是给一群人排队,看看高的矮的是不是间隔均匀。
对样本进行细致的观察和测量,找到其中的规律和特点,从而判断出含量均匀度。
当然啦,不同的东西可能需要不同的方法。
就像不同的人穿不同的衣服才合适一样。
有时候得用这个方法,有时候得用那个方法,得根据具体情况来。
这测定含量均匀度可不能马虎啊!这关系到产品的质量和效果呢。
要是没测好,那可就麻烦大啦。
就好比盖房子,根基没打好,那房子能结实吗?而且啊,做这个测定可得认真仔细,不能有一点儿差错。
就跟绣花似的,得一针一线慢慢来。
稍微不注意,可能结果就不准确啦。
咱再想想,要是吃的药含量不均匀,那治病效果能好吗?肯定不行呀!所以说这含量均匀度测定真的是太重要啦。
在实际操作中,操作人员得有足够的耐心和专业知识。
不能随随便便就下结论,得反复验证,确保结果可靠。
这就像是走钢丝,得小心翼翼,一步一个脚印。
总之呢,含量均匀度测定方法是个很关键的东西,我们得重视起来。
要像对待宝贝一样对待它,让它发挥出最大的作用。
让我们的产品质量过硬,让大家用得放心,用得安心。
你说是不是这个理儿呢?这可不是开玩笑的事儿啊!。
含量均匀度的实验报告

一、实验目的1. 掌握含量均匀度的概念及意义;2. 熟悉含量均匀度测定的原理和方法;3. 提高实验操作技能,培养严谨的科学态度。
二、实验原理含量均匀度是指小剂量或单剂量的固体制剂、半固体制剂以及非均相液体制剂的每片(个)含量符合标示量的程度。
本实验采用紫外分光光度法测定药物含量均匀度,利用紫外-可见分光光度法测定药物含量,根据测定结果判断药物含量是否均匀。
三、实验材料与仪器1. 实验材料:待测药物样品、标准品、对照品、溶剂等;2. 实验仪器:紫外-可见分光光度计、天平、移液器、容量瓶、烧杯等。
四、实验方法1. 标准曲线的绘制:精密称取标准品,用溶剂溶解并定容,配制成一系列不同浓度的溶液。
以浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
2. 样品溶液的配制:精密称取待测药物样品,用溶剂溶解并定容,配制成一系列不同浓度的溶液。
3. 吸光度测定:将标准溶液和样品溶液分别置于紫外-可见分光光度计中,在特定波长下测定吸光度。
4. 含量均匀度计算:根据标准曲线和样品溶液的吸光度,计算出样品溶液的浓度。
再根据样品溶液的浓度和样品的称量,计算出每片(个)药物的含量。
5. 结果分析:根据含量均匀度的定义,判断待测药物样品的含量是否均匀。
五、实验步骤1. 标准曲线的绘制:精密称取标准品,用溶剂溶解并定容,配制成一系列不同浓度的溶液。
以浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
2. 样品溶液的配制:精密称取待测药物样品,用溶剂溶解并定容,配制成一系列不同浓度的溶液。
3. 吸光度测定:将标准溶液和样品溶液分别置于紫外-可见分光光度计中,在特定波长下测定吸光度。
4. 含量均匀度计算:根据标准曲线和样品溶液的吸光度,计算出样品溶液的浓度。
再根据样品溶液的浓度和样品的称量,计算出每片(个)药物的含量。
5. 结果分析:根据含量均匀度的定义,判断待测药物样品的含量是否均匀。
六、实验结果与分析1. 标准曲线绘制:根据实验数据,绘制标准曲线,线性关系良好。
含量均匀度检查法操作规程

含量均匀度检查法操作规程一、仪器和试剂准备1.高效液相色谱仪(HPLC)及其附件;2.所需的标准品和质量控制品;3.色谱柱:选择合适的色谱柱,确保其适应检测的活性成分;4.进样器:设定合适的进样体积,保证样品浓度适中;5.洗涤溶剂和流动相:按照方法要求配置好洗涤溶剂和流动相;6.离心机:用于制备样品溶液;7.干燥器:用于干燥样品或试剂;8.重量计:用于称取试剂和样品;9.pH计:用于测定溶液的pH值;10.紫外可见分光光度计:用于检测溶液的吸光度。
二、操作步骤1.样品的制备(1)将样品药品的数量根据检测要求称取到干燥器中;(2)打开干燥器,将药品在低温下进行干燥,直到其完全干燥;(3)关闭干燥器,等待样品冷却;(4)将干燥后的样品用适量的洗涤溶剂溶解,并进行适当的振荡和离心;(5)取出上清液,即为样品溶液。
2.仪器的配置(1)打开HPLC仪器的电源,并进行预热和平衡;(2)将色谱柱连接好,保证其正常的流动相;(3)调整进样器的体积,设定合适的样品进入量;(4)检查流速、温度和检测波长等参数的设置是否正确。
3.样品的进样(1)用吸管或进样器将样品溶液吸入色谱柱;(2)调整进样器的进样速度和体积,确保样品进入量合适。
4.HPLC方法运行(1)启动HPLC仪器,进入相应的方法运行界面;(2)设置合适的流动相速度,保证样品的快速流动;(3)检测样品的吸光度,记录峰高和峰面积等数据。
5.数据分析与结果记录(1)将样品的吸光度数据转化为样品中活性成分的含量;(2)对各个样品进行含量均匀度分析;(3)判断样品的含量均匀度是否合格;(4)记录各个样品的含量均匀度结果。
6.结果的解释与判断(1)根据含量均匀度检查结果,判断样品的质量是否合格;(2)当样品的含量均匀度达到要求时,判定为合格;(3)当样品的含量均匀度不达标时,判定为不合格;(4)根据不同样品的含量均匀度结果,进行相应的药品调整或重配。
三、操作注意事项1.严格按照方法要求进行操作;2.仔细准备和称取样品和试剂,避免误差;3.所有仪器和试剂都要按照要求进行校准和质量验证;4.样品制备时要避免污染和杂质的存在;5.检查样品进样的速度和体积,保证其准确性和一致性;6.在HPLC方法运行过程中,监测仪器和管路的状态,并及时处理异常情况;7.数据分析和结果判定要准确、客观、合理;8.结果的解释和判断要全面、客观,并根据相应的质量标准进行评价;9.操作结束后,及时清洗和维护仪器设备,确保其正常使用。
含量均匀度 一组

吡罗昔康片、盐酸、甲醇
(二)操作方法
1.取本品1片,置100mL容量瓶中。
2.加0.1mol/L盐酸甲醇溶液适量,超声20 分钟,超声20min使吡罗昔
康溶解。
3. 0.1mol/L盐酸甲醇溶液稀释至刻度,摇匀,滤过。 4. 精密量取续滤液适量,用 0.1mol/L 盐酸甲醇溶液定量稀释制成每 1mL中吡罗昔康的溶液 5.照紫外-可见分光光度法(通则0401),在波长334nm处测定吸光度。 6.按C15H13N3O4S的吸收系数为856计算含量。
(3)粒子形态的影响粒子形态规则,表面平滑,易于混匀;但
各组分的密度差异如果较大,则易于因振动再分离,致均匀度不好。
吡罗昔康片含量均匀度测定
――紫外可见分光光度法
本品含吡罗昔康( C15H13N3O4S )应为标示量的90.0% 〜110.0%
(一)主要仪器与药品
1.仪器
紫外分光光度计
超声波清洗器
(三)记录与计算
记录: 应记录检测方法,所用仪器型号,以及每片测得的结果等。 计算: 1.共做10片,分别测定每片以标示量为100的相对含量X
2.求10片平均值x
3.标准差S
4.标示量与均值之差的绝对值A(A=∣100-x∣)
(四)结果判断
(2)当A > 0.25 L时,若A+1.7 S≤L ,符合规定 若A+1.7 S>L ,不符合规定 注意
检验原始记录填写要求
所用检测方法,仪器型号,测定条件,供试
溶液的制备方法,各测量值,计算结果与判断。
Thank Thank You You
(五)注意事项
1.供试品的主要必须溶解完全,必要时可用乳钵研磨或超声波处 理,促使溶解,并定量转移到容量瓶中。
含量均匀度检查法
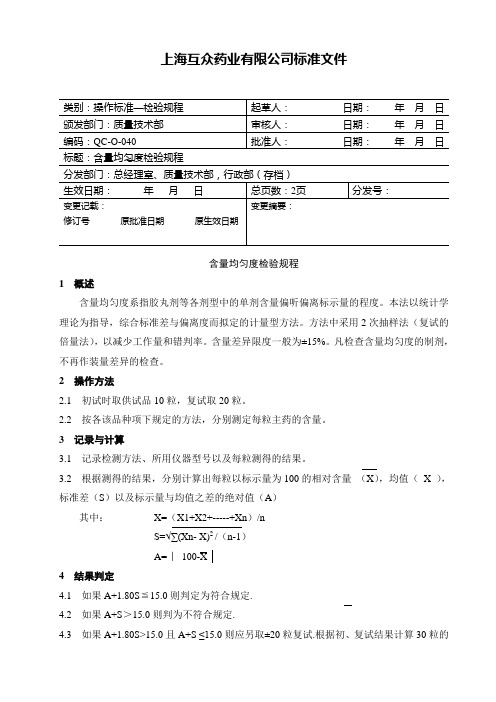
上海互众药业有限公司标准文件标题:含量均匀度检验规程含量均匀度检验规程1 概述含量均匀度系指胶丸剂等各剂型中的单剂含量偏听偏离标示量的程度。
本法以统计学理论为指导,综合标准差与偏离度而拟定的计量型方法。
方法中采用2次抽样法(复试的倍量法),以减少工作量和错判率。
含量差异限度一般为±15%。
凡检查含量均匀度的制剂,不再作装量差异的检查。
2 操作方法2.1 初试时取供试品10粒,复试取20粒。
2.2 按各该品种项下规定的方法,分别测定每粒主药的含量。
3 记录与计算3.1 记录检测方法、所用仪器型号以及每粒测得的结果。
3.2 根据测得的结果,分别计算出每粒以标示量为100的相对含量(X),均值(X ),标准差(S)以及标示量与均值之差的绝对值(A)其中:X=(X1+X2+-----+Xn)/nS=√∑(Xn- X)2 /(n-1)A= ︳100-X4 结果判定4.1 如果A+1.80S≦15.0则判定为符合规定.4.2 如果A+S>15.0则判为不符合规定.4.3 如果A+1.80S>15.0且A+S ≤15.0则应另取±20粒复试.根据初、复试结果计算30粒的2/2 含量均匀度检验规程QC-O-040 X、S、A。
若A+1。
45S≤15.0,即判为符合规定,如A+1.45S>15.0则判为不符合规定.4.4 如该品种项下规定含量均匀度的限度为20%或其他百分数时,应将上述各述各判定式中的15.0改为20.0或其他相应的数值,但各判定式中的系数不变.5 注意事项5.1 供试品的主药必须溶解完全,并定量转移至容量瓶中.5.2 测定所用的溶剂需一次配够,当用量较大时,即使是同批号的溶剂,也应混合均匀后使用。
含量均匀度检查法

含量均匀度检查法(总4页)本页仅作为文档封面,使用时可以删除This document is for reference only-rar21year.March0 9 4 1 含量均匀度检查法本法用于检查单剂量的固体、半固体和非均相液体制剂含量符合标示量的程度。
在生产过程中,某些小剂量的剂型由于工艺或设备的原因,可引起含量均匀度的差异。
本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的准确。
除另有规定外,片剂、硬胶囊剂、颗粒剂或散剂等,每一个单剂标示量小于25mg或主药含量小于每一个单剂重量25%者;药物间或药物与辅料间采用混粉工艺制成的注射用无菌粉末;内充非均相溶液的软胶囊;单剂量包装的口服混悬液、透皮贴剂和栓剂等品种项下规定含量均匀度应符合要求的制剂,均应检查含量均匀度。
复方制剂仅检査符合上述条件的组分,多种维生素或微量元素一般不检查含量均匀度。
凡检査含量均匀度的制剂,一般不再检査重(装)量差异;当全部主成分均进行含量均匀度检查时,复方制剂一般亦不再检查重(装)量差异。
除另有规定外,取供试品10个,照各品种项下规定的方法,分别测定每一个单剂以标示量为100的相对含量X,求其均值和标准差S以及标示量与均值之差的绝对值A (A = | 100-| ) 。
若A + S≤ L,则供试品的含量均匀度符合规定;若A + S > L,则不符合规定;若A + S > L,且A + S < L ,则应另取供试品20个复试。
根据初、复试结果,计算30个单剂的均值、标准差S和标示量与均值之差的绝对值A 。
再按下述公式计算并判定。
当A≤0.25 L时,若A2+ S2≤0.25L2,则供试品的含量均匀度符合规定;若A2+ S2> 0.25L2则不符合规定。
当A > 0.25L时,若A + ≤L,则供试品的含量均匀度符合规定;若A + > L,则不符合规定。
上述公式中L 为规定值。
含量均匀度测定技术

兽药检测技术
含量均匀度检查技术
【结果与判断】 (1)若A +2.2S≤L,即供试品的含量均匀度符合规定; (2)若A+S>L,则不符合规定;
(3)若A +2.2S >L,且A+S<L,则应另取20片(个)
复试。复试的判定依据查看通则。 注:L为含量均匀度的限度,除另有规定外,L=15.0
兽药检测技术
含量均匀度检查技术
【基本操作 】
凡检查含量均匀度的制剂,不再检查重量差异。
【例题 】
取炔诺酮标示量为0.6mg的复方炔诺酮片10片检查含量均 匀度,各片的含主药的量分别为0.54,0.56,0.55,0.64,0.57,
0.58,0.64,0.62,0.55和0.59mg。按含量差异限度为20.0,
判断该片剂的含量均匀度是否符合规定?
兽药检测技术
含量均匀度检查技术
【定义】 ——活性药物在规定条件下溶出的速胶囊剂或注射用无菌粉末,每 片标示量小于10mg或主药含量小于每片重量 5%者; (2)其他制剂,每个标示量小于2mg或主药 含量小于每个重量2%者
兽药检测技术
含量均匀度检查技术
【测定与计算 】
(1)测定每片以标示量为100的相对含量X,
15版药典含量均匀度检查法
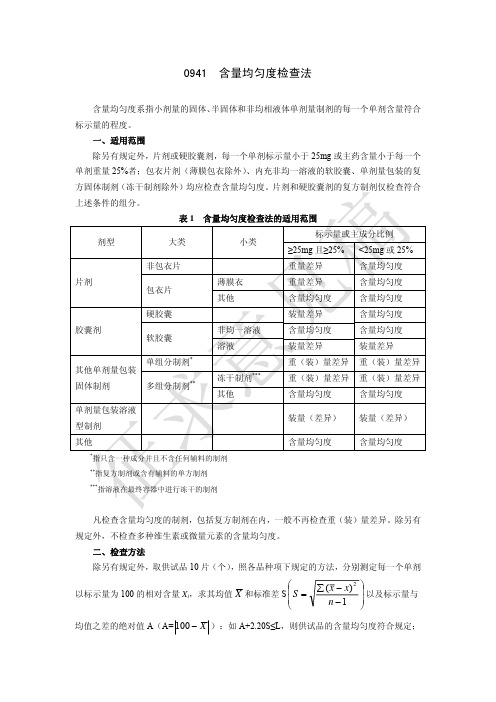
0941含量均匀度检查法含量均匀度系指小剂量的固体、 半固体和非均相液体单剂量制剂的每一个单剂含量符合 标示量的程度。
一、适用范围 除另有规定外,片剂或硬胶囊剂,每一个单剂标示量小于 25mg 或主药含量小于每一个 单剂重量 25%者;包衣片剂(薄膜包衣除外) 、内充非均一溶液的软胶囊、单剂量包装的复 方固体制剂(冻干制剂除外)均应检查含量均匀度。
片剂和硬胶囊剂的复方制剂仅检查符合 上述条件的组分。
表1 剂型 大类 非包衣片 片剂 包衣片 硬胶囊 胶囊剂 软胶囊 单组分制剂* 多组分制剂** 冻干制剂*** 其他 非均一溶液 溶液 薄膜衣 其他 含量均匀度检查法的适用范围 小类 标示量或主成分比例 ≥25mg 且≥25% 重量差异 重量差异 含量均匀度 装量差异 含量均匀度 装量差异 重(装)量差异 重(装)量差异 含量均匀度 装量(差异) 含量均匀度指只含一种成分并且不含任何辅料的制剂 指复方制剂或含有辅料的单方制剂 指溶液在最终容器中进行冻干的制剂<25mg 或 25% 含量均匀度 含量均匀度 含量均匀度 含量均匀度 含量均匀度 装量差异 重(装)量差异 重(装)量差异 含量均匀度 装量(差异) 含量均匀度其他单剂量包装 固体制剂 单剂量包装溶液 型制剂 其他******凡检查含量均匀度的制剂,包括复方制剂在内,一般不再检查重(装)量差异。
除另有 规定外,不检查多种维生素或微量元素的含量均匀度。
二、检查方法 除另有规定外,取供试品 10 片(个) ,照各品种项下规定的方法,分别测定每一个单剂⎛ 以标示量为 100 的相对含量 Xi,求其均值 X 和标准差 S ⎜ S = ⎜ ⎝∑ ( x − x) n −12⎞ ⎟ 以及标示量与 ⎟ ⎠均值之差的绝对值 A(A= 100 − X ):如 A+2.20S≤L,则供试品的含量均匀度符合规定;若 A+S>L,则不符合规定;若 A+2.20S>L,且 A+S≤L,则应另取 20 片(个)复试。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2、适用范围
除另有规定外,片剂、胶囊或注射用无菌粉末,每片(个)标 示量不大于25ml或主药含量不大于每片(个)重量25%者;小于 10mg或主药含量小于每片个重量的5mg;其它制剂,如内容物非均 一溶液的软胶囊、单剂量包装的口服混悬液、透皮贴剂、吸入剂和 栓剂,均应检查含量均匀度。 复方制剂仅检查符合上述条件的组分。
4、检查方法
除另有规定外,取供试品10片(个),按各种药品项下规定的方 法进行。 (1)分别测定每片(个)以标示量为100的相对含量X; (2)求10片(个)相对含量的平均值 x、标准差S、标示量与平均 值之差的绝对值A。
5、结果判定
例:地西泮
6、注意事项
(1)凡检查含量均匀度的制剂,不用检查重(装)量的差异。 (2)供试品的主药必须溶解完全,必要时可用乳钵研磨或超声处理, 促使溶解,并定量转移至容量瓶中。 (3)测定时溶液必须澄清,过滤不清,可离心后,取澄清液测定。 (4)即使是同批号的溶剂,也应混合均匀后使用。
3、必要性
(1)含量均匀度是考察制剂工艺水平的重要指标之一。以前是用装 (重)量差异来衡量的。但随着科学技术的发展及临床要求,装(重) 量差异检查不能满足对小剂量制剂质量控制的要求。重(装)量差异 是检查主药和辅料的总限度,没有明确考察主药的均一性,而主药是 起治疗作用的,尤其是对那些治疗剂量与中剂量比较接近的品种,控 制其含量均匀度显得尤为重要。匀度检查
四组
目
01
概念
2 0 1 7
录
02
适用范围
CONTENTS
03
必要性
04
检查方法
05
结果判定
06
注意事项
1、概念
含量均匀度是指小剂量 或单剂量的固体制剂、半 固体制剂和非均相液体制 剂的每片(个)含量符合 标示量的程度。 目的:控制每片(个) 含量的均一性,以保证用 药剂量准确。
实验:碘化钾片
(3)步骤:取本品1片(10mg规格),置 100ml量瓶中,加水适量,充分振摇,使碘 化钾溶解,用水稀释至刻度,摇匀,过滤, (1)实验材料:碘化钾、碘化 精密量取续滤液5ml,置100ml量瓶中,用 钾片、蒸馏水 水稀释至刻度,摇匀,作为供试品溶液。 (2)实验仪器:容量瓶、量筒、 另取碘化钾对照品,精密称定,加水 玻璃棒、烧杯、分析天平、紫外 溶解并定量稀释制成每1ml中约含5ug的溶 分光光度计、比色杯、擦镜纸、 液,作为对照品溶液。 漏斗、滤纸 照紫外-可见分光光度法(通则0401), 在227nm的波长处测定吸光度,计算含量, 应符合规定(通则0941)。 《中国药典》2015版第二部
必要性
(2)在生产过程中,某些小剂量 的剂型,辅料较多,由于工艺或 设备的原因,或因分散性不好, 难以混合均匀,可引起含量均匀 度的差异,因此仅靠控制重量差 异很难保证给药剂量的准确,故 应检查含量均匀度。 (3)各种固体制剂、半固体制 剂和非均相液体制剂的含量测定, 测定的是多个单剂的平均含量, 而不是单剂含量,故药典规定含 量均匀度检查法和含量测定要相 互配合,同时进行,以全面控制 制剂的质量,确保用药的安全和 有效。
