等电子原理的应用及考点分析
等电子原理及其应用

等电子原理及其应用作者:张晓菲来源:《中学生数理化·学习研究》2017年第01期一、等电子体原理1.发现:1919年Langmuir在大量实验事实的基础上总结出一条经验规律,即等电子原理。
2.等电子体原理分为广义和狭义两种。
(1)狭义:具有相同电子数和相同原子数的分子具有相似的电子结构、相似的几何构型和相似的化学性质。
(2)广义:若几种物质含有相同的电子数和相同的重电子(除氢、氦、锂外),则它们的重原子数的构型往往是相同的。
这里所说的“相同的电子数”,既可以说是总电子数相同,也可以是价电子数相同。
3.中学常见的等电子體价电子数有8、10、14、16、18、24、26、30、32、48十种,按照重原子总数的不同可以归类如表2。
二、等电子体原理的应用利用等电子原理可以较快判断一些分子或离子的构型。
例题锇的名称源自拉丁文,原义“气味”,这是由于锇的粉末会被空气氧化为有恶臭的OsO4(代号A,熔点40℃,沸点130℃)。
A溶于强碱转化为深红色的[OsO4(OH)2]2-(代号B),向含B的水溶液通入氨,生成C,溶液的颜色变为淡黄色。
C十分稳定,C是A的等电子体,其中锇的氧化态仍为+8价。
红外图谱可以检出分子中某些化学键的振动吸收,红外图谱显示C有一个四氧化锇所没有的吸收峰。
C的含钾化合物是黄色的晶体,与高锰酸钾类质同晶。
(1)写出C的化学式。
(2)写出A、B、C最可能的立体结构。
解析:首先我们从C与氨反应的产物知道C中含有氮元素。
如果用氮替换O,由于N是第ⅤA元素,有5个价电子,而O是第ⅥA元素,有6个价电子;每进行一次替换使C增加一个负电荷;然后再从C的含钾化合物“是高锰酸钾类质同晶”这个信息中确认C是-1价离子,于是可以确定C中只有一个N,它的化学式应该是OsO3N-,这个结构与C中有一个OsO4没有的化学键是吻合的。
A(OsO4):价电子总数=8+0=8,价层电子对数目=8÷2=4,成键电子对数目=4,孤电子对数=4-4=0,故结构为正四面体。
第31讲+价层电子对互斥模型、杂化轨道理论及应用-2024年高考化学一轮复习高频考点精讲

(一)微粒空间结构的判断
1.熟记常见分子(离子)的空间结构
微粒组成(A为 中心原子)
实例
中心原子的 中心原子的 微粒空间结构
孤电子对数 杂化方式
BeCl2、CO2、HCN
_0__
__sp__
2024 高考化学一轮复习高频考点精讲
第31讲
价层电子对互斥模型 杂化轨道理论及应用
复习目标
1.掌握价层电子对互斥模型和杂化轨道理论的内容并 能用其推测简单分子或离子的空间结构。 2.掌握键角大小原因并能作出规范描述。
考点一
价层电子互斥模型 杂化轨道理论
必备知识
1.价层电子对互斥模型 (1)理论要点 ①价层电子对在空间上彼此相距最远时,排斥力最小,体系的能量最低。 ②孤电子对排斥力较大,孤电子对越多,排斥力越强,键角越小。 (2)价层电子对互斥模型推测分子(离子)的空间结构的关键——价层电子对数的计算 价层电子对数=σ键电子对数+中心原子的孤电子对数 说明:σ键电子对数=中心原子结合的原子数;
中心原子的孤电子对数=12 (a-xb),其中 ①a表示中心原子的 价电子数 。 对于主族元素:a= 原子的最外层电子数 。 对于阳离子:a= 中心原子的价电子数-离子的电荷数 。 对于阴离子:a= 中心原子的价电子数+离子的电荷数(绝对值) 。 ②x表示 与中心原子结合的原子数 。 ③b表示与中心原子结合的原子 最多能接受的电子数 (氢为 1 ,其他原子=_8_-__该__原__子_
易错辨析
1.价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数( √ ) 2.N2分子中N原子没有杂化,分子中有1个σ键、2个π键( √ ) 3.只要分子的空间结构为平面三角形,中心原子均为sp2杂化( √ ) 4.分子中中心原子通过sp3杂化轨道成键时,该分子一定为正四面体结构( × ) √ 5.SiF4 与 SO23-的中心原子均为 sp3 杂化( )
共价键及分子结构知识梳理

共价键及分子结构知识梳理】一、共价键1- 1共价键的实质、特征和存在实质:原子间形成共用电子对特征:a.共价键的饱和性,共价键的饱和性决定共价分子的。
b共价键的方向性,共价键的方向性决定分子的。
1- 2共价键的类型b键:S-Sb键、S-p c键、p-p b键,特征:轴对称。
n键:p-p n键,特征:镜像对称【方法引领】b键和n键的存在规律b键成单键;n键成双键、三键。
共价单键为b键;共价双键中有1个b键、1个n键;共价三键中有1个b键、2个n 键。
对于开链有机分子:b键数=原子总数-1 ; n键数=各原子成键数之和- b键数(环状有机分子,b键数要根据环的数目确定)原子形成共价分子时,首先形成b键,两原子之间必有且只有1个b键;b键一般比n 键牢固,n键是化学反应的积极参与者。
形成稳定的n键要求原子半径比较小,所以多数情况是在第二周期元素原子间形成。
如C02分子中碳、氧原子之间以p-p b键和p-p n键相连,而SiO2的硅、氧原子之间就没有p-p n键。
【课堂练习1】(1)下列说法不正确的是A .乙烷分子中的6个C —H和1个C —C键都为b键,不存在n键B •气体单质中,一定有b键,可能有n键C.两个原子间共价键时,最多有一个b键D . b键与n键重叠程度不同,形成的共价键强度不同(2)有机物CH2= CH —CH2—C三CH分子中,C—H b键与C — C b键的数目之比为;b键与n键的数目之比为。
二、键参数一一键能、键长与键角2- 1键能的意义和应用a. 判断共价键的强弱b. 判断分子的稳定性c. 判断物质的反应活性d. 通过键能大小比较,判断化学反应中的能量变化【思考】比较C —C和C= C的键能,分析为什么乙烯的化学性质比乙烷活跃,容易发生加成反应?2-2键长的意义和应用键长越短,往往键能越大,表明共价越稳定。
(键长的长短可以通过成键原子半径大小来判断)2个原子间的叁键键长v双键键长v单键键长2-3键角的意义键角决定分子的空间构型,是共价键具有方向性的具体表现。
高中化学选修三 第二章 第一节 共价键 第二课时 键参数 等电子体

仪器分析
简介 荧光检测水中的双酚 A
CO分子和N2分子的某些性质
等电子原理:
原子数相同,价电子总数相同的分子,结构相似, 物理性质相近。具有等电子特征的微粒互称为 等电子体。
仪器分析
简介 荧光检测水中的双酚 A
等电子体
1 等电子体具有相同的化学键类型和分子构型,物理性质相似,但化学性质差别较大。 2 互为等电子体的物质可以是分子和分子,分子和离子,离子和离子。 3 等电子体的价电子数的计算方法 分子型的=各原子最外层电子数之和 离子型的=各原子最外层电子数之和加减离子所带的电荷数 如:NO2=5+6+6+1=18
仪器分析
简介 荧光检测水中的双酚 A
(1)结构式为 PMR谱上
的有机物,在
观察峰给出的强度之比为 ; ( 2 )某含氧 有机物,它的 相对分子质量为 46.0,碳的质量分数为52.2%,氢的质量分数为 13.0%,PMR中只有一个信号,请写出其结构简 式 。 (3)实践中可根据PMR谱上观察到氢原子给 出的峰值情况,确定有机物的结构。如分子式为 C3H6O2 的链状有机物,有 PMR 谱上峰给出的稳 定强度仅有四种,其对应的全部结构, ④ 2∶2∶1∶1,请分别推断出结构简式: ① ② ③ ④ 。
形成2 mo1HCl释放能量:2×431.8 kJ -436.0kJ+242.7kJ) = 184.9 kJ 形成2 mo1HBr释放能量:2×366kJ -(436.0kJ+193.7kJ)= 102.97kJ HCl释放能量比HBr释放能量多,因而生成的HCl更稳定,即HBr更容 易发生热分解生成相应的单质.
仪器分析 简介 荧光检测水中的双酚 A
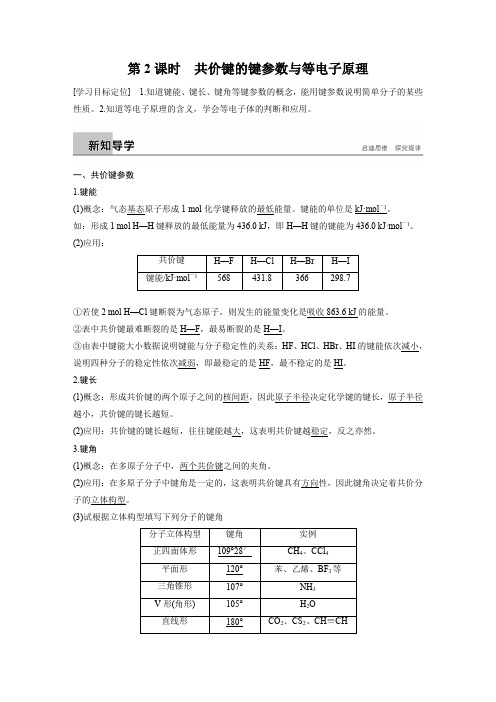
某些共价键的键能
2.1.2键参数、等电子原理课件高二化学人教版选择性必修2

568
431.8
366
298.7
①若使2 mol H—Cl键断裂为气态原子,则发生的能量变化
是 吸收863.6kJ的能量。
②表中共价键最难断裂的是 H—F ,最易断裂的是 H—I 。
③由表中键能大小数据说明键能与分子稳定性的关系:HF、HCl、
HBr、HI的键能依次 减小 ,说明四种分子的稳定性依次 减弱 ,
即HF分子很稳定,最 难 分解,HI分子最不稳定, 易 分解。
[基础•初探]
(3)应用
①判断共价键的稳定性
从键能的定义可知,破坏1mol化学键所需能量越多,即共价键的键能越大,
则共价键越 牢固 。
②判断分子的稳定性
一般来说,结构相似的分子中,共价键的键能越大,分子越稳定。如分子
的稳定性:HF > HCl > HBr > HI。
不能
②非金属性越强的原子形成的共价键越牢固,________________。
(2)从数据中找出一些规律,请写出一条:
同主族元素原子与相同原子结合形成共价键时,该主族元素原子半径越小,共价键越牢固
。
1
218kJ mol
330kJ mol1
试预测C—Br键的键能范围:________________<C—Br键的键能<________________。
___
;由热化学方程式2H2 (g) + S2 (s) =
2H2 S(g)Δ = −224.5kJ ⋅ mol−1 和表中数据可计算出 1molS2(s)变为 1molS2(g)时
4.5
将__________(填“吸收”或“放出”)_______kJ的热量。
吸收
课堂小结
共价键第2课时-人教版高中化学选修三导学笔记
第2课时共价键的键参数与等电子原理[学习目标定位] 1.知道键能、键长、键角等键参数的概念,能用键参数说明简单分子的某些性质。
2.知道等电子原理的含义,学会等电子体的判断和应用。
一、共价键参数1.键能(1)概念:气态基态原子形成1 mol化学键释放的最低能量。
键能的单位是kJ·mol-1。
如:形成1 mol H—H键释放的最低能量为436.0 kJ,即H—H键的键能为436.0 kJ·mol-1。
(2)应用:①若使2 mol H—Cl键断裂为气态原子,则发生的能量变化是吸收863.6 kJ的能量。
②表中共价键最难断裂的是H—F,最易断裂的是H—I。
③由表中键能大小数据说明键能与分子稳定性的关系:HF、HCl、HBr、HI的键能依次减小,说明四种分子的稳定性依次减弱,即最稳定的是HF,最不稳定的是HI。
2.键长(1)概念:形成共价键的两个原子之间的核间距,因此原子半径决定化学键的键长,原子半径越小,共价键的键长越短。
(2)应用:共价键的键长越短,往往键能越大,这表明共价键越稳定,反之亦然。
3.键角(1)概念:在多原子分子中,两个共价键之间的夹角。
(2)应用:在多原子分子中键角是一定的,这表明共价键具有方向性,因此键角决定着共价分子的立体构型。
(3)试根据立体构型填写下列分子的键角例1N—H键键能的含义是()A.由N和H形成1 mol NH3所放出的能量B.把1 mol NH3中的共价键全部拆开所吸收的热量C.拆开约6.02×1023个N—H键所吸收的热量D.形成1个N—H键所放出的热量【考点】共价键的键参数【题点】键能、键长和键角的概念答案 C解析N—H键的键能是指形成1 mol N—H键放出的能量或拆开1 mol N—H键所吸收的能量,不是指形成1个N—H 键释放的能量。
1 mol NH3中含有3 mol N—H键,拆开1 mol NH3或形成1 mol NH3吸收或放出的能量应是1 mol N—H键键能的3倍。
金牌学案高二化学人教版选修3课件:2.1.2共价键的键参数与等电子原理
目标导航 预习导引 一 二
自主预习
合作探究
一、认识键参数 1.键能:气态基态原子形成1 mol化学键释放的最低能量。键能越 大,化学键越稳定。 2.键长:形成共价键的两个原子之间的核间距。键长越短,键能越 大,共价键越稳定。 3.键角:在原子数超过2的分子中,两个共价键的夹角。键角是描 述分子立体结构的重要参数。
自主预习
合作探究
写出常见的18e-微粒,讨论电子数相同的微粒与等电子体是否相 同?
答案:电子数相同的微粒是指微粒中所有的电子数之和相同,但 微粒中原子的数目不一定相同,如18电子的微粒有S2-、HS-、Cl-、 Ar、K+、Ca2+、H2S、H2O2、N2H4、C2H6、CH3OH等。
等电子体是指原子总数相等、价电子总数相同的微粒,其电子总 数不一定相同。如N2O与CO2,其原子总数、价电子总数、电子总 数相等;SO2和O3其原子总数相同、价电子总数相同,但SO2的电子 总数为32,O3的电子总数为24,显然电子总数不同。
目标导航 预习导引 一 二
自主预习
合作探究
是否一定是键长越短键能越大? 答案:不是。比如F—F键的键长短,键能也小。F原子的半径很小, 因此其键长短,而由于F—F键的键长短,两个F原子形成共价键时,原 子核之间的距离很近,排斥力很大,因此F—F键的键能不大。与Cl2 相比,F2的稳定性差,很容易与其他物质反应。
编后语
听课不仅要动脑,还要动口。这样,上课就能够主动接受和吸收知识,把被动的听课变成了一种积极、互动的活动。这对提高我们的学习积极性和口头 表达能力,以及考试时回答主观题很有帮助的。实践证明,凡积极举手发言的学生,学习进步特别快。上课的动口,主要有以下几个方式:
第一,复述。 课本上和老师讲的内容,有些往往非常专业和生硬,不好理解和记忆,我们听课时要试着用自己的话把这些知识说一说。有时用自己的话可能要啰嗦
2022-2023学年山东省潍坊市昌乐及第中学高二化学测试题含解析
2022-2023学年山东省潍坊市昌乐及第中学高二化学测试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 设想通过原电池反应以H2和Cl2为原料生产盐酸。
关于这种原电池的设想正确的是A.正极反应为H2-2e-=2H+B.在电池工作时,H+移向负极C.电池正极发生氧化反应D.以盐酸作为电解质,并不断补充蒸馏水,以维持溶液一定的pH参考答案:D2. 下列化学反应中水作还原剂的是A.CaO+H2O Ca(OH)2 B.2Na+2H2O2NaOH+H2↑C.Cl2+2H2O HCl+HClO D.2F2+2H2O4HF+O2参考答案:D略3. 某烃的结构简式如图,下列说法不正确的是A.1mol该烃完全燃烧消耗O211mol B.与氢气完全加成后的产物中含2个甲基C.1mol该烃完全加成消耗Br23mol D.分子中一定共平面的碳原子有6个参考答案:B略4. 与CO32﹣不是等电子体的是()A.SO3 B.BF3 C.NO3﹣D.PCl3参考答案:D【考点】“等电子原理”的应用.【分析】根据具有相同原子数和电子数的微粒互称为等电子体来解答.【解答】解:CO32﹣含有4个原子,其价电子数都是24.A.SO3含有4个原子,其价电子数都是24,所以是等电子体,故A正确;B.BF3含有4个原子,其价电子数都是24,所以是等电子体,故B正确;C.硝酸根离子含有4个原子,其价电子数都是24,所以是等电子体,故C正确;D.PCl3含有4个原子,其价电子数都是23,不是等电子体,故D错误.故选D.5. 下列解释实际应用的原理表达式中,错误的是A.用排饱和食盐水法收集CI2 :CI2+H2O H++CI-+HCIOB.0.1mo l·L-1H2S 溶液的pH约为4:H2S S2-+2H+C.足量稀盐酸、稀硫酸分别与一定量NaOH溶液反应放出热量相等:H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ·mo l-1D.用Na2CO3溶液处理锅炉水垢:CaSO4(s)+CO32-(aq)CaCO3(s)+SO42-(aq)参考答案:B略6. 在铝中加入某种金属可得到低密度,高强度的新型铝合金,可代替常规的铝合金用于制造航天飞机这种金属是A.锂 B.镁 C.铜 D.锰参考答案:7. 在氯化铁溶液中加入过量的铁粉,充分反应后,下列结论错误的是()A.溶液的质量将增大 B.溶液的颜色由棕黄色变成浅绿色C.溶液中的金属离子全部是Fe2+ D.溶液中的金属离子既有Fe3+,又有Fe2+参考答案:D略8. 右图表示反应X(g) 4Y g)+Z g);△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是()A.第6min后,反应就终止了B.若降低温度,v正和v逆将以同样倍数减小C.X的平衡分解率为85%D.若升高温度,X的平衡分解率将大于85%参考答案:C略9. A、B、C是周期表中相邻的三个元素,A和B是同周期,B和C同主族,三种元素最外层电子总数之和为17,核内质子数之和为31,则A、B、C三种元素是()A.Mg、Al、B B.Li、Be、MgC.N、O、S D.O、F、Cl参考答案:C解:A和B同周期,B和C同主族,设A元素的最外层电子数为x,则B、C最外层电子数为x+1或x﹣1,若B、C元素的最外层电子数为x+1,则x+2(x+1)=17,解得x=5,符合题意;若B、C元素的最外层电子数为x﹣1,则有x+2(x﹣1)=17,解得x=,不符合题意,即A处于ⅤA族,B、C处于ⅥA族.三种元素质子数总和为31,平均质子数==10.3,一定有元素处于第二周期,故三元素处于短周期,可以确定B、C为O元素、S 元素,故A的质子数为31﹣8﹣16=7,则A为N元素,由于A与B同周期,故B为O元素、C为S元素,故选C.10. 向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。
等电子体的判断方法归纳
教学实践2014-06《四川省普通高中新课程教学基本要求(化学学科)》中对于“等电子体和等电子原理”有如下描述:(1)了解等电子原理;(2)结合实例说明“等电子体”具有相似的结构和性质。
《2013年四川省普通高考考试说明(理科综合·化学)》中对“等电子原理”考点是这样描述的:了解“等电子原理”的含义。
围绕这个考点设计的问题应该是很容易作答的,但学生实际作答时错误率极高,经分析发现关键在于对等电子体确定上缺乏方法,对等电子原理的理解不够深入,现就此类问题的分析方法作如下归纳。
原子总数和价电子总数都相同的分子或离子(即等电子体)具有相似的化学键特征,它们的许多性质是相近的,这一原理称为等电子原理。
如果仅从概念字面意义上出发去判断与A粒子互为等电子体的B粒子的化学式,往往感觉无从下手,或东拼西凑地试着写,也往往只注意从“价电子总数”或“原子总数”相同某一方面而错写。
如,写CH4分子的等电子体时许多学生错写成NH3(忽略原子总数不同)、CCl4(忽略价电子总数不同)等,至于再稍复杂一些的,错的更多,实际体现为解决问题的方法上的欠缺。
等电子体的判断一般可采取以下几种方法:一、同族元素互换法即将既定粒子中的某元素换成它的同族元素。
如:l4的等电子体确定将C换成与它同族的IVA族元素有SiCl4、GeCl4等;将Cl换与它同族的VIIA族元素有CF4、CBr4、CI4、CFCl3……同时将C和Cl换成其同族元素可有SiF4、SiFCl3……2.CO2的等电子体确定将O换成与之同族的ⅥA族元素S有COS、CS2,注意不能将C原子换成与之同族的Si原子,因为SiO2为原子晶体,晶体中无单个SiO2分子。
同理,不能将BeCl2的等电子体确定为MgCl2或BeF2,MgCl2和BeF2为离子晶体,晶体中无单个MgCl2和BeF2分子。
3.SO2-4的等电子体确定将一个O原子换成与之同族的S原子得S2O2-3。
专题8-4 等电子体与分子中的“大Π键”(解析版)
等电子体与分子中的“大Π键”考点一等电子体原理【核心知识梳理】1.等电子体原理(1)等电子体:原子总数相同、价电子总数相同的粒子互称为等电子体。
(2)等电子原理:等电子体具有相似的化学键特征,它们的许多性质相近,此原理称为等电子原理,例如CO和N2的熔沸点、溶解性等都非常相近。
(3)等电子原理的应用利用等电子原理可以判断一些简单分子或离子的立体构型。
如SO2和O3的原子数目和价电子总数都相等,二者互为等电子体,中心原子都是sp2杂化,都是V形结构。
(4)常见的等电子体汇总2. 确定等电子体的方法变换过程中注意电荷变化,并伴有元素种类的改变【精准训练1】等电子体1.N2的结构可以表示为,CO的结构可以表示为,其中椭圆框表示π键,下列说法中不正确的是()A.N2分子与CO分子中都含有三键B.CO分子中有一个π键是配位键C.N2与CO互为等电子体D.N2与CO的化学性质相同2.下列粒子属于等电子体的是()A.C O32−和SO3B.NO和O2 C.NO2和O3D.HCl和H2O3.通常把原子总数和价电子总数相同的分子或离子称为等电子体。
人们发现等电子体的空间结构相同,则下列有关说法中正确的是()A.CH4和NH+4是等电子体,键角均为60°B.NO-3和CO2-3是等电子体,均为平面三角形结构C.H3O+和PCl3是等电子体,均为三角锥形结构D.B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道4.已知CO2为直线形结构,SO3为平面正三角形结构,NF3为三角锥形结构,请推测COS、CO2-3、PCl3的空间结构:________、________、________。
考点二分子中“大π键”【核心知识梳理】1. 定域π键(1)概念:两个相邻原子的平行p 轨道“肩并肩”重叠形成,可描述为双轨道双电子π键。
(2)形成定域π键的条件:相邻两个原子提供一个或两个相互平行的未杂化p 轨道。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
或氢离 子 组 合 得 到 的 1 8电 子 微 粒 : I H S P 。 HC 、 、 H 、
SH HS (2 。 i 、 一、)
、
( )8电子也 可 以看 成 “ +9 : 21 9 ” 9电子 微粒 可 以看 成 1 O电子 的分 子少 一个 氢原子 , : 、 H、 即 一F 一O NH 、 C 一; 以 两 两 组 合 为 1 H。 可 8电子 微 粒 , F 、 )、 如 2H ( 2 N H C H 、 H3 2 、 2 C OH等 。
() 是 一 个 裸 露 的 质 子 , 外 无 电 子 , 忆 规 律 3 H 核 记 玻璃深埋地下 。
() 1用化学符号表示下列 4 种微粒 :
A. B. C. D
3 不 溶 于 水 的 油 状 易 挥 发 溶 液 .
废洗液 , 可用 K O Mn 4氧化法 使其 再生 后使 用 。少
剂。 2 含 重金 属 的废 液 .
不溶 于水 的油状 易挥 发溶 液 ( C 2 乙醚 、 如 S、 苯等 ) , 不 能直 接倒 入 下水 道 , 以免 不 慎 引起 火 灾 。少 量 的 乙 醚、 可放 在盘 中在通 风橱 内 自燃 销毁 , 可燃 的少量 苯 不 的该类物质 可放 在通 风橱 内 自行 挥 发 , 大量 的应 回收 。 酚类 的若 大量应 回收 , 少量应 加废碱性 溶液反 应后排 入 下水道 。废草 酸溶 液应 在 H O S 4中加 KMn 4 化 后 O 氧 用大量 的水 冲人下水道 。
下记忆方法 。
11 . 0电 子 的 微 粒 的 记 忆
() 1 原子序数为 1 0的是 Ne 以此为 中心 的前后元素 , 的原子可 以通过 得失 电子 变成 1 O电子微 粒 。如 : 、 N
00 F一、 、 、 2 Al 一、 Ne Na Mg 、 。 。
3 等 电子微 粒在高考 中的考查 . 为巩固提升对上述 1 0电子和 1 8电子微粒 的掌握 , 下 面通 过高考题 目对 此知识 点进行 例析 。 【 1 (0 7 例 1 2 0 年江苏) 通常情况下 , 微粒 A和 B为 分子, C和 E为 阳离子 , D为 阴离子 , 它们都含有 1 个 电 0
量的废洗液也可加废碱液或 石灰使其 生成 C ( H) 沉 r 。 HF有 腐 蚀性 , 能 随意 排放 。 r、 不 B a要用 NaC 3 收或用 N 2 3海波) 0 吸 aS0 ( 还原后 , 再用 水冲走 。如有 剩余 的 HF 应 在安全的地方将 瓶子打碎 , , 用 CC 3 a O 小心 中和 , 然后用大量水 冲走 。 无机碱液如 Na OH、 NH。 的水溶液 , 1: 稀 HC 用 1 1 溶液中和后用 大量 水 冲走 。也 可 留作 酸性 气体 的吸收
四 、 意事 项 注
含酸性铜 、 、 的废 液先用 碱把 p 汞 铅 H调 至 6以上 , 加入过量的 NaS生成硫化物沉淀 , 沉淀物深埋 地下 。 2 将 也可在加过量 N z aS的 同时加入 F S 4 eO 作为 共沉 淀剂 , 过量的 s一 F 抖沉 淀 , 2和 e 从而 吸附 Hg S共沉 淀下来 , 以 便 能 比较完全地清除 C 、 、 b 离子 。单一 C 。 u H P。 u 离 子溶 液 可 加 F 粉 回收 C 。 e u 含镉废 液 , 要把 p 值调至 9 H 左右 , 可生成c ( H) dO 沉淀 , 于铅 、 离子废 液处 理通 常用混 凝沉 淀法 中和 对 镉 沉 淀 。可 用 碱 或 石 灰 乳 将 C 3 C 、 b r 、 P 。 生 成 c r ( H)、 b OH)、 d OH) 淀 , 时加 入 F S , O 。P ( C( 沉 同 e O 作 共沉淀剂也可和前 面讲述 的一 样用过 量 N aS和F S 4 e O
Z HON UE J W( CA GX L UE NKAO
热 点分析
等 电 子 原 理 的 应 用 及 考 点 分 析
北京 大 学 南宁 附属 实验 学校 (3 02 刘 长庚 50 2 )
等 电子粒 子 是指 含有 相等数 目电子 的微 粒 。如果 具有相 同的重原子 ( 子序数 不小 于 4 、 有相 同通式 原 )具 和相同价 电子 的微 粒称 之 为等 电子体 。等 电子粒 子 涉 及知识点多 , 考查 学生 的思 维能 力 和学科 综合 能力 , 能 故在近几年高考推断题 中出现 的频率 较 高。然 而 , 电 等 子微粒和 等 电子 体 的种类 及 数 目比较 多 , 生 难 以记 学 忆 。本文尝试总结等 电子原理 内在 的规律 以便 于记忆 , 并结合相应高考题 目进行解析 。 等 电子微粒 许多教辅材料 按微 粒 的类别 对 等 电子 微 粒进行 分 类 。本 文是按某个微粒的 电子数 进行 变换和 重组 , 使重 组前后 的微粒 的电子数相等 来 区分 。近年来 1 O电子微 粒和 1 8电子微 粒是 高考 备受 青睐 的热 点 , 文给 出 如 本
子 ; 于 A 后 所 得 的 物 质 可 电 离 出 C和 D; B E 三 B溶 A、 、 种 微 粒 反 应 后 可得 C和 一种 白 色沉 淀 。请 回答 :
() 只有一个电子 , 前 面的元 素的原 子可 以与 2H Ne 氢原子组合得到 1 0电子微粒 : 、 。 NH 、 H HF H O、 。 C 。
一
如下 : 多个 H HO 变为 H。 , ( 少个 H 变 为 OH ;
N 多个 H 变为 NH 少个 H H。 [, 变为 NH 。
21 . 8电 子 的 微 粒 的 记 忆
( ) 似于 1 1类 O电子微粒 的记 忆方 法 , A 为 中心 以 r 的1 8电子微 粒有 : 2、 l 、 rK C 抖; S C 一 A 、 、 a 利用 氢原 子
