江苏省东台市高中化学 专题一 化学家眼中的物质世界 课时09 常见物质的检验导学案(无答案)苏教版必修1
(完整word版)高中化学必修一专题一教案苏教版
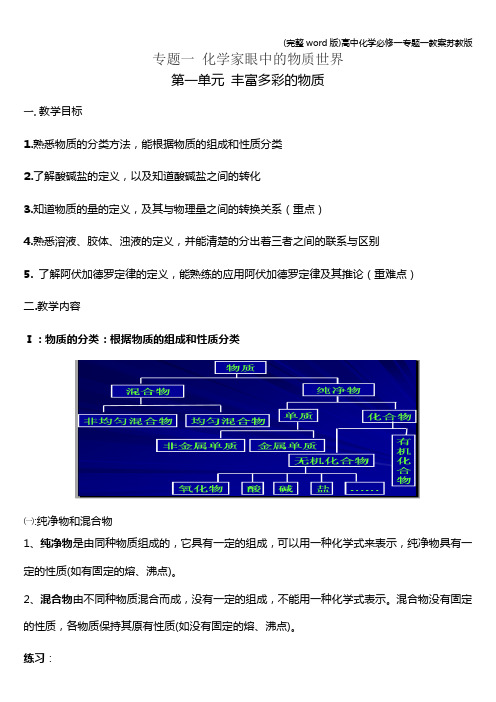
专题一化学家眼中的物质世界第一单元丰富多彩的物质一. 教学目标1.熟悉物质的分类方法,能根据物质的组成和性质分类2.了解酸碱盐的定义,以及知道酸碱盐之间的转化3.知道物质的量的定义,及其与物理量之间的转换关系(重点)4.熟悉溶液、胶体、浊液的定义,并能清楚的分出着三者之间的联系与区别5.了解阿伏加德罗定律的定义,能熟练的应用阿伏加德罗定律及其推论(重难点)二.教学内容Ⅰ:物质的分类:根据物质的组成和性质分类㈠:纯净物和混合物1、纯净物是由同种物质组成的,它具有一定的组成,可以用一种化学式来表示,纯净物具有一定的性质(如有固定的熔、沸点)。
2、混合物由不同种物质混合而成,没有一定的组成,不能用一种化学式表示。
混合物没有固定的性质,各物质保持其原有性质(如没有固定的熔、沸点)。
练习:1、下列物质属于纯净物的是(B)A.洁净的食盐水B.冰水混合物C.净化后的空气D.高锰酸钾完全分解后的剩余物2、某物质经分析知,其中仅含一种元素,此物质(A)A.可能是纯净物也可能是混合物B.可能是单质也可能是化合物C.一定是纯净物D.一定是一种单质㈡:单质和化合物单质:是由一种元素组成的纯净物化合物:是由两种或两种以上的元素组成的纯净物㈢:无机化合物1.氧化物的构成中只含两种元素,其中一种一定为氧元素且显现负价,另一种若为金属元素,则为金属氧化物;若为非金属,则为非金属氧化物。
A.氧化物按照是否与水生成盐,以及生成的盐的类型可分为:酸性氧化物、碱性氧化物、两性氧化物、不成盐氧化物、过氧化物B. 跟碱反应生成盐和水的氧化物,称为酸性氧化物C.跟酸起反应,生成盐和水的氧化物,叫做碱性氧化物练习:1、下列物质按照单质、混合物、氧化物的顺序排列的是(A)A.水银、硬水、水B.石墨、熟石灰、生石灰C .氨气、空气、消石灰D .黄铜、醋酸、干冰2、关于氧化物的下列说法中正确的是( B )A .金属氧化物一定是碱性氧化物B .碱性氧化物一定是金属氧化物C .非金属氧化物一定是酸性氧化物D .酸性氧化物一定是非金属氧化物2. 酸→指电离时产生的阳离子全部都是氢离子的化合物3.碱→指电离时产生的阴离子全部都是氢氧根离子的化合物4. 盐→指电离时生成金属阳离子(或NH 4+)和酸根离子的化合物练习:1、下列各组物质中,按酸、碱、盐、碱性氧化物、酸性氧化物的顺序排列正确的是( B )A 、盐酸、纯碱、氯酸钾、氧化镁、二氧化硅B 、硝酸、烧碱、次氯酸钠、氧化钙、二氧化硫C 、次氯酸、消石灰、硫酸铵、过氧化钠、二氧化碳D 、醋酸、过氧化钠、碱式碳酸铜、氧化铁、一氧化碳2.下列物质分类的正确组合是( D )3.纯净物根据其组碱 酸 盐 酸性氧化物 A纯碱 硝酸 烧碱 二氧化硫 B烧碱 硫酸 食盐 一氧化碳 C苛性钠 醋酸 石灰石 水 D 苛性钾 碳酸 苏打 三氧化硫成和性质可进行如下分类:(1)如图所示的分类方法属于(填序号) BA.交叉分类法B.树状分类法(2)以H、O、S、N、Na五种元素中任意两种或三种元素组成合适的常见物质,分别将其中一种常见物质的化学式填写于下表相应类别中:物质类别酸碱盐氧化物化学式HNO3NaOH Na2SO4SO2(3)从上表酸及碱中各选出一种能相互反应的物质,并写出其反应的化学方程式:HNO3 + NaOH ===NaNO3 + H2OⅡ:化学反应的分类方法酸、碱、盐在溶液中发生得复分解反应,通常有沉淀、气体或水等物质生成。
苏教版高一化学必修一专题一全套教案-【最新整理】
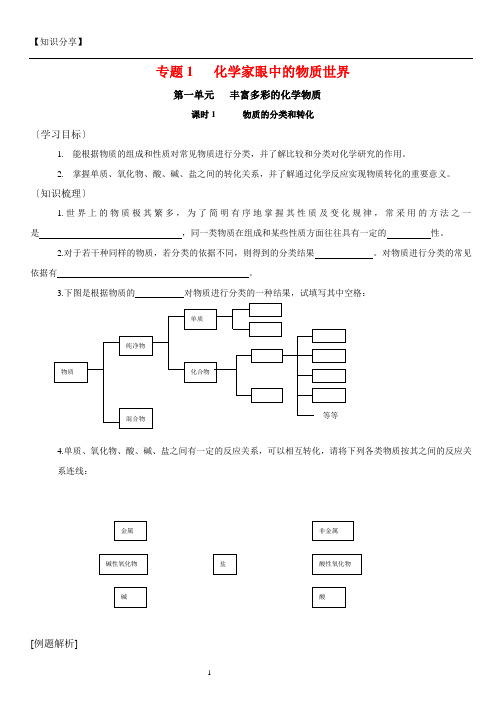
专题1 化学家眼中的物质世界第一单元丰富多彩的化学物质课时1 物质的分类和转化〔学习目标〕1.能根据物质的组成和性质对常见物质进行分类,并了解比较和分类对化学研究的作用。
2.掌握单质、氧化物、酸、碱、盐之间的转化关系,并了解通过化学反应实现物质转化的重要意义。
〔知识梳理〕1.世界上的物质极其繁多,为了简明有序地掌握其性质及变化规律,常采用的方法之一是,同一类物质在组成和某些性质方面往往具有一定的性。
2.对于若干种同样的物质,若分类的依据不同,则得到的分类结果。
对物质进行分类的常见依据有。
3.下图是根据物质的对物质进行分类的一种结果,试填写其中空格:4.单质、氧化物、酸、碱、盐之间有一定的反应关系,可以相互转化,请将下列各类物质按其之间的反应关系连线:[例题解析]例 1.现有下列五种物质:锌粒、硫酸锌、氢氧化锌、氧化锌、硫酸,试关于它们回答下列问题:(1)根据它们组成或性质的不同,把它们分成两大类。
(2)写出它们之间转化的化学方程式。
解析:(1)对所给物质进行分类,首先应根据它们在组成、性质、状态等方面的不同,明确分类的依据,然后再针对不同的依据得出不同的分类结果。
从组成上看,镁条是只含一种元素的纯净物,为单质;另四种物质都是含两种或两种以上元素的纯净物,为化合物。
从状态上看,硫酸为液体,另四种物质为固体。
从性质上看,硫酸镁和硫酸都是易溶物,另三种物质为难溶物,等等(2)单质、氧化物、酸、碱、盐之间有一定的转化规律,可先明确上述物质所属物质类型,再根据此类型物质所具有的性质,写出相应的化学方程式(注意复分解反应发生的条件)。
如:锌属于活泼金属,可与酸(或盐)反应生成相应的盐,据此可写出反应式: Zn + H 2SO 4 == ZnSO 4 + H 2↑ , 依此类推,有:2 Zn + O 2 == 2 ZnO ,Zn(OH)2 + H 2SO 4 == ZnSO 4 + 2H 2O , ZnO + H 2SO 4 == ZnSO 4 + H 2O Zn (O H )2=Z n O +H2O〔基础训练〕1.下列物质中都含有氢元素,按照已学知识判断其中属于酸的是( ) A.NH 3 B.CH 4 C.NaHCO 3 D.HClO 32. 同种类型的物质往往具有某些相同的性质。
高中化学 专题1 化学家眼中的物质世界 第2单元 研究物质的实验方法 第2课时 常见物质的检验 苏教

【思路点拨】 第一步:
【答案】 (1)稀盐酸 气泡 Na2CO3 溶液 Na2CO3+2HCl===2NaCl+H2O +CO2↑ (2)BaCl2 溶液 白色沉淀 Na2SO4 溶液 BaCl2+Na2SO4===BaSO4↓ +2NaCl (3)AgNO3 溶液 白色沉淀 NaCl 溶液 AgNO3+NaCl===AgCl↓+ NaNO3 (4)NaNO3 溶液
(3)无须另选试剂来鉴别一组物质。一般从三个方面考虑: ①利用某些物质的特殊性质(如颜色、气味、溶解性等),首先鉴别出来,然 后再用该试剂去鉴别其他物质。 ②若均无明显外观特征,可考虑能否用加热或焰色反应区别开来。 ③若以上两种方法都不能鉴别时,可考虑两两混合法,记录混合后的反应 现象,分析确定。
(2)在剩余三支试管中分别滴入________,出现________现象的是 ________,化学方程式是_____________________________________________
______________________________________________________________。 (3)再取剩余两支试管对应的溶液,分别滴入________,出现________现象 的是________,化学方程式是_________________________________________ ______________________________________________________________。 (4)三次实验中都没有明显现象的是________________________________。
③“烧”:在外焰上灼烧,观察火焰颜色;观察钾的火焰颜色时,要透过 _蓝__色__钴__玻__璃___。
苏教版化学 必修1 专题1

专题1 化学家眼中的物质世界一、物质的分类(可按组成、状态、性能等来分类)P3 二、物质的转化(反应)类型四种基本反应类型:化合反应,分解反应,置换反应,复分解反应 ☆三、氧化还原反应1.氧化还原反应:有电子转移的反应2. 氧化还原反应 实质:电子发生转移 判断依据:元素化合价发生变化 氧化还原反应中概念及其相互关系如下:失去电子——化合价升高——被氧化(发生氧化反应)——是还原剂(有还原性) 得到电子——化合价降低——被还原(发生还原反应)——是氧化剂(有氧化性) 氧化还原反应中电子转移的表示方法 双线桥法表示电子转移的方向和数目注意:a.“e -”表示电子。
b.双线桥法表示时箭头从反应物指向生成物,箭头起止为同一种元素,应标出“得”与“失”及得失电子的总数。
c .失去电子的反应物是还原剂,得到电子的反应物是氧化剂d .被氧化得到的产物是氧化产物,被还原得到的产物是还原产物氧化性、还原性强弱的判断 ☆四、物质的量1、 物质的量是一个物理量,符号为 n ,单位为摩尔(mol)2、 1 mol 粒子的数目是0.012 kg 12C 中所含的碳原子数目,约为6.02×1023个。
3、 1 mol 粒子的数目又叫阿伏加德罗常数,符号为N A ,单位mol -1。
4、 使用摩尔时,必须指明粒子的种类,可以是分子、原子、离子、电子等。
5.、数学表达式 : AN Nn 摩尔质量1、定义:1mol 任何物质的质量,称为该物质的摩尔质量。
符号:M 表示,常用单位为g/mol2、数学表达式:n = m/M3、数值:当物质的质量以g 为单位时,其在数值上等于该物质的相对原子质量或相对分子质量. 五、物质的聚集状态1、影响物质体积的因素:微粒的数目、微粒的大小和微粒间的距离。
固、液体影响体积因素主要为微粒的数目和微粒的大小;气体主要是微粒的数目和微粒间的距离。
2、气体摩尔体积单位物质的量的气体所占的体积。
高中化学 专题1 化学家眼中的物质世界 第二单元 研究物质的实验方法(第2课时)常见物质的检验课件 苏教版

K12课件
10
重难点一 重难点二
情境导入 知识点拨 典例引领
3.如果某溶液中同时存在 SO42-和Cl-(若不考虑其他阴离子存在
的情况),应如何检验?
探究提示:(1)取少量溶液于试管中,向其中加入过量Ba(NO3)2溶
液。如果有白色沉淀生成,说明溶液中含有 SO42- 。
K12课件
12
重难点一 重难点二
情境导入 知识点拨 典例引领
1.离子的检验,应按照取样、操作、现象、结论的顺序进行描述。 具体应做到:
(1)“先取样,后操作”。如果试样是固体,一般是先配成溶液后再 检验。
(2)“取少量溶液分别加入几支洁净的试管中”进行检验,不得在原 试剂瓶中进Байду номын сангаас检验。
(3)“先现象,后结论”。例如向BaCl2溶液中加入稀硫酸的现象是 “有白色沉淀生成”,不能说成“有白色的BaSO4沉淀生成”。
()
A.先加BaCl2溶液(若有沉淀则滤去),再加AgNO3溶液 B.先加AgNO3溶液(若有沉淀则滤去),再加BaCl2溶液 C.先加Ba(NO3)2溶液(若有沉淀则滤去),再加AgNO3溶液 D.先加AgNO3溶液(若有沉淀则滤去),再加Ba(NO3)2溶液
解析:检验Cl-可以用AgNO3溶液,检验 SO42-可以用Ba(NO3)2溶液,
若先加AgNO3溶液,则能够产生AgCl和Ag2SO4两种白色沉淀;若先 加Ba(NO3)2溶液,则只能产生BaSO4一种白色沉淀,所以应该先加 Ba(NO3)2溶液,后加AgNO3溶液。
答案:C
K12课件
6
自主阅读 自主检测
2.某物质灼烧时,焰色反应为黄色,下列判断中正确的是( ) A.该物质一定是钠的化合物 B.该物质一定含钠元素 C.能确定该物质中是否含钾元素 D.该物质一定是金属钠 解析:焰色反应是元素的性质,故选择B。钠的黄色焰色可掩盖钾 的焰色,故无法确定是否含有钾元素,C错。 答案:B
高一化学苏教版必修1(浙江专用)课件:专题1 化学家眼

实验现象
加入 BaCl2 溶液后 生成白色沉淀,沉淀 溶于稀盐酸,并放出 无色、无味气体
化学方程式(举一例) (1)BaCl2+Na2CO3
BaCO3↓+2NaCl
(2)BaCO3+2HCl BaCl2 +CO2↑+H2O
SO42-
BaCl2 溶 液、稀盐
酸
取少许溶液于试 管中,向其中加 入稀盐酸,再加 入 BaCl2 溶液
(2)检验 SO42-:向第二支试管中滴入几滴用盐酸酸化的 BaCl2 溶液。有 白色沉淀生成,说明成分中含有 SO42-。
如果被检验的物质可溶于水,一般要先配成溶液。另外,进行
检验的文字说明时,要按照实验操作→实验现象→实验结论的顺序来记录。
探究点一 探究点二
探究点二 离子存在的综合推断 1.从颜色推断。溶液如果是无色,则一定不存在有颜色的离子,如 Cu2+(蓝色)、MnO4- (紫色)等。 2.有阳必有阴。如题给信息规定的几种离子中,当推断出几种阳离子能 大量存在,那么该溶液中至少存在一种能大量存在的阴离子;同理,当推断溶 液中一定存在几种阴离子时,那么该溶液中至少存在一种能大量存在的阳 离子。 3.阴、阳离子必须能大量共存。某种离子如一定大量存在,则与之反应 的离子则一定不能大量存在。 4.电解质溶液中离子电荷守恒。即阳离子所带的正电荷之和等于阴离 子所带的负电荷之和。
探究点一 探究点二
【例题 2】某溶液中可能含有下列 6 种离子中的某几种:Cl-、SO42-、CO32-、 NH4+、Na+、K+。为确认溶液组成进行如下实验:
【精编】高中化学专题1化学家眼中的物质世界第二单元研究物质的实验方法第2课时常见物质的检验课件苏教版必
解而不是单质或化合物的性质,与存在状态 无关。 (2)焰色反应可以用于鉴别物质,这种鉴别物质的方法属于物理方法,而 不是化学方法。
例4 有5瓶白色固体试剂,分别是氯化钡、氢氧化钠、硫酸钠、硫酸铵、 无水硫酸铜。现只提供蒸馏水,通过下面的实验步骤即可鉴别它们。请 填写下列空白: (1)取适量固体试剂,分别加入5支试管中,加入适量蒸馏水,振荡试管, 观察到的现象是_5_种__固__体__全__部__溶__解__,__4_支__试__管__中__得__到__无__色__溶__液__,__1_支__试__管___ _中__得__到__蓝__色__溶__液__,被检出的化学物质是_C_u_S_O__4_(或__硫__酸__铜__)_。
12345 6
解析 答案
2.检验实验室存放的蒸馏水中是否含有氯离子,可选用的试剂是 A.硝酸银溶液 B.稀盐酸酸化的硝酸银溶液
√C.稀硝酸酸化的硝酸银溶液
D.稀硫酸酸化的硝酸银溶液
解析 检验氯离子的试剂是硝酸酸化的硝酸银溶液,硝酸酸化的目的是 排除碳酸根等离子的干扰。
12345 6
解析 答案
3.下列溶液中离子检验的结论正确的是
一定含有Ba2+
12345 6
解析 答案
4.为证明某晶体中含 NH+ 4 、K+、SO24-和H2O,下列实验叙述中不正确的是 A.取少量晶体放入试管中,加热,若试管口上蘸有少量无水硫酸铜粉末的
脱脂棉变蓝,则可证明晶体中含有结晶水
√B.取少量晶体溶于水,加入少量NaOH溶液,加热,在试管口用湿润的蓝
_2_A_g_N__O_3_+__H_2_O_+__C__O_2_↑_。
12345 6
解析 答案
制作不易 尽请参考
色石蕊试纸检验,若变红,则可证明晶体的成分中含有NH+ 4 C.取少量晶体溶于水,加适量稀盐酸,无现象,再滴入几滴BaCl2溶液,有
高中化学专题1化学家眼中的物质世界第二单元研究物质的实验方法第2课时常见物质的检验课件苏教版必修1
反应方程式: 如 Na2SO4+BaCl2===
□07 BaSO4↓+2NaCl
。
【注意】 加酸酸化是为了排除其他沉淀的干扰。如 BaCO3、BaSO3 等
均为白色沉淀。
(4)CO32-
检验试剂:盐酸、澄清石灰水。
实验现象:
□08 产生无色无味气体(CO2),
通入澄清的石灰水后,石灰水变浑浊
。Байду номын сангаас
反应方程式:
提示
23
教师点拨区
一、物质检验的分类 1.鉴别:根据不同物质具有不同的特性,用物理或化学方法将两种或两 种以上的已知物质一一区别开来。在给出物质中根据外观、气味、溶解性或 加入某些试剂后产生的不同现象一一区别,也可以先分成若干组,再将每组 内的物质加以区别。 2.鉴定:常指对于一些物质的定性检验。根据物质的某种特性,用实验 的方法来确定它是否是某种物质。 3.推断:根据已给出的检验步骤和现象,结合物质的特性进行分析、推 断,判断所检验的物质是哪种或哪几种,推理出其组成或名称。 以上均需要根据物质的特征反应,选择恰当的试剂和方法,通过特殊的 实验现象来判定,必要时要写化学方程式。
特别提醒 1答题中要有“各取少许”的字样。,答题不能先说出未知物的名称,如 “取某试剂加入到某某物质中”。应该叙述为“若产生……现象,则证明 有……物质”。一般叙述方式为:各取少许―→溶解―→加入某试剂―→必 要的操作―→描述现象―→得出结论。
2若几种溶液中含有不同的阴离子,一般用强酸,根据生成物的颜色、 状态、气味等加以鉴别。如 Na2CO3 和 Na2SO4 以及 Na2SiO3 的鉴别选用盐酸 即可。,若几种溶液中含有不同的阳离子,一般用强碱溶液进行鉴别。如 NH42SO4、MgSO4、Na2SO4 的鉴别选用 NaOH 溶液即可。
苏教版高中化学必修一课件专题一常见物质的检验
•
检验Cl-时稀硝酸的作用?能用其 他酸代替稀硝酸吗?
•
3、SO42-的检验 原理:
(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl K2SO4+BaCl2=BaSO4↓+2KCl
需要用什么试剂? 试剂的加入顺序怎样? 排除哪些离子的干扰?
•
检验SO42-时稀盐酸的作用?能用其 他酸代替稀盐酸吗?
2、Cl-与AgNO3溶液、稀HNO3搭档
3、SO42-与稀盐酸、BaCl2溶液搭档 4、Na+、K+与铂丝(铁丝)、稀盐酸搭档
蓝色钴玻璃
•
活动与探究: 现有NH4Cl、(NH4)2SO4、KCl、K2SO4四种盐对
应的无色溶液。请设计最简单的实验方案进行一 一鉴别。
书面作业: 常见物质的检验学案 【课后作业】
黄色
紫色
砖红色 洋红色
•
黄绿色
绿色Leabharlann 紫红色P22化学物质组成的现代分析方法
仪器分析法:
用元素分析仪测定物质中是否含C、H、O、 N、S等元素
用红外光谱仪来确定物质中是否含有某些 有机基团 用原子吸收光谱确定物质中含有哪些金 属元素
•
课堂总结
本节课的四组“黄金搭档”
1、NH4+与可溶性强碱、湿润的红色石蕊试纸(pH试纸)搭档
信息提示
SO32-能被硝酸氧化成SO42-
Ba(NO3)2也为可溶性的钡盐,能 用它来代替BaCl2进行检验吗?
•
+ K 怎么检验?
•
•
冷焰火就是采用燃点较
低的金属粉末,经过一定 比例加工而成的冷光无烟 焰火。冷焰火燃点低,外 部温度30℃-50℃,对人体 无伤害,适用于舞台造型 设计。
高一化学上学期常见物质的检验江苏教育版PPT课件
灼烧至无色。
除
3、观察钾的焰色时要透过蓝色钴玻 杂
璃观察火焰颜色。
记忆:钾紫、钠黄(指甲蜡黄)
归纳:三、 仪器分析法:
用元素分析仪测定:物质中是否含C、H、O、 N、S等元素
用红外光谱仪来确定:物质中是否含有某些有 机基团
用原子吸收光谱确定:物质中是否含有哪些金 属元素
小结:
分 离 的 方 法
白色沉淀,再加稀盐酸沉淀不溶解,能说明未知 溶液中一定有硫酸根离子吗?
3、在检验硫酸根离子时为什么要加盐酸酸化?
思考:
现有一溶液中已知有铵根离子,氯离子, 硫酸根离子存在,请思考: (1)能否用氯化钡来检验硫酸根离子?
为什么?如不能,则可改用什么试剂? (2)你认为依次沉淀三种离子的顺序是什么?
课堂反馈
整体概况
+ 概况1
您的内容打在这里,或者通过复制您的文本后。
概况2
+ 您的内容打在这里,或者通过复制您的文本后。
概况3
+ 您的内ห้องสมุดไป่ตู้打在这里,或者通过复制您的文本后。
2
常见物质的检验
依据物质的特殊性质和特征反应,选择适当的 试剂和方法,准确观察反应中的明显现象,如 颜色的变化、沉淀的生成和溶解、气体的产生 和气味、火焰的颜色等,进行判断。
归纳:一、离子特征反应检验法
待检物质 检验方法
现象
结论
NH4+ 加浓的氢氧化钠、加热, 试纸变蓝。 (铵盐) 用湿润的红色石蕊试纸放
在 试管口
含有 NH4+。
Cl- (盐 滴加AgNO3,再加稀 生成白色沉 有Cl-
酸盐) 硝酸
淀、不溶解。
SO42(硫酸 盐)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见物质的检验
一.本节课的学习目标
1、学会Cl-、SO42-、CO32-、NH4+等离子的检验;
2、能用焰色反应、离子检验法设计简单的实验方案探究某些常见物质的组成成分;
3、了解一些现代化学的分析方法。
二、自学检测
一、常见离子的检验
1.NH4+的检验:取样品于试管中,加入NaOH溶液后加热,在试管口放一张润湿的红色石蕊试纸,若试纸变蓝,则证明样品中含有铵根离子
2.Cl-的检验:加稀硝酸,和硝酸银溶液,有白色沉底
3.SO42-的检验:先加入过量的HCl,如果待测液无白色沉淀(如果有白色沉淀说明有Ag+), 再加BaCl有白色沉淀产生,则有SO42-离子.
4.CO32-的检验:加入氯化钙(或硝酸钡,硝酸钙,氯化钡)溶液产生白色沉淀(排除HCO3-),再加入盐酸产生无色无味气体(排除SO32-),沉淀溶解,再将产生气体通入澄清石灰水,变混浊(通入过量混浊消失),则证明有CO32-
二、焰色反应
1.原理:金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这叫焰色反应。
叫做焰色反应。
它是一个物理变化。
利用特征焰色可以检验金属或金属离子的存在。
2.操作步骤:⑴烧⑵蘸
⑶烧⑷看
三、合作探究
【实验探究1】NH4Cl、(NH4)2SO4、KCl和K2SO4均可用作化肥。
下列实验将帮助我们探究这几种盐中所含离子的检验方法。
实验1:取两支试管,分别加入2mLNH4Cl和(NH4)2SO4溶液,再各加入2mLNaOH溶液,加热试管,将湿润的红色石蕊试纸靠近试管口,闻气味及观察试纸颜色的变化。
实验现象:
反应方程式:
实验2:取两支试管,分别加入2mLNH4Cl和KCl溶液,各滴几滴稀HNO3,再各滴几滴AgNO3。
现象:
反应方程式:
思考:加入稀硝酸的作用是什么?答:
实验3:取两支试管,分别加入2mL(NH4)2SO4和K2SO4溶液,各滴几滴稀HCl,再各滴几滴BaCl2。
现象:
反应方程式:
思考:稀HCl的作用是什么?答:
2*.某无色透明溶液只可能含有K+,Cu2+,Ca2+,SO42-,CO32-,Cl-中的几种,现进行如下实验:(1)滴加BaCl2溶液,有白色沉淀产生,将沉淀滤出。
(2)上述沉淀有一部分溶于稀HNO3。
(3)向滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀HNO3。
据此判断,该溶液中肯定有,肯定没有,可能有(填离子符号)
3.能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四瓶无色溶液加以区别的一种试剂是 ( ) (必要时可以加热)
A.BaCl2 B.NaOH C.Ba(OH)2 D.AgNO3
4.对某些离子检验及结论正确的是()A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
四.检测清盘
1.常用于检验酒精中是否含水的试剂是 ( ) A.生石灰 B.金属钠 C.硫酸铜晶体 D.无水硫酸铜
2.试管中盛有少量白色固体,可能是铵盐,检验的方法是 ( ) A.加水,将湿润的红色石蕊试纸放在试管口
B.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
C.加氢氧化钠溶液,加热,滴入酚酞试剂
D.加氢氧化钠溶液,加热,滴入紫色石蕊试剂
3.有四瓶常用溶液: ①BaCl2溶液②NaCl溶液③Na2SO4溶液④CuSO4溶液。
不用其他试剂,可通过实验方法将它们一一鉴别出来,鉴别出来的先后顺序可能是
A.①④③② B.①③④② C.④①③② D.④①②③
4.科学的实验方法为我们探索物质的世界提供了一把金钥匙。
下列实验错误的是
A.用一根洁净的铂丝蘸取碳酸钠溶液,置于酒精灯火焰上灼烧可以检验Na+
B.因碘易溶于酒精,所以常用酒精萃取碘水中的碘
C.用洁净的玻璃棒蘸取溶液滴在pH试纸上,跟标准比色卡对照可测定溶液的pH值
D.用蒸馏的方法可以分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物
5.某同学证明NaOH溶液能使酚酞变红是OH-的性质,他设计的下列实验中没有意义
....的是
A.取KOH、Ba(OH)2、Ca(OH)2溶液分别与酚酞试液作用,观察溶液颜色
B.取NaCl溶液与酚酞试液作用,观察溶液颜色
C.测定NaOH的溶解度,证明其易溶于水,并观察溶液的颜色
D.向滴有酚酞的NaOH溶液中加入盐酸,观察溶液的颜色
6.下列说法中正确的是 ( ) A.某溶液与NaOH溶液共热.产生能使湿润的红色石蕊试纸变蓝的气体,说明原溶液中存
在NH4+
B.某溶液中加入盐酸后有无色气体产生,该气体能够使澄清的石灰水变浑浊,则原溶液
中含CO32-
C.用铂丝蘸取某溶液在酒精灯的火焰上灼烧时.火焰呈黄色,说明原溶液中只含有Na+,
不含有K+
D.某溶液中加入BaCl2溶液时,产生白色沉淀,加稀硝酸沉淀不溶解,说明原溶液中存在SO42-
7. 离子检验的常用方法有三种( )
下列离子检验的方法不合理的是
A.NH4+—气体法 B.Fe3+—气体法C.Cl-—沉淀法D.OH-—显色法
8.只用一种试剂,可区别Na2SO4、FeCl3、NH4Cl、MgSO4四种溶液,这种试剂是 ( ) A.HCl B. BaCl2 C . AgNO3 D.NaOH
五课后练习
1.焰色反应是元素的一种(填“物理”或“化学”)性质,不是所有元素都有
特征的焰色反应。
如:、等金属无焰色。
钠及其化合物的焰色呈_____
色,钾及其化合物的焰色呈_____色,且必须透过 进行观察。
焰色反应实验结
束,要用 洗净铂丝,并在火焰上灼烧到 时,才能蘸取其他溶液。
2有一瓶溶液只含Cl -、CO 32-、SO 42-、Na +、NH 4+、K +、Mg 2+
七种离子中的某几种。
经实验: ⑴ 原溶液 −−−−→−NaOH 过量 白色沉淀 ⑵将(1)所得溶液 放出使紫色石蕊试液变蓝的气体
⑶ 原溶液中加BaCl 2溶液不产生沉淀
⑷原溶液中加AgNO 3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解
回答下列问题:
(1)原溶液中一定含有的离子是 ,一定不含的离子是 ,可能含有的离子是
(2)有同学认为实验(4)可以省略,你认为呢?(填“可以”或“不可以”)
说明理由
(3)可能含有的离子如何加以确定? (不需要写操作过程)
六 自我总结
我的收获。
