高一化学必修1氧化还原反应最终讲课稿ppt
合集下载
人教版高中化学必修1第三节氧化还原反应.(共9张PPT)ppt

氧化还 原反应
复分解 反应
(7) NaOH + HCl = NaCl + H2O
二、氧化还原反应与四种基本类型 反应的关系:
化 学 非 氧 化 还 原 反 应 氧化 还原 反 应 置反换反应应 复分解反 应
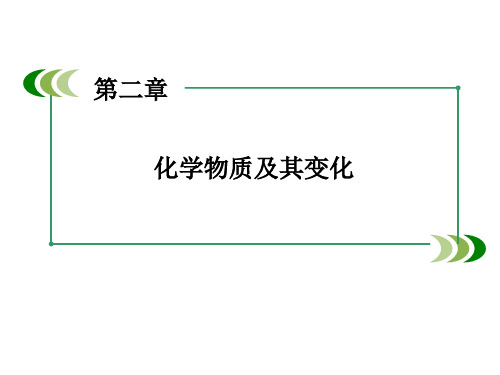
表格
基本反应类 型
反应实例
点燃
化合反应 3Fe+2O2 = Fe3O4 CaO+H2O = Ca(OH)2
分解反应 2H2O 电=解2H2↑+O2↑ CaCO3 =∆ CaO+CO2 ↑
Fe+CuSO4=FeSO4+Cu 置换反应 Zn+H2SO4=ZnSO4+H2 ↑
NaCl+AgNO3=AgCl↓+NaNO3 复分解反应 BaCl2+H2SO4=BaSO4↓+HCl
是否氧 化还原
反应
是
不是
是 不是
关系
20、不要相信普通的东西是有价值的。您必须为生活中的所有事物而奋斗。如果今天和昨天没有什么不同,那就快点改变自己。
化合价升高,失去电子,被氧化
0 0 点燃 +3 -2 (1)4Al + 3O2 == 2Al2O3
化合价降低,得到电子、被还原
O2 是氧化剂 Al是还原剂
Al2O3既是 氧化产物又
升 失 氧 还 降 得 还 氧 是还原产物
化合价升高,失去电子、被氧化
-1
(2)2H2O2
=M=nO=2
-2
2H2O
+
0
部分是 部分不 是
同上
是 都是
是
不是
都 不
不是 是
三、氧化还原反应的一般规律 电子得失(或
氧化还原反应ppt课件

人教版2019必修第一册
第一章 物质及其变化
第三节 氧化还原反应
课时1 氧化还原反应
教学目标与重难点
【教学目标】 1、能够从化合价升降 和电子转移的角度认 识氧化还原反应。 2、理解氧化还原的本 质是电子的转移(得 失或偏移)
【重点】 1、氧化还原反应的特征,即 化合价的升降和电子的转移。
【难点】 1、从微观角度理解氧化还原 反应的本质,即电子的转移 (得失或偏移)。
2Na+Cl2
====
+1 -1
2NaCl
氧化反应、化合价升高— —实质是原子失去电子
Cl
Cl-
氧化还原反应
3.从电子转移的角度——微观本质 思考?到底是什么引起了化合价变化?
②共用电子对的偏移
H 各拿出一个 电子共用 HCl
Cl
0
0 点燃 +1 -1
H2 + Cl2 ==== 2HCl
①得失电子
得到氧,氧化反应 化合价升高
+3
+2
0 +4
氧化还原反应的特征: 有元素化合价的升降
+2 +2
得到氧,氧化反应 化合价升高
0 +4
失去氧,还原反应 化合价降低
失去氧,还原反应 化合价降低
所含元素化合价升高的物质发生的反应为氧化反应 所含元素化合价降低的物质发生的反应为还原反应
氧化还原反应
【练习】判断下列反应是否属于氧化还原反应? (1)Fe + CuSO4 ==== FeSO4 + Cu 是 (2)Zn + 2HCl ====ZnCl2 + H2↑ 是 (3)2H2O2 ==== 2H2O + O2↑ 是 (4)NaOH + HCl ==== NaCl + H2O 否 (5)NaHCO3+HCl= NaCl+CO2↑+H2O 否 (6)CaCO3 == CaO+CO2↑ 否
第一章 物质及其变化
第三节 氧化还原反应
课时1 氧化还原反应
教学目标与重难点
【教学目标】 1、能够从化合价升降 和电子转移的角度认 识氧化还原反应。 2、理解氧化还原的本 质是电子的转移(得 失或偏移)
【重点】 1、氧化还原反应的特征,即 化合价的升降和电子的转移。
【难点】 1、从微观角度理解氧化还原 反应的本质,即电子的转移 (得失或偏移)。
2Na+Cl2
====
+1 -1
2NaCl
氧化反应、化合价升高— —实质是原子失去电子
Cl
Cl-
氧化还原反应
3.从电子转移的角度——微观本质 思考?到底是什么引起了化合价变化?
②共用电子对的偏移
H 各拿出一个 电子共用 HCl
Cl
0
0 点燃 +1 -1
H2 + Cl2 ==== 2HCl
①得失电子
得到氧,氧化反应 化合价升高
+3
+2
0 +4
氧化还原反应的特征: 有元素化合价的升降
+2 +2
得到氧,氧化反应 化合价升高
0 +4
失去氧,还原反应 化合价降低
失去氧,还原反应 化合价降低
所含元素化合价升高的物质发生的反应为氧化反应 所含元素化合价降低的物质发生的反应为还原反应
氧化还原反应
【练习】判断下列反应是否属于氧化还原反应? (1)Fe + CuSO4 ==== FeSO4 + Cu 是 (2)Zn + 2HCl ====ZnCl2 + H2↑ 是 (3)2H2O2 ==== 2H2O + O2↑ 是 (4)NaOH + HCl ==== NaCl + H2O 否 (5)NaHCO3+HCl= NaCl+CO2↑+H2O 否 (6)CaCO3 == CaO+CO2↑ 否
高一化学氧化还原反应精品PPT课件

练习 2.0.3molCu2S与足量的硝酸反应,生成硝酸铜、 巩固 硫酸、一氧化氮和水,则参加反应的硝酸中
被还原的硝酸的物质的量为( B)
A.0.9mol B.1mol C.1.2mol D.2.2mol
根据得失电子守恒,失电子总数 巧解 =0.3×(2+8)=3 mol,故硝酸被
还原成NO共 1 mol。
继续 未被还原的硝酸的物质的量呢?
分析:未被还原的硝酸以Cu(NO3)2形 式存在,共有0.6molCu,故未被还原 的硝酸有0.6×2=1.2mol
氧化性、还原性强弱比较
根据金属性、非金属性强弱来判断
【应用】电解池反应中阴极的放电顺序 如何排列?
K+、 … Al3+(H+) …Zn2+ …H+、Cu2+
从浓醋酸、氨水、纯碱、稀盐酸、KI-淀粉溶液中选 择适当的物质做试剂,用两种简单的化学实验鉴别亚硝
酸钠和氯化钠。试写出两种实验方法使用的试剂和据以
鉴别它们的现象。(其中方法一只能用一种试剂)
参考答案
方法一:(只用一种试剂) 试剂:浓醋酸(或微热的稀盐酸) 现象:放亚硝酸钠的试管上部出现红 棕色有刺激性气味的气体,放氯化钠 的试管无明显变化。 方法二: 试剂:稀盐酸、KI-淀粉溶液 现象:放亚硝酸钠的试管溶液变蓝色, 放氯化钠的试管无明显变化。
综合 2.根据上述实验,试写出少量氯
应用
水和足量氯水分别与FeBr2溶液反 应的离子方程式。
☆① Cl2 + 2Fe2+ = 2Cl- + 2Fe3+
② 2Fe2++42Br-+32Cl2 = 2Fe3++B2rBr2+2+46Cl-?
氧化还原反应 高中化学必修一教学课件PPT 人教版
提示:氧化反应,如: 2H2+O2=点==燃==2H2O;3Fe+2O2=点==燃==Fe3O4。 还原反应,如: H2+CuO==△===Cu+H2O;CO+CuO==△===Cu+CO2。 这种分类标准是得氧为氧化反应,失氧为还原反应。
3.氧化反应和还原反应为什么一定是同时发生的?
提示:在氧化反应和还原反应中,一种物质得氧必有另一种物质失氧,而且它们共同存在于 一个反应中,所以氧化反应中有还原反应,还原反应中也有氧化反应,只是从不同角度来 称呼。故它们是同时发生的,并不是分别独立进行的。
的反应
氧化还原反 有元素化合价升降
应
的化学反应
3.从电子转移角度分析氧化还原反应 化合价的升降与电子转移关系密切,电子转移也是判断氧化还原反应的标准。 (1)氯化钠的形成
氯化钠形成示意图
化合价变化分析
结论
有电子得失 的反应称为 氧化还原反 应
(2)氯化氢的形成
H原子最外层有1个电子,可获得1个电子而形成2个电子的稳定结构,Cl原子最外层有7个电 子,可获得1个电子而形成8个电子的稳定结构。由于两种元素的原子获得电子的能力相差 不大,所以两者发生反应时,双方各以最外层的1个电子组成一个共用电子对,使双方最 外电子层都达到稳定结构,由于Cl原子得电子能力更强一些,因此电子对偏向Cl原子而偏 离H原子,Cl原子显负价,H元素显正价,形成过程为:
(3)电子得失反(偏应移类)与型氧化还原反应的关系
定义
氧化反应
物质中有元素的原子失去电子(或共用电子 对偏离)的反应
还原反应
物质中有元素的原子得到电子(或共用电子 对偏向)的反应
温馨提示氧:化氧化还反原应反或还应原反应能否单独有发生电?子转移(得失或偏移)的反应
3.氧化反应和还原反应为什么一定是同时发生的?
提示:在氧化反应和还原反应中,一种物质得氧必有另一种物质失氧,而且它们共同存在于 一个反应中,所以氧化反应中有还原反应,还原反应中也有氧化反应,只是从不同角度来 称呼。故它们是同时发生的,并不是分别独立进行的。
的反应
氧化还原反 有元素化合价升降
应
的化学反应
3.从电子转移角度分析氧化还原反应 化合价的升降与电子转移关系密切,电子转移也是判断氧化还原反应的标准。 (1)氯化钠的形成
氯化钠形成示意图
化合价变化分析
结论
有电子得失 的反应称为 氧化还原反 应
(2)氯化氢的形成
H原子最外层有1个电子,可获得1个电子而形成2个电子的稳定结构,Cl原子最外层有7个电 子,可获得1个电子而形成8个电子的稳定结构。由于两种元素的原子获得电子的能力相差 不大,所以两者发生反应时,双方各以最外层的1个电子组成一个共用电子对,使双方最 外电子层都达到稳定结构,由于Cl原子得电子能力更强一些,因此电子对偏向Cl原子而偏 离H原子,Cl原子显负价,H元素显正价,形成过程为:
(3)电子得失反(偏应移类)与型氧化还原反应的关系
定义
氧化反应
物质中有元素的原子失去电子(或共用电子 对偏离)的反应
还原反应
物质中有元素的原子得到电子(或共用电子 对偏向)的反应
温馨提示氧:化氧化还反原应反或还应原反应能否单独有发生电?子转移(得失或偏移)的反应
氧化还原反应ppt课件

化合价降低,得电子,被还原
化合价升高,失电子,被氧化
三、四个基本反应类型与氧化还原反应的关系
1、化合反应:
A + B = AB
2、分解反应:
3、置换反应:
4、复分解反应:
AB = A + B
A + BC = B + AC
思考:有单质参加或生成的反应一定是置换反应吗?
AB + CD = AD + CB
C
B D
自我检测
5、下列哪个反应表示二氧化硫被还原( )A、SO2+2H2O+Cl2 = H2SO4+2HCl B、SO2+2H2S = 2H2O+3S↓C、SO2+2NaOH = Na2SO3+H2O D、SO2+Na2CO3 = Na2SO3+CO2↑
B
自我检测
氧化还原反应 第一课时
一、从不同角度认识氧化还原反应
1、从得氧失氧的角度认识氧化还原反应
得到氧原子,发生氧化反应
失去氧原子,发生还原反应
H2 + CuO = Cu + H2O
化合价升高
化合价降低
氧化反应
还原反应
0 +1
失去电子
发生氧化反应
元素化合价降低
得到电子
发生还原反应
口诀:
升、失、氧
降、得、还
二、关于氧化还原反应的几个重要概念
1、氧化剂:
2、还原剂:
反应物中元素化合价降低的物质
(被还原的物质)
(主要从升失氧、降得还入手分析)
氧化性:
(氧化剂具有氧化性)
物质得到电子的性质
√
化合价升高,失电子,被氧化
三、四个基本反应类型与氧化还原反应的关系
1、化合反应:
A + B = AB
2、分解反应:
3、置换反应:
4、复分解反应:
AB = A + B
A + BC = B + AC
思考:有单质参加或生成的反应一定是置换反应吗?
AB + CD = AD + CB
C
B D
自我检测
5、下列哪个反应表示二氧化硫被还原( )A、SO2+2H2O+Cl2 = H2SO4+2HCl B、SO2+2H2S = 2H2O+3S↓C、SO2+2NaOH = Na2SO3+H2O D、SO2+Na2CO3 = Na2SO3+CO2↑
B
自我检测
氧化还原反应 第一课时
一、从不同角度认识氧化还原反应
1、从得氧失氧的角度认识氧化还原反应
得到氧原子,发生氧化反应
失去氧原子,发生还原反应
H2 + CuO = Cu + H2O
化合价升高
化合价降低
氧化反应
还原反应
0 +1
失去电子
发生氧化反应
元素化合价降低
得到电子
发生还原反应
口诀:
升、失、氧
降、得、还
二、关于氧化还原反应的几个重要概念
1、氧化剂:
2、还原剂:
反应物中元素化合价降低的物质
(被还原的物质)
(主要从升失氧、降得还入手分析)
氧化性:
(氧化剂具有氧化性)
物质得到电子的性质
√
人教版化学必修一氧化还原反应ppt33张课件
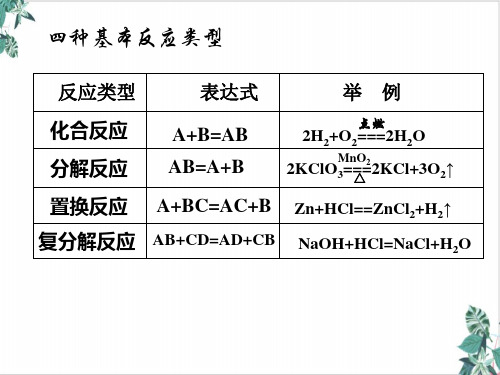
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
高一化学必修1-氧化还原反应PPT课件
在氧化还原反应中,一种元素被氧化,则一定有另一种元素被还原。
反应中不一定所有元素的化合价都变化。
练习2:下列说法正确的是( )
判断方法为:(记住四句话)
高失氧,低得还,若说”剂” ,两相反 ;
还原剂本身被氧化,氧化剂本身被还原。
还原剂被氧化后的生成物是氧化产物(即化合价升高后的产物);
氧化剂被还原后的生成物是还原产物(即化合价降低后的产物)。
2Na + Cl2 == 2NaCl
金属钠能和氯气反应:
0
-1
+1
失去电子,化合价升高, 被氧化
3、转化律----只适用于一种元素发生化合价改变的反应
练习:用双线桥标出下列氧化还原反应的电子转移方向和数目。
1
KClO3 + 6HCl = KCl + 3Cl2↑ + 3H2O
2
H2S + H2SO4 = S + SO2↑ + 2H2O
3
2Na2O2+2H2O=4NaOH+O2↑
4
练习1、在2FeS+6H2SO4(浓)→Fe2(SO4)3+3SO2 +2S+6H2O的反应中: (1)氧化剂是 ,(2)还原剂是 。 (3)氧化产物是___________, (4)还原产物是___________, (5)被氧化的元素是_______, ( 6)被还原的元素是_________, (7)氧化过程是___________, (8) 还原过程是__________。
4. 氧化还原反应的表示: (氧化还原反应、 化合价升降、电子转移和总数)
① Fe2O3 + 3CO 2Fe + 3CO2 ②Zn + 2HCl == ZnCl2 + H2 ↑ ③SO2 + 2H2S == 2H2O + 3S ④2KClO3 2KCl+3O2↑ ⑤3Cl2 + 8NH3 == 6NH4Cl + N2 ⑥MnO2+4HCl浓 MnCl2+Cl2↑+2H2O
《氧化还原反应概念》高一必修一PPT课件(第2.3.1课时)
化
学
反
应
有无化合价变化
化合反应 分解反应 置换反应 复分解反应
氧化还原反应 非氧化还原反应
人教版高中化学必修一精品课件
精品系列课程
你认为以下说法正确吗? 举例说明
1.置换反应全部属于氧化还原反应。 2. 复分解反应全部属于非氧化还原反应。 3. 有单质参加的化合反应都是氧化还原反应 4 .有单质生成的分解反应都是氧化还原反应
高温 C + 2CuO ═ CO2↑ + 2Cu CuO + H2 = 2Cu + H2O
△ 上述几个氧化还原反应除了有氧得失之外还有什么共同点?
各种元素的化合价在反应前后有无变化? 你认为氧化反应、还原反应与元素化合价的升降有什么关系?
人教版高中化学必修一精品课件
精品系列课程
得到氧,化合价升高, 氧化反应 ,被氧化
精品系列课程
电子转移
Na+ Cl-
人教版高中化学必修一精品课件
精品系列课程
●●
Cl
● ●
●
还
●● 得
原
到
反 应
一 个 电
子 ●●
Cl-
● ●
● ●
●●
●
Na
失
去
氧
一
化
个
反
电
应
子
Na+
人教版高中化学必修一精品课件
精品系列课程
【思考与交流5】
通过对氯气与金属钠反应分析,请预测氯气还能与哪些物质反应? 反应中氯气将如何变化? 为什么氯气能发生这些反应?请从微观的角度进行解释。 请以氯气与氢气反应生成氯化氢为例进行说明
淡黄色
点燃或加热
人教版高中化学必修一精品课件
学
反
应
有无化合价变化
化合反应 分解反应 置换反应 复分解反应
氧化还原反应 非氧化还原反应
人教版高中化学必修一精品课件
精品系列课程
你认为以下说法正确吗? 举例说明
1.置换反应全部属于氧化还原反应。 2. 复分解反应全部属于非氧化还原反应。 3. 有单质参加的化合反应都是氧化还原反应 4 .有单质生成的分解反应都是氧化还原反应
高温 C + 2CuO ═ CO2↑ + 2Cu CuO + H2 = 2Cu + H2O
△ 上述几个氧化还原反应除了有氧得失之外还有什么共同点?
各种元素的化合价在反应前后有无变化? 你认为氧化反应、还原反应与元素化合价的升降有什么关系?
人教版高中化学必修一精品课件
精品系列课程
得到氧,化合价升高, 氧化反应 ,被氧化
精品系列课程
电子转移
Na+ Cl-
人教版高中化学必修一精品课件
精品系列课程
●●
Cl
● ●
●
还
●● 得
原
到
反 应
一 个 电
子 ●●
Cl-
● ●
● ●
●●
●
Na
失
去
氧
一
化
个
反
电
应
子
Na+
人教版高中化学必修一精品课件
精品系列课程
【思考与交流5】
通过对氯气与金属钠反应分析,请预测氯气还能与哪些物质反应? 反应中氯气将如何变化? 为什么氯气能发生这些反应?请从微观的角度进行解释。 请以氯气与氢气反应生成氯化氢为例进行说明
淡黄色
点燃或加热
人教版高中化学必修一精品课件
人教化学必修1氧化还原反应PPT(38页)
3 氧化还原反应
§2.3 氧化还原反应
(第1课时)
1.了解氧化还原反应的特征。 2.了解氧化还原反应的实质。(重点) 3.了解氧化还原反应与四种基本类型的关系。 4.学会电子转移的表示方法----双线桥表示法。
人教化学必修1氧化还原反应PPT(38页 )
火箭的升空,需要燃料的燃 烧。燃料燃烧过程中伴随着 很多化学变化和物理变化, 伴随着许多能量的转化。今 天我们来学习一类重要的化 学反应
电子对偏
生,
向的反应 且得失(或偏向
有电子 转移的
反应
偏离)总数相等
化合反应 分解反应
氧化还原反应
化合
分解 置换
点燃
C + O2 == CO2
有单质参加
置换反应
CaO + H2O == Ca(OH)2
△
2KClO3 == 2KCl + 3O2↑
△
Cu(OH)2 == CuO + H2O
复分解反应 有单质生成
写出下列反应的化学反应方程式,分析参加反应的 物质所含元素的化合价在反应前后是否发生了变化?
(1)硫在氧气中燃烧。 (2)铁丝在硫酸铜溶液中反应。 (3)碳酸钙高温受热。 (4)稀硫酸加入到氢氧化钡溶液中。 (5)氢气还原氧化铜。
化合价升高 被氧化(氧化反应)
+2
0
0
CuO + H2 === Cu +
0
0
+1-1
2H2 + Cl2 = 2HCl
因为有元素化合价升降变化,所以是氧化还原反应。
思考:化合价的升降是什么原因引起的?如何在上 述两反应中表达出来?
化合物NaCl 的形成过程
Na
失去 e-后
失去e-
§2.3 氧化还原反应
(第1课时)
1.了解氧化还原反应的特征。 2.了解氧化还原反应的实质。(重点) 3.了解氧化还原反应与四种基本类型的关系。 4.学会电子转移的表示方法----双线桥表示法。
人教化学必修1氧化还原反应PPT(38页 )
火箭的升空,需要燃料的燃 烧。燃料燃烧过程中伴随着 很多化学变化和物理变化, 伴随着许多能量的转化。今 天我们来学习一类重要的化 学反应
电子对偏
生,
向的反应 且得失(或偏向
有电子 转移的
反应
偏离)总数相等
化合反应 分解反应
氧化还原反应
化合
分解 置换
点燃
C + O2 == CO2
有单质参加
置换反应
CaO + H2O == Ca(OH)2
△
2KClO3 == 2KCl + 3O2↑
△
Cu(OH)2 == CuO + H2O
复分解反应 有单质生成
写出下列反应的化学反应方程式,分析参加反应的 物质所含元素的化合价在反应前后是否发生了变化?
(1)硫在氧气中燃烧。 (2)铁丝在硫酸铜溶液中反应。 (3)碳酸钙高温受热。 (4)稀硫酸加入到氢氧化钡溶液中。 (5)氢气还原氧化铜。
化合价升高 被氧化(氧化反应)
+2
0
0
CuO + H2 === Cu +
0
0
+1-1
2H2 + Cl2 = 2HCl
因为有元素化合价升降变化,所以是氧化还原反应。
思考:化合价的升降是什么原因引起的?如何在上 述两反应中表达出来?
化合物NaCl 的形成过程
Na
失去 e-后
失去e-
化学人教版高中必修1高一化学《氧化还原反应》课件-PPT
还原剂:反应中失电子的物质,表现还原性,具 有还原能力,起还原作用。
2、氧化产物:还原剂失电子被氧化对应生成物 还原产物:氧化剂得电子被还原对应生成物 氧化剂(有氧化性)--→还原产物 还原剂(有还原性)--→氧化产物
一、常见的氧化剂和还原剂
1.常见氧化剂
(1)部分非金属单质:如 、Cl2 等O。2
CaCO3 高温 CaO+CO2
(否)
2KClMO△n3O2 2KCl+3O2
(是)
CaO+H2O Ca(OH) 2
(否)
C+O2 点燃 CO2
(是)
CuO+H△2
Cu+H2O
(是)
3C+Fe2O3 高温 2Fe+3CO2
(是)
HCl+NaOH NaCl+H2O
(否)
2HCl+CaCO3 CaCl2+H2O+CO2(否)
(2)含有高价态元素的化合物:如
HNO3、 KMnO、4 FeC等l3。
H2、SO4
2.常见还原剂 (1)活泼的金属单质,如 (2)某些非金属单质,如
Al Zn Fe
、H2 、C 等。 、 C等O。 SO2
(3)某些非金属氧化物,如 、 等。
要点一 氧化性、还原性强弱的判断
1.根据氧化还原反应方程式进行判断 在同一反应中 氧化性:氧化剂>氧化产物;还原性:还原剂>还 原产物; 如:Fe+H2SO4===FeSO4+H2↑ 氧化性:H2SO4>FeSO4,还原性:Fe>H2
四 “双线桥”法
Mg + Cl2 = MgCl2
步骤:
1.标出变价元素的化合价
2、氧化产物:还原剂失电子被氧化对应生成物 还原产物:氧化剂得电子被还原对应生成物 氧化剂(有氧化性)--→还原产物 还原剂(有还原性)--→氧化产物
一、常见的氧化剂和还原剂
1.常见氧化剂
(1)部分非金属单质:如 、Cl2 等O。2
CaCO3 高温 CaO+CO2
(否)
2KClMO△n3O2 2KCl+3O2
(是)
CaO+H2O Ca(OH) 2
(否)
C+O2 点燃 CO2
(是)
CuO+H△2
Cu+H2O
(是)
3C+Fe2O3 高温 2Fe+3CO2
(是)
HCl+NaOH NaCl+H2O
(否)
2HCl+CaCO3 CaCl2+H2O+CO2(否)
(2)含有高价态元素的化合物:如
HNO3、 KMnO、4 FeC等l3。
H2、SO4
2.常见还原剂 (1)活泼的金属单质,如 (2)某些非金属单质,如
Al Zn Fe
、H2 、C 等。 、 C等O。 SO2
(3)某些非金属氧化物,如 、 等。
要点一 氧化性、还原性强弱的判断
1.根据氧化还原反应方程式进行判断 在同一反应中 氧化性:氧化剂>氧化产物;还原性:还原剂>还 原产物; 如:Fe+H2SO4===FeSO4+H2↑ 氧化性:H2SO4>FeSO4,还原性:Fe>H2
四 “双线桥”法
Mg + Cl2 = MgCl2
步骤:
1.标出变价元素的化合价
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学反应的分类
举例 表示式 反应类 小结:四种基本反应类型是根据反应物、生成物的类别及反 型 应前后物质种类的多少来划分的。
化合反 应 分解反 应 置换反 应 复分解 反应
C+O2====CO2
CaCO3==CaO+CO2↑
高温 高温
高温
A+B==AB AB==A+B
C+2CuO==2Cu+CO2↑ A+BC==AC+B AgNO3+NaCl====AgCl AB+CD==AD+C ↓+NaNO3 B
Cl Cl-
失去电子的反应就是氧化反应 得到电子的反应就是还原反应
Na+ Cl-
小结
氧化还原反应 :一种物质被氧化,同时一种被还原的反应
1 特征:反应 前后元素化合价发生变化 2 定义: 凡有电子转移(得失或偏移)的反应叫氧化还原反应. 3 实质: 电子的转移
氧化反应: 失电子的的反应( 特征:元素化合价升高 ) 还原反应: 得到电子的反应( 特征:元素化合价降低 )
Na
元素种类
谢谢你
●● ● ● ●● ● ● ●
没关系,互 相帮助嘛
Cl
Na +
上页 下页 目录 返回
我想要 你给我一个 一个电 电子,好吗? 子。
●● ● ● ●● ●
老兄,干嘛 让我想 愁眉苦脸的? 那好吧 想
+
●
Cl
Na
上页 下页 目录 返回
还原剂
n个e-
氧化剂
氧 化 反 应
失 去 电 子 , 被 氧 化
氧化还原反应的实质:电子的转移(得失或偏移) 还 化合价升高 氧化反应 原 • 失电子 剂 • 总数相等
氧 • 得电子 化 剂 • 实质
总数相等
化合价降低 特征
同时发生
还原反应
氧化剂和还原剂
氧化剂: 定义: 得到电子(或电子对偏向)的物质 表现: 所含元素化合价降低,被还原 还原剂: 定义: 失去电子(或电子对偏离)的物质 表现: 所含元素化合价升高,被氧化 氧化性: 得电子的性质( 氧化剂的性质 ) 还原性:失电子的性质( 还原剂的性质 )
7. 3Cu+8HNO3= 3Cu(NO3)2+2NO↑+4H2O 8. 2NaCl + 2H2O
通电
△
2NaOH + H2↑ + Cl2↑
9. 2KMnO4=K2MnO4+MnO2+O2↑ 10. 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2 ↑ +8H2O
基本反应和氧化还原的关系:
△
△
• Cl2+H2O=HCl+HClO 5. Fe+2FeCl3=3FeCl2
一、氧化还原反应
1.氧化还原反应特征:
反应前后元素化合价发生变化(也是判断依据)
[练习] 用化合价升降的观点去判断下面的反应,哪些是氧化还原反应?
①MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
②2KClO3
③H2+ Cl2
反应前后元素化合价发 生变化。
上页 下页 目录 返回
元素化合价和电子得失的关系
化合价升高,被氧化 0 0 +1 -1
离子化合物: 元素化合价数 = 该元素一个原子得失电子数 化合价升高数 = 失去的电子数 化合价降低数 = 得到的电子数
2Na + Cl2 = 2NaCl
化合价降低,被还原
电子转移
Na Na+
Fe2O3+ 3CO
2Fe + 3CO2
属于上面四种类型中的哪种?
Fe2O3 失氧,被还原,发生还原反应 两者有机 统一,缺 CO 得氧,被氧化,发生氧化反应 一不可 一种物质被还原,另一种物质被氧化的反应 叫氧化—还原反应
1. Fe+H2SO4=FeSO4+H2↑ 2. C+H2O=CO+H2 3. MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
CO CO _______发生氧化反应, __________是还原剂, Fe __________ 是还原产物。
ห้องสมุดไป่ตู้
下列属于氧化还原反应的离子方程式的是(B ) A.CaCO3+2H+ = Ca2++CO2↑+H2O B.2Fe2++Cl2 = 2Fe3++2Cl C.HCO3+H+ = CO2+H2O D.2Na+2H2O = 2Na++2OH+H2↑
练习:请指明下列氧化还原反应的氧化剂、还原剂、氧化
反应、还原反应。
1. Fe+H2SO4=FeSO4+H2↑
△
2. C+H2O=CO+H2
△
3. MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O • Cl2+H2O=HCl+HClO 5. Fe+2FeCl3=3FeCl2
6. 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
练习:
Fe2O3高温下通CO气体,写出化学方程式: Fe2O3 + 3 CO 2Fe + 3CO2 ______________________________________________
高温
得 Fe 指出_______元素化合价降低,_____(得、失)电子, Fe2O3 Fe2O3 _______发生还原反应,___________是氧化剂, CO2 ___________是氧化产物。 失 _______元素化合价升高,_____(得、失)电子, C
2KCl+3O2↑
2HCl
④NaCl(固)+H2SO4(浓)=微热=NaHSO4+HCl ↑ 关键:1)正确判断各反应物、生成物各元素的 化合价及其变化; 2)凡是有化合价升降的化学反应都是氧化还 原反应
化 合 价 3 2 1
0
0
+1
-1
2Na + Cl2
2NaCl
Cl 0 -1 -2
上页 下页 目录 返回
得 到 电 子 , 被 还 原
还 原 反 应
上页 下页 目录 返回
氧化剂
●●
Cl
● ●
●●
还原剂
●
●
Na
氧 化 反 应
还 原 反 应
●●
-● Cl
● ●●
● ●
得 到 电 子 , 被 还 原
失 去 电 子 , 被 氧 化
+ Na
上页 下页 目录 返回
有电子转移(得失或者偏移) 电子转移 的反应都是氧化还原反应。
化合反应
分解反应 复 分 解 反 应
氧化还原反应
置换反应
举例 表示式 反应类 小结:四种基本反应类型是根据反应物、生成物的类别及反 型 应前后物质种类的多少来划分的。
化合反 应 分解反 应 置换反 应 复分解 反应
C+O2====CO2
CaCO3==CaO+CO2↑
高温 高温
高温
A+B==AB AB==A+B
C+2CuO==2Cu+CO2↑ A+BC==AC+B AgNO3+NaCl====AgCl AB+CD==AD+C ↓+NaNO3 B
Cl Cl-
失去电子的反应就是氧化反应 得到电子的反应就是还原反应
Na+ Cl-
小结
氧化还原反应 :一种物质被氧化,同时一种被还原的反应
1 特征:反应 前后元素化合价发生变化 2 定义: 凡有电子转移(得失或偏移)的反应叫氧化还原反应. 3 实质: 电子的转移
氧化反应: 失电子的的反应( 特征:元素化合价升高 ) 还原反应: 得到电子的反应( 特征:元素化合价降低 )
Na
元素种类
谢谢你
●● ● ● ●● ● ● ●
没关系,互 相帮助嘛
Cl
Na +
上页 下页 目录 返回
我想要 你给我一个 一个电 电子,好吗? 子。
●● ● ● ●● ●
老兄,干嘛 让我想 愁眉苦脸的? 那好吧 想
+
●
Cl
Na
上页 下页 目录 返回
还原剂
n个e-
氧化剂
氧 化 反 应
失 去 电 子 , 被 氧 化
氧化还原反应的实质:电子的转移(得失或偏移) 还 化合价升高 氧化反应 原 • 失电子 剂 • 总数相等
氧 • 得电子 化 剂 • 实质
总数相等
化合价降低 特征
同时发生
还原反应
氧化剂和还原剂
氧化剂: 定义: 得到电子(或电子对偏向)的物质 表现: 所含元素化合价降低,被还原 还原剂: 定义: 失去电子(或电子对偏离)的物质 表现: 所含元素化合价升高,被氧化 氧化性: 得电子的性质( 氧化剂的性质 ) 还原性:失电子的性质( 还原剂的性质 )
7. 3Cu+8HNO3= 3Cu(NO3)2+2NO↑+4H2O 8. 2NaCl + 2H2O
通电
△
2NaOH + H2↑ + Cl2↑
9. 2KMnO4=K2MnO4+MnO2+O2↑ 10. 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2 ↑ +8H2O
基本反应和氧化还原的关系:
△
△
• Cl2+H2O=HCl+HClO 5. Fe+2FeCl3=3FeCl2
一、氧化还原反应
1.氧化还原反应特征:
反应前后元素化合价发生变化(也是判断依据)
[练习] 用化合价升降的观点去判断下面的反应,哪些是氧化还原反应?
①MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
②2KClO3
③H2+ Cl2
反应前后元素化合价发 生变化。
上页 下页 目录 返回
元素化合价和电子得失的关系
化合价升高,被氧化 0 0 +1 -1
离子化合物: 元素化合价数 = 该元素一个原子得失电子数 化合价升高数 = 失去的电子数 化合价降低数 = 得到的电子数
2Na + Cl2 = 2NaCl
化合价降低,被还原
电子转移
Na Na+
Fe2O3+ 3CO
2Fe + 3CO2
属于上面四种类型中的哪种?
Fe2O3 失氧,被还原,发生还原反应 两者有机 统一,缺 CO 得氧,被氧化,发生氧化反应 一不可 一种物质被还原,另一种物质被氧化的反应 叫氧化—还原反应
1. Fe+H2SO4=FeSO4+H2↑ 2. C+H2O=CO+H2 3. MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
CO CO _______发生氧化反应, __________是还原剂, Fe __________ 是还原产物。
ห้องสมุดไป่ตู้
下列属于氧化还原反应的离子方程式的是(B ) A.CaCO3+2H+ = Ca2++CO2↑+H2O B.2Fe2++Cl2 = 2Fe3++2Cl C.HCO3+H+ = CO2+H2O D.2Na+2H2O = 2Na++2OH+H2↑
练习:请指明下列氧化还原反应的氧化剂、还原剂、氧化
反应、还原反应。
1. Fe+H2SO4=FeSO4+H2↑
△
2. C+H2O=CO+H2
△
3. MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O • Cl2+H2O=HCl+HClO 5. Fe+2FeCl3=3FeCl2
6. 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
练习:
Fe2O3高温下通CO气体,写出化学方程式: Fe2O3 + 3 CO 2Fe + 3CO2 ______________________________________________
高温
得 Fe 指出_______元素化合价降低,_____(得、失)电子, Fe2O3 Fe2O3 _______发生还原反应,___________是氧化剂, CO2 ___________是氧化产物。 失 _______元素化合价升高,_____(得、失)电子, C
2KCl+3O2↑
2HCl
④NaCl(固)+H2SO4(浓)=微热=NaHSO4+HCl ↑ 关键:1)正确判断各反应物、生成物各元素的 化合价及其变化; 2)凡是有化合价升降的化学反应都是氧化还 原反应
化 合 价 3 2 1
0
0
+1
-1
2Na + Cl2
2NaCl
Cl 0 -1 -2
上页 下页 目录 返回
得 到 电 子 , 被 还 原
还 原 反 应
上页 下页 目录 返回
氧化剂
●●
Cl
● ●
●●
还原剂
●
●
Na
氧 化 反 应
还 原 反 应
●●
-● Cl
● ●●
● ●
得 到 电 子 , 被 还 原
失 去 电 子 , 被 氧 化
+ Na
上页 下页 目录 返回
有电子转移(得失或者偏移) 电子转移 的反应都是氧化还原反应。
化合反应
分解反应 复 分 解 反 应
氧化还原反应
置换反应
