近几年高考化学平衡试题考查特点
历年化学反应速率和化学平衡高考试题

考点6 化学反应速率和化学平衡一、选择题1.(2011·全国卷I ·8)在容积可变的密闭容器中,2mol 2N 和8mol 2H 在一定条件下反应,达到平衡时,2H 的转化率为25%,则平衡时氨气的体积分数接近于( )A 。
5%B 。
10% C.15% D.20% 【答案】选C 。
2.(2011·四川高考·13)可逆反应错误!X(g)+2Y(g)2Z (g )、错误!2M(g)N (g )+P(g )分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板.反应开始和达到平衡状态时有关物理量的变化如图所示: 下列判断正确的是:( ) A 。
反应错误!的正反应是吸热反应B.达平衡(I )时体系的压强与反应开始时体系的压强之比为14:15C 。
达平衡(I )时,X 的转化率为115D 。
在平衡(I )和平衡(II)中,M 的体积分数相等 【答案】选C.3。
(2011·重庆高考·7)下列叙述正确的是( ) A 。
Fe 分别与氯气和稀盐酸反应所得氯化物相同B.K 、Zn 分别与不足量的稀硫酸反应所得溶液均呈中性 C 。
Li 、Na 、K 的原子半径和密度随原子序数的增加而增大 D 。
C 、P 、S 、Cl 的最高价氧化物对应水化物的酸性逐渐增强 【答案】选D 。
4.(2011·重庆高考·10)一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图的是( )【答案】选A 。
5.(2011·江苏高考·10)下列图示与对应的叙述相符的是A.图5表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化B.图6表示0.100 0 mol•L —1NaOH 溶液滴定20。
00mL0。
100 0 mol•L —1CH 3COOH 溶液所得到的滴定曲线 C 。
图7表示KNO 3的溶解度曲线,图中a 点所示的溶液是80 ℃时KNO 3的不饱和溶液 D 。
近三年高考理科综合能力测试题(全国Ⅱ卷)化学部分的特点及启示
2 6
l 3
・3 ・ 3
维普资讯
廷边教育学 院学报
20 丘 06
1 I 年
级
教 材 章节 名称
题 分 总 题 号 值 分 号
24 0年 0
25 0矩 0
分 总 题 分 总 值 分 号 值 分
近三年高考理科综合能力测试题 ( 国 Ⅱ卷 )化 学部分 的特 点及启 示 全
崔顺女
( 延边州教育学院 ,吉林 延 吉 l3 0 ) 3 0 0
摘要 :高考化 学试题是_据 “ 依 考纲 对 中学化学的主体 内容进行重点 的考查.本文对 近三年高考理
科综合能力测试试题 ( 化学部分 )的特点作简要的分析及对今后化学教学的启示。
每 级 i 教 材章节名称 题 分 总 题 号 值 分 号 7 6 5 2 3 7
20 0 4矩 20 0 5矩 20 0 6年
分 总 题 分 总 值 分 号 值 分 3 4 8 6 l 5 2 4
第 一章 化学反应及其 能量变化
有机物之 间的转化方程式 的书写等, 知识 点明显减少 。 象几年来一直作 为高考 必考的氧化还原反应、电
离平衡 、离子浓度 大小的 比较等试题相对较少。这充分反映 了 “ + 3 X”高考命题 中知识 立意 向能力立意
转移 的指导 思想 ,试题 以能力要求构建框 架,知识 点覆盖不求全而广 。
}碱 高物 金 第 三 四 二量 章 卤 索 质 的 属
— — —
29 L 8( 1 l J 63 6 0 l) 6 5l 2
6 2 6
l 4 29
第五章 物质结构 元 素周期律
6
7 8
l 8
l 3 1 6
由“化学平衡”构造的高考真题评析

、
j {{
1
、 I
{ i ●
I
t
; 1- 1 1 J
r 刖
_ _
2 5 8 一2 3 0和 一7 6 5k ・ o 一 . 回答下 列 8 . 、 8. 2 . J t l 1 请 o () 1 用太 阳能分解 1 o 水消耗 的能量是—— k ; 0t l o J
③ 增 加 ;④ > , . >
( )⑤ 0 0 l L ・ n 。 2 . 5 mo ・ mi _ ;
② 根 据表 中数据 , 式计 算 2 . 列 5 0℃时 的分 解 平
衡 常 数 ③ 取 一 定 量 的 氨 基 甲 酸 铵 固体 放 在 一 个 带 活 塞 的密 闭真空容 器 中 , 2 在 5℃ 下 达 到 分 解 平 衡 . 在 恒 若 温 下 压 缩 容 器 体 积 , 基 甲酸 铵 固 体 的 质 量 氨 ( “ 加” 减小” “ 变” . 填 增 “ 或 不 ) ④ 氨基 甲酸铵 分解 反应 的焓变 △ H 变 A S 0 填> 、 或 一) ( < .
一
—
一
1 、k
1
—
_
一
}: j l● f l ’
l {
一 :丰 } 1 — 一 —
{ i
.
: — —
j 、 : l -{ l— ‘ 一
一
l
- - T ̄ I i J
l
一
● — —
’
- — 4 * -
( ) 醇 不 完 全 燃 烧 生 成 一 氧 化 碳 和 液 态 水 的 热 2甲
:
;
问题 :
l f : ‘ l
化学平衡常数在高考试题中的考查视角及解题策略
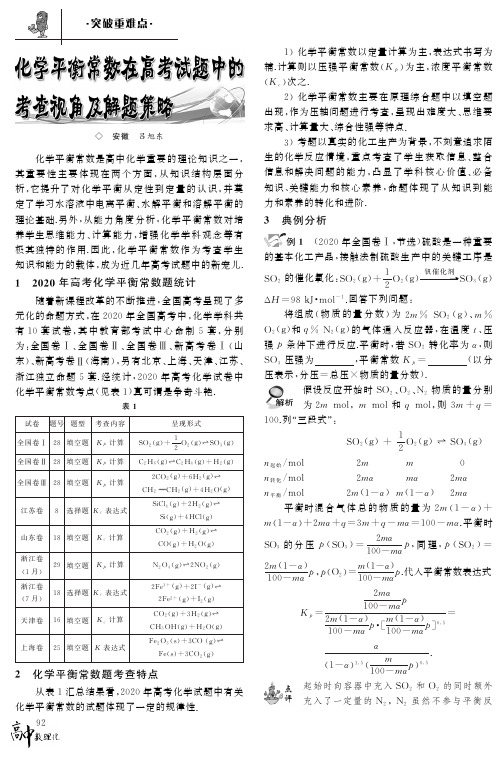
水蒸气呢? 因 为 乙 烯 和 水 蒸 气 的 化 学 计 量 数 之 比 为
1∶4,两者物质 的 量 的 比 值 始 终 为1∶4,如 果 是 乙 烯 的
物质 的 量 分 数 为 0
39,则 水 蒸 气 的 物 质 的 量 分 数 为
所 以,该 条 件 下,水 蒸
0
39 的 4 倍,显 然 是 不 合 理 的 .
极其独特的 作 用 .
因 此,化 学 平 衡 常 数 作 为 考 查 学 生
知识和能力的载体,成为近几年高考试题中的新宠儿 .
1 2020 年高考化学平衡常数题统计
随着新课程改革的不断 推 进,全 国 高 考 呈 现 了 多
元化的命题方式,在 2020 年 全 国 高 考 中,化 学 学 科 共
有 10 套 试 卷,其 中 教 育 部 考 试 中 心 命 制 5 套,分 别
×
4 0
0393
该题把图象和 计 算 有 机 地 结 合 起 来,考 查 了
图1
根据图中点 A (
440K,
0
39),计算该温度时反应
学生从化学平衡移动的视角分析曲线变化
的平衡常数 Kp =
和利用“三段式”计 算 A 点 平 衡 时 各 反 应 物 和 生 成 物
方法 1 假设 n(
CO2 )和 n(H2 )的物质的 量
n(
N2O4),则2-
2
α=3
α,求出 NO2 转化率α=0
4,平衡时 n(
NO2 )=
93
方法与技巧
需 要 特 别 注 意 的 是,由
1
2 mo
l,n(
N2O4)=0
4 mo
l.
于 恒 温 恒 容 条 件,平 衡 时 的 压 强 发 生 了 变 化 不 再 是
近4年全国卷二化学试卷考点分析

近4年全国卷二化学试卷考点分析一、选择题题型及考点与分量二、四道大题题型及考点与分量二、四个大题基本考点与考擦形式具体分析式也都出现了,预计以后几年也会考,信息迁移也是年年都考,但每年考的内容并不一样。
化学原理题主要考擦氧化还原反应和速率和平衡影响因素、K有关计算、盖斯定律和电化学等有关知识题目综合性很强,且都注重图像与线条信息的分析3、工艺流程题工艺流程题一般与化工生产有关,也与实验紧密联系,题目综合性较强,主要考擦考生对化学除杂、化学方程式及化学平衡和电化学相关知识的掌握与运用,这类题注重结合工艺流程图3.实验题下面附近4年全国卷(2)高考真题:2011年普通高等学校招生全国统一考试(全国Ⅱ)理科综合能力测试6.等浓度的下列稀溶液:①乙酸、②苯酚、③碳酸、④乙醇,它们的pH由小到大排列正确的是 A④②③① B③①②④ C①②③④ D①③②④ 7.下列叙述错误..的是 A.用金属钠可区分乙醇和乙醚B.用高锰酸钾酸性溶液可区分己烷和3-己烯 C.用水可区分苯和溴苯D.用新制的银氨溶液可区分甲酸甲酯和乙醛8.在容积可变的密闭容器中,2mol2N 和8mol2H 在一定条件下反应,达到平衡时2H 的转化率为25%,则平衡时氮气的体积分数接近于 A 50%B 10% C.15% D.20%9.室温时,将浓度和体积分别为11.c V 的NaOH 溶液和22.c V 的3CH COOH 溶液相混合,下列关于该混合液的叙述错误的是 A.若7pH >,则一定是1122cV c V =B.在任何情况下都是()()()()3c Na c H c CH COO c OH ++-++=+ C. 7pH =时,若12V V =,则一定是21c c > D. 若12V V =,21c c =,则()()()33CH COO c CH COOH c Na -++=10.用石墨做电极电解CuSO 4 溶液,通电一段时间后,欲使电解液恢复到起始状态,应向溶液中加入适量的A. CuSO 4B. H 2OC. CuOD. CuSO 4 5H 2O11.将足量2CO 通入下列各溶液中,所含离子还能大量共存的是 A 233...K SiO Cl NO +--- B 324...H NH Al SO ++-+ C 224..Na S OH SO +---D 6533...Na C H O CH COO HCO +---12.N A 为阿伏伽德罗常数,下列叙述错误..的是 A .18gH 2O 中含有的质子数为10N A B. 12g 金刚石中含有的共价键数为4N AC .46gNO 2和NO 4混合气体中含有原子总数为3N AD. 1 mol Na 与足量O 2反应,生成Na 2O 和Na 2O 2的混合物,纳失去N A 个电子13.某含铬Cr 2O 2-7废水用硫酸亚铁铵FeSO 4 •(NH 4) SO 4•6H 2O 处理,反应中铁元素和铬原素完全转化为沉淀。
历届高考中的化学平衡常数试题及其答案和详解

1.(1982年高考全国卷第8题)(12分)将9.2克N 2O 4晶体放入容积为2升的密闭容器中,升温到25℃时N 2O 4全部气化,由于N 2O 4发生如下分解反应:N 2O 42NO 2 △H=+56.848kJ/mol ,平衡后,在25℃时测得混和气体(N 2O 4和NO 2)的压强P 为同温下N 2O 4(g)尚未分解时压强的1.2倍,试回答下列问题: (1).平衡时容器内混和气体的压强P 是多少大气压? (2).平衡时容器内NO 2同N 2O 4的物质的量之比是多少? (3).平衡时该反应的平衡常数K 是多少?(4).如改变影响平衡的一个条件(如压力、温度或浓度)时,试将NO 2同N 2O 4的物质的量之比平衡常数K 的变化情况,选用增大、减小或不变等词句填下表:1.[答案] (1)1.47大气压;(2)21;(3)0.01; (4)[解析](1)。
先求混和气体的总物质的量n :设n 1、P 1分别是纯N 2O 4(g)的物质的量和压强,n 、P 分别是混和气体的总物质的量和压强;则PP 1=112.1P P ⨯=nn 1=n922.9 ;n=0.12 mol (2分);再利用PV=nRT 求混和气体的压强P=VnRT =2298082.012.0⨯⨯=1.47大气压(1分)。
(2)设0.1摩尔N 2O 4中有x 摩尔分解,则有如下的对应关系是:N 2O 42NO 2 △H=+56.848kJ/mol起始物质的量:0.1mol 0 变化物质的量: xmol 2xmol 平衡物质的量:0.1-x 2x平衡后,在25℃时测得混和气体(N 2O 4和NO 2)的压强P 为同温下N 2O 4(气)尚未分解时压强的1.2倍,混和气体的总物质的量:0.12mol ;则:0.1-x+2x=0.12;∴ x=0.02mol (2分);平衡时容器内NO 2同N 2O 4的物质的量之比:摩尔数摩尔数422O N NO =02.01.0202.0-⨯=21(1分)(3)k=][][4222O N NO =]21.0[]22[2LX L x -]04.0[]02.0[2=0.01(3分)(平衡常数表示式、平衡时物质的浓度和计算结果各给1分)(4)(每一空格给0.5分,共3分);k 是温度的函数,改变压强和改变浓度都不会改变平衡常数;N 2O 42NO 2△H=+56.848kJ/mol ,正反应是吸热反应,升高温度有利于平衡向正向移动,k 值增大;增大压强,平衡逆向移动,NO 2物质的量减小,N 2O 4物质的量增大,物质的量之比422O N NO 减小;升高温度,平衡正向移动,N 2O 4物质的量减小,NO 2物质的量增大,物质的量之比422O N NO 增大;增加N 2O 4的浓度平衡正向移动,平衡移动N 2O 4物质的量减小,N 2O 4物质的量净增加值大,平衡移动NO 2物质的量增大,物质的量之比422O N NO 减小。
2022-2023年高考化学专题复习《化学平衡条件控制和有机化学实验》

控制变量
NO转化为NO2的转化率如图中实线所示(图中虚线 表示相同条件下NO的平衡转化率随温度的变化)。
下列说法正确的是( B D )双选
A. 反应2NO(g)+O2(g) = 2NO2(g)的ΔH>0 B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率 D. 380℃下,c起始(O2)=5.0×10−4 mol·L−1,NO平衡转化率为50%,则平 衡常数K>2000
反应Ⅰ的ΔH>0,反应Ⅱ的ΔH<0,温度升高使CO2转化为CO的平衡转化率上升, ② 使22C0O℃2转时化,为在C催H3化O剂CH作3的用平下衡CO转2与化H率2反下应降,一且段上时升间幅后度,超测过得下CH降3O幅C度H3的选择性为
48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有
反应Ⅰ:CO2(g)+H2(g) = CO(g)+H2O(g) ΔH=41.2 kJ·mol−1 反应Ⅱ:2CO2(g)+6H2(g) = CH3OCH3(g)+3H2O(g)
ΔH =﹣122.5 kJ·mol−1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡
转化率和平衡时CH3OCH3的选择性随温度的变化如图。 ① 温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是_________________。
解题策
略
实现
化学反应
多:尽可能达到平衡转化率
单一/平行反应 可逆/非可逆反应 吸热/放热反应
对象
目的
快:缩短反应时间,效率高 好:产物选择性好,纯度高
化学反应的计量数
化学反
近三年高考化学(1、2、3卷)真题考点分析

近三年高考化学(1、2、3卷)真题考点分析!本文通过对2016—2019年高考化学各个题目考点、考法的拆解分析、横向对比,总结了近些年的热门考点、命题规律。
希望对你有所帮助!12016、2017、2018年选择题横向对比分析规律总结:(1)I、II、III卷都有的考点为:与生活相联系的化学物质常识、电化学、周期律周期表、有机物常识或是同分异构或空间构型、基本实验操作、NA或相当于NA的计算;(2)只有Ⅰ卷中有无机工业流程题;(3)I、II、III卷近3年都没有考查电解质溶液离子浓度关系或曲线分析。
22016、2017、2018年实验题对比分析规律总结:2016年Ⅰ卷采用装置图提问,Ⅱ卷直接给物质,有回归旧题的感觉。
Ⅲ卷有流程,提问以性质为基础的方程、选装置、作用、目的、原因等。
2017年实验题素材都来自于工业生产,都针对仪器名称及作用、操作方法、某操作原因或目的、写离子方程式等提问,前两套卷还有误差分析或滴定计算。
2018年实验题素材都针对仪器名称及作用、操作方法、某操作原因或目的、写离子方程式等提问,后II、III卷考查了滴定计算。
32016、2017、2018年无机题对比分析规律总结:2016年I、II、III卷都是流程图题。
除结合性质为基础的知识提问以外,还穿插了化学反应原理提问和简单计算。
2017年I、II、III卷都是工业流程图题,6-9空,条件、原因、转化率变化、调pH数值或原因分析,写化学方程或离子方程式;加某试剂的目的,溶度积、含量或转化率计算。
2018年I、II、III卷卷都是工业流程图题,7-8空,条件、原因、调pH数值或原因分析,写电极反应、化学方程或离子方程式;加某试剂的目的,残留量计算。
42016、2017、2018年化学反应原理题对比分析规律总结:2016年Ⅰ卷一改往年气体设问,变为溶液中离子浓度为素材设问,简答减少。
I、II、III卷都有计算。
以判断现象、分析曲线、列表达式、说明原因(或理由)为主。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
近几年高考化学平衡试题考查特点一、图表题增多并突出计算创新,如用压强代替浓度,联系阿伏伽德罗定律考查平衡常数、转化率等相关计算。
1、一定量得CO2与足量得碳在体积可变得恒压密闭容器中反应:C(s)+CO2(g)2CO(g)。
平衡时,体系中气体体积分数与温度得关系如下图所示:已知:气体分压(P分)=气体总压(P总)×体积分数。
下列说法正确得就是( )A.550℃时,若充入惰性气体,v正,v逆均减小,平衡不移动B.650℃时,反应达平衡后CO2得转化率为25、0%C.T℃时,若充入等体积得CO2与CO,平衡向逆反应方向移动D.925℃时,用平衡分压代替平衡浓度表示得化学平衡常数K P=24、0P总【答案】B【解析】选项A中,因容器得体积可变,故充入惰性气体后容器体积变大,混合气体整体被稀释,反应应正向移动,故A错误。
选项B中,设转化得CO2为x,则CO为2X,剩下得CO2为(1-X),由题可知,(1-X)/2X=60%/40%,解得x=0、25,故选项B正确。
选项C中,当同时充入CO2与CO时若要保证平衡不移动,则需要按照反应系数进行添加,即在加入1体积CO2时加入2体积CO,而此时就是等体积加入,相当于CO加少了,平衡应正向移动,故C错误。
选项D中,通过题目所给条件计算KP应等于23、0P总,故D错误。
2、研究了下列反应:2HI(g)H2(g)+I2(g)在716K时,气体混合物中碘化氢得物质得量分数x(HI) t/min 0 20 40 60 80 120X(HI) 1 0、91 0、85 0、815 0、795 0、784X(HI) 0 0、60 0、73 0、773 0、780 0、784①根据上述实验结果,该反应得平衡常数K得计算式为:___________。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k 逆为速率常数,则k逆为________(以K与k正表示)。
若k正=0、0027min-1,在t=40,min时,v 正=__________min-1③由上述实验数据计算得到v正~x(HI)与v逆~x(H2)得关系可用下图表示。
当升高到某一温度时,反应重新达到平衡,相应得点分别为_________________(填字母)根据题意可知2HI(g)H2(g)+I2(g)初始1mol·L-1 0 0平衡0、784mol·L-10、108mol·L-10、108mol·L-1所以K=0、1082/0、7842;平衡时v正=v逆,所以k正x2(HI) =k逆x(H2)x(I2),结合平衡常数表达式可知k逆=K·k正,v正=k正x2(HI)=0、0027min-1ⅹ(0、85)2=1、95×10-3。
3、甲醇就是重要得化工原料,又可称为燃料。
利用合成气(主要成分为CO、CO2与H2)在催化剂得作用下合成甲醇,发生得主反应如下:①CO(g)+2H2(g)CH3OH(g) △H1②CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H2③CO2(g)+H2(g)CO(g)+H2O(g) △H3回答下列问题:(1)已知反应①中得相关得化学键键能数据如下:化学键H—H C—O C O H—O C—HE/(kJ、mol-1) 436 343 1076 465 413由此计算△H1=kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=kJ·m ol-1。
(2)反应①得化学平衡常数K得表达式为 ;图1中能正确反映平衡常数K 随温度变化关系得曲线为 (填曲线标记字母),其判断理由就是。
(3)合成气得组成n(H2)/n(CO+CO2)=2、60时,体系中得CO平衡转化率(α)与温度与压强得关系如图2所示。
α(CO)值随温度升高而(填“增大”或“减小”),其原因就是。
图2中得压强由大到小为_____ ,其判断理由就是_____ 。
【答案】(1)—99;+41(2);a;反应①为放热反应,平衡常数应随温度升高变小;(3)减小;升高温度时,反应①为放热反应,平衡向向左移动,使得体系中CO得量增大;反应③为吸热反应,平衡向右移动,又产生CO得量增大;总结果,随温度升高,使CO得转化率降低;P3>P2>P1;相同温度下,由于反应①为气体分子数减小得反应,加压有利于提升CO得转化率;而反应③为气体分子数不变得反应,产生CO得量不受压强影响,故增大压强时,有利于CO得转化率升高4.化合物AX3与单质X2在一定条件下反应可生成化合物AX5。
回答下列问题:(1)已知AX3得熔点与沸点分别为-93、6 ℃与76 ℃,AX5得熔点为167 ℃。
室温时AX3与气体X2反应生成 1 mol AX5,放出热量123、8 kJ。
该反应得热化学方程式为____________________________________________。
(2)反应AX3(g)+X2(g)AX5(g)在容积为10 L得密闭容器中进行。
起始时AX3与X2均为0、2 mol。
反应在不同条件下进行,反应体系总压强随时间得变化如图所示。
①列式计算实验a从反应开始至达到平衡时得反应速率v(AX5)=______________________。
②图中3组实验从反应开始至达到平衡时得反应速率v(AX5)由大到小得次序为____________(填实验序号);与实验a相比,其她两组改变得实验条件及判断依据就是:b________________________________________________,c____________________________________________。
③用p0表示开始时总压强,p 表示平衡时总压强,α表示AX 3得平衡转化率,则α得表达式为______________;实验a 与c 得平衡转化率:αa 为________,αc 为________。
(1)AX3(l)+X2(g)===AX5(s) ΔH =-123、8 kJ/mol (2)①0、10 mol 10 L×60 min=1、7×10-4 mol·L -1·min -1解:开始时n0=0、4 mol,总压强为160 kPa,平衡时总压强为120 kPa,则n 为120 kPa 160 kPa=n 0、40 mol, n =0、40 mol×120 kPa 160 kPa=0、30 mol, AX3(g)+X2(g) AX5(g)起始时n0/mol:0、20 0、20 0平衡时n/mol:0、20-x 0、20-x x(0、20-x)+(0、20-x)+x =0、30x =0、10v(AX5)=0、10 mol 10 L×60 min=1、7×10-4 mol·L -1·min -1 ②bca 加入催化剂。
反应速率加快,但平衡点没有改变 温度升高。
反应速率加快,但平衡点向逆反应方向移动(或反应容器得容积与起始物质得量未改变,但起始总压强增大) ③α=2(1-p p0) 50% 40% [解析] (1)书写热化学方程式时要注意常温下AX3呈液态,AX5呈固态。
(2)②由图像知,达到平衡所需时间:a >c >b,所以反应速率v(AX5)由大到小得顺序为b >c >a;与实验a 相比,实验b 先达到平衡,化学反应速率快,但平衡点没有变化,说明实验b 加入了催化剂;反应为放热反应,与实验a 相比,实验c 平衡向逆反应方向移动,且反应速率加快,说明实验c 改变得条件就是升高温度。
AX3(g) + X2(g)AX5(g)起始量(mol) 0、2 0、2 0变化量(mol) x x x平衡量(mol) 0、2-x 0、2-x x则有0、4-x 0、4=p p0,解得x =0、4(p0-p)p0,则AX3得转化率为0、4(p0-p)0、2×p0=2(1-p p0);分别将实验a 、c 得p 、p0得数据代入上式,得aa 、ac 分别为50%、40%。
5、用Cl 2生产某些含氯有机物时会产生副产物HC1。
利用反应A,可实现氯得循环利用。
反应A:4HCl +O 22Cl 2+2H 2O(1)已知:Ⅰ反应A 中, 4mol HCI 被氧化,放出115、6kJ 得热量。
400℃ CuO/CuCl2ⅡH 2O 得电子式就是_______________、②反应A 得热化学方程式就是_______________。
③断开1 mol H —O 键与断开 1 mol H —Cl 键所需能量相差约为__________KJ,H 2O 中H —O 键比HCl 中H —Cl 键(填“强”或“若”)_______________。
(2)对于反应A,下图就是4种投料比[n(HCl):n(O 2),分别为1:1、2:1、4:1、6:1、]下,反应温度对HCl 平衡转化率影响得曲线。
①曲线b 对应得投料比就是______________、②当曲线b, c, d 对应得投料比达到相同得HCl 平衡转化率时,对应得反应温度与投料比得关系就是_________________ 、③投料比为2:1、温度为400℃时,平衡混合气中Cl 2得物质得量分数就是_______________、答案:(1) 4HCl +O22Cl2+2H2O △H=-115、6kJ ·mol -1;32;强(2) 4:1;投料比越小时对应得温度越低;30、8%6、硼酸(H 3BO 3)在食品、医药领域应用广泛。
(1)请完成B 2H 6气体与水反应得化学方程式:B 2H 6 + 6H 2O=2H 3BO 3 +________。
(2)在其她条件相同时,反应H 3BO 3 +3CH 3OHB(OCH 3)3 +3H 2O 中,H 3BO 3得转化率()在不同温度下随反应时间(t)得变化见图12,由此图可得出:6070 80 90 100反应温度/℃ H C l 得平衡转化率/% O O Cl Cl243KJ/mol键断裂 498KJ/mol键断裂400℃ CuO/CuCl2①温度对应该反应得反应速率与平衡移动得影响就是_______②该反应得_____0(填“<”、“=”或“>”)、(3)H3BO3溶液中存在如下反应:H3BO3(aq)+H2O(l) [B(OH)4]-( aq)+H+(aq)已知0、70 mol·L-1 H3BO 3溶液中,上述反应于298K 达到平衡时,c平衡(H+)=2、0×10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO3),水得电离可忽略不计,求此温度下该反应得平衡常数K(H2O得平衡浓度不列入K得表达式中,计算结果保留两位有效数字)【解析】(1)根据元素守恒,产物只能就是H2, 故方程式为B2H6 + 6H2O=2H3BO3 +6H2。
