第五章 (3)表面活性剂
五章表面活性剂与药用高分子材料【共28张PPT】

(五)起泡剂与消泡剂
●泡沫:气体分子分散在液体中的分散系统。 ●起泡剂 :HLB高,应用外用避孕泡腾片 ●消泡剂。 HLB 1~3 如硅酮、辛醇等。
(六)去污剂与洗涤剂:HLB13~16 (七)其他
●透皮促进剂 1~2%
●晶型稳定剂
第二节 药用高分子材料(polymer in pharmaceutics)
离子型表面活性剂缔合数<100,非离子型>100. ●临界胶团浓度(CMC,Critical micelle Concentration)
开始形成胶团时溶液的浓度
○CMC测定;如表面张力变化。
○CMC值主要由表面活性剂性质决定;
○CMC值受温度、pH值及电解质的影响。
Unimers
Surfactant Aggregates
Dimers or trimers
Normal micelles spherical
cylindrical
Inverted hexagonal phase Reverse micelles
vesicle
Bilayer lamella
4 nm
(三)亲水亲油平衡值(Hydrophil-Lipophilalance value,HLB值)
不溶于水,有弱W/O的能力。O/W乳剂的辅助乳化剂
7、蔗糖的脂肪酸酯:
●无毒、无味、无臭,可降解。 ●单酯是亲水性,乳化剂
●双酯是不溶于水,润滑剂。
三、 基本特性:
(一)表面活性:显著降低表面张力的性质。
(二)胶团 ● 低浓度时,溶液表面定向排列降低,
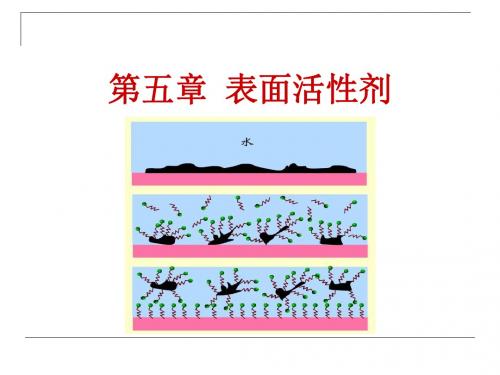
浓度增加(表面饱和)后,胶团或胶束(Micelle)。 -亲油基团向内,亲水基团向外的多分子有序缔合体。
大学表面活性剂复习资料(考试用)

大学表面活性剂复习资料(考试用)表面活性剂化学复习资料名词解释题目第一章表面活性剂的概述1.表面:液体或固体和气体的接触面。
(物质和它产生的蒸汽或者真空接触的面)2. 界面:液体与液体,固体与固体或液体的接触面。
(物质相与相之间的分界面称之为界面)3. 表面张力:指垂直通过液面上任一单位长度、与液面相切的收缩表面的力(N/m)。
4. 表面自由能:指液体增加单位表面上所需做的可逆功,或恒温恒压下增加单位表面积时体系自由能的增值,或单位表面上的分子比体相内部同分子量所具有的自由能过剩值,称为表面自由能(J/m2)。
5. 表面活性:在液体中加入某种物质使液体表面张力降低的性质叫表面活性。
如肥皂中的脂肪酸钠,洗衣粉中的烷基苯磺酸钠等。
6. 表面活性剂:是指在某液体中加入少量某物质时就能使液体表面张力急剧降低,并且产生一系列应用功能,该物质即为表面活性剂。
第二章表面活性剂的作用原理1. 吸附:表面上活性剂这种从水内部迁至表面,在表面富集的过程叫吸附。
2. 低表面能固体:表面活性剂的表面能<100mJ/m2的物质3. 高表面能固体:表面活性剂的表面能>100mJ/m2的物质。
4. 胶束:两亲分子溶解在水中达一定浓度时,其非极性部分会互相吸引,从而使得分子自发形成有序的聚集体,使憎水基向里、亲水基向外,减小了憎水基与水分子的接触,使体系能量下降,这种多分子有序聚集体称为胶束。
(2)反胶束:表面活性剂在有机溶剂中形成极性头向内,非极性头尾朝外的含有水分子内核的聚集体,称为反胶团。
(3)临界胶束浓度:表面活性剂溶液的表面张力随着活性剂浓度的增加而急剧地降低,但是当浓度增加到一定值后,表面张力随溶液浓度的增加而变化不大,此时表面活性剂从分子或离子分散状态缔合成稳定的胶束,从而引起溶液的高频电导、渗透压、电导率等各种性能发生明显的突变,这个开始形成胶束的最低浓度称为临界胶束浓度(CMC)。
(4)亲水-亲油平衡值(HLB):系表面活性剂中亲水和亲油基团对油或水的综合亲合力,是用来表示表面活性剂的亲水亲油性强弱的数值。
表面活性剂应用导论第5章阳离子表面活性剂

5.1 阳离子表面活性剂概述
②锍盐化合物
锍盐化合物可溶于水,具有除草、杀灭软体动物、
杀菌和杀真菌等作用,是有效的杀菌剂,而且对皮肤的
刺激小,因此使用性能优于传统的季铵盐化合物。
氧化锍衍生物是锍盐型阳离子表面活性剂中性能十
分优异的品种,它在阴离子洗涤剂和传统的松香皂配方
中均能保持良好的杀菌性。
R1
+
γ(0.01%溶液) 72.3 72.2 71.9 70.9 68.7 67.1 62.4 53.9 43.7 43.2 43.4 43.6
CH3
+ R N CH2
Cl-
CH3
①随着烷基碳链长度的 增加,表面活性剂的表 面张力逐渐下降。
表中: γ-表面张力,mN/m
5.2 阳离子表面活性剂的性质
(3)表面张力 分子结构相同时,表面张力与溶液的浓度有关:
季铵盐分子中所含的主要是吗啉环、 吡啶环、 咪 唑啉环、 哌嗪环、 喹啉环,等。
主要用作:
湿润剂、洗涤剂、杀菌剂、缓蚀剂、纤维柔软剂、 助染色剂、抗静电剂、分散剂、起泡剂,等。
5.3 几种阳离子表面活性剂
(4)含杂环的季铵盐 ①含有吗啉环的季铵盐
+ C16H33 N
O· HCl ·(SO3OCH3)-
Krafft点可以衡量表面活性剂的溶解性能。
5.2 阳离子表面活性剂的性质
(2)Krafft 温度点 ②Krafft点与成盐的配对阴离子的关系
如,配对阴离子对十六烷基吡啶Krafft点的影响:
+ C16H33 N
X-
配对阴离子X
Cl Br I
Krafft点/℃
17 28 45
按照 Cl、Br、I的次序,表 面活性剂的Krafft点温度升高, 由此可知,其溶解性能将按此 顺序依次降低。
第五章 表面活性物质

5.4 表面活性剂的胶束作用
5.4.4 胶束形成热力学
胶束形成过程是自发过程,胶束体系是热力学稳定性体系。
(1) 相分离模型
胶束的形成 ① 非离子型
新相的形成
动态平衡
aN
am
Kp
=
am aNj
VG0 -RT ln KP
=
-RT
ln
am aNj
17
5.4.4 胶束形成热力学
每摩尔表面活性剂形成胶束时的自由能变化
种类 A B C
HLB a b c
质量 x y z
5.6.3 HLB值的应用
增溶作用 HLB = 15~18 消泡作用 HLB = 1~3 根据HLB值可推测表活剂的可能用途 可根据HLB值选择合适的表面活性剂
27
第五章 表面活性物质
5.7 不溶物的表面膜
- 不溶性物质 (表活剂如R-COOH) 在水表面形成的单分子膜
n = nα+ nβ 但 nα ≠ cα·Vα,浓度不均匀。
7
5.3.1 表面过剩-吸附
α 相溶质的摩尔数 nα β 相溶质的摩尔数 nβ
界面相中溶质过剩量 ns = n-(nα + nβ)
单位面积的表面上过剩 (吸附量):
= ns
A
A -界面相的截面积
一般气相浓度<<液相浓度
nα + nβ ≈ nα
5.3.3 Gibbs吸附公式的应用
考察表面活性剂在界面相中的状态 ♦ 测定表活剂分子在界面上占据的面积
由σ ~ c 曲线 → Г ~ c 曲线
Гm
Гm单分子层饱和吸附量
cc 1
m Km
表面活性剂, Гm 近似看作表面浓度:
第五章涂料中的流变学与表面化学

Wa LG (1 cos ) Wi LG cos S LG (cos 1)
1800,可沾湿; <900,可浸湿; =00,可完全铺展。
表面张力低得液体有向表张力高得固体表面铺展得倾向。
16
5、2用、i表3粗示糙其粗表糙面度得: 润i 湿AALi
Ai为真实得表面积,AL为Ai得投影面积,对于液体i=1,对 于固体,i≥1。
以铺展情况为例:
E1 SGi E2 SLa LG (i a) i LG SG (i a) S E1 E2 (a i)[( SG SL )i LG (a 2i) a]
P85 18
SG SL LG cos
当界面完全接触时,即a=i,再引入本征接触角得概念,可 得
G SL ( SG LG )
粘附功 Wa G 若 Wa 0 此过程可自发进行。 若将上述过程得固体改为液体,则:
G 0 ( LG LG ) 2 LG
内聚功,反映液体自身结合得牢固度,就是液体分子间相互作用力 大小得表征。
13
2、浸湿 指得就是固体浸入液体得过程,如颜料置入漆料过程。
24
5、3流平与流挂
涂料施工后能否达到平整光滑得特性,称为流平性。
当涂料涂布于一个垂直表面时,由于重力,涂料有向下流动得倾 向,可能引起表面不平整得情况,称为流挂。
5、3、1流平性 当涂料涂刷在基材上时,会留下刷痕,刷痕可因涂料干燥前得流 动而减轻。当涂料流平性差时,肉眼可以观测到表面不平得现 象。刷痕有如一个波形。 流平用Orchard公式评价:
4
5、1、3 温度对粘度得影响
按分子热运动得孔穴理论,低分子液体得粘温关系可用 Andrad方程表示:
E
(T ) Ae RT
(E—流动活化能 ) 对某种液体,在适当得温度变化范围内,E近似为定值
表面活性剂
·表面活性剂 ·表面活性剂在界面上的吸附
·胶束理论
·表面活性剂亲水亲油平衡问题
·表面活性剂作用及应用
第一节 表面活性剂概述
一、溶液的表面张力
2 cos h gr
H2O
C2H5OH (aq)
NaCl (aq)
溶液的表面张力不仅与温度、压力有关, 并且还与溶液的种类和浓度有关。
(三)两性表面活性剂
• 两性表面活性剂基本不刺激皮肤和眼睛;在相当宽的pH值 范围内都有良好的表面活性作用;它们与阴离子、阳离子、 非离子型表面活性剂都可以兼容。由于以上特性,可用作 洗涤剂、乳化剂、润湿剂、发泡剂、柔软剂和抗静电剂。
• 主要品种:甜菜碱衍生物、咪唑啉衍生物等。
(四)非离子表面活性剂 • 非离子表面活性剂因在水中不电离以及能够精细地改变分 子结构而具有独特的性质。 • 非离子表面活性剂去除油性污垢的能力很强,而且具有防 止污垢在合成纤维表面再沉积的能力。它们的临界胶束浓 度也比离子型表面活性剂低一到二个数量级。
B、脂肪醇聚氧乙烯醚硫酸盐(AES) • 脂肪醇聚氧乙烯醚硫酸盐又称脂肪醇硫酸盐。由于分 子中加入了乙氧基使其具有很多优点,如抗硬水性强, 泡沫适中而稳定,溶解性好。缺点是在酸性和强碱性 条件下不稳定,易于水解。 • AES采用C12~C14的椰油醇为原料,有时也用C12~C16 醇,与2 ~4分子环氧乙烷缩合。再进一步进行硫酸化, 中和可用氢氧化钠、氨或乙醇胺。
0 与c成对数关系 0
②当浓度小时
cB / c o cB ln(1 ) a a 0 cB =b =kcB 0 a
0 与c成线性关系 0
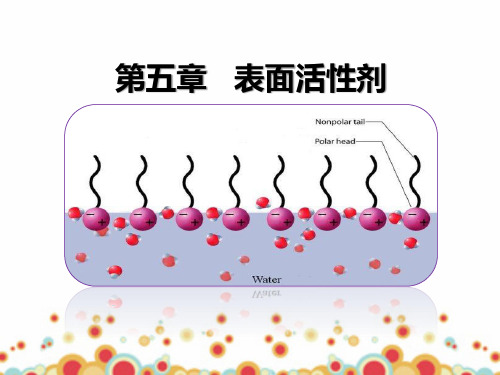
表面活性剂的分子结构: ①具有长碳链(碳原子数大于8)的极性有机化合物。 ②从结构上看,表面活性物质是两亲分子,一端亲水(-OH, -COOH,-SO3Na等),另一端亲油(憎水)(-R等)。 虽然表面活性剂分子是两亲性分子,但并不是所有的两亲 性分子都是表面活性剂,只有亲油部分足够长的两亲性物质 才是表面活性剂。
第五章 表面活性剂
5.1.2 表面活性剂的分子结构特点
分子结构具有不对称性,由非极性的(亲油的 或疏水的)碳氢链和极性的(亲水的或疏油的)基 团两部分组成,而且两部分通常分处分子链的两端。 例如棕榈酸钠(C15H31COONa)
表面活性剂在水中随着浓度增大,表面上聚集 的活性剂分子形成定向排列的紧密单分子层,多余 的分子在体相内部也三三两两的以憎水基互相靠拢, 聚集在一起形成胶束,这开始形成胶束的最低浓度 称为临界胶束浓度。
==CH—
—(C3H6O)— 0.15 氧丙烯基 —CF2— 0.870 CF3—
5.2.2 相转型温度(PIT)
HLB值存在三个缺点:
一是它没有考虑到油相与水相本身的性能;
二是它没有考虑表面活性剂浓度的影响; 三是它没有考虑到温度及各相体积的影响。 针对HLB值的缺点,日本学者筱田耕三提出了相转 型温度PIT(Phase Inversion Temperature)的概念,
1.种类: 胺盐类、季铵盐类
2.结构:含有一个五价氮原子。
3.特点:水溶性大,在酸性和碱性溶液中较稳定具
有良好的表面活性和杀菌作用。 4.应用:杀菌;防腐;皮肤、粘膜手术器械的消毒。 5.常用药物:①苯扎氯铵(洁尔灭);②苯扎溴铵 (新 洁尔灭)
5.1.2.3 两性表面活性剂
分子结构上同时具有正负电荷基团的表面活性 剂,随介质的pH可成阳或阴离子型。 常用品种:卵磷脂、氨基酸型和甜菜碱型两性离子 型表面活性剂。 最大优点:适用于任何PH溶液,在等电点时也无沉 淀。 性质:碱性水溶液中呈阴离子性质,起泡性良好、 去污力亦强; 酸性水溶液中呈阳离子性质,杀菌 力很强,毒性小。
8~10 10~13 >13
在水中分散情况
第五章--表面活性剂

表面活性剂
5.1 概 述
5.1.1什么是表面活性剂
溶质的浓度对溶剂表面张力的影响有三种:
1)物质的加入会使溶剂表面张力略微升高,属于此类物 质的强电解质有无机盐、酸、碱等;
2)物质的加入会使溶剂的表面张力逐渐下降,如低碳醇、 羧酸等有机化合物; 3)物质少量加入就会使溶剂表面张力急剧下降,但降到 一定程度后,就变得很慢或几乎不下降。
1)高级脂肪醇与环氧乙烷加成物
ROH+ nCH2 CH2 O
NaOH Cat.
R O (CH2CH2O)n H
所用脂肪醇有:月桂醇、十六醇、油醇、鲸蜡醇等
2)烷基酚和环氧乙烷的加成物
R OH + nCH2 CH2 O R O (CH2CH2O)n H
所用烷基酚有:壬基酚、辛基酚、辛基甲酚等
3)脂肪酸与环氧乙烷的加成物
单酯盐 O
性质与硫酸酯盐相近,抗电解质、硬化能力较强,洗净能力 好,为低泡性表面活性剂。可作为净洗剂、润湿剂、乳化剂、 抗静电剂和抗蚀剂。缺点:污染环境、影响水质
5.1.3.2 阳离子表面活性剂
这类表面活性剂分为两类: (1)铵盐类表面活性剂,可由高级胺 (C12-18,伯、仲、叔)用盐酸或醋酸处 理而得:
特点:水溶性好,发泡能力强,去污力强;毒性低,对皮肤刺 激性小,有良好的生物降解性和抗微生物能力,优良的抗静电 性和柔软平滑性,与其它表面活性剂相容性好。但是价格较贵。
CH3 R N CH 2 COOCH3
+
5.1.3.4
非离子表面活性剂
亲水基为羟基-OH和醚键-O-
由于亲水性较弱,必须由几个羟基或醚键才能发挥
(1)按工业用途分类:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
五、加溶
1、加溶的概念 当表面活性剂溶液的浓度增大时,表面活性剂会缔合 形成聚集体,胶团(或胶束)。 正胶团:在水相中的胶团称为正胶团,通常指的胶团即 为正胶团,能加溶不溶于水或微溶于水的油类; 反胶团:在油相中的胶团称为反胶团或逆胶团。由于油 的种类很多,油相中的胶团又统称为非水胶团,能加溶水或 极性溶剂。
2012-5-9
23
(1)有机高分子絮凝剂的分子结构与电荷密度 有机高分子絮凝剂一般为共聚物,多为无规或嵌段共聚物,有的在 高分子主链上还带有支链或环状结构。有机高分子絮凝剂为线性结构时, 一般絮凝效果较好。 无规共聚物:单体M1,M2在大分子链上无规排列,两单体在主链上 呈随机分布,没有一种单体能在分子链上形成单独的较长链段。 :~~~~~M1 M1M2 M2M2 M1M2 M1M2 M2M1~~~~~ 目前开发出的共聚物中多数是这一类,如丁二烯-苯乙烯无规共聚 物(丁苯橡胶)。 嵌段共聚物:由较长的M1链段和较长的M2链段间隔排列形成的大分 子链,根据链段的多少可以分为:二嵌段,如苯乙烯-丁二烯共聚物; 三嵌段,如苯乙烯-丁二烯-苯乙烯;多嵌段共聚物等。 对由M1,M2两种单体组成的二嵌段共聚物可表示为:~~~~~ M1M1M1M1 M1M1 M2 M2M2 M2M2 M2~~~~~
2012-5-9
6
(4)加溶于胶团的极性基层 对短链芳香烃类的苯、 乙苯等较易极化的碳氢化合物,开始加溶时被吸附于胶团水界面处,加溶量增多后,插入定向排列的表面活性剂极性 基之间,进而更深地进入胶团内核。在聚氧乙烯基为亲水基 的非离子表面活性剂胶团溶液中,苯加溶于胶团的聚氧乙烯 外壳中(下图d)。
2012-5-9 24
有机高分子絮凝剂的电荷密度取决于分子链节中可电离 基团的数量。 阳离子和阴离子型有机高分子絮凝剂溶解在水溶液中, 能离解成多价的高分子离子并带有大量反离子。许多高分子 离子是柔软弯曲的长链,在水溶液中,由于高分子离子的带 电而使柔顺的分子链变得伸展,高分子离子带的电荷越多, 伸展的程度就越大。 絮凝效率高的有机高分子,其电荷密度和分子量都需 要有一适当值。阴离子絮凝剂应具有较高的分子量和较低的 电荷密度,在水溶液中,其分子链应是柔顺并有一定伸展度 的线性结构。
2012-5-9
11
(2)表面活性剂的类型 具有同样疏水基的表面活性剂,其加溶量次序: 非离子型>阳离子型>阴离子型。 原因:非离子型表面活性剂的cmc比离子型的低,而阳 离子型表面活性剂形成的胶团较疏松,使其加溶作用比阴离 子型的强。 非离子型表面活性剂溶液: 对脂肪烃的加溶作用随疏水基链长增加而增加,但随聚 氧乙烯链长增加而减小; 对于极性有机物,加溶作用随聚氧乙烯链长增加而增加。
加溶作用与乳化作用的区别: 加溶后不存在两相,是热力学稳定体系; 乳化作用则是两种不相混溶的液体形成的液-液分散体系, 有巨大的相界面和界面自由能,是热力学不稳定的多分散体系。 2、加溶的方式 被加溶物在胶团中的加溶方式有四种: (1)加溶于胶团内核 饱和脂肪烃、环烷烃及苯等不易极化 的非极性有机化合物,一般被加溶于胶团的内核中,就像溶于非 极性碳氢化合物液体中一样(下图a)。
2012-5-9
5
(2)加溶于表面活性剂分子间的“栅栏”处
长链醇、胺等极性
有机分子,一般以非极性碳氢链插入胶团内部,而极性头处于表面活性 剂极性基之间,并通过氢键或偶极子(相距很近的符号相反的一对电荷, 如由正负电荷组成的电偶极子)相互作用(下图b)。 (3)吸附于胶团表面 一些既不溶于水也不溶于非极性烃的小分子 极性有机化合物,如苯二甲酸二甲酯以及一些染料,吸附于胶团的外壳 或部分进入表面活性剂极性基层而被加溶(下图c)。
2012-5-9
3
右图为25℃时,微溶物 2-硝基二苯胺溶解度与表面活性剂 溶液浓度曲线。 从图中可以看到,在表面活性剂 浓度小于cmc时,2-硝基二苯胺溶解 度很小,而且不随表面活性剂浓度
图1-16 2-硝基二苯胺在月桂酸钾 水溶液中的溶解度
改变。在cmc以上,溶解度随表面活性剂浓度的增加而迅速 上升。表面活性剂溶液浓度超过cmc越多,微溶物就溶解得 越多。 结论:微溶物溶解度的增加与溶液中胶团形成有密切关 2012-5-9 4 系。
2012-5-9
18
分散体系中加入与分散质点所带电荷相同的离子表面 活性剂,分散体系稳定性增加;若加入与分散质点所带 电荷相反的离子表面活性剂,分散体系稳定性下降。
分散体系中分散剂的重要作用就是防止分散质点接近 到范德华力占优势的距离,使分散体系稳定,而不致絮凝、 聚集。分散剂的加入能产生静电斥力,降低范德华力,有利 于溶剂化(水化),并形成围绕质点的保护层。
2012-5-9 16
在实际应用中,有时需要稳定的分散体,例如油漆涂料、印刷油墨 等,有时又需要破坏分散体,使固体微粒尽快地聚集沉降,例如在污水 处理、原水澄清等方面。表面活性剂对分散作用有很大影响。
2012-5-9 17
2、分散体系的稳定性 相互吸引力:小质点分散体系(胶体分散体系)中的质点, 由于质点间存在范德华引力,以及分散的质点具有较高的自由能, 所以有聚集的倾向,与泡沫、乳状液等一样,皆为热力学不稳定 的体系。 静电斥力:由于质点本身的电离或吸附带电粒子等原因,质 点表面都带有电荷,在分散介质中形成扩散双电层,使粒子在靠 近到一定距离时,因双电层的重叠而产生排斥作用,降低了粒子 间的范德华引力。 胶体的稳定性取决于质点间相互吸引力与静电斥力的相对大 小。
2012-5-9 14
(4)温度 温度对加溶作用的影响与表面活性剂的类型和加溶物的性质有关。 对 溶作用的空间变大,使极性和非极性有机物加溶量均增大。 对于聚氧乙烯醚类非离子表面活性剂,温度升高,聚氧乙烯基的水 化作用减弱,cmc降低,胶团更易形成,胶团聚集数增大。特别是温度升 至表面活性剂浊点时,胶团聚集数会剧增,胶团变大,内核也变大,使 非极性碳氢化合物和卤代烷类有机物的加溶量增加。 极性有机物加溶在胶团的表面活性剂分子之间,其加溶量随温度上 升先增加后下降,在达到表面活性剂的浊点之前会出现一个最大值。这 是因为升高温度使表面活性剂热运动加剧并增加了胶团聚集数,使加溶 量增加。继续升高温度,则加剧了聚氧乙烯的脱水作用使其容易卷缩, 导致加溶空间变小,极性有机物的加溶量减少。
2012-5-9
21
(3)防止固体微粒重新聚集 固体微粒在液体中的分散体系为热力学不稳定体系,微 粒聚集变大是自然趋势。固体分散于液体中后,需要采取有 效措施,防止固体微粒再聚集。 ①表面活性剂降低了固-液界面的界面张力,即增加了 分散体系的热稳定性; ②表面活性剂吸附在固体微粒的表面上,从而增加了防 止微粒再聚集的势垒。因此,加入表面活性剂会降低粒子再 聚集的倾向。
图1-17 加溶方式示意图 2012-5-9 7
上述四种加溶方式,其加溶量的规律:d>b>a>c。 虽然加溶方式主要取决于加溶物和加溶剂(表面活性 剂)的化学结构,但胶团溶液处于动态平衡中,加溶物的位 置随时间迅速改变,各种加溶物在胶团中的平均停留时间为 10-6~10-10s。因此,所谓加溶位置只是优选位置,并不能说 加溶物就不会存在于其他位置。 加溶的本质:由于胶团的特殊结构,从它的内核到水相 提供了从非极性到极性环境的全过渡。因此,各类极性或非 极性的难溶有机物都可以找到适合的溶解环境,而存在于胶 团中。由于胶团粒子一般小于0.1μm,加溶后的胶团溶液仍 是透明液体。 2012-5-9
2012-5-9
19
3、表面活性剂的分散作用 (1)固体粒子的润湿 润湿是固体粒子分散的最基本条件,若要把固体粒子均匀地分散在 介质中,首先必须使每个固体微粒或粒子团能被介质充分润湿。这个过 程的推动力用铺展系数表示。
当铺展系数S>0时,固体粒子就会被介质完全润湿,此时接触角为 0°。 液体中加入表面活性剂,会在液-气界面(水为分散介质)形成定 向吸附,使界面张力降低,有利于铺展系数增大,接触角变小,固体粒 子被充分润湿。
第五章 表面活性剂 5.1 概述 5.2 阴离子表面活性剂 5.3 两性表面活性剂 5.4 表面活性剂的应用
2012-5-9 1
5.1 概述 5.1.1 表面活性剂的分类 5.1.2 表面活性剂的功能及其作用
一、表面活性剂在溶液中的状态 二、泡沫 三、乳化 四、润湿 五、加溶 六、分散 七、洗涤
2012-5-9 2
2012-5-9 9
(1)表面活性剂结构 ①疏水基链长的影响:表面活性剂的链长对加溶量有明显的影响。 在同系物中,碳氢链越长,cmc越小,越易形成胶团,且胶团大小随碳 氢链增长而增加(聚集数增加)。 随着表面活性剂碳氢链的增长,非极性的烃类和弱极性的苯、乙苯 在胶团内核的加溶量会增加。下表列出了乙基苯在羧酸钾同系物水溶液 中的加溶量就说明了这一规律。 胶团对极性有机物的加溶也有类似的规律。例如,25℃时,正辛醇 在0.1mol/L油酸钠(9-十八烯酸钠,C18)溶液中的加溶量大于在十二 酸钾溶液中的加溶量,庚醇在烷基磺酸钠中的加溶量随烷基碳原子数增 加而增加。 ②疏水基结构的影响:疏水基有分支的表面活性剂,其加溶能力较 直链者小,带有不饱和结构的,加溶能力较差。这些都与cmc和胶团聚 集数有关。 2012-5-9 10
8
3、影响加溶能力的因素 表面活性剂的加溶能力可以用加溶物溶解度S与表面 活性剂溶液浓度cs 之比来表示。S/cs 越大,表面活性剂的 加溶能力越强。 影响体系加溶能力的因素:空间因素和能量因素。 空间因素:指胶团提供的容纳加溶物的可用空间大小; 能量因素:是加溶物进入胶团引起体系能量变化的影 响。 表面活性剂结构、加溶物结构、有机添加剂、温度等 会对空间和能量产生影响,进而影响加溶能力。
2012-5-9 20
(2)粒子团的分散或碎裂 粒子团的分散或碎裂涉及到粒子团内部的固-固界面分 离。在固体粒子团中常会存在缝隙,另外粒子晶体由于应力 作用也会使晶体造成微缝隙,粒子团的碎裂就发生在这些地 方。 ①表面活性剂吸附在粒子微裂缝中,会加深微裂缝,而 且可以减少固体质点分散所需的机械功; ②离子型表面活性剂吸附于粒子表面时,可使粒子中质 点获得相同电性的电荷,质点就互相排斥而易于分散在液体 中。
