第五单元化学方程式课题3 利用化学方程式的简单计算(14张PPT)
(新)人教版化学《利用化学方程式的简单计算》PPT课件 (1)

课题3 利用化学方程式的简单计算教学目标: 1、知识与技能在正确书写化学方程式的根底上,进行简单的计算。
2、过程与方法通过由易到难的题组和一题多解的训练,开阔思路,提高解题技巧,培养思维能力,加深对化学知识的认识和理解。
3、情感与价值观培养学生按照化学特点进行思维及审题、分析、计算能力。
教学重点:1、由一种反响物〔或生成物〕的质量求生成物〔或反响物〕的质量。
2、根据化学方程式计算的书写格式要标准化。
教学难点:训练和培养学生按照化学特点去思维的学方法。
教学方法:讲练结合 课 时:二课时 教学过程: 复习提问:写出以下化学方程式并说明化学方程式的涵义 (1) 氯酸钾与二氧化锰共热 〔2〕氢气复原氧化铜 引入新课:〔情景设计〕根据化学方程式的涵义,反响物与生成物之间的质量比可 表示为:2KClO 3==2KCl +3O 2↑ 245 149 96假设 〔 〕g 〔 〕g 48g同理: C + O 2 == CO 2 12 32 44假设 〔 〕g 〔 〕g 22g讲解:这说明:在化学反响中,反响物与生成物之间质量比是成正比例关系,因此,利用正比例关系根据化学方程式和的一种反响物〔或生成物〕的质量,可生成物〔或反响物〕的质量。
讲授新课△点燃根据化学方程式的计算例1:加热分解5.8克氯酸钾,可得到多少克的氧气? 提问:怎样计算?〔在引入的根底上学生答复〕 讲解:解题步骤:设、方、关、比、算、答 设:设未知量方:写出正确的化学方程式〔配平〕关:找关系〔写出有关物质的相对分子质量与计量数的关系,然后再写出量与未知量质量关系,并写在化学式下面。
比:列出正确的比例式算:计算正确答案〔保存小数点一位〕 答: 说明:书写格式[解]:设:可得氧气的质量为x 。
生成氯化钾的质量为y ………………〔1〕设2KClO 3 == 2KCl +3O 2↑…………〔2〕方245 149 96…………〔3〕关5.8g y xx g 968.5245= yg 1498.5245= …………〔4〕比 x=2.3g y=3.5g …………〔5〕算 答:分解5.8克氯酸钾可得到氧气2.3克 …………〔6〕答练习:假设将[例题1]改为:实验室要制取2.3克的氧气。
初中利用化学方程式的简单计算(共31张PPT)

56
2
65
2
m
x
m
y
7、加热15.8g高锰酸钾,当产生1.6g氧气时,固体剩余物的成分是( )
A
A.K2MnO4和MnO2
B.KMnO4、K2MnO4和MnO2
C.KMnO4和MnO2
D.KMnO4和K2MnO4
思路:根据氧气的质量来求生成这么多氧气需要分解多少克高锰酸钾。要注意到15.8克
高锰酸钾有可能没有全部分解。所以15.8克这个数据在此不能直接用于计算。
316 ∶
197 ∶ 87 ∶ 32
65 2 14、有X、Y两种元素,12gX2与XY3反应生成24gC,若反应的化学方程式为X2 + XY3 === 3C,则X、Y两元素的相对原子质量之比为(
= )
13g 2KClO3 ==== 2KCl + 3O2↑
X
(2)气体、液体的体积,要换算成气体、液体的质量。
65
2
5g-3.7g
X
65
2
1.3g = X
X = 0.04g
答:生成氢气的质量为0.04克
4、把23克乙醇(俗称酒精)在空气中充分燃烧后,只生成27克水和44克二 氧化碳,由此推断乙醇由几种元素组成?
思路:乙醇中肯定有什么元素? 为什么有? 乙醇中的C元素、H元素的质量是多少? 怎么计算?
C:44克× H 27克×
65
1
2CX.铁+ 生Y2锈=以=后= 2总Z2质K量M 比原n来O铁的4=加质==量热=大 K2MnO﹢4 MnO2﹢ O2
该 A.物煤质燃中烧碳后、剩氢余元2煤素×渣的的1质质5量8量比小为于3煤︰的1 质量
32
6g A.CH4 B.C2H2 C.CH3OH D.C2H5OH
九年级化学人教版上册第五单元课题3《利用化学方程式的简单计算》课件

第五单元 化学方程式
12.在反应A+3B===2C+3D中,C与D的相对分子质量比为22∶9。
若2.3 g A与足量B充分反应,生成2.7 g D,则在此反应中,参加反应的B
与生成C的质量比为
( B)
A.3∶2
B.12∶11
C.8∶11
D.35∶33
第五单元 化学方程式
13.把A、B、C、D四种纯净物放在一密闭容器中,在一定条件下 充分反应,反应前后各物质的质量如下表。
245
96
x
9.6 g
2x45=99.66g
x=24.5 g
故原混合物中二氧化锰的质量是30 g-24.5 g=5.5 g。
答:原混合物中二氧化锰的质量是5.5 g。
第五单元 化学方程式
15.现有含一定杂质的高锰酸钾样品8.78 g,加热使之完全反应(杂 质不反应),制取了0.56 L氧气(对应条件下氧气的密度为1.429 g/L),试 计算:
第五单元 化学方程式
解:设生成的氢气的质量为x。
CH4=催=高化=温=剂=C+2H2
16
4
32 t
x
146=32x t
x=8 t
答:32吨甲烷裂解,可制得氢气的质量为8吨。
第五单元 化学方程式
能力题
第五单元 化学方程式
10.在化合反应2A+B2===2AB中,A与B2反应的质量关系如右图 所示,现将6 g A和 8 g B2 充分反应,则生成AB的质量是 ( C )
C.②①⑤③④
D.①②⑤③④
第五单元 化学方程式
4.四名学生计算 30 g 碳与足量的氧气反应,可以得到多少克 CO2 时,出现了以下几种算式(x 表示 CO2 的质量),其中正确的是( B )
人教版九年级化学上第五单元课题三利用化学方程式的简单计算教学课件共15张PPT

1×(2×16)
6.3g 2×158 (4)列出比例式········· x 32 32 × 6.3g =0.6g (5)求解············· x= 2×158
x
答:加热分解6.3g高锰酸钾,可以得到氧气的质量为0.6g。 (6)简明地写出答案··
活动元二 构建计算模型
环节一 自主学习 引领示范
2KMnO4 K2MnO4 + MnO2 + O2↑
36
32
316
32
一解二设最后答,方程书写不能差,
准确找到质量比,纯量代入不掺假,
所有单位要一致,列式计算解决它。
谈谈我的收获 感谢您的聆听!
5、规范“解”、“答”
活动元三 体会计算意义
环节一 自编题目 学以致用
【活动内容】 结合已知信息,小组合作,编写 一道有关木炭完全燃烧的化学方 程式的计算题。
已知:木炭有3kg
【题目编写要求】: (1)书写工整; (2)清楚简洁。
活动元三 体会计算意义
环节二
通电
思维延伸
提升素养
△
【比一比】产生等质量的氧气,H2O和KMnO4谁消耗的更多? 2H2O 2H2 + O2
电
活动元二 构建计算模型
环节三 总结计算过程中值得注意的地方
活动要求: 1、设 x 不带单位
1、小组成员互相帮助,用红笔改正错误; 2、正确书写化学方程式(配平、条件、“↑或↓”) 2、共同总结:计算过程中值得注意的问题; 3、算对相对分子质量,找准质量比关系 3、将小组讨论结果记录在学案上,交流分享。 看哪个小组的总结又快又全面! 4、单位规范、统一
圈画关键字 归纳步骤
阅读教材 自学例1
人教版九年级上册 第五单元 课题3《利用化学方程式的简单计算》课件

练习2 (1)氢气在氯气中燃烧生成氯化氢气体,写出该反应的 化学方程式,并计算燃烧100g氢气需要氯气的质量是多 少?生成氯化氢气体的质量是多少?
(2)锌与盐酸(HCl)反应生成氢气和氯化锌。实验室 里用6.5g锌与足量盐酸反应,可制得氢气和氯化锌的质 量各是多少?
根据质量守恒定律计算
例1:有氯酸钾和二氧化锰混合物15克,加热使它 完全反应,结果发现试管内固体物质为10.2克,试 回答: (1)生成多少克氧气? (2)充分反应后,试管内含有那些固体物质?其质量 分别为少克?
1、 把干燥纯净的氯酸钾和二氧化锰混合物19.6克放入大试 管,给试管加热来制取 氧气,在反应不再发生后,等试管冷 却称量,得14.8克固体物质,问:
(1) 制得氧气多少克? (2) 14.8克固体物质里含有哪些物质各为多少克?
(1) 4.8克 (2) 氯化钾7.45克,二氧化锰7.35克
2、把氯酸钾和二氧化锰的混合物16克,加热至不再有气体放出,冷 却后称得剩余固体质量为11.2克。 1)求反应所生成的气体的质量? 2)混合物中氯酸钾的质量? 3)二氧化锰在化学反应前后所占的质量分数? 4)生成的氯化钾质量是多少?
方程式中任意两者互成正比例关系
例题1 加热分解6.3g高锰酸钾,可以得到氧气的质量是多少?
(计算结果保留一位小数)
步骤: 1、设未知量
【解】设:可以得到氧气的质量为x。
2、写出反应的化学方
程式,注意:配平
2 KMnO4 = K2MnO4 +MnO2 + O2
3、写出已知物质的化 学计量数与相对分子 质量的乘积和已知量、 未知量
(1)在这三次实验中,第
次刚好完全反应。
(2)在第
次实验中硫有剩余,剩余
九年级化学5.3利用化学方程式的简单计算优秀课件
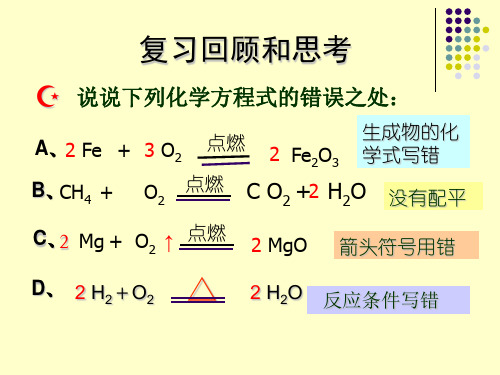
练1: 工业上高温煅烧石灰石(CaCO3)可制得生石
灰(CaO)和二氧化碳,如果要制取10 t 氧化钙,需要
碳酸钙多少 t ?
解:设碳酸钙的质量为x。
Ca — 40
高温
CaCO3 ==== CaO + CO2↑
100
56
C — 12 O — 16
x
10t
100
x
=
56 10t
x = 18t
答:需要碳酸钙18t。
题型二:坐标图形不纯量型
例题2:欲测定某实验室保存的高锰酸钾样品的 纯度.取该样品20g加热使之充分反应,反应过程 中产生氧气的质量与反应时间的关系如图所示.
计算:高锰酸钾样品中高锰酸钾的质量分数.
分析:(1)根据图示,拐点表示 高锰酸钾完全反应生成氧气质量 为1.6g。
(2)根据化学方程式,由 已知量氧气质量求出未知量高锰酸钾的质量。
2KMnO4 === K2MnO4 + MnO2 + O2↑
2×158
32
6g
x
2×158 6g
=
32
x
x = 0.6g
答:可得0.6g氧气。
提醒: 1.只需算参加计算的物质的质量比; 2.除未知数不带单位,其余的都要带单位。
根据化学方程式计算的步骤:
1. 设未知量 (未知量不带单位,已包含了单位)
改正时不如另写正确的格式
练2.实验室用34g过氧化氢和少量二氧化锰混合制 氧气,能到多少g氧气? ( H — 1 ,O — 16 )
小明解法如下:
解:设氧气xg
• 解:设氧气质量为x
H2O2 === H2↑+ O2↑
34
32
人教版九年级上册化学课件:第五单元 课题3 利用化学方程式的简单计算(共15张PPT)
1.初步学会根据化学方程式进行简单的计算。 2.理解有关化学方程式计算的基本思路和解题步骤,提高分析问题和解决问题的能 力。 3.初步认识定量研究化学反应对于社会生产和生活的重要意义。
一、利用化学方程式的计算依据 1.理论依据: 质量守恒 定律。
2.计算依据:化学方程式中各物质的质量比在数值上等于 学计量数 的积之比。
A.化学方程式表示了参加反应的物质是什么,反应后生成的物质又是什么
B.化学方程式表示了一种化学反应的过程
C.在化学方程式中,各反应物的质量比等于各生成物的质量比
D.化学方程式表示了反应前后反应物和生成物的质量关系
2.(2017 天津)已知 A+3B 2C+3D 中,2.3 g A 跟 4.8 g B 恰好完全反应生成 4.4 g
,求解。
5.答:简明地写出答案。
与化学计量数的乘积及
化学方程式要配平,需将纯量代方程;关系式对关系量,计算单位不能忘;关系量间成 正比,解设列答要记牢。
1.12 g碳在氧气中充分燃烧,生成二氧化碳的质量是( C) A.24 g B.36 g C.44 g D.12 g 2.结合镁燃烧的化学方程式,计算各物质间的质量关系。
谢谢观赏
You made my day!
我们,还在路上……
化学方程式 各物质质量比
已知所求
2Mg+ 48
O2
2MgO
32 80
24 g 16 g
40 g
探究点一:利用化学方程式计算的依据 1.依据化学方程式计算出的各物质的相对质量比与实际质量比有什么关系?
答案:由于 物质的质量比 是依据质量守恒定律计算出来的,体现了化学反应由 微观到宏观的过程,因此根据化学方程式计算出的 各物质的相对质量比 等于 实际质量比 。
人教版化学-九年级上册-第五单元课题3利用化学方程式的简单计算
知识点二 利用化学方程式计算的步骤 4.金属氢化物可以快速与水反应制取氢气,如氢化锂(LiH)与水发生反应 的化学方程式为LiH+H2O LiOH+H2↑。若制取10 g氢气,需要消耗 多少克氢化锂?
答案 解:设需要消耗氢化锂的质量为x。
LiH+H2O LiOH+H2↑
8
2
x
10 g
8∶x=2∶10 g
生成氯化钾的质量为4.47 g。
求:(1)生成氧气的质量为
g。
(2)原混合物中氯酸钾的质量分数。
答案 (1)2.88 (2)设10 g混合物中氯酸钾的质量为x。
2KClO3 2KCl + 3O2↑
245
149
x
4.47 g
245= x
149 4.47 g
解得:x=7.35 g
原混合物中氯酸钾的质量分数为:
“a g氯酸钾”,其他物质的质量不变,则a的取值范围是
。
答案 (1)O2 11.18 g (2)通过计算得出氯化钾的质量为11.18 g,大于 10.8 g (3)7.8 g<a≤12.83 g
解析 (1)根据质量守恒定律可知,氧气的质量就是反应前后混合物质 量的差值,然后结合化学方程式即可计算出KCl的质量;(2)通过计算得 出KCl的质量大于10.8 g,故题目所给数据有问题;(3)假设氯酸钾完全反 应,剩余固体是氯化钾和二氧化锰,所以氯化钾的质量为10.8 g-3 g=7.8 g, 结合化学方程式可以计算出氯酸钾的质量为12.83 g;若氯酸钾未分 解,则其质量为10.8 g-3 g=7.8 g,所以7.8 g<a≤12.83 g。
x 44
B. 12= 30 g
课题3 利用化学方程式的简单计算-九年级化学上册课件(人教版)
为
。
解:设消耗乙的质量为x。
C3H8 +5O2 点燃 3CO2 +4H2O 44 5×32
22 kg x
2424kg=
5×32
x
x = 80 kg
答:消耗乙的质量为80 kg。
4 4)g
8g
: 32 :( 32 )g :( 64 )g
: 36 : 36 g
:(72 )g
①生成36g质量的水,需要多少克的氢气和氧气? ②8g的氢气和多少克的氧气,生成多少克的水? 相对分子质量乘以化学计量数之比等于实际质量之比
一、利用化学方程式进行计算的步骤 例1:加热分解6.3g高锰酸钾,可以得到氧气的质量是多少?
相对原子质量:O—16 K—39 Mn—55
1.设未知量 解:设可以得到氧气的质量为X。
2.写方程式
3.找质量比
4.列比例式
5. 求解 6. 答
X=0.6g 答:可以得到氧气的质量是0.6g
小技巧
2*158X=6.3g*32
相对分子质量乘以化学计量 数之比等于实际质量之比
例2:工业上高温煅烧石灰石(CaCO3)可制得生石灰(CaO)和 二氧化碳,如果要制取5.6t氧化钙,需要碳酸钙的质量是多少?
5.乙醇俗称酒精,可用作医用消毒,也常作燃料。其完全燃 烧的化学方程式可表示为:C2H6O+3O2 2CO2 + 3H2O 。 1.23g乙醇完全燃烧需消耗多少克氧气?
6.工业上用电解氯化镁来生产金属镁: MgCl2 Mg+Cl2↑。电解190kg氯化镁理论上能生产 多少千克镁?同时能得到多少千克氯气? (Mg-24 Cl-35.5)
铁的质量是多少? 解:设需要消耗铁的质量为x
2019年秋九年级人教版化学上册课件:第五单元 课题3 利用化学方程式的简单计算(共40张PPT)
(2019辽宁辽河油田兴隆台第一初中期中,36,★★☆)取47.4 g 高锰酸钾, 加热一段时间后停止,共收集到3.2 g氧气。计算: (1)参加反应的高锰酸钾的质量。 (2)剩余固体中氧元素的质量分数(计算结果精确到0.1%)。
答案 (1)31.6 g (2)36.2%
解析 (1)设参加反应的高锰酸钾的质量为x。
15 g-9 g=6 g。该反应的化学方程式可表示为aA+dD bB+cC,要
求A、D的化学计量数之比,可根据化学方程式计算如下:
aA+ dD bB+cC
2na 3nd 6g 9g
答案 A
变式训练
14.0 g硫在一定量的氧气中燃烧,记录数据如下:
实验次序
1
氧气的质量/g
4.5
二氧化硫的质量/g
知识点 利用化学方程式的简单计算 1.利用化学方程式的计算依据:化学反应中各物质的质量关系。 2.利用化学方程式进行计算的解题思路
3.利用化学方程式计算的步骤 利用化学方程式计算的步骤可概括为:“设、方、关、比、算、答”。 ①设未知量,常用x、y等表示,未知量通常不带单位; ②正确完整地写出相应的化学方程式; ③在相关物质的正下方写出相对分子质量与化学计量数的乘积,以及对 应的已知量、未知量; ④依据质量关系列出比例式; ⑤算出未知数; ⑥简明地写出答案。
学法指导
利用化学方程式进行计算时,所书写的化学方程式必须配平,然后利用
物质之间的质量比进行计算,各物质间的质量比即各物质的相对分子质
量(或相对原子质量)与其化学式前面的化学计量数的乘积之比,计算时
特别注意不要漏掉前面的化学计量数。
例 在实验室里,电解5.4 g水,可生成氢气的质量为多少克?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
t3 2.34
仔细分析实验数据,回答下列问题:
t4 2.34
(1)在__时间后,该样品是的氯酸钾已完全分解 (2)求完全反应后放出氧气的质量? (3)求该样品氯酸钾的质量分数?
解:(1)在t3时间后,该样品是的氯酸钾已完全分; (2) 生成氧气2.5g+0.3g-2.34g=0.96g; (3)设样品中含氯酸钾的质量为x;
CaC03 + 2HCl═ CaCl2 + H2O + CO2 ↑
100
44
X
66g
100 : X = 44: 66g X=100×66g÷44=150g
_水2_垢0_0中_g _C×aC10030的%质=量75分%数为:
答:4分钟后,水垢中的CaC03反应完全,该水垢中 CaC03的质量分数为75% 。(假设和答原则上不设分, 但不写假设或答扣0.5分)
回顾上节要点
化学方程式表物及反应条件;
(2)微观上 表明了反应物和生成物各物 质的粒子个数之比; (3)质量上 表明了反应物和生成物各物质的质 量之比(即各物质的相对分子质量与化学式前的 计量数的乘积之比);
2H2 + O2
2×1×2 32 4 : 32
点燃 2H2O
2(1×2+16) : 36
审题思考: 1.该题的计算涉及到了哪个反应? 2.已知的物质和所求的物质各是什么? 3.已知的物质属于反应物还是生成物?所求 的物质属于反应物还是生成物? 4.解题步骤分哪几步?
例题1:加热分解6.3g高锰酸钾,可以得到氧气 的质量是多少? (有关的相对原子质量:K—39 ;O—16; Mn—55)
∆
2X158 32
x=
6.3g
=x
32 X 6g =
2X158
0.6g (单位不丢弃)
实验室要用9.6g氧气做实验。小红同学提议 利用分解过氧化氢的方法来制取氧气。那么, 请你帮小红同学计算一下,至少需要准备多 少过氧化氢?生成水多少?
2H2O2 =M=nO=2= 2H2O + O2↑
(温馨提示:H:1 O:16)
2H2O2 =M=nO==2 2H2O + O2↑
68
32
X
9.6g
6___8__ 32
=_9_X.__6_g
X=20.4g 生成水的质量=20.4g-9.6g=10.8g
答:制取9.6g氧气需要20.4g过氧化氢,生成水 10.8g。
化学计算简单归类
用16克氯酸钾与二氧化锰的 混合物加热,到不再有气体产生 后,残余固体质量为11.2克,问 产生氧气的质量是多少克?同时 产生了多少克氯化钾?
时间 /min
1
2
3
4
5
质量/g 30
50
60
66
66
试回答下列问题:
(1)4分钟后,产生的CO2 不再增加,说明水垢中CaCO3
(填已或未)
反应完全?
(2)该水垢中CaCO3 的质量分数是多少?
19. (5分)解: ①从测量数据表中看出,4分钟以
后二氧化碳的质量不再增加,说明水垢中的CaC03已经 反应完全,最后只能产生CO2气体66g 。 ②设水垢中CaC03的质量为X,则有:
2KClO3=M△=nO=22KCl+3O2 ↑
245
96
x
0.96g
245 96 x = 0.96g
245x 0.96g X=
=2.45g
样品氯酸钾的质量分数= 2.45g/ 2.5g ×100%=98%
答:样品中含氯酸钾的质量为98%
12.(5分)长久使用的热水瓶底部有一层水垢,主要成分是 CaCO3 和Mg(OH)2,某学校化学研究小组的同学通过实验测定水 垢中CaCO3 的含量:取200g水垢,加入过量的稀盐酸,同时测量5 分钟内生成气体的质量,结果如下表:
2,为了测定实验中氯酸钾样品的纯度,某学习小组取 2.5g该样品与0.8g二氧化锰混合,加热该混合物t1时间 后(假设杂质不参加反应),冷却,称量剩余固体质量, 重复以上操作,依次称得加热t1、t2、t3、t4时间后剩余 固体质量,记录数据如下:
加热时间 t1 剩余固体质量/g 2.48
t2 2.41
