(整理)相关异黄酮合成的部分代谢途径图
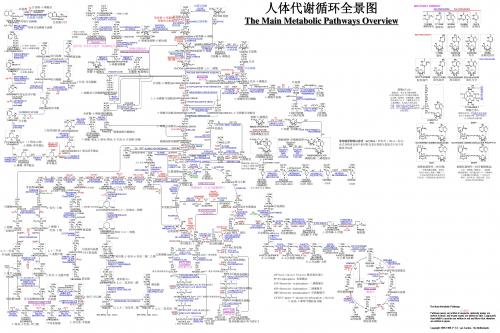
人体8大代谢途径全景图
7-磷酸景天庚酮糖 1,3-双磷酸甘油酸盐 3-磷酸羟基丙酮酸
3-磷酸丝氨酸
甘氨酸
预苯酸
赤藓糖-4-磷酸 分支酸 2-磷酸甘油酸盐 3-磷酸甘油酸盐 2,3-双磷酸甘油酸盐 核糖-5-磷酸盐 o-乙酰丝氨酸 半胱氨酸
辅酶A是一种含有泛酸的辅酶, 在某些酶促反应中作为酰基的载体。 由泛酸、腺嘌呤、核糖核酸、磷酸 等组成的大分子,与醋酸盐结合为 乙酰辅酶A,从而进入氧化过程。 对糖、脂肪及蛋白质的代谢起重要 作用,其中对脂肪代谢的促进作用 更加重要。
乙酰辅酶A
柠檬酸盐 顺乌头酸 苏氨酸
高丝氨酸-0-磷酸盐 高丝氨酸 天门冬氨 4-天冬氨酰磷 酸-4-半醛 天门冬氨酸
草酰乙酸 三羧酸循环(又名柠檬酸循环)
咪唑-丙酮醇-磷酸盐
赤式-咪唑-甘油-磷酸盐
组氨醇-磷酸盐
组氨醇
组氨酸
丙酮酸
2-氧代-丁酸
o-琥珀酸-高丝氨酸
2,3-二氢吡啶二羧酸
苹果酸盐 乙醛酸循环
甘露糖-6-磷酸盐
5-磷酸核酮糖
邻氨基苯甲酸 -N-核酸-磷酸盐
果糖-1,6-二磷酸 核糖-5-磷酸盐 苯丙酮酸 木酮糖-5-磷酸盐 糖酵解 甘油醛-3-磷酸盐
二羟丙酮磷酸盐
甘油激酶
4-羟基-苯丙酮酸
甘油-3-磷酸盐脱氢酶
甘油-3-磷酸盐
丝氨酸 辅酶A(CoA):
脱氧胸苷
脱氧胞苷
脱氧腺苷
脱氧鸟苷
邻氨基苯甲酸
异柠檬酸盐
谷氨酰胺
2-醋酸 -乳酸盐
2-醋酸-2 -羟基-丁酸
胱硫醚
哌啶-2,6-二羧酸
延胡索酸
酮戊二酸盐
谷氨酸盐
谷氨酰磷酸盐
谷氨酸-5-半醛
次生代谢—黄铜的合成通路相关

次生代谢—黄铜的合成通路相关14应用生物科学,1443204000306,王晓云摘要:黄酮类化合物是是一类植物中分布很广且非常重要的多酚类天然产物,黄酮足一类具有抗炎,抗菌,抗病毒等作用的化合物.本文综述了黄酮类化合物的重要合成方法及其最新发展。
从黄酮的分子结构,理化性质等方面入手,研究黄酮合成的通路。
同时,也阐述了一些黄酮的其他性质及在生产生活中的作用。
关键字:黄酮合成通路苯环Baker—Venkaetaraman法引言:黄酮几乎存在于所有绿色植物中,尤其以芸香科,唇形科,石南科,玄参科,豆科,苦苣苔科,杜鹃科和菊科等高等植物中分布较多。
据估计,经植物光合作用所固定的碳2%转变为黄酮类化合物或与其密切相关的其他化合物。
[1] 黄酮类化合物泛指两个苯环(A一与B一环)通过中央三个碳原子相互连结而成的一系列化合物.黄酮类化合物结构中常连有酚羟基、甲氧基、异戊烯基等官能团。
由于其具有抗炎,抗菌,抗病毒等作用,长期以来受到很多人的关注。
随着取代基及其取代位置的不同,而具有不同的物化性质和药理活性。
天然黄酬中,C-5和C-7位有羟基或苯环上有3个羟基的黄酮的活性较高。
而在非天然的黄酮类化合物中,7位羟基被其他基团取代之后仍具有很好的活性旧。
传统的合成方法足采用Baker—Venkaetaraman法重排来合成黄酮类化合物。
[2]随着科技的发展,黄酮合成的方式趋于多样化。
本文通过了解黄酮的基本结构等特征,来总结一些黄酮的传统合成方法及新的合成方法。
1.黄酮化合物的基本结构及生物合成途径1.1.基本结构黄酮(flavonoids)是一类其骨架具有15个碳原子组成的化合物(C6—C3—C6),骨架中含有两个苯环,一个苯环由一个C3部分桥连,C3部分可以是脂肪链,也可以是C6部分形成的六元或五元氧杂环,见图1。
[1]图1 黄酮的基本骨架1.2.黄酮的生物合成1.经过多年的研究,科学家们认为黄酮类化合物是由莽草酸途径和多酮化途径生物合成的产物,黄酮的基本骨架是由3个丙二酰辅酶A(malonylCoA)和1个香豆酰辅酶A(coumaroylCoA)生合而产生的。
异黄酮合成代谢调控关键酶CHS、CHI的特性与研究前景

异黄酮合成代谢调控关键酶CHS、CHI的特性与研究前景第26卷第5期2007年1O月大豆科学SOYBEANSCIENCEV oI_26No.5Oct.2007异黄酮合成代谢调控关键酶CHS,CHI的特性与研究前景李莉,孙欣.,马君兰,赵越(1.东北农业大学,哈尔滨150030;2.黑龙江省农业科学院大豆研究所,哈尔滨150086)摘要查尔酮合酶(Chalconesynthase,CHS)与查尔酮异构酶(Chalconeisomerase,CHI)是异黄酮合成途径中的两个关键酶,它们在植物中的表达效率直接影响到异黄酮的产量.本文综述了植物CHS,CHI的功能,特性,基因结构,进化以及基因表达调控等方面研究的新进展,并对CHS,CHI研究的应用前景进行了展望,在此基础上提出了从根本上提高异黄酮产量的可行途径以及一些亟代解决的问题.关键词异黄酮;查尔酮合酶(CHS);查尔酮异构酶(CHI)中图分类号Q814文献标识码A文章编号1000—9841(2007)05--0762--04 PROGRESS0NKEYENZYMESCHS,CHIOFISOFLAV0NESSYNTHESIZELILi,SUNXin",MAJun—lan,ZHAOYue(1.NortheastAgriculturalUniversity,Harbin150030:2.SoybeanResearchInstituteofHeilongjiangAcademyofAgriculturalSciences,Harbin150086)AbstractChalconesynthase(CHS)andChalconeisomerase(CHI)arethekeyenzymesinisof ia—vonessynthesize,andvariationoftheirexpressionmightaffectthecontentofisoflavones.Th efunction,character,genestructure,geneevolutionandexpressioncontrolofCHSandCH1we resummarizedinthispaper.TheapplicationforegroundofCHSandCH1werealsoprospected, andthemeanstoincreaseisoflavoneswereadvised.KeywordsIsoflavones;Chalconesynthase(CHS);Chalconeisomerase(CHI)异黄酮(Isoflavone)是植物生长过程中形成的次生代谢产物,是生物黄酮中的一种,也是一种植物雌激素,主要是指以3一苯并吡喃酮为母核的化合物,动物体内不能合成.它主要包括大豆黄素(Daidzein),染料木素(Genistein),6一甲氧大豆素(Glycitein)三种游离型甙元和它们的九种葡糖苷.收稿日期:基金项目:作者简介:通讯作者:2006—12—30黑龙江省教育厅资助课题(10551024)李莉(1977一),女,硕士研究生,研究方向植物生理生化.赵越,E—mail;yuezhao一**************;Tel1393613,1116大量的实验表明:异黄酮在植物体内可作为保护性物质,保护植物正常生长,抵制病虫侵害;在动物体内能降低胆固醇,预防癌症,预防骨质疏松,促进繁殖,泌乳和生长等,显示了异黄酮可以作为动物生长的调节剂和促进剂,使其成为动物营养学的研究热点之一[.然而,在自然界中异黄酮的资源十分有限,只局5期李莉等:异黄酮合成代谢调控关键酶CHS,CHI的特性与研究前景限于豆科的蝶形花亚科等极少数植物中,如大豆,墨西哥小白豆,苜蓿和绿豆等植物中,其中异黄酮含量最高的只有苜蓿和大豆(故称为大豆异黄酮),在含量最高的大豆中所含的异黄酮也仅为0.1~0.5.因此研究异黄酮合成的关键酶基因的表达规律,不但可以在分子生物学领域找到提高异黄酮相对含量的方法,而且在深入利用异黄酮资源方面具有极大的应用价值.异黄酮的生物合成途径是研究最早且较深入的次生代谢途径之一,大量研究已经大体揭示了异黄酮生物合成途径(图1):对香豆酸辅I~A(4?Coumaryl-CoA)丙二酰辅酶A(Malonyl—CoA) HS)查尔~j(Chalcone)l查尔酬异构酶(CHI)'类黄flleJ(Flavones)图1植物体内异黄酮合成代谢的一般途径Fig.1Thegeneralpathwayofisoflavone synthesisandmetabolisminplant从图上可知:异黄酮合成途径是植物类黄酮代谢途径的一个分支,部分参与异黄酮合成的酶与参与其它类黄酮类物质(如花色素苷元等)合成的酶相互交叉.其中特别值得提出的是CHS和CHI,作为异黄酮合成途径中的两个关键酶,其表达量的改变或表达功能的丧失及酶的失活都将直接影响到黄酮类代谢产物的量j,所以越来越多的人把目光集中在这两种酶的研究上.1CHS,CHI研究的新进展1.1查尔酮合酶(或苯基苯乙烯酮合酶.Chaleone synthase,CHS)1.1.1CHS蛋白的基本功能CHS蛋白为类黄酮合成途径中的第一个特异性酶,它不需要辅助因子,在特定物种中,CHS蛋白和一个依赖NADPH的还原酶协同作用,催化该途径的第1步反应,即1分子4一香豆酰一CoA与3分子丙二酰一CoA缩合形成查尔酮(又称苯基苯乙烯酮,Chalcone).查尔酮为其它类黄酮(如花色素苷元,异黄烷酮,黄酮醇等)合成提供基本骨架,所以说CHS蛋白催化的反应是整个类黄酮合成途径的重要限速步骤.1.1.2CHS蛋白的基本特性对CHS蛋白的X射线衍射,表明该酶是一个同源二聚体蛋白,有2个功能互相独立的亚基,每个亚基的分子量为4O~45 kDaEs].不同植物问,CHS蛋白氨基酸同源性一般在85以上,表明不同植物的CHS蛋白具有高度的保守性,而这种一级结构的高度的保守性,也说明了不同植物的CHS蛋白功能的高度一致性.比如,被子植物和松柏科植物间CHS蛋白的氨基酸序列同源性高达9O.1.1.3CHS基因的结构CHS基因是世界上第一例从经紫外线辐射的欧芹(Petroselinumhor—tense)悬浮培养细胞中分离的类黄酮生物合成基因],目前EMBL数据库中有来自于19个科8O多个CHS基因编码区全序列.不同植物之问,CHS基因的编码区比较保守,长约1.2kb,不同科问DNA的同源性达6O以上. CHS的基因结构也非常保守,据报道除金鱼草的一个CHS基因AMCHS含有两个内含子外],其余的都只有1个内含子,而且这个内含子的位置在已发现的序列中均相同,即位于第65位(以欧洲赤松的PSCHS为标准)的半胱氨酸密码子内第1和2 位碱基之间,其长度从几十碱基对到几千碱基对不等.外显子I编码约57~64个氨基酸,外显子2编码约340个氨基酸,对CHS基因外显子2氨基酸序列进行排序,结果表明,CHS基因的外显子2比较保守,没有大的插入,缺失突变,科间氨基酸同源性一般在7O以上【6j.不同植物之间,CHS基因拷贝数目差异很大],而且功能上存在明显差异.如,金鱼草和拟南芥的基因组中都只含单个的CHS基因拷贝,菜豆有6~8个,水生三叶草至少有9个,矮牵牛中有12 个,非洲菊中有3个.同一植物体内虽然也存在CHS多个编码基因,但在不同品系中的表达活性不同.如:Pinusstrobus中的CHS1和CHS2基因编码的蛋白质有88的同源性,但CHS1催化查尔酮合成,CHS2催化二酮基CoA与甲基丙二酰CoA 的缩合反应;矮牵牛中至少有8个CHS基因,有的品系有一个基因表达活性高,有的品系有2个基因表达活性较高.1.1.4CHS基因的进化CHS基因是一个多基因家族,依据类黄酮物质存在与否,推测该基因最早出现在藓类,在CHS基因的进化中基因重复一分歧大豆科学5期(duplication—divergence)是经常发生的事件.攀枝花苏铁的两个克隆CPAI和CPAS分布在相距很远的分支中,说明CHS基因的重复在裸子植物就已经发生,依据已有数据,欧芹,拟南芥和金鱼草中似乎都只存在一个拷贝,而在其他物种中均有多个, 其中豆科的拷贝数最多,但在分支图上,豆科的27 个序列却只形成一组,即这些序列重复发生在豆科分化之后.以上分析说明CHS基因在不同的科中发生的重复和丢失的情况不同,因此,很难确定直系同源的CHS基因成员,从而很难用此基因进行被子植物科间系统发育的研究.1.1.5CHS基因的表达调控CHS基因的表达能被光照[,生理钟【1..,低温"],BA和GA5],脯氨酸及碳水化合物,P蛋白[1等所调节.CHS基因的表达也是与其它基因相互作用的结果,如FIN2,FJN5基因的突变导致CHS表达受损伤口,而L兀厂Tl和ICXI基因的突变则导致CHS基因表达水平的提高口引.1.2查尔酮异构酶(或查尔酮一黄烷酮异构酶, Chalconeisomerase,CHI)1.2.1CHI蛋白的基本功能CHI蛋白是第一个被认识的与类黄酮合成相关的酶,它催化分子内环化反应,通过选择性地连接一个在结构上有益于闭环的离子化的查耳酮,使双环的查耳酮变为有生物学活性的三环的(S)一黄烷酮,即形成第1个类黄酮产物.CHI催化活性具有pH依赖性,在pH7.5时,其催化活性为90,而在pH6.0时,其催化活性则为50L1.这一步反应也可以在没有CHI蛋白的条件下在植物体中缓慢自发进行.1.2.2CHI蛋白的基本特性CHI蛋白以单体的形式普遍存在于大多数植物中,分子量因植物组织而异,约24~29kDaL1.通过比较发现,不同植物CHI蛋白的氨基酸序列同源性在50以上,存在明显差异,但这一差异集中在靠近N端与C端的部分氨基酸残基上,这说明在整个进化过程中,CHI蛋白的进化是趋于保守的.CHI蛋白的1.85A分辨率晶体结构显示,它具有一个奇怪的口一三明治折叠,这种三维结构的特异性可能与其催化活性的立体化学特异性有关,活性位点裂口的拓扑学效应限制了环化反应的立体特异性L1.CHI基因序列家族及其蛋白的这种三维折叠结构在植物中具有唯一性,已被建议作为植物特有的基因标记【1.1.2.3CHI基因的结构CHI基因在多种植物中被克隆(已克隆的CHI基因信息可在NCBI的主页上获得),具有较高的同源性,约499/6~809/6[3].植物中的CHI基因家族主要分为两大类[1:TypeI类CHI基因编码的酶蛋白只能将查尔酮异构化为(2S)一黄烷酮;TypelI类CHI基因编码的酶蛋白除了具有TypeI类的功能外,还能将6,_脱氧查尔酮异构化为(2S)一5一脱氧黄烷酮,它主要存在于豆科植物中.现在把在真菌和细菌中发现的,与植物CHI基因直向同源(orthologous)的CHI基因[1,归为TypeIII.在研究矮牵牛的CHI时发现,它含有两个CHJ基因,CHJA(AF233637)和CHJB(Xl4590). CHIA全长726bp,编码241个氨基酸L2叩;CHIB全长2l70bp,编码220个氨基酸.CHIA基因编码区上游存在两个启动子PAl和PA2,PAl和PA2在不同矮牵牛花组织中具有不同的驱动活性.PAl启动子在花冠组织中驱动CHIA表达,而PA2启动子仅在花药发育后期和花粉粒组织中启动CHJA ¨.CHIB只有一个启动子,仅仅在花药发育早期(未成熟的花粉组织)驱动CRIB基因表达.此外, CHIA和CRIB基因启动子区域有37bp的高度保守的DNA序列.1.2.4CHI基因的表达调控研究发现,CHI酶蛋白的积累与消失受光调控和紫外辐射诱导,并与CHS蛋白的积累存在协同性L2...另外,CHI也受P 蛋白的影响口引.实验表明,这种协同积累效应是因为CHI基因和CHS基因mRNA协同表达的结果....2研究前景大豆起源于中国,我国大豆的种质资源十分丰富.近几年,我国的科技界对于大豆蛋白,大豆磷脂,大豆低聚糖等成分的研究已逐渐深入,与国际上相关的研究与交流也比较多,但对于大豆异黄酮这一国际新热点的研究,却远远落后于欧,美,日本等国.它的研究的深入开展及成果的推广应用,将对我国相关方面的研究有极大的推动作用,并可以带来巨大的社会与经济效益L2引.改良栽培环境,贮藏条件,加工工艺等,这些方法确实在某些程度上提高了大豆异黄酮的含量,但不是从根本上提高其产量的方法.随着细胞生物学和分子生物学的不断发展,越来越多的研究者把工作重点转移到以为基础的生物技术上来,以期望在5期李莉等:异黄酮合成代谢调控关键酶CHS,CHI的特性与研究前景765 提高异黄酮类次生代谢物的产量的同时降低成本,主要表现在其代谢关键酶的分子克隆及基因工程方面L2,这也已经成为生命科学的一个新生长点.进一步了解对CHS,CHI特异性基因的结构特点,克隆,测序,作用机制,表达部位和时空表达模式的研究,将利于进一步研究它们的基因表达调控机理,同时也为更好的改造这些基因,进而改变它们的表达活性,富集特定目的次生代谢产物——异黄酮提供更多的基础资料.若能同时增强多个基因的协同表达则是提高异黄酮产量的捷径.人们在研究中发现,cHs基因和cH基因的表达在很多方面确实具有协同性,如它们同时受转录因子P蛋白的影响,转录因子P蛋白就充当了"分子开关"的作用,随着分子生物学的不断发展,在各国科学研究工作者的共同努力下,这些问题终将会得到解决,也将为异黄酮类次生代谢产物的研究开拓新的途径.参考文献[1][2][3][4][5][6][7][8]谷利伟,谷文英,过世东.新型生长调节剂——异黄酮类植物雌激素[J].饲料添加剂,2000,21(12):26—28. ShelaghRMuir,GeoffJCollins,SusanRobinson,eta1.Ovet expressionofpetuniachalconeisomeraseintomatoresultsin fruitcontainingincreasedlevelsofflavonols[J].NatureBio—technology,2001,19:470—474.KarinSpringob,JunichiroNakajima,ManfiYamazaki,eta1. Recentadvancesinthebiosynthesisandaccumulationofan—thocyanins[J].NaturalProductReport,2003,(20):288—303.KreuzalerF,RaggH,FautzE,eta1.Uv—inductionofchalcone synthasemRNAincellsuspensionculturesofPct—roselinum hotense[J].ProceedingsNationalAcademyofScience,USA, 1983,8O:2591—2593.SommerH,SaedlerH.Structureofthechalconesynthase geneofAntirrhinummajus[J].MolecularandGeneralGe—netics,1986,202:429—434.王金玲,瞿礼嘉,陈军,等.CHS基因外显子2的进化规律及用于植物分子系统学研究的可行性[J].科学通报,2000,45 (9):942—950.DurbinML,McCaigB,CleggMT.Molecularevolutionofthe chalconesynthasenmhigenefamilyinthemorninggloryge—nome[J].PlantMolecularBiology,2000,42:79—92. SchroderJ,RaiberS,BergerT,eta1.Plantpolyketidesyn—thase:achalconesynthase-typeenzymewhichperformsacon~densationreactionwithmethylmalonyl—CoAinthebiosynthe—sisofC—methylatedchalconcs[J].Biochemistry,1998,37: 8417—8d25.[9]ArthurJM.Radiationandanthocyaninpigmentsin:Biological EffectsofRadiation[M].DugganBMed.NewY ork:McGraw HiIl,1936:1109—1118.[10][11][12][13][14][15][16][17][18][19][20][21][22][23]ThainSC,MurtasG,LynnJR,eta1.Thecircadianclockthat controlsgeneexpressioninArabidopsisistissuespecific[J]. PlantPhysiology,2002,130(1):102—110.LeyvaA,JarilloJA,SalinasJ,eta1.Lowtemperatureinduces theaccumulationofPhenylalanineAmmonia—LyaseandChal- coneSynthasemRNAsofArabidopsisthalianainalight—de—pendentmanner[J].PlantPhysiology,1995,108:39—46. KanekoM,ItohH,InukaiY.Wheredogibberellinbiosynthe—sisandgibberellinsignalingoccurinriceplants[J].ThePlant Journal,2003,35:104.GrotewoldE,PetersonT.Isolationandcharacterizationofamaizegeneencodingehaleoneflavononeisomerase[J].Molee—ularandGeneralGenetics,1994,242(1):1—8.ChoDS,HongSH,NamHG,SohMS.FIN5positivelyreg—ulatesfar—redlightresponsesinArabidopsisthaliana[J]. PlantCellPhysiology,2003,44(6):565—572.BiezaK,LoisR.AnArabidopsismutanttoleranttolethalul—traviolet—Blevelsshowsconstitutivelyelevatedaccumulation offlavonoidsandotherphenolies[J].PlantPhysiology,2001, 26(3):1105.JezJM,NoelJP.Reactionmechanismofchalconeisomerase pHdependence,diffusioncontrol,andproductbindingdiffer—ences[J].JournalofBiologicalChemstry,2002,277(2):1361—1369.NorimotoShimada,ToshioAoki,ShuseiSato,eta1.Acluster ofgenesencodesthetwotypesofehaleoneisomeraseinvolved inthebiosynthesisofgeneralfalavonoidsandlegume-speeif—ics—deoxy(iso)FlavonoidsinLotusjaponicas[J].PlantPhysi—ology,2003,131(3):941—951.JezJM,BowmanME,DixonRA.Structureandmechanism oftheevolutionarilyuniqueplantenzymeehalconeisomerase [J].NaturalStructuralBiology,2000,7(9):786—791. GensheimerM,MushegianA.Chalconeisomerasefamilyand fold:nolongeruniquetoplants[J].ProteinScience,2004,13 (2):540—544.TunenAJV,KoesRE,MolJNM,eta1.Cloningofthetwo chalconeflavanoneisomerasegenesfromPetuniahybrid:co—ordinate,light—regulatedanddifferentialexpressionoffla—vonoidgenes[J].EMBOJ,1988,7:1257—1263. TunenAJV,HartmanSA,MolNM,eta1.Regulationofehaleoneisomerase(CHI)geneexpressioninpetuniahydria: theuseofalternativepromotersincorolla,anthersandpollen [J].PlantMolecularBiology,1989,12:539—551.杨茂区,陈伟,冯磊,等.大豆异黄酮的生理功能研究进展[J]. 大豆科学,2006,3:320—324.BurbulisIE.Winkel—ShirleyB.Interactionsamongenzymes oftheArabidopsisflavonoidbiosyntheticpathway[J].Pro—ceedingsNatinonalAcademyofScience,1999,96(22):29—34.。
黄酮类化合物的药物代谢研究进展_何佳珂

表 1 部 分黄酮类化合物的取代基类型
取代位置与取代基
化合物
3
5
6
7
8
2′
3′
4′
5′
6′
芹菜素 apigenin
H
OH
H
OH
H
ห้องสมุดไป่ตู้
H
H
OH
H
H
柚皮素 naringenin
H
OH
H
OH
H
H
H
OH
H
H
高良姜黄素 galangin OH
OH
H
OH
H
H
H
H
H
H
山萘甲黄素 kaempferideOH
OH
H
OH
第 35卷第 21期 2010 年 11月
VNolo.v3e5m, beIsrs, ue2 01201
大鼠肝细胞以及亚细胞制备物 中 , 山柰酚的代谢主要为 A环 7位羟基葡萄糖醛酸化 [ 16] 。 甲 氧基黄 酮类化 合物在 O-去甲 基反应后随 即进行 Ⅱ 相代谢 。 WalleUK等 [ 6] 发现 5, 7-二甲 氧基黄酮本身不发生 结合反 应 , 而是 由 CYPP450在 A环 5 位或者 7位 O-脱甲 基代 谢后 , 紧 接着 才进 行葡 萄糖 醛 酸化 反应 。 1.4 肠道菌群 代谢
异黄酮

结构式
一直被认为具有维生素P的活性,并不断被发现有更多生理活性,对机体代谢起调节的功能性质。
大豆含有多种异黄酮。作为综合利用,可从大豆皮渣中萃取,以石油醚提纯结晶。其中染料木素有降低胆固 醇,促进钙质吸收,调节机体免疫功能的保健作用,使大豆食品更具有特殊的食用价值。
产品功能
0 1
预防更年期 综合征
心脏病也是一种与雌激素相关的疾病,作为植物雌激素的大豆异黄酮其降低血脂、预防心脏病的机制为:雌 激素样的作用促进甲状腺素分泌,促进胆汁排泄。在降低胆固醇时能降低低密度脂蛋白(LDL)胆固醇,而不降 低高密度脂蛋白(HDL)胆固醇,已是被充分证明了的。异黄酮作为黄酮类化合物的特色,具有生物抗氧化作用, 这一点非常重要。因为低密度脂蛋白(LDL)胆固醇的氧化是动脉硬化过程的关键因子。每天接受80毫克染料木 黄酮纯品的妇女可增加动脉弹性约26%。
谢谢观看
0 2
预防、改善 骨质疏松
0 3
预防心血管 疾病
0 4
预防早老性 痴呆
0 6
改善经期不 适
0 5
美容、延缓 衰老
降低胆固醇
改善性功能
预防疾病
在妇女绝经前后,由于卵巢功能减退,体内雌激素水平下降,引起各器官组织的功能调整不相适应,出现一 系列病症,而补充雌激素可以达到预防和治疗这类病症的目的。
妇女更年期的表现:潮热、出汗、畏寒、胸闷、心悸、气短、头眩、血压波动等;出现情绪不稳定、烦躁、 易激动或抑郁、多虑、失眠、记忆力减退、思想不集中、综合判断力下降。
早老性痴呆症是目前最常见的一种痴呆症,女性多患。近年来研究表明,人类的大脑也属于雌激素作用的靶 组织,脑内具有记忆功能的海马突触小体含雌激素受体,医学界已证实,雌激素水平与老年性痴呆密切相关,服 用大豆异黄酮和真正的雌激素对脑部都是有益的。
大豆异黄酮项目简介课堂PPT

保质期:二年
16
谢谢, 请多提宝贵意见
17
个人观点供参考,欢迎讨论
大豆异黄酮结构式
1
三种主要成分的3D图:
Genistin
Daidzin
Glycitin
2
功能与应用
近年来,大量地流学病研究、动物实验研究和体外实 验研究均一致显示,大豆异黄酮对多种肿瘤具有抑制作用, 其中对乳腺癌、前列腺癌、结肠癌及白血病等较为明显
3
防癌抗癌
近年来的研究表明,大豆异黄酮在治疗和抑制一些与 激素相关的癌症,如前列腺癌、乳腺癌等癌症方面卓有成 效。
代谢物的浓度显著下降,而上述代谢物可与DNA生成加合物,具有遗传毒 性,被认为是乳腺癌的危险因子。根据此结果,Xu等认为影响体内雌激素代谢 也是异黄酮抗癌的机制之一。另有一些学者认为异黄酮的促进SHBG合成以及 延长月经周期的作用,也是其可能的抗癌机制。
绝经后潮热症状及骨质疏松
Albertazzi等对104名绝经后女性进行了膳食干预试验,结果表明大豆蛋白
保质期:二年
9
黄酮甙元的概述
异黄酮(isoflavones)是植物雌激素的一类,它们结构 与雌激素相似,为含有芳香环的非类固醇化合物。大豆异 黄酮在大豆中通常以没有活性的糖苷结合形式存在,只有 经肠道菌群的葡萄糖苷酶分解后,形成非糖苷型异黄酮才 具有生物活性。自然界中,鸡豆黄素A(biochaninA)和刺 芒柄花素(formononetin)分别是大豆苷原和染料木黄酮的 前体,这两种前体在肠道菌群作用下转化成大豆异黄酮: 染料木黄酮可进一步代谢成对甲基酚,大豆苷原则可分解 成活性更强的雌马酚(equol)和邻上甲基安哥拉紫檀素 (o-DMA)。未被肠道菌群分解的结合型异黄酮个易被 吸收,直接从胆汁分泌入肠道排山体外;去糖苷型的异黄 酮经肝肠循环代谢,可与糖苷重新结合形成无生物活性的 化合物。
细胞的代谢(降低化学反应活化能的酶)思维导图高一上学期

细胞的代谢(降低化学反应活化能的酶)思维导图高一上学期一、细胞的代谢1. 细胞代谢的定义细胞代谢是指细胞内进行的一系列化学反应,这些反应包括合成、分解、转化和运输等过程。
细胞代谢是维持细胞生命活动的基础,它保证了细胞能够从外界环境中获取能量和物质,同时将废物排出体外。
2. 细胞代谢的类型细胞代谢主要分为两大类:合成代谢和分解代谢。
(1) 合成代谢:指细胞利用能量将小分子合成大分子的过程,如蛋白质、核酸、多糖等生物大分子的合成。
(2) 分解代谢:指细胞利用能量将大分子分解为小分子的过程,如糖、脂肪、蛋白质等生物大分子的分解。
二、酶1. 酶的定义酶是一种生物催化剂,它能够加速化学反应的速率,同时降低化学反应所需的活化能。
酶在细胞代谢中起着至关重要的作用,它能够使细胞内的化学反应在适宜的温度和pH值下进行。
2. 酶的特性(1) 高效性:酶能够显著提高化学反应的速率,使细胞代谢过程能够在短时间内完成。
(2) 专一性:每种酶只能催化特定的底物,即具有高度专一性。
(3) 可逆性:酶催化反应是可逆的,即酶既能催化正反应,也能催化逆反应。
(4) 温度和pH值的影响:酶的活性受温度和pH值的影响,每种酶都有其最适宜的温度和pH值范围。
三、酶的作用机制1. 锁钥模型锁钥模型认为,酶与底物之间存在着互补的形状,底物像钥匙一样插入酶的活性中心,从而形成酶底物复合物。
酶通过改变底物的构象,降低化学反应的活化能,使反应得以进行。
2. 催化机制(1) 酸碱催化:酶能够提供或接受质子,从而改变底物的电荷分布,降低反应的活化能。
(2) 共价催化:酶与底物形成共价键,使底物发生构象变化,降低反应的活化能。
(3) 亲核催化:酶提供亲核基团,攻击底物中的亲电中心,降低反应的活化能。
(4) 金属离子催化:酶中的金属离子能够与底物形成配位化合物,降低反应的活化能。
四、酶的调控1. 酶活性的调控酶活性受到多种因素的调控,如温度、pH值、底物浓度、产物浓度等。
黄酮类化合物的提取

一、溶剂提取法:国内外使用最广泛的方法,步骤多、周期长、产率低、产品中有机溶剂易残留。
溶剂系统主要有乙醇,水溶液、丙酮-水溶液、NaOH-水溶液、NaOH-乙醇等。
精提物常在粗提物制备基础上精制,常用液-液提取法、沉淀法和吸附.洗脱法。
以60%丙酮为起始溶剂粗提取,再脱脂、去银杏酚酸等15道工艺制成提取物。
NaOH-水溶液提取效果最好,NaOH-乙醇溶液次之,正丁醇萃取水溶液中银杏黄酮苷,获得最佳萃取条件为萃取5 min温度60℃4次,萃取物中黄酮苷含量为57%。
V水:V正丙醇=1:25最佳。
银杏叶精提物树脂吸附纯化法以石油醚回流提取,再以80%乙醇回流提取,减压浓缩,新型澄清剂沉降,树脂分级吸附,pH值为3—4酸水和酸性25%乙醇洗涤,75%乙醇洗脱,喷雾干燥将银杏叶洗净,于60℃烘干至恒重,粉碎,过50目筛。
称取粉末25 g,置于索氏提取器中恒重,粉碎,过50目筛。
称取粉末25 g,置于索氏提取器中加入60%乙醇至250.0 ml,80℃下回流提取3.0 h,蒸馏回收乙醇,并用活性炭脱色,得银杏叶黄酮提取物。
乙醇浓度为50%一70%时,提取率随浓度增加提高,当浓度70%时提取率达最大。
随水浴温度升高总黄酮提取率快速增加。
当温度80℃时提取率达最大。
提取时间为三小时为佳。
黄酮类化合物(英语:Flavonoid,又称类黄酮[1])是指基本母核为2-苯基色原酮类化合物,现在则泛指两个具有酚羟基的苯环通过中央三碳原子相互连接的一系列化合物。
他们来自于水果、蔬菜、茶、葡萄酒、种子或是植物根。
虽然他们不被认为是维生素,但是在生物体内的反应里,被认为有营养功能,曾被称为“维生素P”:黄酮类(英语:Flavones)是一类基于2-苯基色原酮-4-酮(2-苯基-1-苯并吡喃-4-酮)骨架的黄酮类化合物,如右图所示。
银杏叶黄酮的研究程序溶剂提取法:国内外使用最广泛的方法,步骤多、周期长、产率低、产品中有机溶剂易残留。
