苏氨酸PPT课件
合集下载
饲料添加剂学课件-氨基酸添加剂

基酸。分为L型和D型,动物对L型蛋氨酸的吸收和利用
效率比D型高,D型要经异构酶转化为L型蛋氨酸后,才
能参与体内蛋白质的合成。常用的包括DL-蛋氨酸、
DL-蛋氨酸羟基类似物、DL-羟基蛋氨酸类似物钙盐、N
—羟甲基蛋氨酸钙(保护性蛋氨酸)。
• 第三章 营养性添加剂(氨基酸添加剂)
•
色氨酸添加剂——常用的形式为L—色氨酸,合成的
• 维生素名称及常用名
维生素名称
俗
名
脂
维生素A
视黄醇,抗干眼醇
溶
维生素D2
麦角钙(骨)化固醇,钙化固醇,麦角固醇
性
维生素D3
胆钙化固醇
维
维生素E
生育酚,抗不育维生素
生 素
维生素K1 维生素K2 维生素K3
叶绿醌,植物甲基萘醌,抗出血维生素 合鸡醌,甲基萘醌类 甲萘醌
维生素B1
硫胺素,神经炎维生素
水 溶 性
赖氨酸
100
100
100
精氨酸
42
36
30
组氨酸
32
32
32
色氨酸
18
19
20
异亮氨酸
60
60
60
亮氨酸
100
100
100
缬氨酸
68
68
68
苯丙+ a
95
95
95
苏氨酸
65
67
70
蛋+胱b
60
65
70
蛋氨酸
30
30
30
胱氨酸
30
35
40
• 注:a 53%+47%;b 50%+50%。
氨基酸的代谢课件

(一)、生成尿素(尿素循环)
排尿素动物在肝脏中合成尿素的过程称尿素循环 1932年,Krebs发现,向悬浮有肝切片的缓冲液
中,加入鸟氨酸、瓜氨酸、Arg中的任一种, 都可促使尿素的合成。
《氨基酸的代谢》PPT课件
尿素循环途径(鸟氨酸循环)
总的结果 P311反应式
《氨基酸的代谢》PPT课件
1、 氨甲酰磷酸的生成(限速步骤) 肝细胞液中的a.a经转氨作用,与α-酮戊二
(3)
《氨基酸的代谢》PPT课件
《氨基酸的代谢》PPT课件
(四) 非氧化脱氨基作用
产生NH3和酮酸
①脱水脱氨基
②脱巯基脱氨基 ③ 直接脱氨基 ④水解脱氨基 ⑤氧化-还原脱氨基
两个氨基酸互相发生氧化还原反应,生成有机酸、酮 酸、氨。
⑥脱酰胺基作用
谷胺酰胺酶:谷胺酰胺 + H2O → 谷氨酸 + NH3 天冬酰胺酶:天冬酰胺 + H2O → 天冬氨酸 + NH3
N-乙酰Glu激活氨甲酰磷酸合酶 I、II
《氨基酸的代谢》PPT课件
2、 合成瓜氨酸(鸟氨酸转氨甲酰酶)
鸟氨酸转氨甲酰酶存在于线粒体中,需要Mg2+作为辅因子 瓜氨酸形成后就离开线粒《体氨基,酸的进代入谢》细PPT胞课件液。
3、 合成精氨琥珀酸(精氨琥珀酸合成酶)
精氨琥珀酸合成酶的催化机制
《氨基酸的代谢》PPT课件
肾中a.a占代谢库的4%。
血浆中a.a占代谢库的1~6%。
肝、肾体积小,它们所含的a.a浓度很高,血浆a.a是体 内各组织之间a.a转运的主要形式。
《氨基酸的代谢》PPT课件
氨基酸来源与去路
食物蛋白质 组织蛋白质
体内自身合成的AA
氨基酸生产ppt课件

A
ห้องสมุดไป่ตู้
活性 超过生理需要量
A合成酶系(E1,E2…) 反馈抑制
A
野生型菌株酶合成水平的反馈阻遏
在日常生活中,随处都可以看到浪费 粮食的 现象。 也许你 并未意 识到自 己在浪 费,也 许你认 为浪费 这一点 点算不 了什么
野生型菌株酶活性水平的反馈抑制
Gene编码酶
效应物位点 过量A 酶活中心
过量A作用效应物位点,酶构型变化,影响酶活性中心而失活
在日常生活中,随处都可以看到浪费 粮食的 现象。 也许你 并未意 识到自 己在浪 费,也 许你认 为浪费 这一点 点算不 了什么
25.1 概述
氨基酸的生产方法
第三类用抗氨基酸结构类似物突变株,如利用乳糖发酵
短杆菌 的S-(2-氨基乙基)-L-半胱氨酸(AEC,赖氨酸结构类食物) 抗性菌株生产赖氨酸。利用黄色短杆菌的5-甲基色氨酸(5-MT,酪 氨酸结构类似物)抗性菌株生产酪氨酸。
在日常生活中,随处都可以看到浪费 粮食的 现象。 也许你 并未意 识到自 己在浪 费,也 许你认 为浪费 这一点 点算不 了什么
25.1 概述
氨基酸的生产方法
2、酶法:利用酶来制造氨基酸。应用完整 菌体或从微生物细胞抽提的酶类合成氨基酸。 天冬氨酸已于1973年应用完整菌体固定化 进行生产,这是世界上最早应用固定化菌体 的例子。赖氨酸、色氨酸、丙氨酸也可以生 产。
同功酶的主要功能在于其代谢调节。在一个分支代 谢途径中,如果在分支点以前的一个较早的反应是 由几个同功酶所催化时,则分支代谢的几个最终产 物往往分别对这几个同功酶发生抑制作用而不致过 剩
在日常生活中,随处都可以看到浪费 粮食的 现象。 也许你 并未意 识到自 己在浪 费,也 许你认 为浪费 这一点 点算不 了什么
ห้องสมุดไป่ตู้
活性 超过生理需要量
A合成酶系(E1,E2…) 反馈抑制
A
野生型菌株酶合成水平的反馈阻遏
在日常生活中,随处都可以看到浪费 粮食的 现象。 也许你 并未意 识到自 己在浪 费,也 许你认 为浪费 这一点 点算不 了什么
野生型菌株酶活性水平的反馈抑制
Gene编码酶
效应物位点 过量A 酶活中心
过量A作用效应物位点,酶构型变化,影响酶活性中心而失活
在日常生活中,随处都可以看到浪费 粮食的 现象。 也许你 并未意 识到自 己在浪 费,也 许你认 为浪费 这一点 点算不 了什么
25.1 概述
氨基酸的生产方法
第三类用抗氨基酸结构类似物突变株,如利用乳糖发酵
短杆菌 的S-(2-氨基乙基)-L-半胱氨酸(AEC,赖氨酸结构类食物) 抗性菌株生产赖氨酸。利用黄色短杆菌的5-甲基色氨酸(5-MT,酪 氨酸结构类似物)抗性菌株生产酪氨酸。
在日常生活中,随处都可以看到浪费 粮食的 现象。 也许你 并未意 识到自 己在浪 费,也 许你认 为浪费 这一点 点算不 了什么
25.1 概述
氨基酸的生产方法
2、酶法:利用酶来制造氨基酸。应用完整 菌体或从微生物细胞抽提的酶类合成氨基酸。 天冬氨酸已于1973年应用完整菌体固定化 进行生产,这是世界上最早应用固定化菌体 的例子。赖氨酸、色氨酸、丙氨酸也可以生 产。
同功酶的主要功能在于其代谢调节。在一个分支代 谢途径中,如果在分支点以前的一个较早的反应是 由几个同功酶所催化时,则分支代谢的几个最终产 物往往分别对这几个同功酶发生抑制作用而不致过 剩
在日常生活中,随处都可以看到浪费 粮食的 现象。 也许你 并未意 识到自 己在浪 费,也 许你认 为浪费 这一点 点算不 了什么
氨基酸 ppt课件

鸡肝 羊肉(瘦)
鲢鱼 猪肉(瘦)
龙虾 核桃 豆浆 牛奶 鸡蛋
ppt课件
蛋白含量
18.2 17.3 17 16.7 16.4 15.4
4 3 13
3
ppt课件
4
氨基酸和蛋白质
蛋白质(肉 类)
消化系统
氨基酸
ppt课件
5
为何要补充氨基酸?
缺乏
疾病
健康
ppt课件
6
20种氨基酸
支链氨基酸
甘氨酸 Gly
排内除分垃泌圾 调新节陈内代分谢泌和神经系统 激免活疫免力疫低系下统
ppt课件
29
精品氨基酸
ppt课件
30
脏器(代谢与内分泌) 血管(硬化堵塞缺血)
ppt课件
31
氨基酸对高血压的作用
ppt课件
32
动脉硬化和血栓发生原因
垃
损
炎
堆积
硬化
血
圾
伤
症
黏附
堵塞
栓
ppt课件
33
氨基酸防止和 逆转动脉硬化及血栓形成
ppt课件
24
氨基酸----品牌!
ppt课件
25
高科技
GMP
英国 肠溶 德国 缓释 美国 螯合
ppt课件
26
精品氨基酸—“动物人参”—蚕蛹
ppt课件
27
氨基酸—高吸收率90%以上 氨基酸直接被小 比肠例和接血近液母吸乳收
ppt课件
28
有效改善慢性疾病
吸吸收收率高细全胞面饥调饿理肠胃
修细复胞细受胞损激和活变细性胞和组 垃织圾器毒官素机能
11
氨基酸对生命的作用
1.构成人体的基本材料
氨基酸生产工艺课件(PPT 55页)

2.1 用野生株的方法
• 这是从自然界获得的分离菌株进行发酵 生产的一种方法。
• 典型的例子就是谷氨酸发酵。 • 改变培养条件的发酵转换法中,有变化铵
离子浓度、磷酸浓度,使谷氨酸转向谷 氨酰胺和缬氨酸发酵
2.2 用营养缺陷变异株的方法
• 这一方法是诱变出菌体内氨基酸生物合 成某步反应阻遏的营养缺陷型变异体, 使生物合成在中途停止,不让最终产物 起控制作用。
• 日本在美国、法国等建立了合资的氨基 酸生产厂家,生产氨基酸和天冬甜精等衍 生物。
• 国内生产氨基酸的厂家主要是天津氨基酸公司, 湖北八峰氨基酸公司,但目前无论生产规模及产 品质量还难于与国外抗衡。
• 在80年代中后期,我国从日本的味之素、协和发 酵以技贸合作的方式引进输液制剂的制造技术 和仿造产品,1991年销售量为二千万瓶,1996年达 六千万瓶,主要厂家有无锡华瑞,北京费森尤斯,昆 明康普莱特,但生产原料都依赖进口。
二肽甜味剂(α-天冬酰苯丙氨酸甲酯),此产 品1981年获FDA批准,现在每年产量已达 数万吨。
• 2.饲料工业: • 甲硫氨酸等必需氨基酸可用于制造动物饲料 • 3.医药工业:
• 多种复合氨基酸制剂可通过输液治疗营养或代 谢失调
• 苯丙氨酸与氮芥子气合成的苯丙氨酸氮芥子气 对骨髓肿瘤治疗有效,且副作用低。
第二节 氨基酸生产工艺
• 氨基酸是构成蛋白成分
• 目前世界上可用发酵法生产氨基酸有20 多种。
氨基酸
• α 碳原子分别以共价键连接氢原子、羧基 和氨基及侧链。侧链不同,氨基酸的性 质不同。
氨基酸的用途
• 1.食品工业: • 强化食品(赖氨酸,苏氨酸,色氨酸于小
麦中) • 增鲜剂:谷氨酸单钠和天冬氨酸 • 苯丙氨酸与天冬氨酸可用于制造低热量
第3章-氨基酸的简介PPT课件

丝氨酸 Serine
O
H 2N CH C OH
CH 2
OH
S
( α-氨基-β-羟基丙酸 )
.
17
一、脂肪族氨基酸(含羟基或硫)
丝氨酸 Serine 苏氨酸 Threonine
O
H 2N CH C OH CH OH
CH 3
T
( α-氨基-β-羟基丁酸 )
.
18
-
COO
-
COO
-
COO
-
COO
H3N+ C H H C NH 3+ H3N+ C H H C NH 3+
.
24
注意:
丝氨酸和苏氨酸侧链含有β-羟基,具有伯醇和 仲醇的离子化特性。
丝氨酸的羟甲基可以参与很多酶的活性部位反 应。
苏氨酸具有两个手性碳原子,通常出现在蛋白 质中的是L-苏氨酸。
半胱氨酸在蛋白质中经常以其氧化型的胱氨酸 存在。胱氨酸是由两个半胱氨酸通过它们侧链 上的-SH氧化成共价的二硫桥连接形成的。
.
14
一、脂肪族氨基酸(中性)
甘氨酸 Glycine 丙氨酸 Alanine 缬氨酸 Valine 亮氨酸 Leucine 异亮氨酸 Ileucine
O
H 2 N CH C OH
CH CH 3
CH 2
CH 3
I
(α-氨基-β-甲基戊酸 )
.
15
注意:
甘氨酸是唯一不含手性碳原子的氨基酸,因此 不具旋光性。
将α-COO-画在顶端,垂直画一个氨基酸,然 后与立体化学参考化合物甘油醛相比较, α氨基位于α-碳左边的为L-异构体,位于右边的 为D-异构体。
绝大多数氨基酸是L-型氨基酸,近年来,D-型 氨基酸在哺乳动物生命活动中的意义引起了越 来越多的关注。
有机化学氨基酸PPT课件

第21页/共45页
(3)三级结构—— 在二级结构的基础上,多肽链间通过氨基酸残基侧链的相互作用, 在三维空间沿多个方向进行卷曲、折叠、盘绕形成紧密的球状结构称为蛋白质的三级
结构。
蛋白质的三级结构 是其他次级键,如 -S-S-(二硫 键)、离子键、氢 键、疏水键、支链 等,共同作用的结 果。
第22页/共45页
第4页/共45页
2、茚三酮反应 用途:鉴别α-氨基酸
O
OH
2
OH
O
水合茚三酮
+ RCHCOOH
NH2
α-氨基酸
O
O
N
O
O
兰紫色
第5页/共45页
1 大蒜的药用价值与氨基酸
O H2 O S C CHC OH
NH2
O SS
S OH
蒜素
现代抗生素问世之前,大蒜制剂被用来治疗霍乱, 痢疾,肺结核等疾病,大蒜制剂还能降低胆固醇, 阻止血小板聚集,对心血管有利,并有一定的抗 菌作用。副作用:味道大
第13页/共45页
2、分类 二肽 三肽 多肽
3、命名 以含有完整羧基的氨基酸为母体,将以羧基
参加形成肽链的氨基酸中的酸字改为“酰”,依次 加在母体前面
O
NH2CH2 C NHCH2COOH 甘氨酰甘氨酸 或甘·甘
CH3 O
O
O
CH2OH
NH2CH C NH CH C NH CH2C NH CHCOOH
第17页/共45页
水蛭素多肽——抗血栓分子药理 1884年Haycraft首先发现新鲜医用水蛭Hirud medicinalis提取物含抗凝血物质,但直至1955年Mark wardt等从医用水蛭中才分离出水蛭素(hirudin,HV),共有 7种异构体。1984年Dodt首先测出其一级结构,确认HV是 一条含65个左右氨基酸的多肽。HV酶是血液凝固、止血过程和血栓形成的中心 酶之一。它专一性地水解纤维蛋白原上的Agr-Gly键,使之转变成纤维蛋白;纤维 蛋白相互作用会进一步形成血栓。HV的2个结构域通过不同的机制分别和凝血酶 相互作用,抑制其活性。其C端长链通过和凝血酶的纤维蛋白原识别部位结合,拮 抗凝血酶对纤维蛋白原的识别。而HV的N末端核心结构域通过和凝血酶的活性部 位结合而抑制它的催化活性。临床实验结果也表明,HV的抗栓作用不需要其它因 子的作用;又不会引起出血等副作用。其效果超过小分子肝素。因此被认为是 2010年前最强的可逆性凝血酶直接抑制剂。全球约有20亿美元市场销售量。
氨基酸PPT幻灯片课件
20
等电点(pI)
对于任何一种氨基酸来说,总存在一定的pH值,使其净 电荷为零,这时的pH值被称为等电点。pI是一个氨基酸的 特征常数。在等电点pH时,氨基酸在电场中,不向两极移 动,并且绝大多数处于兼性离子状态,少数可能解离成阳 离子和阴离子,但解离成阴、阳离子的趋势和数目相等。
21
氨基酸的主要反应性质
17
18
特殊的酸碱性质与等电点
由于氨基酸既含有碱性的氨基又含有酸性的羧 基,因此氨基酸具有特殊的解离性质,但氨基 算的碱性和酸性分别弱于单纯的胺和羧酸。一 个氨基酸分子内部的酸碱反应使氨基酸能同时 带有正负两种电荷,以这种形式存在的离子被 称为兼性离子(zwitterions)或两性离子。
19
氨基酸的两性解离
质氨基酸:含硒半胱氨酸(第21种)和吡咯赖氨酸 (第22种)
非蛋白质氨基酸——不能直接参入到蛋白质分子 之中,或者是蛋白质氨基酸翻译后修饰产物
例如:瓜氨酸、鸟氨酸和羟脯氨酸
4
氨基酸的分类
① 脂肪族 ② 芳香族 ③ 含硫族
① 极性/不带电荷 ② 碱性/酸性
疏水:非极性R基团
亲水:极性的R基团 (电中性、带负电荷、 带正电荷)
2
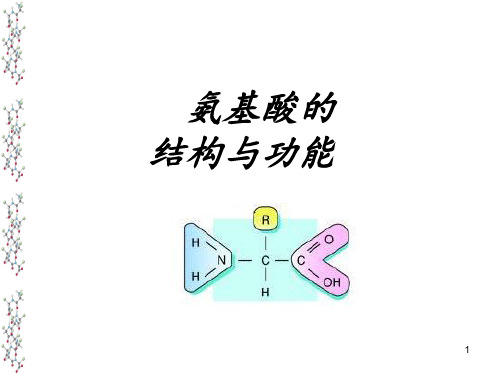
氨基酸的结构通式
不同的侧链基团 不同的理化性质
3
蛋白质氨基酸和非蛋白质氨基酸
蛋白质氨基酸,即标准氨基酸——在蛋白质生物 合成中,由专门的tRNA携带,直接参入到蛋白 质分子之中
共22种:20种常见+2种不常见 ① 相同的结构通式 ② 差别在侧链基团(R基团) ③ 所有的生物体都含有常见的20种;2种不常见的蛋白
5
亲水氨基酸VS疏水氨基酸
亲水氨基酸,即极性氨基酸,其R基团呈极性,一般能 和水分子形成氢键,故对水分子具有一定的亲和性。它 们包括:Ser、Thr、Tyr、Cys、Sec、Asn、Gln、Asp、 Glu、Pyl、Arg、Lys、His;
等电点(pI)
对于任何一种氨基酸来说,总存在一定的pH值,使其净 电荷为零,这时的pH值被称为等电点。pI是一个氨基酸的 特征常数。在等电点pH时,氨基酸在电场中,不向两极移 动,并且绝大多数处于兼性离子状态,少数可能解离成阳 离子和阴离子,但解离成阴、阳离子的趋势和数目相等。
21
氨基酸的主要反应性质
17
18
特殊的酸碱性质与等电点
由于氨基酸既含有碱性的氨基又含有酸性的羧 基,因此氨基酸具有特殊的解离性质,但氨基 算的碱性和酸性分别弱于单纯的胺和羧酸。一 个氨基酸分子内部的酸碱反应使氨基酸能同时 带有正负两种电荷,以这种形式存在的离子被 称为兼性离子(zwitterions)或两性离子。
19
氨基酸的两性解离
质氨基酸:含硒半胱氨酸(第21种)和吡咯赖氨酸 (第22种)
非蛋白质氨基酸——不能直接参入到蛋白质分子 之中,或者是蛋白质氨基酸翻译后修饰产物
例如:瓜氨酸、鸟氨酸和羟脯氨酸
4
氨基酸的分类
① 脂肪族 ② 芳香族 ③ 含硫族
① 极性/不带电荷 ② 碱性/酸性
疏水:非极性R基团
亲水:极性的R基团 (电中性、带负电荷、 带正电荷)
2
氨基酸的结构通式
不同的侧链基团 不同的理化性质
3
蛋白质氨基酸和非蛋白质氨基酸
蛋白质氨基酸,即标准氨基酸——在蛋白质生物 合成中,由专门的tRNA携带,直接参入到蛋白 质分子之中
共22种:20种常见+2种不常见 ① 相同的结构通式 ② 差别在侧链基团(R基团) ③ 所有的生物体都含有常见的20种;2种不常见的蛋白
5
亲水氨基酸VS疏水氨基酸
亲水氨基酸,即极性氨基酸,其R基团呈极性,一般能 和水分子形成氢键,故对水分子具有一定的亲和性。它 们包括:Ser、Thr、Tyr、Cys、Sec、Asn、Gln、Asp、 Glu、Pyl、Arg、Lys、His;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O
苏氨酸脱水酶
• 苏氨酸 PLP
H2O
NH4
+
=
CH3--CH2--C--COO
-
a--酮丁酸
途径2
途径3
O
-- -O
苏氨酸脱氢酶
苏氨酸
H
=
CH3--C--C--COO
-
NAD+
NADH+H +
NH3 +
a-羟基-β-酮丁酸
CO2 =
CH3--C--CH2--NH3
氨基丙酮
途径3
途径4:琥珀酰-CoA
苏氨酸
.
苏氨酸
• 生糖氨基酸 • 天冬氨酸族 • α-酮戊二酸衍生 类型包括谷氨酸、 谷氨酰胺、甲硫氨 酸、苏氨酸、异亮 氨酸及赖氨酸(以草 酰乙酸为底物)提供 碳原子
代谢
三条代谢途径
1.由苏氨酸醛缩酶催化裂解生成甘氨酸和乙醛后 者氧化形成乙酸。乙酸氧化形成乙酰--CoA。 甘氨酸会形成丙酮酸
2.由丝氨酸--苏氨酸脱水酶转变为a--酮丁酸
途径1
HH
-- --- --
• H3C--C--C--COO - 苏氨酸羟甲基转移酶 H2C--COO- +H3C--C--H
又称丝氨酸羟甲基转移酶
=
O
--+OH N3+NH3
乙醛
苏氨酸
甘氨酸
CoA
H3--C--SCoA
=
O
乙酰--CoA
途径1
乙酰-CoA
乙酰辅酶A是人体内重要的化学物质,能源物 质代谢的重要中间代谢产物,在体内能源物质 代谢中是一个枢纽性的物质。
• 苏氨酸也可以变为琥珀酰-CoA进入三羧酸循 环和其他代谢途径
先天性氨基酸代谢缺陷症
病 名: 甲基丙二酸血症
临床症状: 除血中积累甲基丙二酸外,其它症状
表现为,新生儿呕吐,惊厥,死亡,严重的 智力迟钝 代谢缺陷:
缺乏甲基丙二酰-CoA变位酶(有些病 人对维生素B12治疗有反应)
生 物 合 成
苏氨酸
▪必要氨基酸 必需氨基酸指的是人体自身(或其它脊椎动 物)不能合成或合成速度不能满足人体需要, 必须从食物中摄取的氨基酸
• 苏氨酸可分解为甘氨酸和乙醛,通过甘氨酸 形成一碳单位 一碳单位就是指具有一个碳原子的基团。指 某些氨基酸分解代谢过程中产生含有一个碳 原子的基团,包括甲基、亚甲基、甲烯基、 甲炔基、甲酰基及亚氨甲酰基等。特点:1. 不能在生物体内以游离形式存在;2.必须以 四氢叶酸为载体。
糖、脂肪、蛋白质三大营养物质通过乙酰辅 酶A汇聚成一条共同的代谢通路——三羧酸循 环和氧化磷酸化,经过这条通路彻底氧化生 成二氧化碳和水,释放能量用以ATP的合成。
乙酰辅酶A是合成脂肪酸、酮体等能源物质的 前体物质,也是合成胆固醇及其衍生物等生 理活性物质的前体物质。
三 羧 酸 循 环
三羧酸循环
途径2
3.脱氢脱羧形成氨基丙酮
4.附加
生物合成
由天冬氨酸的羧基还原,有ATP的参与,活化 羧基并提供一个磷酸基,生成天冬氨酸-β-半 醛。以上反应过程与细菌及植物合成L-赖氨 酸的一段过程完全相同。天冬氨酸-β-半醛以 NADPH为辅酶,在脱氢作用下还原生成L-高 丝氨酸
高丝氨酸在其激酶作用下在羟基位置转移ATP 上的一个磷酸集团形成O-磷酰-L-高丝氨酸, 再经苏氨酸合酶作用,水解下磷酸基团形成 苏氨酸
